临床试验中为了实现安全性的充分评价,对不良事件的深入细致分析是一个极其重要的方面。然 而,在临床试验实践中所获取的不良事件信息常常因受试者的地域、语言、民族、文化等不同在表达上有所不同,给不良事件资料的汇总归类、数据管理和统计分析带来困难。如何统一不良事件的表达并达 到术语上的标准化,同时有利于数据管理和统计分析,则需要专门进行标准化编码工作,以确保不良事件原意表达的本质归属。勿容置疑,使用统一的术语集不仅能提高临床试验分析时数据的质量、时效性 和可用性,还可推动日益发展的电子数据交换,药事管理机构和医药行业均可从中受益。国际医学用语 词典 (MedDRA) 可为临床试验不良事件报告标准化提供有力支持,目前正得到广泛应用。本文将在对MedDRA综合介绍的基础上,进一步阐述其应用于临床试验不良事件统计分析和不良反应监测的相关事宜。
1 MedDRA介绍 1.1 MedDRA发展概况MedDRA是由ICH (人 用药物注册技术要求国际协调会) 主办开发、在医药事务管理活动中使用的一套医学标准术语 (medical dictionary for regulatory activities),中文翻译为《ICH国际医学用语词典》[1]。1994年10月,ICH提出在世界范围内建立一个统一的、用于药事管理的医学术语 集,在英国药事署的医学术语数据库基础上进行了改进,制作了MedDRA1.0版作为一种新的医学术语集。1997年7月,ICH会议上推出执行版本2.0版,并决定将名称改用MedDRA。起初MedDRA有英文版和日文版。随后MedDRA又有了中文版、捷克文版、荷兰文版、法文版、德文版、匈牙利文版、意大利文版、葡萄牙文版和西班牙文版 (共11种语言)。MedDRA发布以后很快被欧盟、美国、日本所接受并逐渐在商业领域中广泛运用。此外,一些商业软件在其产品中也包含了MedDRA。著名数据分析公司ORACLE在旗下Clinical trial产品中采用MedDRA对新药临床试验中出现的不良反应进行标准化编码。
MedDRA术语集的成功不仅取决于长期维护,而且也在于它能随着医学/科学的进步和管理环境的变化而与时俱进。ICH公开竞标任命了MedDRA维护和支持服务组织 (MSSO),在ICH管理委员会的监督与指导下工作。该机构与国际制药企业协会联合会 (IFPMA) 缔结合约,负责MedDRA的维护、发行与进一步开发,成为执行MedDRA术语集的必要组成部分。
MedDRA自出版以来,每季度更新一次。在2001年6月4.0版发布以后,更新频率缩减为半年 (每年的3月和9月),现在最新的版本是2015年9月发行的18.1版。MedDRA的更新由用户提出请求,比如增加MedDRA中还没有的医学概念,再由国际医学专家考虑不同国家的语言情况和医学背景,达成一致后,决定如何将这些术语添加到MedDRA,并映射到相应的组群 (groups)。
1.2 MedDRA术语集的适用范围MedDRA术语集适用于人用的所有药品开发阶段。MedDRA包含与这些产品相关的媒体、健康相关及监管概念。MedDRA收录的医学术语范围包括: 体征、症状、疾病、诊断、适应证 (可以是体征、症状、疾病、诊断、疾病诊断/ 预防以及生理功能改变)、各类检查的名称和定性结果 (例如: 增加、减少、正常、异常、存在、缺失、阳性和阴性)、外科及内科的各种处置、病史/社会史/家族史、用药错误、产品质量问题、设备相关问题等。
虽然社会环境通常不被视为医学术语,但如果与药事管理数据的评估有关 (如: 根据危险因素的暴露评估临床疗效时),也属于“医学”范畴,例如: 国外旅行 (PT)、物质使用 (PT)、烟草使用 (HLT)、以及亲人死亡 (HLT) 等。上述术语集是为药事管理机构和被监管的医疗产品行业编制的。这些组织可在上市前和上市后的药事管理流程中,利用此术语集进行数据输入、检索、评估和表达,例如可用在临床研究、自发性不良反应及不良事件报告、药事管理资料提交以及产品信息监管等方面。
MedDRA不包括以下内容: 药品/制剂、仪器/设备/诊断产品、试验设计的名称; 人口统计学信息 (性别、年龄、种族和宗教等); 表示全体而非患者个人的限定词 (如: 罕见、常见); 表示严重程度的描述词 (仅当这些描述词如“严重”和“轻微”影响术语的特异性时,才使用此类描述词,如“严重智力障碍”相对于“轻微智力障碍”); 计量检查结果数值 (如: 血清钠141 mEq·L-1) 等。
1.3 MedDRA结构层次MedDRA词典中的术语名称各异,多达9.8万余条,各术语之间通过5层级的结构进行归属和关联 (表 1)。MedDRA的层级结构提供了上下级别,上级术语是范围较广的一组术语,适用于其下级的每个术语。层级结构的各层级则代表本术语集内的各种纵向联系。层级结构是实现灵活的数据检索和清晰的数据表达的重要机制。五级结构为数据检索提供了多种选择,根据检索特异度的要求可通过特异的或宽泛的组来检索,低位语 (lowest level term,LLT) 的特异性最高。不同层次的术语具有不同的作用。随着版本的更新,LLT与首选语 (preferred tem,PT) 逐渐增多,被淘汰或不经常使用的术语不会被删除,但被标记为“非现行 (non-current)”,而目前在用的编码则标记为“现行 (current)”。最高一级的系统器官分类 (system organ class) 已长期保持26类 (表 2),预测MedDRA19.0版将会增加一类。
|
|
表 1 MedDRA的分级结构 (18.1版) |
|
|
表 2 MedDRA的系统器官分类 (SOC) (18.1版) |
26个SOC分类代表互不排斥的平行轴。MedDRA的术语具有“多轴性” (multiaxiality),即一个术语出现在多个SOC中,并根据不同的类别分组 (如: 按病因或发病部位)。一个LLT只能连接到一个PT, 而从PT以上,可以通过多条路径连接到上一个级 别水平的术语,即一个PT可以连接到几个HLT。一个HLT可以连接到几个HLGT,每一HLGT又可以连接到几个SOC分类。这种一个医学概念 (即PT) 隶属于一个以上的SOC的特性被称为“多轴性”。MedDRA的“多轴性”允许使用不同的分类对数据集的数据以不同的形式检索、演示和表达。组术语在本术语集中是预先定义的,不是由数据输入员特别选择的。更确切的说,在结构化的术语集中,选择了数据输入的术语后,会在各个层级中自动为其分配组术语。术语的多轴对应关系也是预先指定的,可确保在进行数据检索时无论选择哪个SOC,都可进行全面、一致的数据检索。需要注意的是,在多轴结构中,一个PT尽管可属于多个SOC分类,但其中只有一个被指定为主SOC (primary SOC),其余为次SOC (secondary SOC)。选择主SOC的目的是帮助MedDRA用户在数据分析时保证SOC分类统计的唯一性,避免汇总数据时重复计算。特别指出,在26个SOC中,3个没有多轴性,即“临床检查”、“外科与内科处置”、“社会环境”。
1.4 MedDRA代码及MedDRA编码术语选择在MedDRA中,代码 (code) 是指与每一个术语相对应的8位阿拉伯数字代码,即每个术语均有一个唯一的非表达性数字代码。非表达在此处表示这些代码本身不包含任何信息 (如层级结构中SOC分配的层级等)。每个类别下的每个术语都有一个指定的代码。这些代码按字母顺序分配,从12015110701开始。当有新的术语加入时,顺序产生一个新的代码。用过的MedDRA代码通常不会再用于新术语,但有些情况如术语被更名时 (如: 更正拼写),则原代码不变。每个代码在各个语言版本中代表相同概念。
MedDRA编码与MedDRA代码是两个完全不 同的概念。MedDRA代码是MedDRA术语本身固 有的,而MedDRA编码是对临床试验中收集到的医学术语进行标准化的一项工作过程。ICH指导委员 会的一个工作组制定了MedDRA术语选择的指导文件 (MedDRA term selection: points to consider)[2, 3],随MedDRA版本的更新而更新,旨在促进用MedDRA编码时术语选择的正确性与一致性,最终达到医学上有意义的检索、分析和报告。基于MedDRA进行医学编码时,术语选择应遵循以下10条基本原则: ① 源数据质量: 原始报告信息的质量直接影响数据产出的质量,对不明确、令人困惑或无法理解/识别的数据必须澄清。② 质量保证: 数据管理机构的编码指南应说明术语选择方法和质量保证程序,具有设计良好的资料收集表格、合格的编码人员和审核人 员,采用系统自动编码应确保结果能真实反映所报告信息的完整性。③ 不要改变MedDRA: MedDRA是标准化术语,具有预定义的术语层次结构,不能随意更改,如果发现不正确或不合理,应向MSSO提交变更请求。④ 总是先选择LLT: LLT最准确地反映报告的原文信息。⑤ 只选择现行的LLT: 避免用非现行LLT。⑥ 必要时的请求: 没有合适的术语用于反映报告的信息,可向MSSO请求。⑦ 使用临床判断: 如果找不到精确的匹配,通过临床判断合理地在现有术语中需找对应。⑧ 选择多条术语: 某些特殊的医学概念不能用一条术语代表时,可选择使用多条术语。⑨ 检查层级结构: 考虑LLT时,检查LLT之上的层次关系以保证能准确反映所报告术语的含义。⑩ 针对报告的所有信息且不得增加信息: 所报告的每一条信息都要给出术语选择; 如果仅仅是症状、体征信息,切勿选择诊断术语而妄图增加信息。
医学编码工作繁琐、精细、重要,编码员通常不仅需要具有医学背景并经过医学编码的专业性培训,还需要与临床科学家 (clinical scientist)、研究者、数据管理员乃至监察员通力合作。
1.5 标准MedDRA查询标准MedDRA查询 (standardized MedDRA queries,SMQ) 的产生源于MedDRA用户对采用标准查询工具获取安全性数据的需求,某种情况下,用户通过MedDRA获取某一疾病的数据,可以直接以疾病名称为检索术语进行检索,为了全面获取可能病例,有时会以该疾病相关症状、体征或实验室检查等术语为查询条件,因为这些症状、体征、实验室检查或其组合可能是该疾病诊断的依据。为满足这一需求,MSSO于2003年开发出SMQ,并随MedDRA更新而更新,保持同步发行。SMQ的制定是一个动态的过程,建议跟踪MedDRA、MSSO的网站更新[4]。
SMQ是一组与某特定疾病或关注点有关的MedDRA术语集合及在其基础上建立的查询策略,术语集合中的术语主要是PT,包括体征、症状、诊断、综合征、体格检查、实验室检查和其他生理检查数据等。SMQ旨在帮助识别和查询用MedDRA编码的数据库中可能相关的报告或病例。一个SMQ的检索范围有广义和狭义之分,狭义的检索范围用以确认与所关心问题高度相关的病例,即强调检索的特异性; 而广义的检索范围则检索所有可能的病例,即强调检索的敏感性。除检索范围有广狭之分外,SMQ还提供“滤网式”搜索选项,比如按照医疗诊断逻辑、特定的权重和算法可以有效地增强广泛检索范围的特异性。
2 MedDRA用于临床试验不良事件分析 2.1 临床试验不良事件信息的采集不良事件(adverse event,AE) 是指患者或临床试验受试者接受一种药品后体内发生的任何非有利的医学结果,但并不一定与治疗有因果关系。AE信息采集是临床试验安全性评价的基础性工作。一般来说,符合要求的AE信息应包括: 名称、基本描述、开始时间及结束时间、严重程度分级、干预治疗及医疗措施、对研究药物剂量的影响、与研究药物的关系、是否为严重AE (SAE)、转归情况、是否因不良事件而退出等[5]。AE管理是临床试验质量控制的重要组成部分,直接影响到试验的科学性和可信度,必须确保AE数据收集的及时性、准确性和完整性,为AE数据的标准化和编码分析奠定良好基础。
2.2 MedDRA用于不良事件编码MedDRA可用于医药产品的研发与应用的整个周期的行政管理,对医学信息进行分类、检索、报告与信息交流。其目标是提供一个全面、特异的术语集,简化药事管理过程,促进管理过程的标准化。MedDRA对于新药上市前后不良事件报告的电子传输,以及临床试验数据的编码尤其重要。世界卫生组织 (WHO) 1969年曾发布了专业的药品不良反应术语集WHO-ART (WHO adverse reactions terminology),在WHO各成员国和全球的制药企业和临床研究组织广泛使用,一直是不良反应术语合理编码的基础。WHO国际药物不良反应监测协作中心 (WHO Collaborating Centre for International Drug Monitoring) 乌普萨拉 (瑞典东南部城市) 监测中心 (Uppsala Monitoring Centre — UMC) 承担其维护工作。随着MedDRA的发展,2008年,UMC在Vigibase数据库中开始应用MedDRA术语 集进行编码。WHO-ART与MedDRA之间建立了基于文字匹配的映射关系,WHO-ART中所有的首选语都可以匹配到MedDRA中相应的条目。这种映射关系在每年3月份更新,方便了报告者在将不良反应报告提交WHO的同时,还可提交给其他组织机构。
由于MedDRA庞大的术语群,对数据量较大的不良事件数据库进行人工编码具有很大的难度,已开发一些可供检索和/或自动编码的工具。随着临床试验技术的不断进步,临床试验的数据管理呈现出电子化的发展趋势,电子数据采集(electronic data capture,EDC) 系统应运而生,日渐普及,有力地促进了MedDRA的应用和推广。有些EDC系统已具备用MedDRA进行编码的功能。系统可根据对AE的描述及逐词术语 (verbatim term) 与MedDRA中的LLT进行匹配,并转化成对应的代码 (即自动编码)。匹配机制可设计为精确匹配和模糊匹配,匹配结果给予提示,并经人工核定,确保匹配的成功率。成功匹配后给予系统记忆,下次遇相同术语时则可实现自动编码。当然,这里的人工核定有必要建立质量保证机制,以确保编码的准确性。据统计,即使使用自动编码工具也只可以完成约85% 不良反应词语的编码,剩余的仍需手工进行。图 1显示了借助EDC系统实现MedDRA编码的一般性流程。
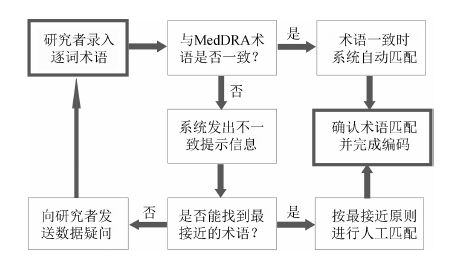
|
图 1 采用EDC系统进行MedDRA编码的一般性流程示意图 |
在ICH E3 (临床研究报告的结构与内容) 指导原则中,其第12点的安全性评价 (12. Safety Evaluation) 部分将安全性相关的数据分析分为3个层次[6],一是暴露的程度,二是一般的AE和实验室检查变化情况,三是SAE和其他重要的AE; 给出了由粗到细进行分析和表达的3种方法,一是用表格或图形展示汇总类数据,二是按单病例列举相关数据,三是特别关注事件的叙述性说明。笼统地分析不良事件数据,或者单个列举不良事件的常规做法都不容易获得安全性的全貌。ICH E3要求的不良事件列表形式颇为细致 (表 3),列举到每种不良事件及其对应的例数和发生率; 区分不同试验分组,按机体系统 (body system) 分类给出不同严重程度 (轻度、中度、重度)、不同相关类别 (有关、无关) 下的不良事件汇总。有人认为此表列举太过详细,但ICH 2012年发布的针对E3的问题和解答 (questions & answers) 中坚持,该表只要求列出发生不良事件的患者识别号 (ID),无需个体的更加详细信息,仍然只是数据汇总表格[7]。有学者认为该表按机体系统对不良事件分组归类的方法对揭示药物的安全性特点具有重要作用。目前,进行不良事件分析时经常采用MedDRA的SOC分类法也正是体现了ICH E3的思想。表 4给出了目前不良事件分析时可供使用的一种基于MedDRA的SOC分类综合统计表形式。
|
|
表 3 ICH E3建议的不良事件统计汇总列表示例 (治疗组X,n = 50). *N11为患者的识别号,其他类同 |
|
|
表 4 不良事件按SOC和PT分类的统计汇总列表示例. +: 发生AE超过1次的病例数; #: 系统器官分类 (SOC); *: 首选语 (PT) |
MedDRA是一套在医药产品研发与应用整个周期中使用的以药事管理为目的的医学术语集,其涵盖范围广泛,实现了临床试验医学术语的标准化。不良事件报告和分析作为临床试验安全性评价的重要内容,关键在于信息采集的准确性和标准化,MedDRA的应用很好地推进了这些工作的深入。MedDRA编码工作的推行必将对我国不良事件的规范管理、统计分析乃至整个临床试验的规范化运作产生深远和积极的影响。
| [1] | Bo QY, Xiong NN, Zou JD, et al. Internationally agreed medical terminology: medical dictionary for regulatory activities [J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2007, 12: 587-590. |
| [2] | International Conference on Harmonisation (ICH). Meddraterm selection: points to consider. ICH-Endorsed Guide for MedDRA Users, Release 4.10. Based on MedDRA Version 18.1 [EB/OL]. http://www.meddra.org/sites/default/files/guidance/file/9491-18 10_termselptc_r4_10_sep2015.pdf. |
| [3] | International Conference on Harmonisation (ICH). MedDRA DATA RETRIEVAL ANDPRESENTATION: POINTS TO CONSIDER. ICH-Endorsed Guide for MedDRA Userson Data Output, Release 3.10 Based on MedDRA Version 18.1 [EB/OL]. http://www.meddra.org/sites/default/files/guidance/file/9610-1810_datretptc_r3_10_sep2015.pdf. |
| [4] | Hou YF, Tian CH, Liu CL, et al. Analysis and implications of standardised MedDRA queries [J]. Chin J Pharmacovigilance (中国药物警戒), 2011, 8: 438-441. |
| [5] | Liu YX, Yao C, Chen F, et al. Safety assessment in randomized controlled clinical trials [J]. Natl J Androl (中华男科学杂志), 2004, 10: 74-79. |
| [6] | ICH. ICH Harmonised Tripartite Guideline: Structure and Content of Clinical Study Reports (E3, Current Step 4 version, dated 30 November 1995) [EB/OL]. http://www.ich.org/filead min/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E3/E3_Guideline.pdf. |
| [7] | ICH E3 Implementation Working Group. ICH E3 Guideline: Structure and Content of Clinical Study Reports-Questions & Answers (R1) (Current version, dated 6 July 2012) [EB/OL]. http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E3/E3_QAs_R1_Step4.pdf. |
 2015, Vol. 50
2015, Vol. 50


