临床试验质量管理的重要内容是保证数据质量,而对源数据进行规范管理则是保证数据质量的关键[1]。我国《药物临床试验质量管理规范》规定: “病历作为临床试验的原始文件,应完整保存。病例报告表中的数据来自原始文件并与原始文件一致,试验中的任何观察、检查结果均应及时、准确、完整、规范、真实地记录于病历和正确地填写至病例报告表中”[2]。临床试验病例报告表中的每个数据都应该有其对应的源数据和源文件,以便核实、溯源和重建[3]。
随着临床试验技术的不断进步,临床试验的数据管理呈现出电子化的发展趋势[4, 5]。因研究者、申办方或合同研究组织 (contract research organization,CRO) 观念、经费和管理要求的不同,以及技术水平的差异,当前我国临床试验的源数据处于纸质和电子形式并存的状态。
本文件为临床研究者、申办方、合同研究组织和相关的监管部门在临床试验中参与源数据收集、审核、存档的人员提供质量管理要求,目的是确保源数据的真实性、可靠性、完整性和可溯源性。
1 源数据定义及相关概念 1.1 源数据源数据 (source data) 是指临床试验中的原始记录或其核证副本 (certified copy) 上记载的所有信息,包括临床发现、观测结果以及用于重建和评价该试验所必须的其他相关活动记录 (ICH E6-GCP)[1, 6, 7, 8, 9]。这些数据的载体都是客观存在的,可以是纸质文件的形式,也可以是计算机系统中的电子形式。前者可称为纸质源数据,后者称为电子源数据。纸质源数据包括临床试验期间来源于申办者、研究者、受试者等各方相关活动并以纸质载体呈现的原始记录、报告或其核证副本上的所有信息。电子源数据包括最初就以电子形式记录和储存的临床试验相关活动的所有信息。
1.2 源文件源文件 (source document) 是指临床试验中产生的原始文件、数据和记录。源文件可以是纸质的或电子的,其中包含了源数据[8, 9]。例如,医院病历、医学图像、实验室记录、备忘录、受试者的日记或评估清单、药房发药记录、仪器自动记录的数据、缩微胶片、照相底片、磁介质、X光片,以及保存在药店、实验室和参与临床试验的医技科室的相关文件和记录,包括复制或抄录的核证副本。
1.3 数据单元数据单元 (data element) 指记录受试者观测结果的最小单位[8, 9]。事实上,所有源数据中反映事物某一特征的最小单位均可视为数据单元。源数据是由一系列数据单元构成的逻辑集合。例如,受试者的血常规检验报告单,其中的源数据就是由受试者的年龄、性别、红细胞计数、白细胞计数、血小板计数等数据单元构成的。
1.4 数据单元标识符数据单元标识符 (data element identifiers) 是电子源数据独有的并与数据单元关联的、用于定义和识别该数据单元的一组信息[8, 9],通常包括数据单元生成的系统日期、时间以及该数据单元所属的受试者编号等。一旦将数据单元录入到计算机系统,该信息即由系统自动生成且无法变更。数据单元标识符主要 用于帮助申办方、监管部门和其他授权机构审查电子 源数据中的稽查轨迹和支持电子数据系统间的传输。此外,数据单元标识符也有助于监管部门对临床试验的重建和评价。电子数据采集系统 (electronic data capture,EDC系统) 以及在此系统中建立的电子病例报告表 (electronic case report form,eCRF) 应该具有显示数据单元标识符信息的功能。
2 源数据形式源数据有纸质和电子两种形式。
2.1 纸质源数据纸质源数据表现于纸质载体上,其来源和表现可以是多样化的。一般可分为以下几种类型:
① 由研究者或研究助理首次填写产生的数据。例如: 门诊病历; 住院病历。
② 受试者根据试验要求亲自填写产生的数据。例如: 日记卡; 临床结果自我评估表; 知情同意书等。
③ 经过验证的受试者电子临床结果评估系统产生的首次以纸质形式呈现的数据。例如: 检验科室的检验报告单; 检查科室的检查报告单; 临床试验药物分发和管理文件。
④ 其他源数据。由研究人员或受试者记录的数据,例如临床试验过程中首次产生的原始笔记、备忘录、药房配药记录等相关的纸质工作文件。
⑤ 以上源数据的核证副本。例如誊抄在纸质病例报告表中的被主要研究者签字认可的原始数据。
2.2 电子源数据电子源数据以电子形式附载于计算机系统中,这些数据的生成和表现也是多样化的[8]。一般可以分为以下几种类型:
① 经过验证的电子数据采集系统中由研究者现场直接录入产生的数据。
② 受试者或研究者电子临床结果评估系统 (electronic clinical outcome assessment,eCOA) 直接产生的以电子形式存储并可以实现传输的数据。这 些系统均需要符合监管部门的要求。例如: 电子日记 (electronic diary,eDiary); 电子患者报告结果系统 (electronic patient reported outcome,ePRO); 电子医生报告结果系统 (electronic physician reported outcome) 等。
③ 检验报告、检查报告、药物分发管理等过程中,由经过验证的电子系统直接产生和电子形式存储的,并通过验证的系统传输过程而获得的数据。例 如: 中心实验室的实验室信息管理系统 (laboratory information management system,LIMS),存储了各类实验室指标的检测结果和专业评估报告; 医学影像检查科室的医学影像存档和通信系统 (picture archiving & communication system,PACS),存储了各类医学影像的检查结果和专业评估报告; 受试者的动态血压、心电生理、脑电生理等监测设备,存储了所记录的监测结果和专业评估报告; 药物分发和管理系统记录的有关数据; 其他,如中央随机化系统记录的有关受试者随机分配的信息等。
④ 电子健康/医疗档案 (electronic health/medical record,EHR/EMR) 中存储的源数据。病例报告表中同时出现在电子健康档案中的有关内容,相应的数据可从电子健康档案中直接导出。值得注意的是,当使用电子健康档案系统的机构进行临床试验时,申办方必须评估所使用的电子健康档案系统能多大程度满足临床试验要求,用于临床试验源数据载体的电子健康档案系统必须经过系统验证,至少应具备可靠的稽查轨迹记录功能和完善的权限管理体系[4]。
2.3 电子源数据的优势随着医院信息化的不断进步和电子数据采集系统的应用,临床试验中的纸质源数据逐步被电子源数据替代。相比纸质源数据,电子源数据表现出诸多的优点[6, 7, 8],例如:
① 电子源数据直接输入/传输至电子病例报告表或电子数据采集系统,减少了数据的转录环节,避免了数据转录过程中的人为疏失,增加了数据的唯一性和共享性。
② 提高了数据采集的准确性和完整性。当数据以电子形式录入或传输,可通过启动实时系统预设的逻辑核查程序自动实现数据的实时核查,既提高了工作效率,也能更好保证临床试验数据质量。
③ 实现了数据的远程实时监查。通过在线实时访问,能及早掌握研究进展,及早发现问题,尤其是临床试验安全性方面的问题,节省了临床监查员用于数据核查的时间和费用。
④ 电子系统的可溯源性使源数据的任何更改均留有痕迹,这一机制可有效地防范篡改、伪造数据等不端行为,也使同时性得到保障。
⑤ 大大减少了从数据录入、清理、质疑管理到数据审查和锁库的时间。
3 源数据的管理要求源数据在使用和操作过程中应遵循以下的管理要求[6, 7, 8, 9]。
3.1 根据研究目的和要求选择合理的数据采集方式选择不同数据采集方式时,应该考虑且不限于以下因素: ① 试验的分期; ② 监管部门对试验数据质量的要求; ③ 申办方对访问数据和频率的要求; ④ 研究机构的条件和经验; ⑤ 研究机构人员对数据采集技术的经验; ⑥ 研究项目的连贯性等。
申办方授权选择的数据采集方式应记录在数据管理计划中。
3.2 可溯源性(traceability)应清晰记录从源数据到最后的分析数据集整个流程。每个源数据的产生者、产生日期和时间、源数据及其归属者 (如受试者) 的关系、源数据修改时的原因及其相关证据等,均应清楚地体现在源数据的质量监管链中[8]。数据溯源举例见表 1。
|
|
表 1 数据溯源举例 |
包括ALCOA+CCEA共9点要求。
① 可归因性 (attributable): 源数据系统应记录有关数据的产生者,或从哪些电子源系统派生而成的。
② 易读性 (legible): 应按当地的法规要求,选用适当语言,并力争做到源数据的术语和定义清晰明了易读。尽可能地用临床数据交换标准协会 (Clinical Data Interchange Standards Consortium,CDISC) 标准术语。
③ 同时性 (contemporaneous): 数据系统中的临床试验观察及其记录,应及时和尽量实时采集。
④ 原始性 (original): 应确保原始记录及其核证副本的原始性。
⑤ 准确性 (accurate): 应通过人员培训、仪器校正和电子系统验证等措施确保数据的准确性。
⑥ 完整性 (complete): 应使用核查程序以了解数据的完整性。
⑦ 一致性 (consistent): 同一数据在不同的数据系统中应保持一致性。
⑧ 持久性 (enduring): 源数据应能长久地保存在源数据系统中,直到法规要求的时间。
⑨ 可用性 (available): 源数据应以适当的格式输出,例如: CDISC操作数据模型 (operational data model,ODM)、可扩展标记语言 (extensible markup language,XML) 等,以便审阅。
3.4 源数据的更正必须取得合理的授权稽查轨迹应记录源数据的产生和其更正的全部过程,包括更正人、更正时间和更正理由。
3.5 研究者应保存完整的源文件或其核证副本在整个研究和审查过程中,研究者应能随时访问源数据或其核证副本。当复制电子源数据时,其过程应确保该副本与原件完全一致。
3.6 申办方不应独有电子源数据的控制权防止未经授权者对电子源数据的访问。研究者应该独有控制电子源数据的修改权限。
3.7 应当采取必要的措施保证源数据的安全性由于电子源数据和纸质源数据载体的介质不同,因而需采取不同的安全防范措施。
4 源数据的生命周期在源数据产生之前,用于记录观测结果的介质 (纸质或电子) 是空白无内容的,不具有被法规部门监管的意义。该介质可能是受试者的医疗记录 (例如: 医院的临床病历),也可能是一个等待填写的纸质或电子病例报告表。当研究者按临床试验方案的要求,开始记录数据,介质将成为具有被法规监管意义的一个源文件,其中的数据则成为源数据。整个过程应按临床试验要求进行监管,并在研究结束后,保留源数据至要求期限,经申请进行销毁。
为了进一步了解对源数据的定义和质量管理要求,以下是对源数据产生到生成分析数据集的整个生命周期 (包括空白介质、填写转录、归档和研究结束共四个状态) 的相应说明[7]。一般来说,该过程包括8个步骤 (图 1),即: 准备、采集、控制和访问、核查和更正、保存、审查和监管、产生核证副本和过期处理。
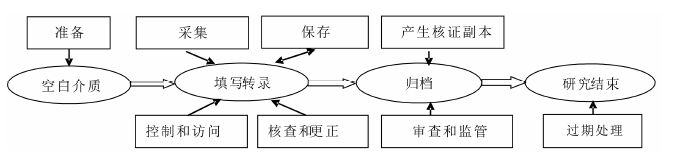
|
图 1 源数据的生命周期图 |
从数据收集的完整性和连贯性考虑,应预先制定源数据生成方案,避免源数据收集过程可能发生的遗漏或错误。应按临床试验方案设计的目的和要 求,选择和设计病例报告表、患者日记卡或其他数 据采集介质等,明确收集数据的具体方法,按数据单元的逻辑性合理地集合成源文件。使用CDISC临床数据获取协调标准 (clinical data acquisition standards harmonization,CDASH) 设计能提高病例报告表设计质量和采集效率,并能减少数据转换过程中的错误,增强其连贯性和易读性。
4.2 采集在数据采集的过程中,需确保采集数据的一致性。编写CRF填写指南并在填表前对研究者进行填写培训,涉及到受试者需要填写的表单也需将注意事项告知受试者,这样可以帮助提高数据采集质量,确保数据填写的及时性、准确性和完整性。
电子源数据采集时,申办方应对源数据的产生者 (如相关人员、系统、设备和仪器等) 进行授权、管理和维护并应用在各个研究机构。就受试者电子临床结果评估系统产生的源数据而言,受试者应被列为源数据产生者。
需要注意的是,应确保数据采集方式和过程在各研究机构的一致性。统一培训和编制电子数据采集系统操作指南可以帮助提高数据采集质量。数据管理计划中应说明从源数据到最后的分析数据集的整个流程。
当所用的系统、设备或仪器能导入成电子临床数据采集系统中的数据单元时,还应要求其能同时生成数据单元标识符,用来关联对应的系统、设备或仪器的源数据。例如,心电图仪若能自动将数据传输到电子病例报告表上,则生成的数据单元应能通过数据单元标识符自动关联到心电图仪上对应的源数据。当电子设备或仪器自动将第三方产生的数据传输至电子数据采集系统或者数据管理系统时,该传输过程在实施前应当通过系统验证,以确保实施无误。
4.3 控制和访问研究者应具有在其研究机构产生的源数据的控制权。当使用电子病例报告表时,研究者通过授权账户直接控制电子病例报告表/电子数据库中的源数据录入、修改、审阅及签字。在使用纸质病例报告表的情况下,研究者全权监控纸质病例报告表中的源数据,并通过数据澄清表授权数据录入人员对电子数据库中的源数据进行修改。如果数据的采集和存储是在申办方全权控制下的中央服务器上,申办方不应拥有电子源数据的唯一控制权,同时也不应具有对电子数据采集系统中研究者录入数据的修改权。为了满足源数据质量管理的要求,除了申办方保留在中央服务器上的记录外,临床研究机构也应保存一份完整的电子数据库源数据的核证副本 (如刻录在只读CD上的数据库数据/文件)。
电子源数据的访问需要授权和设置权限,以保护受试者的权益和避免未经授权的更改。申办方和监管机构应拥有对电子源数据的访问和审查权限。访问权限以及访问级别 (如用户帐户) 应有明确的规定。
4.4 核查与更正源数据的核查应参照ICH E6和我国临床试验法规的相关规定[1, 2, 3]进行。源数据的核查是保证临床试验数据真实完整的重要步骤,是临床监查员的基本职责,也是源数据从原始记录被誊写或转录过程中必不可少的质量控制步骤。源数据的更正需获得研究者的授权和同意。为了提高数据的完整性、及时性,稽查轨迹应记录源文件的产生和所有源数据更正的历史。当对纸质源数据进行更正时,应使用数据澄清表。数据质疑过程通常是由监查员或数据管理员在核查数据的过程中发现数据疑问后发起的,由研究者完成答疑后,监查员或数据管理员对答疑数据无异议后完成。更正前后数据应确保清晰可辨,并注明更正人、更正时间和更正理由。受试者填写日记卡后发现有错误时,应向研究者报告,并更正数据中的错误,注明更正人、更正时间和更正理由以维护稽查轨迹。
电子源数据只有临床研究者或经授权的临床工作人员才有权更正。更正数据后,相应的数据单元标识符中必须有数据更改的日期、时间、更改者及更改原因等记录,且不能抹去之前的数据。在稽查轨迹中,自动传输数据的仪器或系统应该具有追溯的功能,用以记录数据更改的情况。数据产生者录入的数据单元都应附有数据单元标识符。尽可能利用电子病例报告表中的即时提示与数据核查功能以减少数据录入过程中的错误与缺失。即时提示功能可用于提醒数据产生者关于缺失、不合逻辑或不合要求的数值,如: 日期超出预定范围等; 也可用于在恰当的地方提醒数据产生者填写更多的附加信息,如: 若出现异常的实验室检查值,则提醒研究者判断并填写相关的不良事件记录。
4.5 保存应确保源数据合理的保存和归档,以保证数据的完整性和持久性。相应的标准操作规程应具体规范源数据的保存环境和档案室人员管理的要求。纸质源数据应受到妥善保护,如注意档案室的温度、湿度,是否防水、防火和防虫等,以免遭受损坏。重要文件或某些特殊的数据文件 (如热敏纸记录的数据文件等) 应该以扫描方式转化成保存更久的电子核证副本文件。此外,所有的数据及其文件,包括更改的相关文件都应当保存完整,以便申办方和/或研究者以及监管机构对纸质或电子源数据或文件的证据链作出审查和稽查。对电子源数据而言,数据管理计划中应说明源数据的保存方法、时间、系统、人员和相应的供应商。由于采集或存储数据的供应商可能是独立于申办方和研究者的另外一个法律实体,应签署详细的合同并在合同中规定服务提供商的职责。
4.6 审查和监管源数据质量控制应确保收集到的所有数据符合ALCOA+要求。临床研究者应严格遵循数据收集的有
关要求,并对每位受试者的源文件进行审核并视不同的情况采用手工签名或电子签名。在特定情况下,某些病例报告表中涉及设盲的数据可以不经研究者审核,例如在渗透性利尿药物的盲态研究中,尿液渗透压不应该提供给临床研究者,避免破盲。经常使用的操作方法是配备另一组无涉及该试验管理的独立人员进行平行管理该项数据。相应的操作方法应在相关文件 (如数据管理计划) 中明确说明。监管机构或申办方 (例如临床监查员) 应对原始数据进行核查。可供查阅的源数据应具有完整的记录,包括原始数据及其修改历史。
4.7 产生核证副本应确保源数据的核证副本是完整而准确的。完整的核证副本认证应包括数据、日期格式、说明文字、数据格式、签名和授权以及完整的稽查轨迹。各临床研究机构应具有审阅数据并获得核证副本的能力。数据管理计划中应有对核证副本进行认证的流程说明。
4.8 过期处理根据源数据质量管理要求,源数据应能长久地保存在源数据系统中,直到监管部门要求的文件保存期限。为了减少不必要的文件存储,过期后的文件可采取销毁的方式予以处理。申办方如果对文件保存时间有特别要求,应与临床研究机构事先约定。文件销毁规程应当通过标准操作规程加以管理,并有清晰的记录在案备查。
| [1] | FDA. ICH guidance for industry E6 Good Clinical Practice: Consolidated Guidance. 2012. http://www.fda.gov/Drugs/Gui danceComplianceRegulatoryInformation/Guidances/default.htm. |
| [2] | CFDA. Good Clinical Practice (药物临床试验质量管理规范) [S]. 2003. http://www.sda.gov.cn/WS01/CL0053/24473. html. |
| [3] | Center of Drug Evaluation, CFDA. Technical Guidelines for Data Management in Clinical Trials (临床试验数据管理工作技术指南) [S]. 2012. http://www.cde.org.cn/news.do?method=largeInfo&id=312673. |
| [4] | FDA. Code of Federal Regulations, Title21 part 11: Electronic Records; Electronic Signatures-Scope and Application [S]. 2003. |
| [5] | FDA. Guidance for Industry on Computerized Systems Used in Clinical Investigations [S]. 2007. http://www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/default. htm. |
| [6] | EMA. eSource Reflection Paper [EB/OL]. 2010. http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_ and_proc edural_guideline/2010/08/WC500095754.pdf. |
| [7] | CDISC. CDISC's eSource Data Interchange document (eSDI) [EB/OL]. 2006. http://www.cdisc.org/system/files/all/cdisc_blog_entry/applicat ion/pdf/esdi.pdf. |
| [8] | SCDM. eSource White Paper [EB/OL]. 2013. http://www. scdm.org/sitecore/content/be-bruga/scdm/Publications/white%20paper.aspx. |
| [9] | FDA. Guidance for Industry on Electronic Source Data in Clinical Investigations [S]. 2013. http://www.fda.gov/down loads/Drugs/GuidanceComplianceRegulatoryInformation/Guid ances/UCM328691.pdf. |
 2015, Vol. 50
2015, Vol. 50


