2. 福建医科大学, 福建 福州 350005
2. Fujian Medical University, Fuzhou 350005, China
华法林 (warfarin) 为香豆素类口服抗凝药,迄今被广泛应用于瓣膜病、瓣膜置换术后、房颤、肺栓塞和深静脉血栓等的治疗。但在临床应用中除药效 滞后外,还同时存在抗凝治疗窗窄、剂量个体差异 大、疗效与安全性影响因素多等特点,用药初期往往需要频繁监测与剂量调整,给临床带来极大的不便与一定的风险。华法林在中国人群的群体药动学/药效学 (population pharmacokinetic/pharmacodynamic,PPK/PD) 研究尚未见报道。本文通过收集接受华法林抗凝治疗患者的多个谷浓度血样及相关临床信息,采用HPLC-UV法测定华法林血药浓度,PCR-限制性内切酶法 (PCR-RFLP) 检测患者CYP2C9及VKORC1基因分型,并应用NONMEM软件定量考察患者性别、年龄、体重、CYP2C9及VKORC1基因分型、疾病状况、合并用药及随机变异等对华法林血药浓度与国际标准化比值 (international normalized ratio,INR) 的影响,建立华法林PPK/PD模型,以备后续用以提前模拟患者服用不同剂量华法林后的血药浓度和INR值,为临床个体化给药提供参考。
材料与方法
研究对象 本研究经福建医科大学附属第一医院医学伦理委员会批准,选取接受华法林钠片 (3 mg/片,芬兰奥立安集团) 抗凝治疗的本院住院患者,并征得受试知情同意。建模共收集73例患者,190个血药浓度数据及263个INR值,患者资料见表 1,其中合并用药主要考察使用例数超过总例数的10% 者,包括胺碘酮、地高辛、螺内酯。
基因型检测采集患者空腹12 h以上的外周静脉血2 mL置EDTA-Na2抗凝管中,4 ℃冷藏,24 h内提取DNA,采用PCR-RFLP法测定CYP2C9*3及VKORC1-1639 G/A基因型[1] (限制性内切酶Nsi I、Msp I,美国赛默飞世尔科技公司)。
|
|
Table 1 Demographic data of the patients for modeling. INR: International normalized ratio; ALB: Serum albumin; Scr: Serum creatinine; Clcr: Creatinine clearance rate; NYHA: New York Heart Association |
采集患者服用华法林后不同时间的谷浓度血样2~4个,按本研究参照文献[2]建立的HPLC法测定浓度。测定时精密吸取250 μL血浆样品置试管中,依次加入80.0 μg×mL-1的地西泮内标储备液12 μL、1 mol·L-1盐酸缓冲液100 μL、有机溶剂 (环己烷-二氯甲烷,9∶1) 3 mL,涡旋振荡2 min,4 000 r×min-1离心5 min,取上层有机相2 mL,40 ℃水浴氮气挥干,残渣用流动相200 μL复溶,10 000 r×min-1离心3 min,取20 μL进样,进行色谱分析。色谱条件: Nova-pak C18色谱柱 (150 mm × 3.9 mm,4 μm); 流动相为甲醇-0.5%醋酸 (60∶30); 流速0.9 mL·min-1; 检测波长305 nm; 柱温30 ℃。
标准曲线及回收率、精密度 血浆华法林标准 曲线回归方程为: 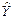 = 0.144 4 X + 1.026 4 (r = 0.999 4,n = 7),线性范围为0.048~2.500 μg×mL-1,最低检测限为0.016 μg×mL-1。方法回收率及精密度均符合生物样品分析要求。
= 0.144 4 X + 1.026 4 (r = 0.999 4,n = 7),线性范围为0.048~2.500 μg×mL-1,最低检测限为0.016 μg×mL-1。方法回收率及精密度均符合生物样品分析要求。
建立华法林用药记录单,准确记录患者性别、年龄、身高、体重、服药剂量、服药时间、采血时间、肝肾功能、合并用药 (胺碘酮、地高辛、螺内酯、抗菌药等)、主要诊断、心功能NYHA分级、基因型与血药浓度检测结果及相对应的INR值(由我院检验科采用SYSMEX试剂、凝固法测定凝血酶原时间PT后计算所得)。并将患者信息编写成NONMEM数据CSV文件。
数据分析应用NONMEM软件 (VersionⅥ,ICON,USA); FOCE-I算法。
建立基本模型分别尝试一房室和二房室模型描述华法林药动学过程,参照文献[3]采用最大效应模型 (Emax-model) 群体药效学建模方法,编写Fortran控制代码,并运行NONMEM程序对数据进行拟合,以模型目标函数值 (objective function value,OFV)、拟合优度及参数合理性为标准进行筛选。最后选择 一房室模型拟合PPK,Emax模型拟合PPD。其中吸收速率常数Ka参照文献[4]定为0.362 h-1,药动学参数 包括华法林的清除率CL和表观分布容积V。药效学参数包括药效消除速率常数KE0、最大效应Emax、半数有效浓度EC50。参数的个体间变异采用指数模型 Pi = P × eηi (Pi为第i个患者的某药动学或药效学参数,P为该参数的群体典型值,ηi是呈正态分布、均数为0、方差为ω2的个体间变异)。个体内随机效应 (残差) 采用指数模型Y = F × eε (Y为患者的血药浓度或INR观测值,F是Y相应的模型预测值,ε是呈正态分布、均数为0、方差为σ2的残差变异)。
筛选协变量,建立最终模型基本模型确定后,应用NONMEM程序贝叶斯反馈法计算基本模型个体药动学、药效学参数,并通过趋势图初步考察协变量 (固定效应因素) 如性别、年龄、体重、CYP2C9*3、VKORC1-1639G/A基因型、肝肾功能、心功能分级、高血压、合并用药等对药动学、药效学参数CL及EC50的影响,筛除无关的协变量,而后通过假设检验向前包容法和向后剔除法确定某一协变量对参数是否存在显著影响。向前包容法即在基本模型基础上用加法、乘法、指数等模型 (取使OFV和变异值最小者) 逐一加入各协变量,若OFVmin下降大于3.84 (P < 0.05),予以保留在模型中,否则剔除,按此标准逐一考察所有协变量,最后得到全回归模型。向后剔除法[5]则是从全回归模型中逐一剔除协变量,考察此因素存在的必要性。此时用更严格的统计学标准进行检验,若剔除某协变量后,模型OFV值上升大于6.63 (P < 0.01),表示该因素的存在具显著意义,应留在模型中,否则剔除。依此,逐一剔除使OFV值上升小于等于6.63的协变量,即得最终模型。最终模型的确定基于参数的估算精度、拟合优度和最小目标函数值。
群体药动学/药效学模型评价 模型的评价采用拟合优度诊断和统计学方法检验。拟合优度通过散点图诊断。统计学检验则分别由非参数自举法 (Bootstrap) 通过1000个自举数据集考察模型的稳定性和内部有效性[6],由蒙特卡洛法产生1 000套模拟数据集进行正态化预测分布误差 (normalized predictive distribution error,NPDE)[7]验证模型的预测性能。
结果1 最终模型
影响因素筛选过程显示,VKORC1基因分型对华法林的EC50存在显著影响,体重和CYP2C9基因分型对华法林的相对清除率 (CL) 存在显著影响,分别使OFV值下降8.354、7.919、7.425; 而性别、年龄、心功能分级、血清白蛋白、血肌酐、高血压及合并应用胺碘酮、螺内酯、抗菌药等因素均不影响华法林的药动学或药效学参数。其中,CYP2C9和VKORC1确定以乘法模型进行拟合,体重则以幂函数模型加入。最终模型表述如下式1~6,各参数估算值见表 2。
| CL = θCL·(WT/60)θWT·θCYP·eηCL (if CYP2C9*1/*1, θCYP = 1; if CYP2C9*1/*3,θCYP = 0.708) | (1) |
| V = θV | (2) |
| KE0 = θKE0 | (3) |
| Emax = θEmax | (4) |
| EC50 =θEC50·θVKOR·eηEC50 (if VKORC1-1639AA, θVKOR = 1; if GA,θVKOR = 2.01) | (5) |
| E0 = θE0·eηE0 | (6) |
药动学/药效学参数CL、V、KE0、Emax、EC50、E0分别为华法林的清除率、表观分布容积、药效消除速率常数、最大效应、半最大效应浓度及基线效应; θ为相应参数的群体典型值,其中θCYP和θVKOR分别为协变量C YP2C9*3和VKORC1-1639G/A基因型对应的系数; θWT为体重对清除率影响的幂值; η为呈正态分布,均数为0,方差为ω2的参数个体间变异。
|
|
Table 2 PPK/PD parameter estimates and results of bootstrap analysis for the final model. θCL,θV,θKE0,θEmax,θEC50,and θE0 were the population parameters typical value of warfarin clearance,apparent volume of distribution,efficacy elimination rate constant,maximum effect,concentration for half maximal effect and baseline effect; θCYP and θVKOR respectively for CYP2C9 and VKORC genotype corresponding coefficient; θWT, power value for the effect of body weight on clearance; ω,coefficient of variation for inter-individual variability; σ,coefficient of variation for proportional residual error; RSE,relative standard error; [p2.5,p97.5],95% Confidence interval. Relative bias (%) = |(Boot strapmedian - Final model estimate)| / Final model estimate × 100 |
从诊断图 1A、C可见,无论PK指标血药浓度 还是PD指标INR,最终模型的群体预测值 (PRED)、个体预测值 (IPRE) 与实测值 (DV) 的拟合优度均良好,且血药浓度和INR的加权残差 (WRES) 对PRED、时间 (Time) 及患者编号 (ID) 的散点图 (图 1B、D) WRES值大部分分布于 ± 2之间,表明模型的趋势性偏差呈均匀分布,模型拟合效果理想,浓度及INR预测值能较准确地反映实测值。

|
Figure 1 Diagnostic plots of concentrations and INR in the final model. WRES: Weighted residual; ID: Patient identification number. A: Population predicted and individual predicted concentrations vs observed concentrations; B: Concentrations WRES vs population predicted concentrations,ID and TIME; C: Population predicted and individual predicted INR vs observed INR; D: INR WRES vs population predicted INR,ID and TIME |
应用R for NONMEM程序对自举成功的各参数进行统计分析,结果见表 2; 由Bootstrap法自举数据集估算的参数值与由原数据集估算的参数值接近,各参数相关偏差均不超过6.3%,且由原数据集估算的参数值都落在Bootstrap估算参数值的95%置信区间,即[2.5%,97.5%]的百分位数范围之内,且95%置信区间均不包括0,提示由原数据集建模的参数估计是无偏倚估计,模型具有较好的稳定性和内部有效性。
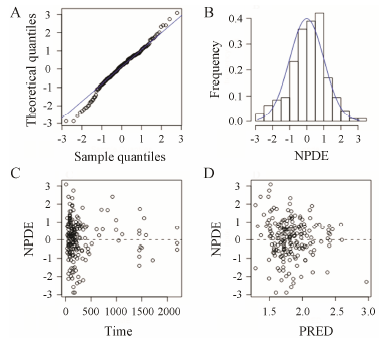
4 模型预测性能验证NPDE验证结果如图 2,分位数图 (Q-Q图) 和NPDE分布图均显示符合正态分布。Wilcoxon符号秩和检验P = 0.093,Fisher方差检验P = 0.204,Shapiro- Wilks正态分布检验P = 0.090,整体检验P值为0.269,各P值均 > 0.05,进一步证明NPDE方差齐性且符合正态分布,所建模型具有较强的预测能力。
讨论华法林通过抑制维生素K依赖性凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的合成,产生抗凝作用。由于对已经合成的上述凝血因子并无直接对抗作用,导致其抗凝疗效明显滞后,约需5天后,待消除半衰期最长的凝血因子Ⅱ(半衰期50~90 h) 耗竭才出现最大抗凝效应[8]。临床研究发现,华法林口服给药后3~9 h或更快达血药浓度峰值,而抗凝作用达高峰在2~7日后,凝血指标INR值达稳定的时间则可为16天[9]。华法林
|
Figure 2 NPDE metrics for the population PK/PD model of warfarin. A: Normal quantile-quantile plot for NPDE; B: Distribution of NPDE; C: NPDE versus time; D: NPDE versus PRED |
治疗窗窄,加上客观存在的药效明显滞后和不可忽视的个体差异,难以常规应用药动学原理优化给药方案。本研究通过探讨给药信息、血药浓度与疗效指标INR的关系,将PK特征与PD特征及患者个体因素联系起来,建立华法林PPK/PD模型,可望能更好地辅助华法林的个体化给药。
本研究应用NONMEM法建立PPK/PD模型,可实现INR“点对点”的预测,即通过Bayes反馈,可以模拟特定患者服用不同剂量华法林后的INR预测值,再根据临床期望的目标INR值,选择适宜的给药剂量。本法有别于 传统多元线性回归剂量算法的优点在于: ① 避免了传统剂量算法以单一INR治疗窗为目标而忽略不同疾病或个体因治疗窗改变可能存在
剂量需求不一的情况; ② 避免传统剂量算法可能出现的不整剂量 (如计算值为2.668 mg) 造成的给药误差; ③ 本法不仅可根据已经确认的预测因素给出个体化的起始剂量,还可通过观察患者用药后临床反馈数据,再次或多次进行模拟与预测,从而提高早日实现目标INR的成功率或避免过度抗凝。
本研究基于NONMEM法建立的中国人华法林PK/PD模型显示患者体重、CYP2C9、VKORC1基因多态性是影响华法林PK/PD的重要因素。其中,体重、CYP2C9基因型主要影响华法林药动学参数,VKORC1基因型主要影响华法林药效学参数。华法林清除率 (CL) 群体典型值为0.162 L·h-1,半数有效浓度 (EC50) 群体典型值为2.62 μg·mL-1,分别与Hamberg等[3]报道的0.139 L·h-1和2.2 μg·mL-1相近。
有文献[10]报道CYP2C9*3型突变主要为1 075位碱基序列由A突变成C,相应第359位氨基酸也由异亮氨酸 (Ile) 突变为亮氨酸 (Leu),由于异亮氨酸参与了酶的活性构件,突变型改变了酶结构,从而降低了酶的催化能力。因此,在携带CYP2C9突变基因的个体中,华法林总清除率降低,导致对华法林的需求剂量降低或出血并发症发生率增加。此结果也可解释对于CYP2C9*1/*3基因携带者,本法估算华法林清除率时需乘以系数0.708。本研究发现携带VKORC1-1639GA的患者,EC50增大到2.01倍,因此与VKORC1-1639AA基因携带者相比,要加大华法林抗凝剂量,与文献[3, 11]报道的结果相似。其可能机制为,VKORC1-1639G/A等位基因中,碱基G能够将该基因启动子的活性增加近50%,从而使得VKORC1 mRNA表达增加,进而引起VKORC1活性增强,生成了更多的凝血因子[11]。本研究病例中未检测到含突变纯合子的CYP2C9*3/*3型,可能因为中国人CYP2C9*3/*3基因型分布比例仅约0.6%[10]。此外,VKORC1-1639基因型检测结果,84.9%为AA型,野生GG型仅检出1例,未能进行定量考察。今后研究拟扩大样本量,进一步考察其对华法林PK/PD参数的影响。
本研究还发现,体重也是影响中国人华法林清除率的因素之一,随着体重的增加,华法林清除率增大,提示给药剂量需考虑患者体重因素。未发现合用胺碘酮对华法林PK/PD参数有显著影响,考虑可能因多数建模患者合用胺碘酮的时间较短,对华法林抗凝效果的影响不明显[12]。
本文基于NONMEM法建立的PPK/PD模型同 时纳入了体重、CYP2C9、VKORC1基因型,初步获得了中国人华法林PK/PD参数群体典型值。验证显示最终模型稳定有效、具有较好的拟合优度与预测 性能,可为临床制定华法林个体化给药方案提供参考。
| [1] | Ozer N, Cam N, Tangurek B, et al. The impact of CYP2C9 and VKORC1 genetic polymorphism and patient characteristics upon warfarin dose requirements in an adult Turkish population [J]. Heart Vessels, 2010, 25: 155-162. |
| [2] | Hu MH, Pan F, Sun W, et al. Determination of warfarin in plasma after cardiac valve replacement by HPLC [J]. J Third Mil Med Univ (第三军医大学学报), 2011, 33: 1651-1652. |
| [3] | Hamberg AK, Dahl ML, Barban M, et al. A PK-PD model for predicting the impact of age, CYP2C9, and VKORC1 genotype on individualization of warfarin therapy [J]. Clin Pharmacol Ther, 2007, 81: 529-538. |
| [4] | Hung Y. 2.5mg/5mg Warfarin Pharmacokinetics and Pharmacodynamics in Healthy Chinese (华法林钠片剂2.5mg、5mg在健康中国人的药代药效动力学研究) [D]. Beijing: Chinese Peking Union Medical College, 2004. |
| [5] | Yano Y, Beal SL, Sheiner LB. Evaluating pharmacokinetic/pharmacodynamic models using the posterior predictive check [J]. J Pharmacokinet Pharmacodyn, 2001, 28: 171-192. |
| [6] | Ette EI, Williams PJ, Kim YH, et al. Model appropriateness and population pharmacokinetic modeling [J]. J Clin Pharmacol, 2003, 43: 610-623. |
| [7] | Brendel K, Comets E, Laffont C, et al. Metrics for external model evaluation with an application to the population pharmacokinetics of gliclazide [J]. Pharm Res, 2006, 23: 2036-2049. |
| [8] | Chen XQ, Jin YY, Tang G. New Pharmacology (新编药物学) [M]. Beijing: People's Medical Publishing House, 2011: 536-537. |
| [9] | Wadelius M, Chen LY, Lindh JD, et al. The largest prospective warfarin-treated cohort supports genetic forecasting [J]. Blood, 2009, 113: 784-792. |
| [10] | Zhao SJ, Yuan J. The influence of molecular mechanism on gene polymorphism of CYP2C9, genotype detection and drug metabolism [J]. Guangdong Med J (广东医学), 2006, 27: 1268-1270. |
| [11] | Yang L, Ge W, Yu F, et al. Impact of VKORC1 gene polymorphism on interindividual and interethnic warfarin dosage requirement-a systematic review and meta analysis [J]. Thromb Res, 2010, 125: 159-166. |
| [12] | Xie S, Liu H, Lou Y, et al. Effects of amiodarone dose on the initial anticoagulation response of warfarin within 1 week in patients with heart valve replacement [J]. Chin Pharm J (中国药学杂志), 2010, 45: 593-596. |
 2015, Vol. 50
2015, Vol. 50


