肿瘤分子靶向治疗 (molecular targeted therapy) 与激素治疗、免疫治疗和细胞毒化疗药治疗共同构成了现代肿瘤药物治疗的主要治疗手段。肿瘤分子靶向治疗是指在细胞分子水平上,针对主要的致癌相关分子设计相应的治疗药物,药物进入体内后特异性选择致癌分子发生作用,下调受体的表达或下游基因的活化,达到程序化逆转肿瘤细胞分化的能力,或者间接靶向肿瘤新生血管,使肿瘤细胞缺血而产生凋亡、坏死[1]。与传统细胞毒药物不同的是,分子靶向治疗主要针对病变细胞,具有特异性抗肿瘤作用,可以减少对正常组织的损伤,因此毒性 (骨髓抑制、脱发和肾功能损害等) 明显减少。1997年,首个分子靶向药物利妥昔单抗被FDA批准用于治疗非霍奇金淋巴瘤,此后分子靶向药物的研发呈现了迅猛发展的态势,并于2010年初入选了本世纪最初10年科学领域十项重大进展。目前对分子靶向药物的分类尚没有确切的定义,临床上大多采用单克隆抗体药物和小分子药物 (主要为酪氨酸激酶抑制剂) 两类,本文为了尽量囊括已上市的各类分子靶向药物,总结到目前为止FDA批准的绝大多数不同靶点的药物,并根据主要作用机制进行分类。期望通过对这些药物的了解进一步加深对靶向治疗药物发展的认识,同时对此领域形成一个较完整的概念。
1 与表皮生长因子受体家族相关的分子靶向药物表皮生长因子受体 (epidermal growth factor receptor,EGFR) 家族属于受体酪氨酸激酶家族,包括EGFR (HER1/ErbB-1)、ErbB-2 (HER2/neu)、ErbB-3 (HER-3) 和ErbB-4 (HER-4)。EGFR家族蛋白定位于细胞膜上,由胞外配体结合区、跨膜疏水结构区和胞内酪氨酸激酶区三部分组成。当与配体 (主要为表皮生长因子和转化生长因子α) 结合后,受体蛋白可以形成同型/异型二聚体,发生自磷酸化,激活下游包括Ras-Raf-MAPK和PI3K-Akt-mTOR等信号通路。这些信号通路的激活参与了细胞生长、分裂和分化等调控,从而介导了细胞分化、生存、迁移、侵袭、黏附和细胞损伤修复等一系列过程[2]。
近年对EGFR家族受体的研究主要集中于ErbB1和HER2,根据药物作用靶点和性质的不同,可将其分为酪氨酸激酶抑制剂和单克隆抗体两类。
1.1 酪氨酸激酶抑制剂 (tyrosine kinase inhibitor,TKI)TKI可以进入细胞内,直接作用于EGFR家族受体的胞内区,干扰ATP结合,阻断激酶的自身磷酸化,从而阻断异常的信号传导产生抑瘤效果。目前FDA批准上市的药物有吉非替尼 (gefitinib,Iressa®,2003)、厄洛替尼 (erlotinib,Tarceva®,2004)、拉帕替尼 (lapatinib,Tykerb®,2007) 和阿法替尼 (afatinib,Gilotrif®,2013)。
吉非替尼作用于EGFR (ErbB1),2003年第一个被批准用于二线/三线治疗非小细胞肺癌 (non-small cell lung cancer,NSCLC) 患者[3]。研究发现,EGFR是否为突变型成为吉非替尼能否产生良好疗效的预测因子,该临床指导意义同样适用于随后上市的厄洛替尼 (EGFR TKI) 和阿法替尼 (EGFR/HER2 TKI)。对于检测出EGFR突变体阳性的NSCLC患者,厄洛替尼效果更优,可以作为一线治疗药物用于临床[4]。与前两种药物相比,阿法替尼与受体以不可逆方式结合,不易从ATP结合位点被替换,一定程度上克服了肺癌患者长期服用这类药物后所产生的获得性耐药[5]。
拉帕替尼作为EGFR/HER2双重激酶抑制剂,主要用于治疗HER2阳性的乳腺癌 (原发性乳腺癌患者有25%~30% 过度表达HER2)。目前拉帕替尼已被批准与卡培他滨或来曲唑联合治疗HER2高表达的转移性乳腺癌患者[6]。
1.2 单克隆抗体 (monoclonal antibody,mAb)mAb一方面可以特异性地识别受体的胞外区,与配体相互竞争,从而阻断EGFR家族的激活及其下游信号蛋白的磷酸化; 另一方面还可引发受体的内吞降解,减少受体密度,从而减弱细胞生长信号的传导。此外,mAb与受体的结合还可以激发补体介导的细胞杀伤效应(complement dependent cytotoxicity,CDC) 和抗体依赖的细胞杀伤效应 (antibody-dependent cell- mediated cytotoxicity,ADCC),发挥间接抗肿瘤作 用。目前FDA已经批准上市的该类药物包括曲妥珠单抗 (trastuzumab,Herceptin®,1998)、西妥昔单抗 (cetuximab,Erbitux®,2004)、帕尼单抗 (panitumumab,Vecibix®,2006)、帕妥珠单抗 (pertuzumab,Perjeta®,2012) 和ado-trastuzumab emtansine (Kadcyla®,2013)。
西妥昔单抗特异性针对EGFR (ErbB1) 受体,其药效与K-RAS基因是否突变密切相关。野生型的K-Ras受上游的EGFR信号调控,但当其基因发生突变时,K-Ras蛋白处于持续活化状态,不受上游信号影响。因此针对ErbB1的单克隆抗体在K-RAS突变时无法有效发挥抗肿瘤作用[7]。这种用药对象的筛选同样适用于2006年上市的帕尼单抗 (EGFR-mAb),一种完全人源化的IgG2单克隆抗体[8]。与西妥昔单抗 (人鼠嵌合型单抗) 相比,帕尼单抗具有更高的受体亲和性,且半衰期更长,免疫原性更低,治疗前不需预处理。
曲妥珠单抗于1998年首次由Genentech公司 研发,选择性作用于HER2,与其他化疗药联合可以用于治疗HER2阳性的乳腺癌和胃癌患者[9]。此后Genentech公司又推出了靶向HER2的帕妥珠单抗和抗体−药物偶联物ado-trastuzumab emtansine。帕妥珠单抗作为第一个HER2二聚化抑制剂,与曲妥珠单抗的作用靶点有所不同,因此这两种单抗被批准可以用于联合治疗HER2阳性的转移性乳腺癌[10]。Ado- trastuzumab emtansine作为一种较新的药物形式,由曲妥珠单抗和微管抑制剂药物DM1 (一种美登素的衍生物) 通过硫醚链接子 (MCC linker) 共价链接。通过与HER2受体的结合,ado-trastuzumab emtansine被内吞进细胞,在溶酶体内降解后释放出DM1,对细胞周期产生阻滞作用,引发细胞凋亡。目前FDA批准ado-trastuzumab emtansine作为单药可用于既往接受过紫杉类和曲妥珠单抗治疗的HER2阳性、转移性乳腺癌[11]。
2 与血管生成抑制相关的分子靶向药物近年来,靶向肿瘤新生血管的治疗逐渐得到了人们的关注,通过抑制肿瘤血管生成,阻断肿瘤的营养来源和迁移通道,从而达到治疗目的。促进新生血管生成的活性物质有很多,其中血管内皮生长因子 (vascular endothelial growth factor,VEGF) 起着非常重要的作用,以VEGF和VEGFR为靶点成为最常见的抗血管生成分子靶向研究。
2.1 靶向VEGF的药物VEGF家族结合3种类 型的酪氨酸激酶受体: VEGFR1 (flt1)、VEGFR2 (flt2或KDR) 和VEGFR3 (flt3)。其中VEGFR2是与血 管生成和血管渗透性相关的最重要受体,且主要和VEGF-A结合发挥作用。目前已开发的针对VEGF药物有贝伐单抗 (bevacizumab,Avastin®,2004) 和ziv- aflibercept (Zaltrap®,2012)。贝伐单抗高亲和力结合所有VEGF亚型(主要为VEGF-A),抑制新生血管生成,是首次批准上市的VEGF抑制剂,同时也是最成功的血管抑制类药物。其适应证广泛,可以与其他化疗药联合治疗转移性结直肠癌、NSCLC、转移性肾癌和胶质母细胞瘤等,临床效果明显[12]。Ziv-aflibercept是一种重组的融合蛋白 (由VEGF和VEGFR结合的片段和IgG1的Fc段融合得到),作为一个可溶性的受体,可与VEGF-A、VEGF-B和PLGF结合发挥抑制作用。
2.2 靶向VEGFR的药物针对VEGFR的药物大多为小分子的酪氨酸激酶抑制剂,其机制与EGFR TKIs类似,但特异性不强,往往这些抑制剂同时结合许多其他受体家族 (如血小板衍生生长因子受体、干细胞因子受体等),因此这类药物也被称为多靶点激酶抑制剂。目前已被批准的有索拉菲尼 (sorafenib,Nexavar®,2005)、舒尼替尼 (sunitinib,Sutent®,2006)、帕唑替尼 (pazopanib,Votrient®,2009)、凡德他尼 (vandetanib,Caprelsa®,2011)、cabozantinib (Cometriq®,2012)、阿西替尼 (axitinib,Inlyta®,2012)、瑞格非尼 (regorafenib,Stivarga®,2012) 和乐伐替尼 (lenvatinib,Lenvima®,2015)。由于这些药物所针对的不同靶点与肿瘤细胞的增殖、血管的生长及肿瘤基质微环境的维持密切相关,因此多靶点激酶抑制剂既可以抑制血管的形成又能直接抑制肿瘤细胞的增殖,临床批准用于多种恶性肿瘤,如肾癌、甲状腺癌、胃肠道间质癌和结直肠癌等。关于抗体类的药物,目前上市的只有刚批准的完全人源化的单抗ramucirumab (Cyramza®,2014),其特异性靶向VEGFR2,阻断配体与受体的结合,从而达到信号转导抑制、血管形成受阻等目的。
3 与细胞膜特异性抗原相关的分子靶向药物以特异性抗原分子为靶点的药物较多,其中针对EGFR家族和VEGF家族的抗体药物已在前面有所涉及,在此不再赘述。
CD20多表达于正常或癌化的B细胞,在超过90% B细胞非霍奇金淋巴瘤 (non-Hodgkin’s lymphomas,NHL) 和多数B细胞慢性淋巴细胞白血病 (chronic lymphocytic leukemia,CLL) 上均呈阳性表达,同时CD20在正常造血干细胞、分化成熟的浆细胞及其他类型造血细胞系中无表达,因此CD20成为B淋巴 细胞瘤治疗一个很好的靶 点[13]。这类药物包括利妥昔单抗 (rituximab,Rituxan®,1997)、替伊莫单抗 (90Y-ibritumomab tiuxetan,Zevalin®,2002)、托西莫单抗 (131I-tositumomab,Bexxar®,2003)、ofatumumab (Arzerra®,2009) 和obinutuzumab (Gazyva®,2013)。利妥昔单抗作为第一个被FDA认证的单抗类药物 (I型人/鼠嵌合单抗),与ofatumumab (II型全人源化单抗) 和obinutuzumab (II型人源化单抗,糖基化修饰) 均为单一的CD20单克隆抗体,主要通过CDC 和ADCC作用诱发B细胞凋亡。经过人源化改造,ofatumumab较利妥昔单抗具有更低的免疫原性及耐受性,但结合的亲和力也出现了一定程度的降低。随后obinutuzumab通过修饰Fc段增强了对受体FcγIIIa的亲和力,对NHL的总体响应率及耐受性更强。替伊莫单抗与托西莫单抗是典型的mAb偶联物,除上述促B细胞凋亡作用外,该类型的药物还可将发射β粒子或α粒子的放射性核素引向药物靶点,进一步杀伤肿瘤细胞。CD52同样高表达于B-CLL上,因此也可以将CD52作为CLL治疗的分子靶点。基于此,抗CD52的阿仑单抗 (alemtuzumab,Campath®) 于2001年获得FDA批准,用于治疗难治复发性B-CL L[14]。
其他的特异性靶点还有CD33、CD30、CD3-CD19和GD2,上市的药物分别为吉妥珠单抗 (gemtuzumab ozogamicin,Mylotarg®,2000)、brentuximab vedotin (Adcetris®,2011)、blinatumomab (Blincyto®,2014) 和dinutuximab (Unituxin®,2015)。吉妥珠单抗是由单抗和细胞毒抗肿瘤抗生素calicheamicin偶联形成,偶联的抗体特异性针对CD33抗原,该抗原在80% 以上的急性髓性白血病 (acute myeloid leukemia,AML) 中表达,因此该药被批准用于60岁以上CD33阳性的AML患者[15]。由于毒性和疗效等原因,吉妥珠单抗已于2010年被撤市。CD30在霍奇金淋巴瘤和间变大细胞淋巴瘤的细胞表面高表达,而在正常个体仅表达于少数活化B细胞和T细胞,因此抗CD30的单抗偶联物brentuximab vedotin于2011年被FDA批准用于这两类肿瘤的治疗。Dinutuximab结合于细胞表面的糖脂GD2,可以用于治疗神经胶质瘤高风险的儿童患者[16]。尽管单克隆抗体在临床应用中取得了巨大的成功,但是它们所针对的都是单一的靶标,功能上依然具有改进的空间。Blinatumomab作为第一个双特异性抗体,同时针对肿瘤细胞表面的CD19抗原和T细胞表面的CD3抗原。通过与T细胞的直接连接,blinatumomab可以上调细胞黏附分子的分泌,溶细胞蛋白的产生,炎性细胞因子的释放和T细胞的增殖,从而最终导致CD19阳性细胞的凋亡[17]。
4 其他相关的分子靶向治疗 4.1 Raf/MEK/MAPK信号通路相关抑制剂丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK) 途径,是将细胞外刺激信号传递到细胞核,介导细胞产生反应的最为重要通路之一。当配体与相应受体激酶 (如EGFR) 结合后可以激活Ras-MAPK通路,而活化后的MAPK进入细胞核,调节与细胞增殖或分化相关基因的转录,引起相应的生物学效应。在多种恶性肿瘤细胞中普遍存在MAPK通路的持续激活,目前已被批准的该类抗肿瘤药主要集中在Raf和MEK 两个位点上。
RAF基因家族包括ARAF、BRAF和CRAF,在多数肿瘤中,BRAF的表达率和突变率[绝大部分为BRAF (V600) 突变] 比ARAF和CRAF更高,其中黑色素瘤约有40%~68% 发生这种突变,使得BRAF成为最有吸引力的 治疗黑色素瘤的靶标。目前除了前面提到的多靶点小分子抑制剂索拉非尼和瑞格非尼可以部分抑制B-Raf活性外,已批准上市的、主要针对该靶点的药物有维罗非尼 (vemurafenib,Zelboraf®,2011) 和达拉非尼 (dabrafenib,Tafinlar®,2013)。维 罗非尼被批准用于BRAF (V600) 变异体阳性的黑色素瘤,其优异的效果使之成为黑色素瘤治疗上的里程碑式药物[18]。与维罗非尼的研发策略和路径不同,达拉非尼不是维罗非尼的模拟物,两者结构类型不同,药代性质更是差别明显[19]。MEK家族 (MEK1和MEK2) 由于其催化底物的特异性MAPK1和MAPK2,也成为肿瘤靶向治疗的理想靶点。尽管有许多MEK抑制剂进行了临床试验,但只有曲美替尼 (trametinib,Mekinist®,2013) 被批准用于黑色素瘤的治疗[20]。由于单一给药效果不佳,2014年被批准与达拉非尼 (作用靶点不同) 联合用药。
4.2 PI3K/Akt/mTOR信号通路相关抑制剂与Raf/MEK/MAPK一样,PI3K/Akt/mTOR信号传导通路也和肿瘤的发生发展密切相关。多种生长因子和细胞因子与受体结合后引起受体酪氨酸磷酸化,PI3K通过调节亚基与这些分子结合而被募集到质膜,并由催化亚基催化PI生成PIP3。PIP3进一步激活Akt和mTOR,促进癌细胞的生长、增殖和血管生成等。整个通路中,以PI3K和mTOR为靶的抗癌药物研究成为近年研究的热点。
吉利德 (idelalisib,Zydelig®,2014) 是第1个批准上市的PI3Kδ抑制剂,高度选择性作用于δ亚基,可以抑制恶性B细胞的趋化和黏附,促进凋亡,现已被批准用于CLL和滤泡型B细胞非霍奇金淋巴瘤等肿瘤的治疗[21]。针对mTOR位点的药物有西罗莫司 (temsirolimus,Torisel®,2007) 和依维莫司 (everolimus,Afinitor®,2009)。PI3K/Akt/mTOR通路的持续活化可以导致乳腺癌对于激素产生耐药性,因此西罗莫司被批准可与依西美坦联合治疗激素受体阳性、HER2阴性的乳腺癌。此外这类药物还可以降低缺氧诱导 因子和VEGF的产生,从而具有抑制肿瘤新生血管的作用。因此西罗莫司和依维莫司分别在2007年和2009年被批准用于晚期肾癌的治疗。
4.3 Bcr-Abl激酶抑制剂 90% 以上的慢性髓性白血病 (chronic myelognous leukemia,CML)患者表现为费城染色体阳性,其编码形成的Bcr-Abl蛋白具 有持续酪氨酸激酶活性,在CML的发展中扮演着十分重要的角色[22]。20世纪末,一类针对Bcr-Abl蛋 白的酪氨酸激酶抑制剂的研究广泛开展,其中伊马替尼 (imatinib mesylate,Gleevec®,2001) 首先脱颖而出,开启了CML治疗的新纪元[23]。随后上市的同类药物主要针对伊马替尼的耐药性进行优化,包括第二代的达沙替尼 (dasatinib,Sprycel®,2006)、尼洛替尼 (nilotinib,Tasigna®,2007) 和博舒替尼 (bosutinib,Bosulif®,2012) 及第三代的ponatinib (Iclusig®,2012)。新型药物的产生主要通过增强结合力,扩大结合位点等方法增强其抗耐药性,第三代的ponatinib结构进一步优化 (碳碳三键的引入),使得ponatinib可以规避T315I突变体上异亮氨酸的位阻效应,在对dasatinib和nilotinib均耐药的CML患者身上有明显的反应[24]。
4.4 组蛋白脱乙酰酶抑制剂 (histone deacetylase inhibitor,HDACI)组蛋白脱乙酰酶抑制剂可以抑制HDAC的酶活性,增强组蛋白的乙酰化,使得染色质松弛,基因转录被激活。这种结果可以引起肿瘤抑制因子p21WAF1/CIP1的表达增强,其作为细胞周期依赖性蛋白激酶 (cyclin-dependent protein kinases,CDKs) 的天然抑制剂,可以抑制CDKs的活性导致细胞周期G1/S期的停滞。目前FDA批准的上市药物有伏立诺他 (vorinostat,Zolinza®,2006)、romidepsin (Istodax®,2009)、belinostat (Beleodaq®,2014) 和panobinostat (Farydak®,2015)。其中belinostat属于环肽类,与其他3个药物的结构类型 (异羟肟酸类) 有所不同。研究表明,与正常细胞相比,HDACIs对肿瘤细胞的毒性更强,目前多应用在多发性骨髓瘤,T细胞淋巴瘤的治疗上[25, 26]。
4.5 蛋白酶体抑制剂 (proteasome inhibitor,PSI)蛋白酶体与泛素化信号构成的泛素−蛋白酶体是哺 乳动物细胞内主要的蛋白水解酶体系,可降解大多数胞内蛋白,包括p21、p53、c-myc和NF-κb等众 多调节细胞周期和凋亡的关键蛋白。PSI通过抑制蛋白酶体活性而干扰和影响细胞原有的功能,尤其是对肿瘤细胞的生长有明显的抑制作用。这类药物有 硼替佐米 (bortezomib,Velcade®,2003) 和卡非佐米 (carfilzomib,Kyprolis®,2012)。硼替佐米是一种蛋白酶体可逆抑制剂,针对26S蛋白酶体中糜蛋白酶样活性位点,成为美国近十年来第1个批准用于多发性骨髓瘤的药物。卡非佐米为第二代蛋白酶体不可逆抑制剂,与硼替佐米相比,选择性更强,疗效更好且周围神经毒性低[27, 28]。
4.6 已批准上市的其他靶向抑制剂在异常复杂的细胞信号通路中,还有其他一些信号分子作为治疗靶点应用于临床,但由于其研究时间较短,所上市的药物品种不多,现对其进行简单介绍。
Palbociclib (Ibrance®,2015) 作为CDK4和6的抑制剂,近期刚被FDA批准上市,成为这类抑制剂的代表[29]。CDKs和细胞周期蛋白对细胞周期的调控起到重要的作用,当细胞受到生长信号的刺激时,细胞周期蛋白表达上调,激活相应的CDKs,导致Rb蛋白磷酸化,释放出重要的核转录因子E2F,从而引起一系列与S期有关的靶分子 表达,促使细胞完成DNA复制。体内外实验表明,palbociclib与来曲唑联用,可以增强乳腺癌的敏感性,抑制Rb磷酸化水平以及下游信号的传导,因此比单个药物的抗肿瘤效果明显。
依鲁替尼 (ibrutinib,Imbruvica®,2013) 是布鲁顿酪氨酸激酶 (Bruton’s tyrosine kinase,BTK) 的小分子抑制剂,通过与BTK活性位点的半胱氨酸残基共价结合,抑制BTK酶的活性。BTK在B细胞的生长成熟中扮演着重要的作用,2013年依鲁替尼被批准用于治疗套细胞淋巴瘤和慢性淋巴细胞白血病的治疗[30]。
奥拉帕尼 (olaparib,Lynparza®,2014) 是第一 个上市的多聚ADP核糖聚合酶 (poly ADP-ribose polymerase,PARP) 抑制剂,批准单药治疗BRCA基因突变的卵巢癌患者。奥拉帕尼利用DNA修复途径的缺陷,优先杀死肿瘤细胞[31]。
克唑替尼 (crizotinib,Xalkori®,2011) 和ceritinib (Zykadia®,2014) 是间变型淋巴瘤激酶 (anaplastic lymphoma kinase,ALK) 抑制剂,属于受体酪氨酸激酶抑制剂家族,2011年被批准用于ALK阳性的NSCLC患者的治疗。Ceritinib的作用机制及适用范围与克唑替尼相似,其抑制ALK的活性更强,可用于既往接受过克唑替尼并产生耐药性的患者[32, 33]。
Vismodegib (Erivedge®,2012) 是hedgehog (Hh)信号通路的抑制剂,通过与平滑跨膜蛋白发生作用,阻断Hh下游信号产生效应。Hh信号通路的异常激活可以促进下游靶基因如c-Myc,VEGF等表达,引 起细胞过度增殖,导致肿瘤发生。研究表明,在皮肤基底细胞癌中存在着Hh信号通路异常激活的现象,vismodegib也成为第一个被批准用于治疗基底细胞癌的药物[34]。
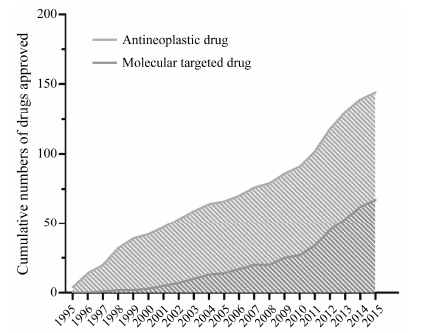
5 展望绝大多数被FDA批准的抗肿瘤药物和分子靶向药物见图 1,从而不难看出抗肿瘤药物的总体发展呈现逐年递增的趋势。自分子靶向药物发现以来 (1997年),后期新上市的抗肿瘤药物中,分子靶向药物占了很大部分,2010年后,分子靶向药物的研发更是进入快速发展阶段。毋庸置疑,分子靶向药物的发现是传统抗肿瘤化疗药的一次飞跃,对于肿瘤治疗也是一次重大的进展。由EvaluatePharma公司统计的、2014年销售前10位抗肿瘤药物中,至少6个是典型的分子靶向药物,而销售最好的前3种均为单克隆抗体药 (rituximab、bevacizumab和trastuzumab)。这表明分子靶向药物已经得到了市场的认可,肿瘤内科治疗的理念正朝着新的方向迈进。虽然目前传统的化疗药依然是多种肿瘤治疗的主力军,但分子靶向药物的加入无疑对其是一种极大的补充,随着人们对肿瘤发展分子机制的逐渐深入,分子靶向药物将扮演着更加重要的作用,其针对的靶点也会愈加趋于多样化。本文所涉及的分子靶向药物见表 1,从中也不难发现,药物的治疗靶点已不再局限于表面生长因子受体或血管抑制等,更多潜在的靶点正不断被发掘出来,可以说这种寻找肿瘤分子特异性靶点的策略给现代抗肿瘤药物的研发提供了源源不断的活力。当然分子靶向药物也存在着自身的局限性,通过特异性的抑制肿瘤细胞的某种信号分子或单一通路常常会诱发其他信号通路的激活或靶点的基因突变造成耐药性的产生,因此临床上常采取联合给药策略及设计新一代的药物或多靶点药物等。此外,发现更多的分子靶向药物疗效预测因子 (如EGFR、K-RAS突变型检测) 也是临床上亟需解决的问题。这对于实现患者的个体化治疗及确保药物使用的有效性方面具有积极的意义。
|
|
Table 1 Summary of molecular targeted drugs approved by FDA from 1997 to 2015. EGFR: Epidermal growth factor receptor; HER2: Human epidermal growth factor receptor 2; VEGF: Vascular endothelial growth factor; PDGFR: Platelet-derived growth factor receptor; RET: Orphan receptor tyrosine kinase; FLT: Fms-like tyrosine kinase; CSF-1R: Colony stimulating factor 1 receptor; FGFR: Fibroblast growth factor receptor; HDAC: Histone deacetylase; BTK: Bruton’s tyrosine kinase; ALK: Anaplastic lymphoma kinase; PARP: Poly ADP-ribose polymerase; CDK: Cyclin-dependent kinase |
|
Figure 1 Statistical results of antineoplastic drug and molecular targeted drug from 1995 to 2015 |
| [1] | Li EX. Molecular Targeted Therapy for Malignant Tumor (恶性肿瘤分子靶向治疗) [M]. 2nd ed. Beijing: People's Medical Publishing House, 2011: 3-14, 252-265, 568-592. |
| [2] | Yarden Y. The EGFR family and its ligands in human cancer: signalling mechanisms and therapeutic opportunities [J]. Eur J Cancer, 2001, 37: S3-S8. |
| [3] | Kris MG, Natale RB, Herbst RS, et al. Efficacy of gefitinib, an inhibitor of the epidermal growth factor receptor tyrosine kinase, in symptomatic patients with non-small cell lung cancer: a randomized trial [J]. J Am Med Assoc, 2003, 290: 2149-2158. |
| [4] | Siegel-Lakhai WS, Beijnen JH, Schellens JH. Current knowledge and future directions of the selective epidermal growth factor receptor inhibitors erlotinib (Tarceva®) and gefitinib (Iressa®) [J]. Oncologist, 2005, 10: 579-589. |
| [5] | Wang YF, Song Y. Progress in the therapy of afatinib for non-small cell lung cancer [J]. Chin J Lung Dis (Elect Ed) (中华肺部疾病杂志: 电子版), 2012, 5: 364-370. |
| [6] | Moreira C, Kaklamani V. Lapatinib and breast cancer: current indications and outlook for the future [J]. Expert Rev Anticancer Ther, 2010, 10: 1171-1182. |
| [7] | Bokemeyer C, Van Cutsem E, Rougier P, et al. Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer: pooled analysis of the CRYSTAL and OPUS randomised clinical trials [J]. Eur J Cancer, 2012, 48: 1466-1475. |
| [8] | Douillard JY, Oliner KS, Siena S, et al. Panitumumab- FOLFOX4 treatment and RAS mutations in colorectal cancer [J]. New Engl J Med, 2013, 369: 1023-1034. |
| [9] | Hudis CA. Trastuzumab -mechanism of action and use in clinical practice [J]. New Engl J Med, 2007, 357: 39-51. |
| [10] | Keating GM. Pertuzumab: in the first-line treatment of HER2-positive metastatic breast cancer [J]. Drugs, 2012, 72: 353-360. |
| [11] | Niculescu-Duvaz I. Trastuzumab emtansine, an antibody- drug conjugate for the treatment of HER2+ metastatic breast cancer [J]. Curr Opin Mol Ther, 2010, 12: 350-360. |
| [12] | Ferrara N, Hillan KJ, Gerber HP, et al. Discovery and development of bevacizumab, an anti-VEGF antibody for treating cancer [J]. Nat Rev Drug Discov, 2004, 3: 391-400. |
| [13] | Deng CL, Zou J, Song HF. Advances in the research of anti- CD20 therapeutic monoclonal antibodies [J]. Acta Pharm Sin (药学学报), 2013, 48: 1515-1520. |
| [14] | Lozanski G, Heerema NA, Flinn IW, et al. Alemtuzumab is an effective therapy for chronic lymphocytic leukemia with p53 mutations and deletions [J]. Blood, 2004, 103: 3278-3281. |
| [15] | Bross PF, Beitz J, Chen G, et al. Approval summary: gemtuzumab ozogamicin in relapsed acute myeloid leukemia [J]. Clin Cancer Res, 2001, 7: 1490-1496. |
| [16] | Thompson CA. Dinutuximab approved for high-risk neuroblastoma [J]. Cancer Discov, 2015, doi: 10.1158/2159- 8290.CD-NB2015-044. |
| [17] | Nagorsen D, Baeuerle PA. Immunomodulatory therapy of cancer with T cell-engaging BiTE antibody blinatumomab [J]. Exp Cell Res, 2011, 317: 1255-1260. |
| [18] | Jang S, Atkins MB. Which drug, and when, for patients with BRAF-mutant melanoma? [J]. Lancet Oncol, 2013, 14: E60-E69. |
| [19] | Guo ZR. Research method of classical medicinal chemistry dabrafenib [J]. Acta Pharm Sin (药学学报), 2014, 49: 747-750. |
| [20] | Wright CJM, McCormack PL. Trametinib: first global approval [J]. Drugs, 2013, 73: 1245-1254. |
| [21] | Fruman DA, Cantley LC. Idelalisib -a PI3Kδ inhibitor for B-cell cancers [J]. New Engl J Med, 2014, 370: 1061-1062. |
| [22] | Konopka JB, Watanabe SM, Witte ON. An alteration of the human c-abl protein in K562 leukemia cells unmasks associated tyrosine kinase activity [J]. Cell, 1984, 37: 1035-1042. |
| [23] | Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia [J]. New Engl J Med, 2001, 344: 1031-1037. |
| [24] | Cortes JE, Kim DW, Pinilla-Ibarz J, et al. A phase 2 trial of ponatinib in Philadelphia chromosome-positive leukemias [J]. New Engl J Med, 2013, 369: 1783-1796. |
| [25] | Ma XJ, Ezzeldin HH, Diasio RB. Histone deacetylase inhibitors: current status and overview of recent clinical trials [J]. Drugs, 2009, 69: 1911-1934. |
| [26] | Atadja P. Development of the pan-DAC inhibitor panobinostat (LBH589): successes and challenges [J]. Cancer Lett, 2009, 280: 233-241. |
| [27] | Adams J, Kauffman M. Development of the proteasome inhihitor VeleadeTM (bortezomib) [J]. Cancer Invest, 2004, 22: 304-311. |
| [28] | Parlati F, Lee SJ, Aujay M, et al. Carfilzomib can induce tumor cell death through selective inhibition of the chymotrypsin-like activity of the proteasome [J]. Blood, 2009, 114: 3439-3447. |
| [29] | Rocca A, Farolfi A, Bravaccini S, et al. Palbociclib (PD 0332991): targeting the cell cycle machinery in breast cancer [J]. Expert Opin Pharmacother, 2014, 15: 407-420. |
| [30] | Wiestner A. Targeting B-cell receptor signaling for anticancer therapy: the Bruton's tyrosine kinase inhibitor ibrutinib induces impressive responses in B-cell malignancies [J]. J Clin Oncol, 2013, 31: 128-130. |
| [31] | Marchetti C, Imperiale L, Gasparri ML, et al. Olaparib, PARP1 inhibitor in ovarian cancer [J]. Expert Opin Investig Drugs, 2012, 21: 1575-1584. |
| [32] | Shaw AT, Kim DW, Mehra R, et al. Ceritinib in ALK- rearranged non-small-cell lung cancer [J]. New Engl J Med, 2014, 370: 1189-1197. |
| [33] | Shaw AT, Solomon B, Kenudson MM. Crizotinib and testing for ALK [J]. J Natl Compr Canc Netw, 2011, 9: 1335-1341. |
| [34] | Sekulic A, Migden MR, Oro AE, et al. Efficacy and safety of vismodegib in advanced basal-cell carcinoma [J]. New Engl J Med, 2012, 366: 2171-2179. |
 2015, Vol. 50
2015, Vol. 50


