2. 皖南医学院药学院, 安徽 芜湖 241002
2. School of Pharmacy, Wannan Medical College, Wuhu 241002, China
自1985年美国食品药品监督管理局 (FDA) 批准莫罗单抗-CD3 (muromonab-CD3) 注射液用于治疗急性器官移植排斥反应以来,单克隆抗体类药物在基础研发和临床应用等方面获得飞速发展。目前,抗体药物主要用于心血管疾病、感染、免疫疾病和癌症治疗[1]。在癌症治疗方面,除了利用单克隆抗体的治疗功能外,还利用单克隆抗体作为靶向分子来降低化疗药物的非特异性毒性、提高治疗效果。在众多以
单克隆抗体为载体的新型靶向给药体系研究中,抗体-药物偶联物 (antibody-drug conjugates,ADCs) 是当前的一个研究热点[2, 3]。但传统的抗体-药物偶联物是由小分子抗肿瘤药物和抗体中的天然氨基酸通过链接段偶联而成,难以控制药物和抗体偶联的位置及化学计量,从而造成了产物具有多样性,且难以批次重复和最优化设计。近年来,基于Thiomab、非天然氨基酸、转移酶等进行的定点偶联技术有效克服 了上述缺点,使得位点专一的抗体-药物偶联物成为ADCs研究新趋势。本文主要从定点偶联的方法出发,除介绍传统ADCs的发展历史外,还综述了位点专一的抗体-药物偶联物的研究现状和偶联技术。
1 ADCs的发展历史ADCs的起源可以追溯到上世纪初,德国医生/科学家Paul Ehrlich首次用“魔弹”来描述通过肿瘤表面抗原进行细胞毒素的靶向运输体系[4]。1975年,伴随着杂交瘤技术在鼠抗上取得的里程碑式发展,ADCs得以在动物模型进行试验,步入迅速发展期。2000年5月,FDA批准了第一个ADCs药物Mylotarg® (gemtuzumab ozogamicin,GO) 上市,该药由人源化抗-CD33抗体 (hP67.6) 和小分子药物calicheamicin通过酸敏型腙键偶联而成,平均药抗比2~3,主要用于治疗急性髓细胞性白血病 (图 1)。但该药上市后的临床药效不明显,并且会增加患者患肝小静脉闭塞病的概率,因此辉瑞公司于2010年6月主动将其撤回[5]。2011年8月FDA批准了第二个ADC药物Adcetris® (brentuximab vedotin,SGN-35) 上市,该药由人源化抗CD30单克隆抗体huC242和MMAE通过酶裂解型二肽键 (Val-Cit) 偶联而成,平均药抗比4,主要用于治疗霍奇金淋巴瘤和系统性渐变性大细胞淋巴瘤。2013年2月FDA批准了第三个ADC药物Kadcyla® (ado-trastuzumab emtansine,T-DM1) 上市,该药由抗HER-2单抗和美登素衍生物DM1通过稳定的硫醚键偶联而成,平均药抗比3.5,主要用于治疗HER-2 (+) 乳腺癌。虽然目前仅有两个ADCs药物批准上市,但还有近20个ADCs处于临床I期和II期研究阶段,大量的ADCs处于临床前开发阶段[6, 7]。
2 传统ADCs的偶联方式及缺点当前处于临床评价阶段的ADCs主要是利用抗体上易于反应的氨基酸和小分子药物实现偶联,例如利用赖氨酸或者利用抗体链间二硫键还原所生成的半胱氨酸。
一个人源化抗体包括了80~90个赖氨酸,因此对部分赖氨酸修饰完全不会对天然二硫键造成影响,也不会使抗体的稳定性、生物物理特性或亲和力发生明显的变化。但通过赖氨酸偶联,每个抗体会偶联上0~8个小分子药物,偶联的位置可能会发生在抗体轻链和重链上近40个不同赖氨酸残基上 (图 2A),会生成一百多万种ADCs[8]。Lazar等[9]用质谱研究了 平均药抗比为3.5~4的huC242-DM4,结果表明当 每个抗体上偶联的maytansinoid数目从0~7变化时,ADCs的物理化学特性仅发生了细小的变化,但会互相产生干扰,干扰作用符合二项式分布。当然,在可控的偶联条件下,不同批次的maytansinoid和赖氨酸偶联的位置基本一致。修饰抗体中赖氨酸的方法除 了用于合成其他maytansinoid偶联物外,还可用于合成ado-trastuzumab emtansine[10]和calicheamicin偶联物[11]。
通过还原抗体中天然的链间二硫键获得的半胱氨酸制备ADCs时,载药量取决于二硫键的还原程度。一个完全降解的IgG1抗体一般有8个半胱氨酸残基,当二硫键被部分还原或者药抗比为4的ADCs都会生成一系列药抗比为0、2、4、6、8的混合物,其中又以药抗比为2和4的产物为主 (图 2B)。Brentuximab vedotin[12]以及其他auristatin ADCs[13]就是药物与二硫键部分还原后的巯基偶联制成。
虽然传统ADCs制备是通过赖氨酸或者还原二硫键所得半胱氨酸与小分子药物偶联,具有无需重组抗体或改变细胞培养环境来引入可偶联基团的优点。但是制备过程中无法控制药物和抗体偶联的位置,无法控制产物中药物和抗体的比例,故所得ADCs具有多样性,药抗比不固定,治疗指数低,并且批次可重复性差,无法进行精确化学计量。因此,将小分子药物和抗体在特定位置偶联成为新一代ADCs药物研究的重点。
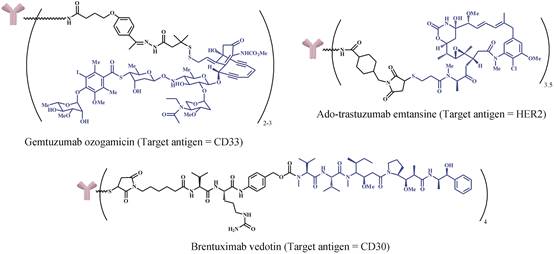
|
Figure 1 Structure of ADCs approved by FDA[7] |
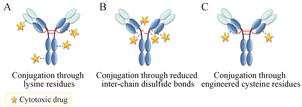
|
Figure 2 Conjugation method for ADCs production[8] |
Thiomab技术最早由Genentech公司的Junutula等[14]报道,他们采用基因工程技术 在曲妥珠单抗 (trastuzumab) 的轻链V110C和重链A114C特定位置处插入半胱氨酸残基,然后将半胱氨酸上的巯基和单甲基auristatin E (MMAE) 偶联,合成了位点专一的anti-MUC16抗体-药物偶联物 (图 3),其中药抗比为2的产物高达92.1%。这种定点偶联的方式既不会干扰免疫球蛋白折叠和组装,也不会改变抗体和抗原的结合模式; 且和传统无序偶联得到的ADCs药物相比,使用Thiomab抗体的ADCs药物在保留体内抗肿瘤活性的同时又提高了耐受性、降低了系统毒性。Pillow等[15]也采用Thiomab技术在曲妥珠单抗上引入了半胱氨酸残基,合成了位点专一、药抗比为2或4的曲妥珠单抗-美登素偶联物 (ThioTmab-MPA-May和ThioTmab-MC-May)。与FDA批准的trastuzumab-MCC-DM1相比,这些链接段稳定、偶联点固定的抗体-药物偶联物不仅组成均一,而且能消除DM1在血浆中的释放,提高治疗活性。
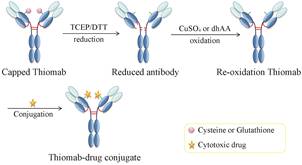
|
Figure 3 Conjugation method through Thiomab[14] |
这种工程化引入半胱氨酸的技术还用于合成二聚吡咯开苯并吖庚三烯 (PBD) 的位点专一的偶联物——SGN-CD33A和h1F6239C-PBD (图 4)。Kung Sutherland等[16]通过在抗体h2H12的重链S239C处引入半胱氨酸和PBD定点偶联,获得治疗急性髓性白
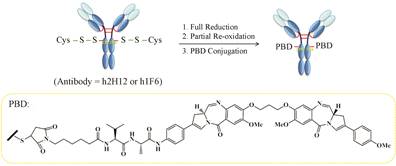
|
Figure 4 Conjugation method of SGN-CD33A and h1F6239C-PBD[17] |
血病的抗体-药物偶联物SGN-CD33A。在此偶联物混合产物中,约95% 的抗体都是连有两个小分子药物,平均药抗比为1.9; 临床前实验表明SGN-CD33A比GO活性更高,且在耐多药的AML模型中也表现出了活性。SGN-CD33A现已作为治疗急性髓性白血病的药物进入I期临床研究。类似的,Jeffrey等[17]将anti- CD70抗体的重链239处进行修饰后与PBD定点偶联,所得偶联物h1F6239C-PBD药抗比为2,体外毒性实验显示其对CD70(+) 的肾脏上皮肾细胞癌 (RCC) 和非何杰金淋巴瘤 (NHL) 的细胞株具有潜在的特定免疫性,血浆稳定性提高; 移植RCC或NHL的动物实验则表明单一或每周的有效治疗剂量低至0.1 mg·kg-1,可耐受剂量高达2.5 mg·kg-1。
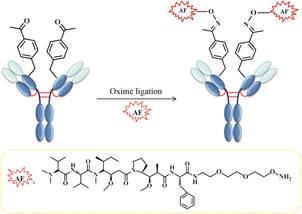
3.2 引入非天然氨基酸生物正交反应是指那些在活体细胞或组织中,能够在不干扰生物自身生化反应条件下进行的化学反应。通过生物正交反应引入非天然氨基酸——对乙酰苯丙氨酸 (pAcPhe) 是另外一种常用的定点偶联方法[18]。该方法使用一个进化过的可以特异性识别非天然氨基酸的酪氨酰-tRNA/氨酰-tRNA合成酶对,通过中国仓鼠卵巢细胞 (CHO) 转染以代替琥珀密码子的第21个氨基酸,所得细胞即可用于合成带有基因译码——对乙酰苯丙氨酸残基的各种抗体。Axup等[19]先将对乙酰苯丙氨酸定点引入到anti-Her2抗体的Fab片段或全长IgG1上 (图 5),
|
Figure 5 Conjugation method through pAcPhe[19] |
再通过肟键与auristatin衍生物定点偶联制备位点专一的抗体-药物偶联物。所得偶联物具有优秀的药代动力学特性、潜在的体外抗Her2+肿瘤细胞的活性,并能使移植瘤老鼠的肿瘤体积变小。Kularatne等[20]也通过向anti-CXCR4 IgG中引入pAcPhe实现与auristatin定点偶联,所得位点专一的CXCR4-auristatinADCs的半数效应浓度 (EC50) 约为 (80~100)×10-12 mol·L-1,可用于各种转移性癌症的治疗。
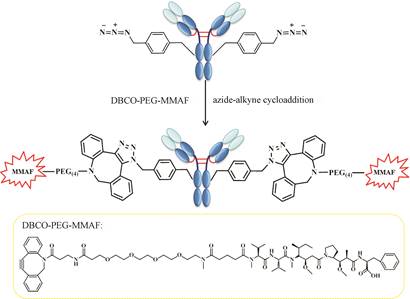
Zimmerman等[21]找到了一种对对苄基叠氮-L-苯丙氨酸 (pAMF) 具有高度活性和特异性的新型詹氏甲烷球菌酪氨酰-tRNA合成酶变体,该酶能在无细胞表达的aaRS-tRNA-nnAA体系中将非天然氨基酸pAMF引入到曲妥珠单抗上,此后通过高活性叠氮-炔环加成反应 (SPAAC) 与二苯并环辛基-聚乙二醇- MMAF (DBCO-PEG-MMAF) 实现定点偶联 (图 6)。所得偶联物药抗比为1.2~1.9,具有较高的体外细胞毒性,EC50为0.043~0.071 nmol·L-1。
|
Figure 6 Conjugation method through pAMF[21] |
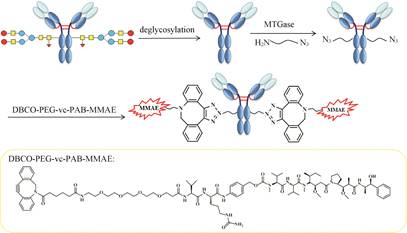
转谷氨酰胺酶 (transglutaminase) 是一种可以催化转酰基反应,导致蛋白质 (或多肽) 之间发生共价交联的酶。Jeger等[22]发现了一种来自细菌的转谷氨酰胺酶 (BTG),其仅识别去糖基IgGs上Fc区域的Q295位置,此位置可与带氨基的底物进行反应,底物和抗体的比率可精确到2∶1。Dennler等[23]将此技术应用到了ADCs的合成上,发展了一种基 于微生物转谷氨酰胺酶 (MTGs) 的化学-酶解合成ADCs的方法,通过高反应活性叠氮-炔环加成反应 (SPAAC) 可以将去糖基曲妥珠单抗和MMAE衍生物偶联制得结构均一、药抗比为2的Trastuzumab- MMAE (图 7)。此偶联方法不用改造抗体的序列结 构,操作简单; 且所得偶联物具有高细胞毒性,对BT-474和SK-BR-3细胞株的IC50分别为89.0×10-12和21.7×10-12 mol·L-1{Dennler,2014 #109}。值得注意的是此方法和上述 在抗体上引入非天然氨基酸pAMF的过程中都采用了SPAAC反应,所得偶联物均具有相似的链接段DBCO-PEG(4)。
|
Figure 7 Conjugation method based on transglutaminase[23] |
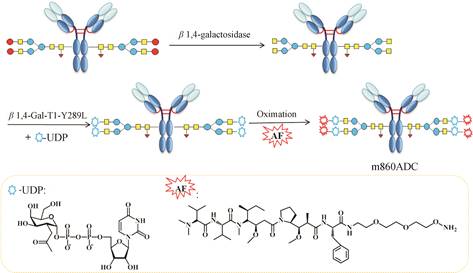
糖基转移酶 (glycotransferase) 是合成低聚糖过程中涉及的蛋白大家族,其负责将活化的糖核苷酸上的糖基残基转移至糖受体或糖蛋白/脂质体上。通过糖基转移酶同样可合成位点专一的抗体-药物偶联物,该方法是利用突变的糖基将具有化学活性的糖基附加到抗体上可发生糖基化反应的位置,然后与药物分子定点偶联生成ADCs。Zhu等[24]通过此方法将具有化学活性的酮基-半乳糖连接至单抗m860上,
然后将其通过肟化反应和aminooxy auristatin F合成了m860ADCs (图 8)。这些ADCs结构均一,平均药抗比为4,对HER-2 (+) 肿瘤细胞具有潜在的、特异性的杀伤性,其中对MCF-7细胞株的IC50为0.26 nmol·L-1,对JIMT-1细胞株的IC50为0.087 nmol·L-1。Zhou等[25]报道了一种经由氨基酸残基的酶催化反应合成位点专一的ADCs的新方法,该方法是先通过半乳糖和唾液酸转移酶将抗体Asn-297处的天然多糖进行体外酶改造后引入唾液酸终端,然后用高碘酸钠将唾液酸氧化生成醛基,再通过醛基和药物末端羟胺的肟化反应合成位点专一的ADCs。所得偶联物平均药抗比约为1.6 (此数值刚好等同于唾液酸残基的数目),在体外具有高度的靶向选择性和抗肿瘤活性。
|
Figure 8 Conjugation method based on glycotransferase[24] |
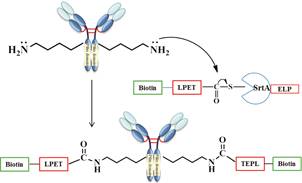
分选酶A (Srt A) 是一种具有膜结合巯基转肽酶催化功能的酶,它能识别蛋白中的主要序列LPXTG (X为任意氨基酸),裂解苏氨酸 (threonine) 和甘氨酸 (glycine) 间的肽键后形成一种稳定的中间体,再通过硫酯键把SrtA中的巯基连接到苏氨酸羧基上。Bellucci等[26]首次报道了一种来自金葡菌中的SrtA的非经典作用——修饰重组蛋白。该反应可在体外高度定点地将小分子药物通过异构肽键偶联到肽,工程化靶向蛋白或单抗上,连接位置仅发生在特定氨基酸序列中赖氨酸的ε-氨基处 (图 9),此位置即可定点偶联多个小分子药物。该过程大大克服了传统分选酶A催化的天然肽连接反应的局限性,提供了一种新型定点修饰氨基酸残基的方法,有望用于位点专一的ADCs的合成。
|
Figure 9 Conjugation method based on Srt A[26] |
抗体-药物偶联物不仅充分利用了抗体的特异性、亲和性和小分子药物的强药效,还通过将小分子药物靶向运输到目标细胞,从而大大降低小分子药物的潜在毒性。抗体-药物偶联物涉及的偶联技术会
对ADCs的药效、抗原亲和力、安全性产生较大的影响。新型定点偶联技术的出现为ADCs的研究开辟了重要的方向。位点专一的ADCs研究经历了不足十年时间,所用偶联方法也只有寥寥几类,但其所合成ADCs具有高度均一性、化学可计量、可重复性高等优点。定点偶联技术为ADCs的发展提供了新的研究思路,将成为未来ADCs研发的重点。
| [1] | Nelson AL, Dhimolea E, Reichert JM. Development trends for human monoclonal antibody therapeutics [J]. Nat Rev Drug Discov, 2010, 9: 767-774. |
| [2] | Bouchard H, Viskov C, Garcia-Echeverria C. Antibody-drug conjugates -a new wave of cancer drugs [J]. Bioorg Med Chem Lett, 2014, 24: 5357-5363. |
| [3] | Mullard A. Maturing antibody-drug conjugate [J]. Nat Rev Drug Discov, 2013, 12: 329-332. |
| [4] | Perez HL, Cardarelli PM, Deshpande S, et al. Antibody-drug conjugates: current status and future directions [J]. Drug Discov Today, 2014, 19: 869-881. |
| [5] | Zhu GD, Fu YX. Design of next generation antibody drug conjugates [J]. Acta Pharm Sin (药学学报), 2013, 48: 1053-1070. |
| [6] | Lambert JM. Drug-conjugated antibodies for the treatment of cancer [J]. Br J Clin Pharmacol, 2013, 76: 248-262. |
| [7] | Chari RV, Miller ML, Widdison WC. Antibody-drug conjugates: an emerging concept in cancer therapy [J]. Angew Chem Int Ed Engl, 2014, 53: 3796-3827. |
| [8] | Panowksi S, Bhakta S, Raab H, et al. Site-specific antibody drug conjugates for cancer therapy [J]. MAbs, 2014, 6: 34-45. |
| [9] | Lazar AC, Wang L, Blattler WA, et al. Analysis of the composition of immunoconjugates using size-exclusion chromatography coupled to mass spectrometry [J]. Rapid Commun Mass Spectrom, 2005, 19: 1806-1814. |
| [10] | Lambert JM, Chari RV. Ado-trastuzumab Emtansine (T-DM1): an antibody-drug conjugate (ADC) for HER2-positive breast cancer [J]. J Med Chem, 2014, 57: 6949-6964. |
| [11] | Casi G, Dario N. Antibody-drug conjugates: basic concepts, examples and future perspectives [J]. J Control Release, 2012, 161: 422-428. |
| [12] | van de Donk NW, Dhimolea E. Brentuximab vedotin [J]. MAbs, 2012, 4: 458-465. |
| [13] | Alley SC, Zhang XQ, Okeley NM, et al. The pharmacologic basis for antibody-auristatin conjugate activity [J]. J Pharmacol Exp Ther, 2009, 330: 932-938. |
| [14] | Junutula JR, Raab H, Clark S, et al. Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index [J]. Nat Biotechnol, 2008, 26: 925-932. |
| [15] | Pillow TH, Tien J, Parsons-Reponte KL, et al. Site-specific trastuzumab maytansinoid antibody-drug conjugates with improved therapeutic activity through linker and antibody engineering [J]. J Med Chem, 2014, 57: 7890-7899. |
| [16] | Kung Sutherland MS, Walter RB, Jeffrey SC, et al. SGN- CD33A: a novel CD33-targeting antibody-drug conjugate using a pyrrolobenzodiazepine dimer is active in models of drug-resistant AML [J]. Blood, 2013, 122: 1455-1463. |
| [17] | Jeffrey SC, Burke PJ, Lyon RP, et al. A potent anti-CD70 antibody-drug conjugate combining a dimeric pyrrolobenzodiazepine drug with site-specific conjugation technology [J]. Bioconjug Chem, 2013, 24: 1256-1263. |
| [18] | Hutchins BM, Kazane SA, Staflin K, et al. Site-specific coupling and sterically controlled formation of multimeric antibody fab fragments with unnatural amino acids [J]. J Mol Biol, 2011, 406: 595-603. |
| [19] | Axup JY, Bajjuri KM, Ritland M, et al. Synthesis of site- specific antibody-drug conjugates using unnatural amino acids [J]. Proc Natl Acad Sci USA, 2012, 109: 16101-16106. |
| [20] | Kularatne SA, Deshmukh V, Ma J, et al. A CXCR4-targeted site-specific antibody-drug conjugate [J]. Angew Chem Int Ed Engl, 2014, 53: 11863-11867. |
| [21] | Zimmerman ES, Heibeck TH, Gill A, et al. Production of site-specific antibody-drug conjugates using optimized non- natural amino acids in a cell-free expression system [J]. Bioconjug Chem, 2014, 25: 351-361. |
| [22] | Jeger S, Zimmermann K, Blanc A, et al. Site-specific and stoichiometric modification of antibodies by bacterial transglutaminase [J]. Angew Chem Int Ed Engl, 2010, 49: 9995-9997. |
| [23] | Dennler P, Chiotellis A, Fischer E, et al. Transglutaminase- based chemo-enzymatic conjugation approach yields homogeneous antibody-drug conjugates [J]. Bioconjug Chem, 2014, 25: 569-578. |
| [24] | Zhu Z, Ramakrishnan B, Li J, et al. Site-specific antibody- drug conjugation through an engineered glycotransferase and a chemically reactive sugar [J]. MAbs, 2014, 6: 1190-1200. |
| [25] | Zhou Q, Stefano JE, Manning C, et al. Site-specific antibody- drug conjugation through glycoengineering [J]. Bioconjug Chem, 2014, 25: 510-520. |
| [26] | Bellucci JJ, Bhattacharyya J, Chilkoti A. A noncanonical function of sortase enables site-specific conjugation of small molecules to lysine residues in proteins [J]. Angew Chem Int Ed Engl, 2015, 54: 441-445. |
 2015, Vol. 50
2015, Vol. 50


