肿瘤细胞表面特定的受体为药物“定向于”靶组织提供重要的识别位点, 是实现肿瘤靶向递药的重要生物学基础, 而通过此类受体的相应配体 (导向分子) 介导则是靶向递药的重要策略[1, 2]。维生素是细胞生长的必需物质, 肿瘤细胞因其快速增殖需要消耗大量的维生素, 在其细胞表面往往过度表达多种维生素受体[3], 因此, 一些维生素受体具有成为肿瘤生物标志物的重要潜力。而维生素分子量小、体内稳定性强且易通过化学方法与其他材料相偶联, 若作为导向功能分子, 与多肽、蛋白等大分子相比有一定的优势。例如, 因部分肿瘤表面高度表达叶酸受体, 叶酸在介导肿瘤靶向递药、显像与诊断等方面得到了广泛的研究。生物素又称维生素H、辅酶R, 是一种维持生长、发育的必要营养素, 在细胞分裂 (包括肿瘤细胞的分裂) 中发挥了重要作用[3, 4, 5, 6]。近年来研究表明, 一些过度表达叶酸受体或维生素B12受体等肿瘤细胞同时也高表达生物素受体, 而且生物素受体往往具有更高的表达量[5]。针对同一种肿瘤细胞分别采用不同维生素作为导向分子的递药研究显示, 生物素表现出比叶酸、核黄素等更优的靶向性[3, 7]。目前, 以生物素为导向分子介导靶向治疗研究的“抑瘤谱”已经涵盖了卵巢癌、结肠癌、肺癌、肾癌和乳腺癌等多种肿瘤, 体现出良好的应用前景[5, 8]。
光动力治疗 (photodynamic therapy, PDT) 是继放化疗后又一种新的肿瘤治疗方法[9, 10], 其原理是光敏剂遇到特定波长光激发后产生的单线态氧能直接杀死肿瘤细胞。同时, PDT还能破坏肿瘤内血管, 阻止肿瘤细胞从机体摄取其所需营养物质。此外, 光敏剂还能激活机体免疫系统, 进一步增强对肿瘤的治疗效果[11, 12, 13]。光动力治疗也面临进一步提高疗效和降低毒副作用的客观需求, 如多数光敏剂的理化性质不理想 (疏水性强和溶解性差), 对其药效充分发挥有一定的限制, 而过量的光辐照也会产生光毒炎症。结合纳米载体增溶和靶向递释等策略, 有望显著提高光敏剂在病灶部位的蓄积程度, 实现高效低毒的治疗目标。
胰腺癌被称为癌症之王, 其恶性程度高, 手术切除率低, 化疗、放疗均不敏感, 发病率和死亡率近年来明显上升[14, 15, 16]。光动力疗法结合药物靶向递送有望为胰腺癌治疗提供有益思路。竹红菌乙素 (hypocrellin B, HB) 是一种新型天然苝醌类光敏剂[17, 18], 已被广泛用于治疗类风湿关节炎、胃炎、胃、十二指肠溃疡病和真菌感染性皮肤病[19, 20]。与传统的光敏剂相比, 竹红菌乙素的单线态氧产率高, 对肿瘤细胞和病毒具有明显的光动力作用[20, 21]。基于此, 本文拟探索以生物素为导向分子、纳米胶束为载体递送光敏剂实现胰腺癌实体瘤的光动力靶向治疗。具体以竹红菌乙素 为模型药物, 聚乙二醇-磷脂酰乙醇胺 [poly (ethylene glycol)-distearoyl phosphatidyl ethanolamine, mPEG2000- DSPE] 为载体材料, 生物素-聚乙二醇-磷脂酰乙醇胺 [biotin-poly(ethylene glycol)-distearoyl phosphatidyl ethanolamine, Biotin-PEG3400-DSPE] 为功能材料, 构建生物素修饰的聚合物胶束制剂并系统评价其体内外靶向性及其药效。
材料与方法 药品与试剂竹红菌乙素 (hypocrellin B, HB, 上海源叶生物科技有限公司); 聚乙二醇-磷脂酰乙醇胺 [poly (ethylene glycol)-distearoyl phosphatidyl ethanolamine, mPEG2000-DSPE], 生物素化聚乙二醇-二硬脂酰磷脂酰乙醇胺 [biotin-poly(ethylene glycol)- distearoyl phosphatidyl ethanolamine, Biotin-PEG3400- DSPE] (Avanti Polar Lipids公司)、1, 1 (十八烷基)-3, 3, 3, 3'-四甲基吲碘 (1, 1'-dioctadecyl-3, 3, 3', 3'-tetramethylindotricarbocyanine iodide, DiR, 美国Invitrogen公司); 尼罗红 (Nile Red, Nil, 上海晶纯生化科技 股份有限公司); 2', 7'-二氯荧光素二乙酸酯 (2', 7'- dichlorofluorescin diacetate, DCFH-DA, 天津希恩思生化科技有限公司); 胎牛血清 (美国Gibco公司), 其他试剂均为分析纯。
仪器激光粒度分析仪 (Nano ZS, 英国马尔文公司); 微型挤出器 (Mini-extruder, Avanti Polar Lipids公司); 流式细胞仪 (ACEA NovoCyte, 杭州艾森生物有限公司); 荧光倒置显微镜 (IX-73, 日本奥林巴斯); 小动物活体成像系统 (FX PRO, 美国Bruker公司)。
细胞模型BxPC-3细胞购自南京凯基生物科技发展有限公司。细胞在含10% 胎牛血清的RPMI 1640培养基中于37 ℃、5% CO2条件下连续培养。实验细胞为处于对数生长期的细胞。
动物模型将处于对数生长期的BxPC-3胰腺癌细胞消化制成高浓度细胞悬液。在BALB/c裸鼠 [雌雄各半 (20 ± 2) g, 购自上海斯莱克实验动物有限责任公司] 右前肢腋窝皮下接种5×106个细胞。实验裸鼠由西南大学药学院实验动物中心进行屏障系统SPF级动物房饲养, 自由饮食和饮水, 当皮下瘤大小为50~100 mm3时, 用于体内靶向性考察和体内药效实验。
胶束的制备将HB溶于氯仿中, 质量浓度为0.5 mg·mL-1。称取适量的mPEG2000-DSPE和Biotin- PEG3400-DSPE混合溶解于氯仿中, 加入适量的上述竹红菌乙素溶液, 减压除去有机溶剂并旋转成膜, 以pH 7.4的PBS缓冲液于37 ℃水化, 经微型挤出器过30 nm膜, 即得载竹红菌乙素的生物素修饰胶束 (B- HB/MIC)。非修饰的载竹红菌乙素胶束 (HB/MIC) 制备方法相同, 只是制备时不加Biotin-PEG3400-DSPE。按同样方法制备包载不同荧光探针的胶束用于后续表征实验 (以Nil为荧光探针, 分别制备Nil/MIC和B-Nil/MIC; 以DiR为荧光探针, 分别制备DiR/MIC、B-DiR/MIC)。
胶束的表征对所得胶束进行粒径和多分散度 (polydispersity index, PDI) 测定。采用紫外分光光度法测定药物包封率。确定竹红菌乙素的最大吸收波长 (λmax) 为259 nm, 绘制竹红菌乙素在该条件下的标准曲线。测定竹红菌乙素胶束包封率: 取载药后未经纯化的竹红菌乙素胶束两份, 一份经葡聚糖凝胶柱纯化后收集, 另一份不作其他处理仅稀释至同样体积, 均加入3倍体积甲醇破乳24 h, 采用UV (λmax = 259 nm) 法测定总的竹红菌乙素浓度C0及胶束中竹红菌乙素的浓度C。按以下公式计算包封率 (EE): EE = C / C0 × 100%。同法测定荧光素的包封率。
BxPC-3细胞对胶束的摄取将BxPC-3细胞接种于24孔板中, 培养过夜后, Nil、Nil/MIC和B-Nil/ MIC以无血清培养液配成含Nil等量 (10 μg·mL-1) 的培养液, 避光条件下加入各孔中, 每组8孔, 避光培养2 h后, 弃去培养基, PBS洗3次。同组实验中 前4孔用4% 多聚甲醛在37 ℃固定30 min, PBS洗 3次, DAPI染色, PBS洗3次, 荧光倒置显微镜下观 察; 后4孔用胰酶溶液消化后, 直接以流式细胞仪测定 (Nil, 激发波长为488 nm, 发射波长为580 nm)。
HB在BxPC-3细胞内产生的单线态氧(reactive oxygen species, ROS)的测定将BxPC-3细胞接种于24孔板中, 培养过夜后, HB、HB/MIC和B-HB/ MIC以无血清培养液配成含HB等量 (0.8 μg·mL-1) 的培养液, 避光条件下加入各孔中, 并加入10 μmol·L-1 DCFH-DA, 避光培养2 h后, 弃去培养基, PBS洗3次, 加入新鲜的培养基, 分别给予激光照射 (450 nm, 20 J·cm-2), 再培养0.5 h后, 用胰酶溶液消化, 直接以流式细胞仪测定 [dichlorofluorescein (DCF), 激发波长为488 nm, 发射波长为530 nm]。
HB对BxPC-3的暗毒性及光剂量的考察将BxPC-3细胞以每孔5 000个细胞均匀接种于96孔培养板中, HB以无血清培养液配成0.8 μg·mL-1母液, 分别经等倍稀释后于避光条件下加入各孔中, 调整其终质量浓度分别为0.8、0.4、0.2、0.1、0.05、0.025和0.012 5 μg·mL-1, 避光培养2 h后, 弃去培养基, PBS洗3次, 加入新鲜的培养基, 激光照射 (450 nm, 5、10、20、30 J·cm-2), 同时设单纯光照及空白对照组 (n = 3), 再培养0.5 h后, 用MTT法检测细胞存活率[22], 即每孔加入MTT溶液 (5 mg·mL-1) 20 μL, 孵育4 h后弃去上清液, 每孔加入DMSO 150 μL终止 反应。将培养板水平振荡10 min, 用酶标仪在490 nm 处测定吸光度值 (A), 按下式计算细胞存活率:
细胞存活率 = A样品/A对照×100%
其中A样品为实验组的吸光度值, A对照为空白对照组的吸光度值。
体外药效学实验将BxPC-3细胞以每孔5 000个细胞均匀接种于96孔培养板中, HB、HB-MIC和B-HB/MIC以无血清培养液配成0.8 μg·mL-1母液, 分别经等倍稀释后于避光条件下加入各孔中, 调整其终质量浓度分别为0.8、0.4、0.2、0.1、0.05、0.025和0.012 5 μg·mL-1, 避光培养2 h后, 弃去培养基, PBS洗3次, 加入新鲜的培养基, 激光照射 (450 nm, 20 J·cm-2), 设载体胶束浓度 (即空白胶束与实验组载体的浓度一致) 对照组及空白对照组 (n = 3), 再培养0.5 h后, 采用上述MTT法测定细胞存活率。
生物素修饰胶束的体内靶向性考察分别制备粒径大小相当、含不同比例生物素 (0%、0.5%、5% 和20%, mol/mol) 的载近红外荧光探针 (DiR) 胶束, 经尾静脉注射 (200 μL, 10 μg·mL-1) 后于4、6、8、10和12 h分别进行荧光成像检测 (DiR, 激发波长为720 nm, 发射波长为790 nm)。
体内药效学实验将18只皮下荷瘤裸鼠随机分为3组 (每组6只), 分别设为空白对照组 (0.9% NaCl)、HB/MIC组和B-HB/MIC组。将相应制剂经尾静脉注射 (200 μL, 0.5 mg·kg-1 HB), 给药后6 h给予光照射 (450 nm, 30 J·cm-2)。每隔一天记录每组小鼠的体重变化并用游标卡尺测量肿瘤最长直径和最短直径, 瘤体积由以下公式计算得到: V = (dmax×dmin2) / 2, 其中dmin和dmax分别为肿瘤的短径和长径 (mm); 根据测量的结果计算相对肿瘤体积 (relative tumor volume, RTV), 计算公式为: RTV = Vt / V0。其中V0为给药时测量的肿瘤体积, Vt为每隔一天测量的肿瘤体积。治疗结束后, 取瘤组织, 拍照并记录肿瘤质量, 计算瘤重抑制率, 计算公式如下: 瘤重抑制率 = (WC-WT) / WC × 100%, WC: 对照组瘤重, WT: 治疗组瘤重。
数据分析应用SPSS17.0软件对肿瘤大小变化进行统计学分析, P < 0.05为具有显著性差异。
结果与讨论 1 聚合物胶束的制备通过薄膜水化法制备所得各类载药胶束的粒径均很小, 平均粒径在40 nm左右, 分散均匀, 包封率高, 提示表面经生物素修饰不影响载药胶束的基本性质: B-HB/MIC的平均粒径为 (36.74 ± 2.16) nm, 分布较均匀 (PDI为0.102 ± 0.015), 包封率达 (80.06 ± 0.19) %; HB/MIC的平均粒径为 (39.43 ± 3.18) nm, PDI为0.117 ± 0.008, 包封率达 (79.16 ± 0.36) % (表 1)。
|
|
Table 1 Characterization of polymeric micelles. |
经体外定量 (流式细胞术, 图 1A) 和定性 (荧光倒置显微镜, 图 1B) 检测, 细胞摄取实验结果显示, BxPC-3细胞摄取的Nil量从高到低依次是B-Nil/MIC、Nil/MIC和游离Nil。表面经生物素修饰的胶束其细胞摄取量显著高于未经修饰的胶束, 提示生物素能有效介导靶细胞对胶束的摄取。尼罗红本身具有较好的脂溶性, 但游离Nil在本实验中的入胞量显著低于两种胶束, 这可能是Nil在培养基中分散较差、易聚集沉淀, 在一定时间内影响其入胞效率。
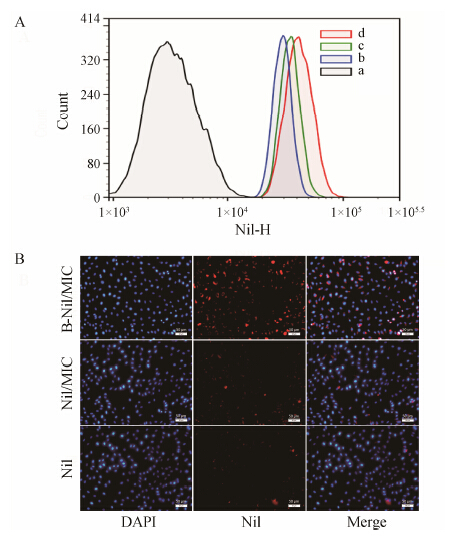 | Figure 1 In vitro cell uptake studiesA: Flow cytometry analysis of either peptide-modified or unmodified Nil-loaded polymeric micelles: PBS (a), free Nil (b), Nil/MIC (c) and B-Nil/MIC (d); B: Fluorescence microscopy images of BxPC-3. Nil uptake is represented by the red fluorescence |
活体成像实验结果 (图 2) 显示, 各生物素化胶束组在肿瘤部位的蓄积程度均显著高于未经修饰的胶束, 提示生物素在体内能介导聚合物胶束主动靶向肿瘤。对于不同生物素比例的胶束而言, 5% (mol/mol)生物素化胶束的肿瘤靶向性明显强于0.5% (mol/mol) 的生物素化胶束, 提示在一定范围内, 生物素化程度与聚合物胶束的肿瘤靶向性呈正相关。而20%(mol/ mol) 生物素化胶束的体内效果并未优于5% (mol/mol) 生物素化胶束, 提示过高的生物素化程度并不会带来更高的靶向蓄积效果, 单一载体上导向分子 (生物素) 的密度过高可能反而会出现相互竞争而导致载体靶向性降低。值得一提的是, 上述细胞实验采用的是常规细胞培养基, 其本身含有生物素, 而所用模型动物也采用常规饲料 (含生物素) 喂养。在体内外均面临游离生物素竞争性干扰的前提下, 生物素化胶束展现出良好的肿瘤靶向性, 体现出其较好的应用前景。
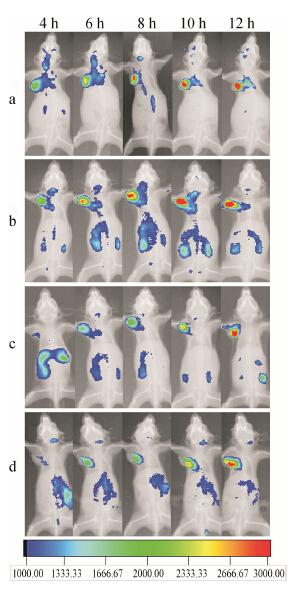 | Figure 2 Effect of the amount of peptide ligand on the targeting efficiency of B-DiR/MIC.Ex vivo fluorescent imaging study: 20 mol%(a),5 mol%(b),0.5 mol%(c),0 mol%(d) |
DCFH-DA本身无荧光 (图 3A), 进入细胞后被酯酶水解为DCFH。在活性氧存在时DCFH被氧化为不能透过细胞膜的强绿色荧光物质DCF, 其荧光强度与细胞内ROS水平成正比。经相同剂量的光照处理后, 以DCF的荧光强度为评价指标, 显示在BxPC-3细胞内诱导产生ROS的量从高到低依次是B-HB/MIC、HB/MIC、游离HB (图 3B), 一方面验证了竹红菌乙素经特定光照后能产生ROS, 另一方面再次证明了生物素能有效介导聚合物胶束被胰腺癌细胞摄取。
 | Figure 3 Chemical structure of DCFH-DA.B: Flow cytometric detection of ROS generated during HB-loaded formulations mediated PDT (photodynamic therapy) with a ROS probe, DCFH-DA: PBS (a), free HB (b), HB/MIC (c) and B-HB/MIC (d). C: The cells were incubated with HB (0.8, 0.4, 0.2, 0.1, 0.05, 0.025, 0.012 5 μg·mL-1, respectively) for 2 h and then irradiated with a 450 nm laser at a total fluence of 5, 10, 20, 30 J·cm-2, respectively. D: The cells were incubated with HB, HB/MIC, B-HB/MIC (the concentration of HB is 0.8, 0.4, 0.2, 0.1, 0.05, 0.025, 0.012 5 μg·mL-1, respectively) for 2 h and then irradiated with a 450 nm laser at a total fluence of 20 J·cm-2. The viability was evaluated by MTT method. n= 3, x±s |
通过对光剂量及光敏剂HB浓度的考察, 结果显示, 即使在较高光敏剂剂量条件下 (≤0.8 μg·mL-1), HB本身无明显毒性 (暗毒性), 而当激光照射后则产生细胞毒性。采用线性回归法计算得到光剂量分别为5、10、20和30 J·cm-2时, HB的IC50分别是1.259、0.803 4、0.296 2和0.263 0 μg·mL-1。结果提示, 随着光剂量的提高, HB的细胞毒性相应增加并逐渐趋于稳定 (图 3C)。在给予20 J·cm-2光剂量后, HB/MIC和B-HB/MIC的IC50分别为0.154 2和0.106 9 μg·mL-1, 均低于游离药物的0.296 2 μg·mL-1 (图 3D), 初步体现出经聚合物胶束包载以及进一步生物素化的优势, 这一趋势也与细胞摄取实验以及ROS测定结果一致。
4 体内药效学评价瘤体积相对值随时间变化曲线见图 4, 给药组的BxPC-3皮下瘤生长均受到显著抑制。其中, 生物素化胶束组的治疗效果显著优于普通胶束组 (P < 0.01), 普通胶束组的瘤重抑制率为69.69%, 生物素修饰胶束后瘤重抑制率提高到94.95%, 此结果与前述体外药效实验相符合, 提示生物素化聚合物胶束具有良好的胰腺癌靶向性, 能够有效介导靶向治疗。聚乙二醇-二硬脂酰磷脂酰乙醇胺 (PEG-DSPE) 是目前为数不多的获批药用辅料的两亲性聚合物, 除了可作为长循环脂质体的“隐形材料”外, PEG-DSPE在一定条件下能形成纳米胶束用于包载和递送药物。PEG-DSPE所形成的载药胶束粒径普遍很小[23], 对于部分渗透性差的胰腺癌而言 (粒径小于50 nm的纳米药物才能有效渗透)[24], 可能是一种较为理想的递药系统。生物素作为小分子, 稳定性强且易于修饰, 生物素化的PEG- DSPE制备工艺十分成熟, 本文采用的也是商业化的Biotin-PEG-DSPE。随着生物素介导靶向的“抑瘤谱”不断扩大, 经生物素修饰的PEG-DSPE载体材料有望在抗肿瘤靶向制剂研发中扮演重要的角色。
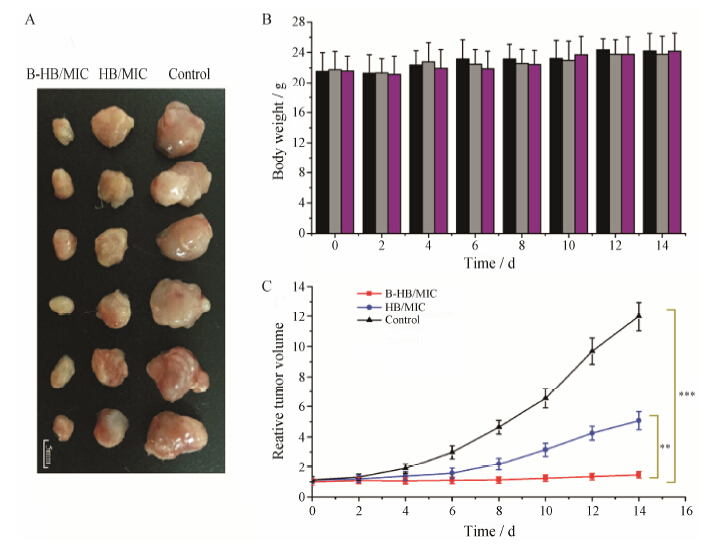 | Figure 4 In vivo antitumor study (PDT) using different formulations of HB (0.5 mg·kg-1).A: Photographs of tumors from various treatment groups. B: The weight of BALB/c nude mice after tail vein of saline ( ), HB/MIC ( ), HB/MIC ( )and B-HB/MIC( )and B-HB/MIC( ). C: Relative tumor volumes of various treatment groups. n = 6, x±s. **P < 0.01, ***P < 0.005 ). C: Relative tumor volumes of various treatment groups. n = 6, x±s. **P < 0.01, ***P < 0.005 |
本文制备了一种具有胰腺癌治疗潜力的聚合物胶束制剂: mPEG2000-DSPE组装形成的纳米胶束粒径较小、分散性较好、对脂溶性药物包封率高; 适宜比例的生物素作为导向分子能有效介导纳米胶束对胰腺癌细胞的体内外识别; 靶向递药策略能显著提高光动力药物的治疗效果。目前, 胰腺癌治疗面临疾病标志物相对较少、渗透性差和放化疗不敏感等困难, 上述研究结果能为胰腺癌治疗提供一定的参考。
| [1] | Zhang L, Wei G, Lu WY. Application of activatable cell-penetrating peptide in the field of tumor therapy [J]. Acta Pharm Sin (药学学报), 2014, 49: 1639-1643. |
| [2] | Torchilin VP. Drug targeting [J]. Eur J Pharm Sci, 2000, 11: 81-91. |
| [3] | Tripodo G, Mandracchia D, Collina S, et al. New perspectives in cancer therapy: the biotin-antitumor molecule conjugates [J]. Angew Chem Int Ed, 2014, 8: 1-4. |
| [4] | Shi JF, Wu P, Jiang ZH, et al. Synthesis and tumor cell growth inhibitory activity of biotinylated annonaceous acetogenins [J]. Eur J Med Chem, 2014, 71: 219-228. |
| [5] | Chen S, Zhao X, Chen J, et al. Mechanism-based tumor-targeting drug delivery system. Validation of efficient vitamin receptor-mediated endocytosis and drug release [J]. Bioconjug Chem, 2010, 21: 979-987. |
| [6] | Vadlapudi AD, Vadlapatla RK, Pal D, et al. Functional and molecular aspects of biotin uptake via SMVT in human corneal epithelial (HCEC) and retinal pigment epithelial (D407) cells [J]. AAPS J, 2012, 14: 832-842. |
| [7] | Russell-Jones G, McTavish K, McEwan J, et al. Vitamin-mediated targeting as a potential mechanism to increase drug uptake by tumours [J]. J Inorg Biochem, 2004, 98: 1625- 1633. |
| [8] | Shi JF, Wu P, Jiang ZH, et al. Synthesis and tumor cell growth inhibitory activity of biotinylated annonaceous acetogenins [J]. Eur J Med Chem, 2014, 71: 219-228. |
| [9] | Vrouenraets MB, Visser GW, Snow GB, et al. Basic principles, applications in oncology and improved selectivity of photodynamic therapy [J]. Anticancer Res, 2002, 23: 505-522. |
| [10] | Nyman ES, Hynninen PH. Research advances in the use of tetrapyrrolic photosensitizers for photodynamic therapy [J]. J Photochem Photobiol B, 2004, 73: 1-28. |
| [11] | Castano AP, Mroz P, Hamblin MR. Photodynamic therapy and anti-tumour immunity [J]. Nat Rev Cancer, 2006, 6: 535-545. |
| [12] | Dougherty TJ, Gomer CJ, Henderson BW, et al. Photodynamic therapy [J]. J Natl Cancer Inst, 1998, 90: 889-905. |
| [13] | Robertson CA, Evans DH, Abrahamse H. Photodynamic therapy (PDT): a short review on cellular mechanisms and cancer research applications for PDT [J]. J Photochem Photobiol B, 2009, 96: 1-8. |
| [14] | Hidalgo M. Pancreatic cancer [J]. N Engl J Med, 2010, 362: 1605-1617. |
| [15] | Ikeda N, Adachi M, Taki T, et al. Prognostic significance of angiogenesis in human pancreatic cancer [J]. Br J Cancer, 1999, 79: 1553. |
| [16] | Stathis A, Moore MJ. Advanced pancreatic carcinoma: nilrent treatment and future challenges [J]. Nat Rev Clin Oncol, 2010, 7: 163-172. |
| [17] | Wang P, Xu C, Xu J, et al. Hypocrellin B enhances ultrasound-induced cell death of nasopharyngeal carcinoma cells [J]. Ultrasound Med Biol, 2010, 36: 336-342. |
| [18] | Mulrooney CA, O'Brien EM, Morgan BJ, et al. Perylenequinones: isolation, synthesis, and biological activity [J]. Eur J Org Chem, 2012, 21: 3887-3904. |
| [19] | Song L, Zhao B, Xie J, et al. Interactions of hypocrellin B with hyaluronan and photo-induced interactions [J]. Biochim Biophys Acta, 2006, 1760: 333-339. |
| [20] | Ma G, Khan SI, Jacob MR, et al. Antimicrobial and antileishmanial activities of hypocrellin A and B [J]. Antimicrob Agents Chemother, 2004, 48: 4450-4452. |
| [21] | Toffoli DJ, Gomes L, Vieira Jr ND, et al. Photodynamic potentiality of hypocrellin B and its lanthanide complexes [J]. J Opt A Pure Appl Opt, 2008, 10: 687-688. |
| [22] | Cetin Y, Bullerman LB. Cytotoxicity of Fusarium mycotoxins to mammalian cell cultures as determined by the MTT bioassay [J]. Food Chem Toxicol, 2005, 43: 755-764. |
| [23] | Tang N, Du G, Wang N, et al. Improving penetration in tumors with nanoassemblies of phospholipids and doxorubicin [J]. J Natl Cancer Inst, 2007, 99: 1004-1015. |
| [24] | Cabral H, Matsumoto Y, Mizuno K, et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size [J]. Nat Nanotechnol, 2011, 6: 815-823. |
 2015, Vol. 50
2015, Vol. 50


