2. 河南大学 护理学院, 河南 开封 475004
2. Nursing College, Henan University, Kaifeng 475004, China
随着人们生活水平的改善和生活方式的变化,代谢综合征发病率越来越高。肝脂肪变性(hepatic stestosis)是代谢综合征的一种表现,也是非酒精肝病的早期改变。肝脂肪变性主要是甘油三酯过量在肝内蓄积引起的,随着病情的发展还会演化为非酒精性肝炎、肝硬化和肝癌。因此寻找有效的方法清除肝内蓄积的甘油三酯,减缓肝脂肪变性的发展成了亟待解决的医学问题。有实验显示,高脂饮食诱发肝脂肪变性时,小鼠体内一氧化氮合成酶被抑制,血浆硝酸盐和亚硝酸盐含量下降[1]。该结果提示,一氧化氮在脂肪肝发生发展过程中发挥重要作用。许多研究表明,人体存在硝酸盐-亚硝酸盐-一氧化氮通路,该通路对维持体内一氧化氮平衡发挥重要作用[2]。硝酸盐主要来源于蔬菜、饮用水和肉制品中,本身没有生物活性,进入胃肠道后被吸收入血,再由口腔周围腺体分泌进入口腔,在口腔共生细菌硝酸盐还原酶的作用下转变为有生物活性的亚硝酸盐。亚硝酸盐随唾液咽下,再次被肠道吸收进入血液循环。人体自身也会由一氧化氮氧化产生内源性亚硝酸盐。正常人血浆中亚硝酸盐约80%是内源性的,过多的亚硝酸盐会通过肾脏和粪便排出体外[3]。高脂血症患者通过饮用富含硝酸盐的蔬菜汁,可明显降低血浆中甘油三酯含量[4]。动物实验也发现,高脂饲养的小鼠可导致高脂血症和肝脂肪变性,同时肝内亚硝酸盐含量下降,通过饮水补充亚硝酸盐可以降低血浆甘油三酯含量[5]。这些实验结果提示,亚硝酸盐具有调节甘油三酯代谢的作用,但作用机制不清楚。目前,有关亚硝酸盐对肝细胞脂肪变性的影响尚未见文献报道。肝细胞有两条代谢甘油三酯的通路,一条是经典的细胞溶质中性脂肪酶分解,另一条是经自噬溶酶体酸性水解[6]。肝细胞自噬能力下降是肝细胞脂肪变性的主要原因[7]。一氧化氮具有调节自噬的作用。作为一氧化氮供体,亚硝酸盐是否能通过诱导自噬分解甘油三酯,减轻肝细胞脂肪变性是本课题关注的主要问题。为此,本文选用亚硝酸钠(sodium nitrite,SN)代表亚硝酸盐,利用油酸(oleic acid,OA)诱导人肝细胞系脂肪变性模型,观察了亚硝酸钠对肝细胞脂质蓄积的影响。 材料与方法 试剂和主要仪器
亚硝酸钠(分析纯,天津市晨福化学试剂厂);油红O[生工生物工程(上海)股份有限公司];无血清无酚红RPMI-1640培养基(Gibico公司);胎牛血清(FBS,杭州四季青生物公司);牛血清白蛋白(BSA,北京索莱宝科技有限公司);甘油三酯(TG)检测试剂盒(北京普利莱基因技术有限公司);油酸、3-甲基腺嘌呤(3-MA)、氯喹(CQ)、Lyso-Tracker RedDND-99、兔抗人MAP1-LC3B单克隆抗体和FITC标记的羊抗兔IgG (Sigma公司);兔抗人p-HSL、兔抗人T-HSL、鼠抗鸡囊(C4)β-actin单抗和ECL Western blot化学发光检测试剂盒(Santa Cruz公司);DM2500徕卡荧光显微镜(德国);UV-540紫外-可见分光光度计(美国UNICAM公司);DYY-7C型电泳仪、WD-9413B凝胶成像分析仪(北京市六一仪器厂)。 细胞培养和肝细胞脂肪变性模型制备
人肝细胞系L-02购自中国医学科学院上海生化细胞所,生长在含10 mL·L-1热灭活胎牛血清的RPMI-1640培养基中,置5 mL·L-1 CO2、37℃恒温密闭式孵箱内培养传代。用10% BSA溶解OA制成储存液。细胞生长至对数生长期,用1.2 mmol·L-1 OA诱导L-02细胞24h制作肝细胞脂肪变性模型。 油红O染色检测肝细胞脂滴积聚
以1×104个L-02细胞接种于预置盖玻片的6孔培养板中培养24 h,吸弃培养孔中的培养基。实验分4组:对照组为等体积的10% BSA;单纯SN组为培养基稀释的SN (0.2 mmol·L-1);OA组为1.2mmol·L-1 OA孵育;亚硝酸钠处理组为OA诱导24 h的细胞加SN (0.2 mmol·L-1)。以上4组均平行设置3-MA组,在各组处理时加入3-MA (5 mmol·L-1)。各组细胞培养24 h后,取出盖玻片,用PBS洗涤3遍,4%多聚甲醛固定10 min,用油红O染液于37℃避光染色20 min,50%异丙醇冲洗20 s,双蒸水洗3次至背景透明,DM2500徕卡荧光显微镜可见光拍照,同时用相差显微镜拍摄同批次样本相差图像。 比色法检测肝细胞甘油三酯含量
实验分组和处理同油红O染色一致。实验结束时,吸弃培养孔中的培养基,PBS洗2遍,每孔加入裂解液200 μL,混匀后室温静止10 min。取100 μL裂解液转移至1.5 mL离心管中(剩余裂解液用BCA法蛋白定量试剂盒进行蛋白定量),70℃加热10 min,于室温、3 500×g离心5 min,取上清液,按试剂盒说明书操作,用酶标仪比色法检测TG。 免疫荧光检测细胞内LC3-Ⅱ
各组以1×104个细胞接种于6孔板中,板内预置经多聚赖氨酸预处理的盖玻片。实验分4组:对照组为等体积的10% BSA;OA组为1.2 mmol·L-1OA孵育;亚硝酸钠处理组为OA诱导24 h的细胞加SN (0.2 mmol·L-1);CQ干预组,预先用OA诱导24 h的细胞加入SN和CQ (20 μmol·L-1)。各组细胞培养24 h后,取出盖玻片,冷丙酮固定6 min,自然干燥。3% H2O2室温孵育15 min,10% BSA、4℃封闭过夜,PBS冲洗3次,每次5 min,每张盖玻片加100µL兔抗人LC3B工作液,4℃过夜孵育,PBS洗3次,加FITC标记的羊抗兔IgG二抗,37℃孵育30 min,PBS洗3次,自来水冲洗,自然干燥,硅油封片,实验重复3次,徕卡DM2500荧光显微镜下拍照。 细胞溶酶体荧光染色
细胞分组和处理同LC3Ⅱ免疫荧光实验。实验结束时,吸去培养液,加Lyso-Tracher Red DND-99工作液,28℃孵育30 min,去除染色液,PBS洗3次,徕卡DM2500荧光显微镜下拍照。同时用相差显微镜拍摄样本相同视野的相差图像。 透射电镜标本的制备
实验结束时,离心收获细胞,用2.5%戊二醛及1%锇酸双重固定,乙醇丙酮逐级脱水,环氧树脂包埋,德国LEICAULTRACUTUCT超薄切片机切片,醋酸双氧铀和枸橼酸铅双重染色后,JEM100CX-Ⅱ透射电镜观察并拍照。 Western blot检测蛋白表达
消化收集各种处理的细胞,用RIPA 200 μL充分裂解提取蛋白,考马斯亮蓝G-250法测样品蛋白浓度,均衡每组蛋白浓度后,以12% SDS-PAGE凝胶电泳分离。电转移蛋白至NC膜,5%脱脂奶粉封闭过夜,加入各种一抗(1:200)于4℃封闭袋中孵育过夜,二抗孵育1 h。化学发光法显示结果,压片曝光。凝胶图像分析系统拍照,采用IPP软件对目的条带进行灰度分析。实验重复3次。 统计学分析
数据均采用x±s表示,应用SPSS13.0软件包处理,进行单因素方差分析及LSD-t检验,P<0.05被认为统计学具有显著性。 结果 1亚硝酸钠对肝细胞脂质蓄积的影响
各组L-02细胞油红O染色结果(图1A)显示,对照组细胞质内只可见少量红染的微小脂滴;1.2 mmol·L-1 OA处理24 h后,可见OA组细胞质内出现大量体积较大的脂滴;单纯0.2 mmol·L-1亚硝酸钠组细胞质内脂滴含量与对照组相比没有明显差异;亚硝酸钠处理组细胞质内脂滴体积变小,数量明显减少。各组加入Class Ⅲ PI3K特异性抑制剂3-MA (5 mmol·L-1)后,只有亚硝酸钠处理组细胞质内脂滴体积扩大,数量增加;其他3组细胞质内脂滴无论体积还是数量都没有发生明显变化。细胞内甘油三酯含量检测结果(图1B)显示,与对照组相比,单纯亚硝酸钠组细胞内甘油三酯含量无明显变化;OA组细胞内甘油三酯明显增加;与单纯OA处理组相比,亚硝酸钠处理组细胞内甘油三酯含量明显下降,加用3-MA后,细胞内甘油三酯含量明显升高。
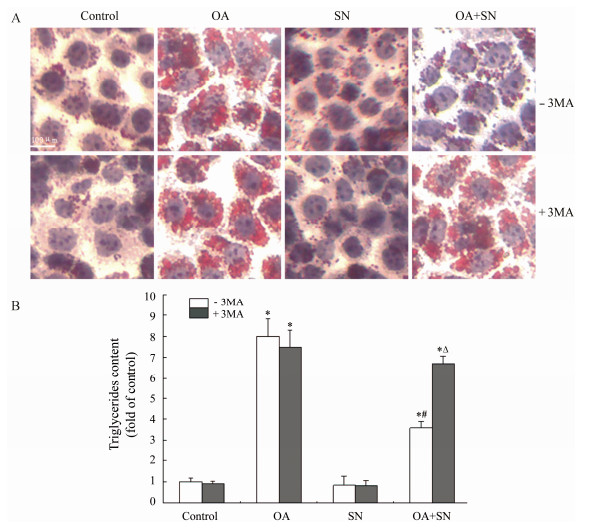 | Figure 1 Sodiumnitrite (SN) reduced lipid accumulation in free fatty acid-loaded L-02 cells. L-02cells were incubated with 1.2mmol·L-1 oleic acid (OA) for 24 h and then given various treatments.A: After another 24 h, L-02 cells were stained with oil red O. B:Intracellular triglyceride was quantified. n = 3, x±s. 3-MA: 3-Methyladenine.P < 0.05 vs control group; #P < 0.05 vsOA group; ΔP < 0.05 vs OA+SNgroup |
肝细胞经4%多聚甲醛固定后,在相差镜头下脂滴显示为黑色,细胞质内处于降解阶段的自噬体显示为大小不一的空泡[8]。图2是各组细胞爬片固定后在相差物镜下的图像。对照组和单纯亚硝酸钠组细胞质内没有明显的脂滴和空泡,OA组细胞质内脂滴明显增多;与OA组相比,亚硝酸钠处理组脂滴明显减少,空泡大量增多。加3-MA后,亚硝酸钠处理组脂滴又开始增多,空泡明显减少;其他3组没有发生这种现象。
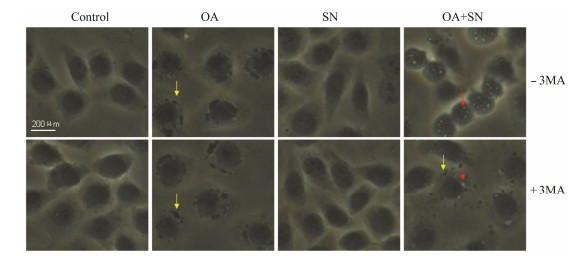 | Figure 2 Sodiumnitrite increases the number of cytoplasm vacuoles in the cells of hepaticsteatosis. L-02 cells were incubated with 1.2 mmol·L-1 OA for24 h and then given various treatments. After another 24 h, L-02 cellswere treated by 4% paraformaldehyde and thenshooting under phase contrast microscope. Representative images show thelipid droplet (yellow arrow) and the cytoplasm vacuoles (red arrow) |
在自噬体形成阶段,微管相关蛋白LC3-Ⅰ转化为LC3-Ⅱ,聚集在自噬体膜上;在自噬体降解阶段,LC3-Ⅱ和自噬降解的底物一起与溶酶体融合,在自噬溶酶体内被酸性水解酶降解。用氯喹抑制自噬溶酶体可以阻止LC3-Ⅱ降解,从而使细胞内LC3-Ⅱ含量增多。此现象提示,细胞自噬性降解的自噬潮(autophagic flux)存在[9]。图3为LC3免疫荧光照片,LC3-Ⅰ在细胞质内弥散分布,LC3-Ⅱ聚集在自噬体膜上呈绿色的荧光亮点。对照组和OA组细胞内只有很弱的点状聚集的荧光。与对照组相比,亚硝酸钠处理组LC3点状聚集的荧光明显增多;加氯喹处理后,LC3点状聚集的荧光点变得更多。
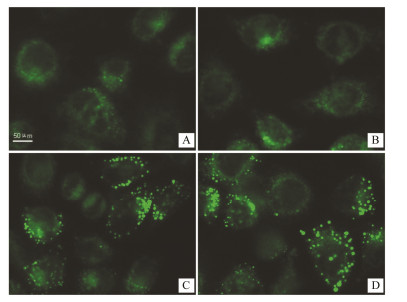 | Figure 3 Sodiumnitrite increase autophagy flux in the cells of hepatic steatosis. L-02cells were incubated with 1.2 mmol·L-1 OA for 24 h and then givenvarious treatments. After another 24 h, L-02 cells were stained withLC3 immunofluorescence. A: Control group;B: OA group; C: OA + SN group; D: OA + SN + chloroquine (CQ) |
细胞自噬时,LC3-Ⅰ转化为LC3-Ⅱ。由于这两种蛋白对抗体结合能力差别很大,LC3-Ⅱ检测敏感性高于LC3-Ⅰ,因此本文单纯比较LC3-Ⅱ蛋白表达水平来评价自噬水平[10]。图4是各组Western blot检测结果,OA组LC3-Ⅱ表达水平与对照组没有明显差异。亚硝酸钠处理组LC3-Ⅱ表达水平明显高于油酸组,加氯喹后,LC3-Ⅱ表达水平升高更加明显。
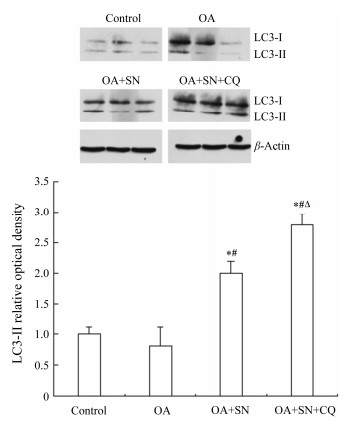 | Figure 4 Sodiumnitrite promote LC3-II protein expression inthe cells of hepatic steatosis. L-02 cells were incubated with 1.2 mmol·L-1OA for 24 h and then given various treatments. After another 24 h, L-02 cellslysates were subjected to immunoblotanalysis with anti-LC3 and anti-β-actin antibodies. Densitometryanalysis for the expression level of LC3-II was performed using image software,which was further normalized with its loading control (β-actin). Digitaldata are presented as the ratio of LC3-II of the vehiclecontrol from at least three independent experiments.n = 3, x±s. *P < 0.05 vscontrol group; #P < 0.05 vs OA group, ΔP < 0.05 vs OA+SNgroup |
利用溶酶体标记物Lyso-TrackerRed荧光染色结合同一视野下相差图像可以观察脂滴与溶酶体重合的情况。图5结果显示,对照组溶酶体呈现散碎荧光,相应的相差图片有一些散在的小空泡,可见个别脂滴没有与溶酶体重合。OA组溶酶体标记物呈较弱的弥散荧光,相应的相差图片有大量脂滴。亚硝酸钠处理组溶酶体标记物呈现多个聚集的点状荧光,这些荧光点与相应的相差图片中脂滴重合;加氯喹后,细胞质内溶酶体标记物呈现片状荧光,相应的相差图片呈现出许多空泡,与OA组相比,脂滴与荧光亮点重合的现象明显减少。
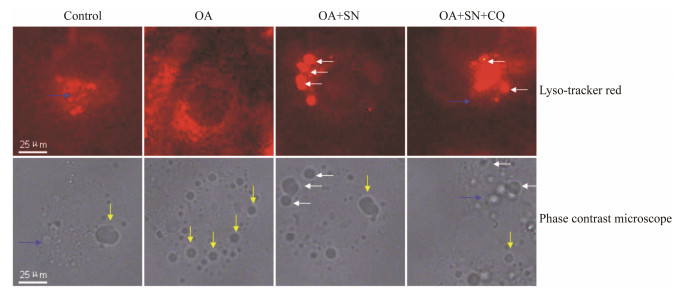 | Figure 5 Sodium nitrite increases the numberof lysosomes in the cells of hepatic steatosis. L-02 cells were incubatedwith 1.2 mmol·L-1 OA for 24 h and then given various treatments. Afteranother 24 h, L-02 cells were stained with lyso-tracker red. Representativeimages show the colocalization of lipiddroplet (yellow arrow) from phase contrast microscope image and lysosomes(white arrow) detected by fluorescence microscope. The blue arrowdenote the cytoplasm vacuoles |
透射电镜结果显示(图6),对照组细胞质内线粒体和内质网等细胞器结构正常,可见一些小的细胞质包涵体。OA组细胞内有大量脂滴堆积,线粒体体积变小,未发现自噬体。亚硝酸钠处理组细胞质内出现许多自噬溶酶体,表现为自噬体内脂质和细胞器降解,结构模糊;加氯喹处理后,细胞质内的自噬泡多处于自噬体阶段,可见双层膜包围的结构清晰的细胞器和脂滴。
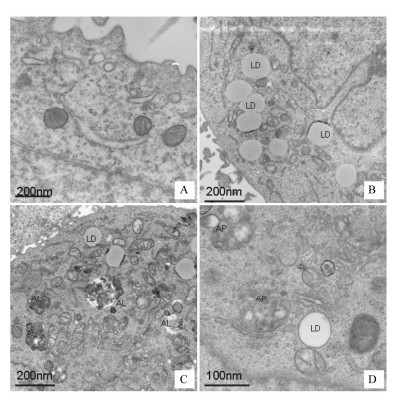 | Figure 6 Sodium nitrite increasesthe number of autolysosomes in the cells of hepaticsteatosis. L-02 cells were incubated with 1.2mmol·L-1 OA for 24 h and then given various treatments. Afteranother 24 h, L-02 cells were further processed for TEM. LD: Lipiddroplet; AL: Autolysosome; AP: Autophagosome. A: Control group; B: OAgroup; C: OA + SN group; D: OA + SN + CQ |
细胞溶质内激素敏感脂酶(hormone sensitive lipase,HSL)是一种中性脂肪分解的酶,该酶被磷酸化激活,发挥细胞溶质内降解甘油三酯的作用。图7显示激素敏感脂酶Western blot检测结果,各组细胞总的激素敏感脂酶(T-HSL)表达水平未见明显差别。与对照组相比,磷酸化的激素敏感脂酶(p-HSL)在OA组明显升高。亚硝酸钠处理组p-HSL表达水平明显低于OA组;加氯喹后p-HSL表达水平又明显升高。
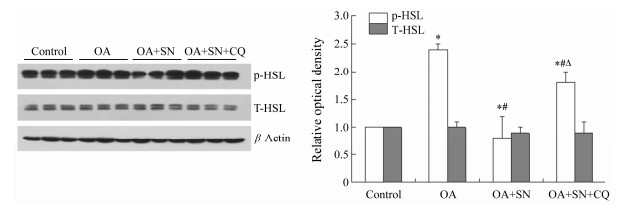 | Figure 7 Sodiumnitrite decreased phosphorylation of hormone sensitive lipase (p-HSL) proteinexpression in the cells of hepatic steatosis.L-02 cells were incubated with 1.2 mmol·L-1 OA for 24 h and thengiven various treatments. After another 24 h, L-02 cells were subjected toimmunoblot analysis with anti-T-HSL and anti-p-HSL antibodies. Densitometryanalysis for the expression level of hormone sensitive lipase (HSL) was performedusing image software, which was further normalized with its loading control (β-actin).Digital data are presented as the ratio of HSL of the vehicle controlfrom at least three independent experiments. n = 3, x±s. *P < 0.05 vs controlgroup; #P < 0.05 vs OA group; ΔP < 0.05 vsOA+SN group |
日常生活中,人体摄入的脂肪酸分为饱和脂肪酸与不饱和脂肪酸,其中不饱和脂肪酸占饮食中的比例较大。油酸与肝细胞内甘油合成的甘油三酯是人体脂肪的主要成分。用油酸等不饱和脂肪酸体外孵育肝细胞是建立肝细胞脂肪变性模型的常用方法[11]。肝细胞内多余的脂肪常以脂滴的形式储存。肝细胞内蓄积少量的脂质对细胞而言可能是无害的,但是细胞内蓄积大量脂质会造成细胞损害甚至凋亡。高脂血症患者血浆中油酸浓度一般为0.6~2.0 mmol·L-1 [12]。本实验建立肝细胞脂肪变性模型所用的油酸浓度为1.2 mmol·L-1,此浓度位于人体可暴露的范围内。结果显示,用此浓度的油酸孵育肝细胞24 h可以使肝细胞质内形成大量脂滴,同时又不会造成肝细胞凋亡。
众所周知,服用亚硝酸钠0.3~0.5 g会使人中毒,3 g足以致人死亡[13]。0.3 g亚硝酸钠相当于4.35 mmol·L-1,人体日常不会接触到这么高的剂量。人体唾液内亚硝酸盐含量最高,浓度一般为0.06 mmol·L-1,当摄入菠菜、莴笋、生菜和腌肉等富含硝酸盐的食物后,亚硝酸盐含量最高才能达到1.8 mmol·L-1;成年人一天摄入300 g蔬菜,相当于人体摄入0.1 mmol·kg-1亚硝酸盐[14]。考虑到人体内产生的亚硝酸盐占更大的比例,故本实验选用的亚硝酸钠浓度为0.2 mmol·L-1,应该属于人体日常可暴露的低剂量范围[15]。
脂质在肝细胞内至少有两条分解途径,即溶质中性水解酶和自噬溶酶体内酸性水解酶分解[16]。在正常情况下,脂肪酸进入肝细胞胞质内,一方面促进甘油三酯合成,另一方面也会激活细胞溶质内的中性水解酶。当大量脂肪酸进入肝细胞胞质内,甘油三酯合成速度大于分解速度,甘油三酯逐渐储存在脂滴内,致使肝细胞内脂滴体积增大,数量增多。少量脂滴激活自噬,将甘油三酯包裹在自噬体内,然后在溶酶体酸性环境下降解,这个过程被称为脂质自噬(lipophagy)[17]。过量脂滴在肝细胞内蓄积会破坏脂质自噬,从而造成肝细胞坏死或凋亡[18]。
本实验发现,采用1.2 mmol·L-1油酸诱导肝L-02细胞24 h,细胞质内出现大量脂滴,细胞质内甘油三酯含量大量增加,用自噬抑制剂3-MA也不能改变此现象。结果提示细胞自噬功能受到抑制。与单纯油酸组相比,油酸作用24 h后用亚硝酸钠处理24 h,细胞内脂滴体积变小,数量减少,细胞质内甘油三酯含量下降,相差图片也显示细胞质内空泡增多。这种现象可以被自噬抑制剂3-MA逆转。结果提示,亚硝酸钠激活了肝脂肪变性的细胞脂质自噬,从而减少肝细胞内甘油三酯含量。
脂质自噬发生时,LC3-Ⅰ转化为LC3-Ⅱ。在LC3-Ⅱ的协助下,由自噬泡包裹小脂滴或大脂滴的一部分形成自噬体,再与溶酶体融合形成自噬溶酶体,脂质与LC3-Ⅱ、p62等包含物一同被溶酶体酸性水解酶降解,此过程也被称为自噬潮[19]。LC3免疫荧光结果显示,油酸组几乎没有出现LC3荧光亮点,亚硝酸钠处理组LC3-Ⅱ荧光亮点增多,用氯喹抑制溶酶体后,LC3-Ⅱ降解减少,亚硝酸钠处理组LC3-Ⅱ荧光亮点进一步增多。Western blot检测细胞LC3-Ⅱ蛋白表达也呈现出一致结果。结果提示,油酸抑制了肝细胞的自噬能力,亚硝酸钠可以增强细胞自噬能力[20]。为了进一步了解细胞脂滴降解和自噬的关系,用Lyso-TrackerRed染色,荧光显微镜下观察了细胞溶酶体分布,并与同一视野下的相差图像进行对比分析。结果发现,亚硝酸钠促进肝脂肪变性细胞的溶酶体增多,大部分溶酶体和脂滴共定位;用氯喹抑制溶酶体后,此现象明显减少。结果提示,亚硝酸钠诱导自噬参与肝细胞脂滴的降解。在透射电镜下,油酸组细胞质内储存大量脂滴,几乎没有发现自噬现象,提示细胞自噬功能被大量脂质抑制。亚硝酸钠处理后,肝脂肪变性细胞内脂滴被自噬体包裹,处于降解阶段的自噬溶酶体明显增加;氯喹作用后自噬体虽然存在,但自噬体内的脂质和细胞器大多处于没有降解状态。电镜结果再次提示,亚硝酸钠可以促进肝脂肪变性的细胞脂质自噬能力,从而加速细胞内甘油三酯的分解。
为了初步了解甘油三酯通过细胞脂质自噬分解和细胞溶质内分解这两条途径之间的关系,本实验又用Western blot方法检测了激素敏感脂酶的表达。HSL是细胞溶质分解甘油三酯的关键酶,该酶被磷酸化修饰后激活,在中性环境分解甘油三酯[21]。结果显示,不同处理对肝细胞内T-HSL蛋白表达量没有影响。油酸可诱导肝细胞p-HSL表达升高。尽管在油酸作用下,细胞溶质脂质分解能力代偿性增强,由于细胞脂质自噬能力被抑制,致使甘油三酯合成速度大于分解速度,细胞发生了脂肪变性。结果还显示,亚硝酸钠处理组p-HSL表达水平明显低于油酸组;加氯喹抑制自噬后,p-HSL表达水平又明显升高。这些结果提示,甘油三酯通过细胞脂质自噬分解和细胞溶质内分解这两条途径之间可能存在相互抑制关系。但是要证明这种现象,还需要进一步研究。
综上所述,大量的脂滴蓄积在肝细胞内,细胞自噬功能被抑制。低剂量的亚硝酸钠能促进肝脂肪变性的L-02细胞脂质自噬,加速脂质分解,减轻肝脂肪变性细胞脂质蓄积。
| [1] | Eccleston HB, Andringa KK, Betancourt AM, et al. Chronic exposure to a high-fat diet induces hepatic steatosis, impairs nitric oxide bioavailability, and modifies the mitochondrial proteome in mice [J]. Antioxid Redox Signal, 2011, 15: 447- 459. |
| [2] | Lidder S, Webb AJ. Vascular effects of dietary nitrate (as found in green leafy vegetables and beetroot) via the nitrate-nitrite-nitric oxide pathway [J]. Br J Clin Pharmacol, 2013, 75: 677-696. |
| [3] | Kapil V, Weitzberg E, Lundberg JO, et al. Clinical evidence demonstrating the utility of inorganic nitrate in cardiovascular health [J]. Nitric Oxide, 2014, 38: 45-57. |
| [4] | Zand J, Lanza F, Garg HK, et al. All-natural nitrite and nitrate containing dietary supplement promotes nitric oxide production and reduces triglycerides in humans [J]. Nutr Res, 2011, 31: 262-269. |
| [5] | Stokes KY, Dugas TR, Tang Y, et al. Dietary nitrite prevents hypercholesterolemic microvascular inflammation and reverses endothelial dysfunction [J]. Am J Physiol Heart Circ Physiol, 2009, 296: H1281-H1288. |
| [6] | Singh R, Kaushik S, Wang Y, et al. Autophagy regulates lipid metabolism [J]. Nature, 2009, 458: 1131-1135. |
| [7] | Fu XM, Xie J, Hu ZW. Mycelium of Hirsutella hepiali Chen et Shen activates autophagy and protects against metabolic syndrome in mice fed with high fat diet [J]. Acta Pharm Sin (药学学报), 2014, 49: 615-621. |
| [8] | Chen PM, Gombart ZJ, Chen JW. Chloroquine treatment of ARPE-19 cells leads to lysosome dilation and intracellular lipid accumulation: possible implications of lysosomal dysfunction in macular degeneration [J]. Cell Biosci, 2011, 1:1-10. |
| [9] | Hua F, Yu JJ, Li K, et al. Autophagy in ageing and ageing-related diseases [J]. Acta Pharm Sin (药学学报), 2014, 49: 764-773. |
| [10] | Mizushima N, Yoshimori T. How to interpret LC3 immunoblotting [J]. Autophagy, 2007, 3: 542-545. |
| [11] | Kang OH, Kim SB, Mun SH, et al. Puerarin ameliorates hepatic steatosis by activating the PPARα and AMPK signaling pathways in hepatocytes [J]. Int J Mol Med, 2015, 35: 803- 809. |
| [12] | Shiwaku K, Hashimoto M, Kitajima K, et al. Triglyceride levels are ethnic-specifically associated with an index of stearoyl-CoA desaturase activity and n-3 PUFA levels in Asians [J]. J Lipid Res, 2004, 45: 914-922. |
| [13] | Wang B, Zhou DS. Investigation and analysis of the intoxication accident of sodium nitrite [J]. Mod Prevent Med (现代预防医学), 2013, 40: 589-590. |
| [14] | Carlström M, Larsen FJ, Nyström T, et al. Dietary inorganic nitrate reverses features of metabolic syndrome in endothelial nitric oxide synthase-deficient mice [J]. Proc Natl Acad Sci U S A, 2010, 107: 17716-17720. |
| [15] | Xu HR, Lin B, Wang SQ, et al. Sodium nitrite improves epithelial-mesenchymal transition of hepatoma cells in mice bearing H22 [J]. Acta Pharm Sin (药学学报), 2012, 47: 1470- 1476. |
| [16] | Kovsan J, Bashan N, Greenberg AS, et al. Potential role of autophagy in modulation of lipid metabolism [J]. Am J Physiol Endocrinol Metab, 2010, 298: E1-E7. |
| [17] | Liu K, Czaja MJ. Regulation of lipid stores and metabolism by lipophagy [J]. Cell Death Differ, 2013, 20: 3-11. |
| [18] | Singh R, Cuervo AM. Autophagy in the cellular energetic balance [J]. Cell Metab, 2011, 13: 495-504. |
| [19] | Zhou SW, Zhang M, Zhu M. Liraglutide reduces lipid accumulation in steatotic L02 cells by enhancing autophagy [J]. Mol Med Rep, 2014, 10: 2351-2357. |
| [20] | Rubinsztein DC, Cuervo AM, Ravikumar B, et al. In search of an “autophagomometer” [J]. Autophagy, 2009, 5: 585- 589. |
| [21] | Hsiao PJ, Chen ZC, Hung WW, et al. Risk interaction of obesity, insulin resistance and hormone-sensitive lipase promoter polymorphisms (LIPE-60 C > G) in the development of fatty liver [J]. BMC Med Genet, 2013, 14: 54-61. |
 2015, Vol. 50
2015, Vol. 50

 , 皇甫超申1
, 皇甫超申1