神经退行性疾病是由遗传、年龄或氧化应激等因素导致的神经元进行性死亡或丢失而引起的神经系统功能障碍, 如阿尔茨海默病 (Alzheimer’s disease, AD)、帕金森氏病 (Parkinson’s disease, PD) 和肌萎缩侧索硬化症 (amyotyophic lateral sclerosis, ALS) 等。虽然这类疾病发病的确切机制尚未阐明, 但近年来研究表明胶质细胞持续活化介导的神经炎症可引起神经元变性坏死, 导致中枢神经系统功能紊乱, 与神经退行性疾病的发生发展有密切的关系。热休克蛋白70 (heat shock protein 70, HSP70) 是细胞内重要的分子伴侣, 可维持细胞内环境的稳态。近年研究发现, 在神经系统中HSP70除了具有分子伴侣的功能, 在调节炎症中也起着重要作用, 可通过抑制炎症信号通路中关键蛋白的活性而抑制脑内炎症反应, 进而发挥保护神经元的作用。因此, 研究HSP70对神经炎症的抑制作用对寻找有效治疗神经退行性疾病的药物具有重要意义。本文主要综述HSP70对神经炎症的调节作用, 并以常见的神经退行性疾病AD、PD和ALS为例, 阐述HSP70在这些疾病中对炎症的调节作用, 最后对HSP70作为治疗神经退行性疾病的靶点进行讨论。
1 HSP70热休克蛋白是一种在高温或应激条件下诱导表达的高度保守的分子伴侣蛋白[1], 广泛存在于细胞核、细胞质、内质网和线粒体中。按照分子量大小分为多个家族, 如HSP40、HSP60、HSP70、HSP90和HSP100等。其中以HSP70研究的最多, 主要包括组成型HSC70 (HSC70/HSPA8)、诱导型HSP72 (HSP72/ HSPA1A)、内质网中的BiP (Grp78/HSPA5) 及线粒体中mtHSP70 (Grp75/mortalin/HSPA9) 等。在HSP70的家族成员中, 以胞浆诱导型HSP72的细胞保护作用和炎症调节方面研究的最多。在本文中, 用HSP70表示整个HSP70家族。
HSP70由两个功能结构域组成, 一个是N端分子质量为45 kDa的核苷酸结合域 (nucleotide binding domain, NBD), 另一个是C端分子质量约为30 kDa的底物结合域 (substrate binding domain, SBD), 二者通过疏水氨基酸连接。SBD包括一个保守的β-三明治亚结构域和一个α-螺旋片段可变区功能域。α-螺旋位于β-三明治亚结构域之上, 像一个盖子覆盖在结合通道上面, 阻止结合底物的逃脱, 又称α-螺旋盖[2]。HSP70通过ATP依赖方式调节与底物的亲和性。在ATP结合状态下, α-螺旋盖处于开放状态, β-三明治亚结构域识别暴露疏水氨基酸的损伤蛋白, 并与之结合。ATP在HSP40催化下水解成ADP, 这时α-螺旋盖关闭, 底物与HSP70稳定结合, HSP70开始修复损伤的蛋白。在核酸转换因子 (nucleotide exchange factor, NEF) 的作用下, ADP转换成ATP, α-螺旋盖开放, 底物被释放, 完成了损伤蛋白质的修复 (图 1)。
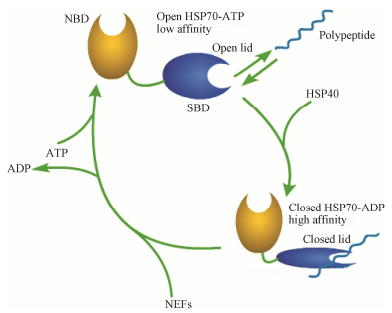 | Figure 1 Interactions of HSP70, HSP40, substrate polypeptide and nucleotide exchange factors (NEFs) |
作为重要的分子伴侣, HSP70参与细胞内蛋白质从头合成、定位及修饰; 帮助新生、未折叠蛋白质折叠并保持天然构象; 帮助错误折叠的蛋白质恢复天然构象; 将严重损伤的蛋白质运输到泛素−蛋白酶体系统 (ubiquitin-proteasome system, UPS) 或溶酶体进行降解。HSP70并不是独立行使功能, 通常受到一系列辅助分子伴侣 (co-chaperone) 的调控。辅助分子伴侣HSP40 (也称J-域蛋白) 可与HSP70的NBD结构域结合, 激活ATP酶[3]。核交换因子BAG-1与NBD结构域结合催化ADP的释放[4]。还有一些辅助分子伴侣, 如CHIP (C-terminus of heat shock protein 70- interacting protein) 和HOP (HSP-organising protein), 可以与HSP70的C端结合, 延长底物与HSP70的作用时间[5]。随着对HSP70研究的深入, 发现HSP70除了具有分子伴侣功能, 还与炎症和凋亡有着密切的关系。HSP70能感知细胞内炎症和凋亡信号变化 并对此做出反应, 这也是机体适应环境变化的一种防御性措施。在核转录因子κB (nuclear transcription factor kappa B, NF-κB) 炎症信号通路中, HSP70可抑制NF-κB与IκB的解离和NF-κB p65入核, 从而抑制炎症反应。
2 神经炎症在神经退行性疾病中的作用对中枢神经系统炎症的认识开始于1987年McGeer等[6]报道的一篇具有里程碑意义的研究论文, 发现在AD患者脑内有大量活化的小胶质细胞, 首次证实了神经炎症参与AD的病理过程。随后, 在AD患者脑内又发现了补体蛋白和整合素, 进一步证实了炎症反应在AD脑发病中的作用[7]。此外, 流行病学研究发现长期服用非甾体抗炎药可降低AD[8]和PD[9]的发病风险, 进一步证实了以胶质细胞激活为特征的炎症反应在神经退行性疾病中的作用。
小胶质细胞和星形胶质细胞是位于脑内的固有免疫细胞。其中小胶质细胞是脑内主要的免疫效应细胞, 在中枢神经系统内分布广泛, 通过免疫监视功能维持中枢神经系统内环境稳定。在受到外界致病因 子刺激时, 小胶质细胞被激活, 变成阿米巴样, 吞噬损伤的组织、异物、细胞碎片和病原体, 有利于组织修复。若炎症持续存在, 变成慢性炎症, 胶质细胞被过度激活, 释放多种化学因子、细胞因子和兴奋性氨基酸等毒性物质损伤神经元[10]。受损的神经元会释放出细胞内蛋白, 与胶质细胞膜表面受体结合, 进一步激活胶质细胞, 从而在神经元凋亡和胶质细胞激活之间形成一种恶性循环, 导致神经元慢性进行性死亡和丢失。在AD患者和相应的动物模型中发现大量激活的胶质细胞[11], 激活的胶质细胞产生大量的炎症因子能够引起tau蛋白的磷酸化和神经元突触素 (synaptophysin) 水平降低[12], 这种炎症反应可导致动物空间记忆能力障碍[13]。1-甲基-4-苯基-1,2,3,6-四氢吡啶 (MPTP) 能够使动物黑质致密部小胶质细胞激活, 导致多巴胺神经元变性[14]。因此抑制神经炎症具有神经保护作用, 可缓解神经退行性疾病的病理进程。在脂多糖 (lipopolysaccharides, LPS) 刺激的原代小胶质细胞中, 化合物吡咯并奎宁醌 (pyrroloquinoline quinine, PQQ) 能够显著抑制一氧化氮 (nitric oxide, NO)、肿瘤坏死因子-α (tumor necrosis factor-α, TNF- α)、白细胞介素-1β (interleukin-1β, IL-1β) 和IL-6等炎症介质的释放及诱导型一氧化氮合酶 (inducible nitric oxide synthase, iNOS)、环氧化物水解酶-2 (COX-2)、单核细胞趋化蛋白-1和巨噬细胞炎性蛋白- 1α等炎症蛋白的表达[15]。在慢性MPTP动物模型中, 罗格列酮能抑制小胶质细胞的激活, 恢复CD206至正常水平, 保护多巴胺神经元[14]。本实验室研究发现番荔枝酰胺衍生物FLZ可抑制大鼠黑质注射LPS引起的神经炎症, 改善PD症状[16]。上述研究表明, 抑制神经炎症可能是治疗神经退行性疾病的重要靶点, 也是缓解神经退行性疾病病理进程的一个新的治疗策略。
3 HSP70对神经炎症的调节作用在β-淀粉样蛋白和路易小体中发现有HSP70共存, 这是第一个证据表明HSP70参与神经退行性病变的病理过程。后来在激活的胶质细胞附近发现了HSP70的高表达, 研究者逐渐把目光转向HSP70与神经炎症之间关系的研究上。HSP70在细胞内可通过多种途径抑制炎症反应, 其在细胞内作为抗炎分子已得到大量的实验证实。检测住院老年患者与其他患者脑内炎症反应的情况, 发现随着年龄的增长血清中HSP70的含量逐渐下降, 表明衰老可降低HSP70的功能[17]。实验研究表明致炎因子如IL-1、IFN-γ和TNF-α等刺激胶质细胞能够诱导HSP70的表达[18]。在LPS刺激的单核巨噬细胞中, 薰衣草精油可以通过上调HSP70的表达抑制IL-1β和超氧阴离子的产生, 降低磷酸化NF-κB及TLR-4的水平, 减轻LPS引起的炎症反应[19]。用LPS刺激大鼠原代星形胶质细胞, 化合物6-姜烯酮能通过诱导HSP70的生成抑制炎症介质的释放、iNOS和COX-2的合成以及NF-κB的激活[20] 。大鼠脑内给予适量的酒精预处理, 发现可以通过增加HSP70和HSP27的表达抑制Aβ聚集引起的神经炎症, 从而预防衰老或AD初期认知功能的障碍[21]。Doeppner等[22]在脑缺血模型小鼠脑内发现, HSP70可抑制小胶质细胞的激活, 减少脑组织损伤面积, 维持血脑屏障的完整性。在过表达HSP70的小胶质细胞和星形胶质细胞混合培养体系中发现小胶质细胞对星形胶质细胞的毒性完全受到抑制[23]。以上实验表明, HSP70可通过抑制炎症反应减轻炎症介质对神经元的毒性, 产生神经保护作用。
NF-κB是一条重要的炎症信号通路, 脑内的炎症反应与NF-κB激活紧密相关。在静息状态下, NF-κB在胞浆与它的抑制蛋白IκB结合, 这时NF-κB的活性处于抑制状态。缺血、氧化应激及内毒素都能使NF- κB与IκB解离从而激活NF-κB。 IκB受IκB激酶 (IKK) 调节, IKK由IKKα和IKKβ组成, 激活后可磷酸化IκB, IκB被蛋白酶体降解释放出NF-κB。此外, NF-κB自身也可以诱导IκB的降解[24]。NF-κB与IκB解离后转位进入细胞核, 与相应的DNA元件结合, 调控炎症基因的转录。研究发现大脑受到损伤后NF-κB迅速被激活, 在12 h达到顶峰 [25, 26]。LPS腹腔注射后2~6 h, 大脑皮层神经元NF-κB即被激活, 12 h后在变性神经元附近的星形胶质细胞中NF-κB也被激活, 表明NF-κB参与神经炎症反应。HSP70可与IκB和IKK相互作用抑制IκB的磷酸化以及与NF-κB的解离, 因此HSP70可通过抑制NF-κB信号通路而抑制炎症反应 [27, 28, 29] (图 2)。在多发性硬化症的动物模型中, 雷公藤甲素通过HSP70稳定NF-κB/IκB复合物, 抑制NF-κB的核转位。在体外实验中, 雷公藤甲素通过上调HSP70 mRNA和蛋白表达抑制致炎因子如TNF-α、IL-1β mRNA的表达[30]。多发性硬化症患者高表达HSP70可降低脑内炎症反应, 使神经退行性疾病进展缓慢[31]。以上研究表明HSP70是一种重要的炎症调节蛋白, 在调节炎症的过程中, 与NF-κB信号通路中的多个位点蛋白相互作用, 抑制神经炎症反应和保护神经元。
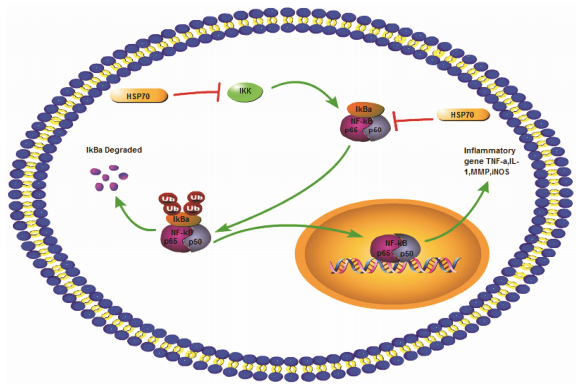 | Figure 2 Inhibition of HSP70 on NF-κB signaling pathway |
神经退行性疾病如AD、PD和ALS等, 神经元缓慢、进行性丢失与胶质细胞激活介导的炎症反应有密切的关系。越来越多的证据表明, HSP70是调节神经炎症的重要蛋白, 高表达HSP70可抑制脑内炎症反应。神经退行性疾病的发生与年龄相关, 研究发现衰老可致脑内HSPs功能明显降低[17], 而氧化应激和异常蛋白质的聚集会激活胶质细胞导致炎症的发生, 造成HSPs功能低下与神经炎症反应之间的不平衡, 导致炎症扩大和恶化。因此过表达HSP70抑制炎症反应可能对神经退行性疾病有保护作用。可以推测, 研究和设计小分子热休克蛋白诱导剂或许可能成为一种防治神经退行性疾病的新途径。高温是最原始的诱导HSP70高表达的方法, 但是在很多情况下将动物整体暴露于高温下是不可行的。目前研究发现, 采用药理学方法诱导HSP70表达可能是一种极富前景的治疗神经退行性疾病的方法。目前已开发出多种小分子HSP70诱导剂, 实验表明它们可有效地抑制神经炎症和保护神经元。Aβ1-42能够引起小鼠皮层炎症反应, 过氧化物酶体增殖激活受体γ (peroxisomeproliferator- activated receptors γ, PPARγ) 激动剂可以通过上调HSP70的表达抑制IκBα的降解, 降低NF-κB的活性产生抗炎作用, 减轻小鼠学习记忆损害[32]。吡咯烷二硫代氨基甲酸盐 (PDTC) 可上调HSP70表达从而抑制NF-κB的活性, 减少致炎因子的产生, 改善莨菪碱诱发的AD小鼠模型学习记忆和认知功能障碍[33]。在MPTP诱发的小鼠PD模型中, 雷公藤红素减轻MPTP的毒性作用与其诱导HSP70的表达有关[34]。南蛇藤醇可能通过提高HSP70的表达, 抑制SOD1-G39A转基因小鼠脑中炎症因子的释放、炎症蛋白的表达和胶质细胞的激活, 在运动神经元中发挥神经保护作用[35]。在MPTP诱发的小鼠PD模型中, 南蛇藤醇通过上调HSP70的表达, 抑制胶质细胞的激活, 抑制炎症反应, 保护多巴胺能神经元[34]。生胃酮 (carbenoxolone) 是一种HSP70诱导剂, 可减轻鱼藤酮诱发的小鼠PD 模型脑中星形胶质细胞的激活, 抑制TNF-α、IL-6和IL-1β等炎症因子的释放、炎症蛋白COX-2、iNOS的表达和NF-κB的核转位, 对PD具有保护作用[36]。在α-synuclein转基因小鼠中FLZ可通过提高中脑HSP70的表达, 抑制α-synuclein引起的神经炎症, 改善小鼠运动行为学障碍 (未发表数据)。以上研究表明通过脑内高表达HSP70可抑制神经炎症反应, 降低炎症对神经元的损害, 达到神经保护作用, 在神经退行性疾病的发生发展中都起着重要作用。因此合理调控HSP70的表达对于细胞的健康状态至关重要, HSP70在药理学上可作为一种新型的神经保护的分子靶点。
5 结语与展望作为重要的分子伴侣, HSP70不仅能够对蛋白 质进行质量调控, 还可抑制脑内炎症反应, 对维持神经系统内环境的稳态有重要意义。分子生物学研究表明脑内异常蛋白聚集和炎症的发生可能与HSP70系统功能低下有密切的关系, 认为HSP70直接或间接参与神经退行性疾病的发病, 是一种重要的分子靶点。因此提高HSP70的表达对神经退行性疾病具有治疗作用。采用药理学方法提高HSP70的表达可抑制神经炎症的发生和保护神经元, 是一种有效可行的方法。目前一些非常有前景的、可提高HSP70表达的小分子化合物正在研发中, 临床前研究表明这些化合物对神经退行性疾病具有保护作用。尽管在HSP70研究方面取得了一些令人满意的结果, 但是找到选择性好的HSP70诱导剂仍是一个漫长的工作, 面临着巨大的挑战, 如目前没有一个可以完全模拟神经退行性疾病病因和发病机制的动物模型, 导致化合物的药效学评价受到限制。另外临床上神经退行性疾病病因复杂, 发病严重程度不一致, 涉及到的信号通路较多, 而HSP70诱导剂只针对一个靶点, 这是开发神经保护剂面临的问题。但是, 以HSP70为靶点抑制神经炎症的神经保护剂的开发是神经退行性疾病治疗中的一大进步, 是神经保护疗法的具体体现, 是极富前景的治疗神经退行性疾病的方法。
| [1] | Ritossa F. A new puffing pattern induced by temperature shock and DNP in drosophila [J]. Cell Mol Life Sci, 1962, 18: 571-573. |
| [2] | Zhu Z, Zhao X, Burkholder WF, et al. Structure analysis of substrate binding by the molecular chaperone DanK [J]. Science, 1996, 272: 1606-1614. |
| [3] | Sterrenberg JN, Blatch GL, Edkins AL. Human DNAJ in cancer and stem cells [J]. Cancer Lett, 2011, 312: 129-142. |
| [4] | Knapp RT, Wong MJ, Kollmannsberger LK, et al. Hsp70 cochaperones HspBP1 and BAG-1M differentially regulate steroid hormone receptor function [J]. PLoS One, 2014, 9: e85415. |
| [5] | Allan RK, Ratajczak T. Versatile TPR domains accommodate different modes of target protein recognition and function [J]. Cell Stress Chaperones, 2011, 16: 353-367. |
| [6] | McGeer PL, Itaqaki S, Tago, H, et al. Reactive microglia with senile dementia of Alzheimer type are positive for the hisocompatibilty glycoprotein HLA-DR [J]. Neurosci Lett, 1987, 79: 195-200. |
| [7] | McGeer PL, McGeer EG, Kawamata T, et al. Reaction of the immune system in chronic degenerative neurological diseases [J]. Can J Neurol Sci, 1991, 18: 376-379. |
| [8] | Heneka MT, O'Banion MK, Terwel D, et al. Neuroinflammation processes in Alzheimer's disease [J]. J Neural Transm, 2010, 117: 919-947. |
| [9] | Rees K, Stowe R, Patel S, et al. Non-steroidal anti-inflammatory drugs as disease-modifying agents for Parkinson's disease: evidence from observational studies [J]. Cochrane Database Syst Rev, 2011, 9: CD008454. |
| [10] | Gonzalez-Scarano F, Baltuch G. Microglia as mediators of inflammatory and degenerative disease [J]. Annu Rev Neurosci, 1999, 22: 219-240. |
| [11] | Yoo Y, Byun K, Kang T, et al. Amyloid-beta-activated human microglial cells through ER-resident proteins [J]. J Proteome Res, 2015, 14: 214-223. |
| [12] | Li Y, Liu L, Barger SW, et al. Interleukin-1 mediates pathological effects of microglia on tau phosphorylation and on synaptophysin synthesis in cortical neurons through a p38-MAPK pathway [J]. J Neurosci, 2003, 23: 1605-1611. |
| [13] | Deng X, Li M, Ai W, et al. Lipopolysaccharide-induced neuroinflammation is associated with Alzheimer's like amyloidogenic axonal pathology and dendritic degeneration in rats [J]. Adv Alzheimer Dis, 2014, 3: 78-93. |
| [14] | Pisanu A, Lecca D, Mulas G, et al. Dynamic changes in pro-and anti-inflammation cytokines in microglia after PPAR-γ agonist neuroprotective treatment in the MPTPp mouse model of progressive Parkinson's disease [J]. Neurobiol Dis, 2014, 71: 280-291. |
| [15] | Yang C, Yu L, Kong L, et al. Pyrroloquinoline quinone (PQQ) inhibits lipopolysaccharide induced inflammation in part via downregulated NF-κB and p38/JNK activation in microglial and attenuates microglia in lipopolysaccharide treatment mice [J]. PLoS One, 2014, 9: e109502. |
| [16] | Tai W, Ye X, Bao X, et al. Inhibition of Src tyrosine kinase activity by squamosamide derivative FLZ attenuates neuroinflammation in both in vivo and in vitro Parkinson's disease models [J]. Neuropharmacology, 2013, 75: 201-212. |
| [17] | Njemini R, Bautmans I, Onyema OO, et al. Circulating heat shock 70 in health, aging and disease [J]. BMC Immunol, 2011, 12: 24-32. |
| [18] | D'Souza SD, Antel JP, Freedman MS. Cytokine induction of heat shock protein expression in human oligodendrocytes: an interleukin-1-mediated mechanism [J]. J Neuroimmunol, 1994, 50: 17-24. |
| [19] | Huang MY, Liao MH, Wang YK, et al. Effect of lavender essential oil on LPS-stimulated inflammation [J]. Am J Chin Med, 2012, 40: 845-859. |
| [20] | Shim S, Kim S, Choi DS, et al. Anti-inflammatory effects of [6]-shogaol: potential of HDAC inhibition and HSP70 induction [J]. Food Chem Toxicol, 2011, 49: 2734-2740. |
| [21] | Collins MA, Neafsey EJ, Wang K, et al. Moderate ethanol preconditioning of rat brain cultures engenders neuroprotection against dementia-inducing neuroinflammatory proteins: possible signaling mechanisms [J]. Mol Neurobiol, 2010, 41: 420- 425. |
| [22] | Doeppner TR, Kaltwasser B, Fengyan J, et al. TAT-Hsp70 induces neuroprotection against stroke via anti-inflammatory actions providing appropriate cellular microenvironment for transplantation of neural precursor cells [J]. J Cereb Blood Flow Metab, 2013, 33: 1778-1788. |
| [23] | Zheng Z, Kim JY, Ma H, et al. Anti-inflammatory effects of the 70 kDa heat shock protein in experimental stroke [J]. J Cereb Blood Flow Metab, 2008, 28: 53-63. |
| [24] | Hayden MS, Ghosh S. Shared principles in NF-κB signaling [J]. Cell, 2008, 132: 344-362. |
| [25] | Chen G, Shi J, Hu Z, et al. Inhibitory effect on cerebral inflammatory response following traumatic brain injury in rats: a potential neuroprotective mechanism of N-acetylcysteine [J]. Mediators Inflamm, 2008, doi: 10.1155/2008/716458. |
| [26] | Chen NJ, Chio L, Lin WJ, et al. Beyond tumor necrosis factor receptor: TRADD signaling in toll-like receptors [J]. Proc Natl Acad Sci USA, 2008, 105: 12429-12434. |
| [27] | Feinstein DL, Galea E, Aquino DA, et al. Heat shock protein 70 suppresses astroglial-inducible nitric-oxide sythnase expression by decreasing NF-κB activation [J]. J Biol Chem, 1996, 271: 17724-17732. |
| [28] | Ran R, Lu A, Zhang L, et al. Hsp70 promotes TNF-mediated apoptosis by binding IKKγ and impairing NF-κB survival signaling [J]. Genes Dev, 2004, 18: 1466-1481. |
| [29] | Sheppard PW, Sun X, Khammash M, et al. Overexpression of heat shock protein 72 attenuates NF-κB activation using a combination of regulatory mechanisms in microglia [J]. PLoS Comput Biol, 2014, 10: e1003471. |
| [30] | Kizelsztein P, Komarnytsky S, Raskin I. Oral administration of triptolide ameliorates the clinical sighs of experimental autoimmune encephalomyelitis (EAE) by induction of HSP70 and stabilization of NF-κB/IκBα transcriptional complex [J]. J Neuroimmnuol, 2009, 217: 28-37. |
| [31] | Boiocchi C, Osera C, Monti MC, et al. Are Hsp70 protein expression and genetic polymorphism implicated in multiple sclerosis inflammation? [J]. J Neuroimmunol, 2014, 268: 84-88. |
| [32] | Heneka MT, Gavrilyuk V, Landreth GE, et al. Noradrenergic depletion increases inflammatory response in brain: effects on IκB and HSP70 expression [J]. J Neurochem, 2003, 85: 387- 398. |
| [33] | Abd-EI-Fatthah MA, Abdelakader NF, Zaki HF. Pyrrolidine dithiocarbamate protects against scopolamine-induced cognitive impairment in rats [J]. Eur J Pharmacol, 2014, 723: 330- 338. |
| [34] | Cleren C, Callogasan NY, Chen J, et al. Celastrol protects against MPTP-and 3-nitropropionic acid-induced neurotoxicity [J]. J Neurochem, 2005, 94: 995-1004. |
| [35] | Kiaei M, Kipiani K, Petri S, et al. Celastrol blocks neuronal cell death and extends life in transgenic mouse model of amyotrophic lateral sclerosis [J]. Neurodegener Dis, 2005, 2: 246-254. |
| [36] | Thakur P, Nehru B. Inhibition of neuroinflammation and mitochondrial dysfunctions by carbenoxolone in the retenone model of Parkinson's disease [J]. Mol Neurobiol, 2015, 51: 209-219 |
 2015, Vol. 50
2015, Vol. 50


