有机阴离子转运多肽 (organic anion transporting polypeptides, 人类用OATPs表示, 其他物种用Oatps表示) 是一类广泛表达于身体各器官和组织的多特异性转运蛋白家庭, 其中家族成员OATP1B1在正常生理条件下选择性地表达于肝细胞的基底外侧膜上。OATP1B1转运的底物十分广泛, 包括胆汁酸、胆红素、甲状腺素、甾类结合物和大量外源性物质如药物, 包括抗癌药甲氨蝶呤、抗结核药利福平和他汀类降脂药等[1]。
不良药物相互作用是合并症及多重用药的常见结果, 比如一些中草药可能影响某些药物的药代动力学性质。虽然之前的报道主要集中在药物代谢酶相关的药物相互作用, 但是中草药与转运体的相互作用最近也得到了越来越多的重视。有研究表明在植物中广泛存在的黄酮类化合物可能与一些外排转运体如P-糖蛋白 (P-gp)、乳腺癌耐药蛋白 (BCRP) 和多药耐药相关蛋白1 (MRP1) 有相互作用, 这意味着药物与黄酮类化合物有可能发生转运体介导的药物−药物或药物−食物相互作用[2]。目前, 已有一些研究表明某些天然产物对肝摄取转运体OATP1B1的功能存在影响[3,4,5,6,7]。因为天然产物的种类繁多以及OATP1B1对药物处置和代谢的重要作用, 希望鉴定得到更多对OATP1B1功能有影响的天然产物, 以及这些天然产物是否对不同OATP1B1底物存在不同的影响。本研究用OATP1B1的荧光底物荧光素甲氨蝶呤 (FMTX) 来衡量OATP1B1的功能, 在96孔板中用稳定表达OATP1B1的CHO细胞对21种天然产物进行了筛 选。由于被摄入细胞中FMTX的量可以用酶标仪直接扫描测得, 因此该方法可用于化合物库的高通量筛选[8]。运用该方法从天然产物提取物中筛选得到了一些OATP1B1的抑制剂, 并测定了它们的IC50值。同时, 为了研究这些天然产物对OATP1B1介导摄取的影响是否存在底物依赖, 建立了检测OATP1B1底物药物氟伐他汀和罗伐他汀的LC-MS/MS方法, 并运用这一方法对天然产物抑制OATP1B1功能的底物依赖性进行了研究。
材料与方法 试剂异槲皮苷 (isoquercitrin) (纯度≥90%)、氟伐他汀 (fluvastatin) (纯度≥98%)、利福平 (rifampicin) (纯度≥98%) 和罗伐他汀 (rosuvastatin) (纯度≥98%) 均从Sigma公司购得; 荧光素甲氨蝶呤 (fluorescein methotrexate, FMTX) 从Biotium购得; 菊花梗叶黄酮 (chrysanthemum flavonids) (混合物)、桑皮苷A (mulberroside A) (含量≥98%) 和桑皮黄素 (mulberrin) (含量≥98%) 由苏州大学药学院刘江云课题组提供; 黄芪甲苷 (astragaloside A)、大豆苷 (daidzin)、薯蓣皂苷 (dioscin)、甘草次酸 (glycyrrhetinic acid)、甘草酸 (glycyrrhizic acid)、金丝桃苷 (hyperoside)、甘草苷 (liquiritin)、芍药苷 (paeoniflorin)、葛根素 (puerarin)、槲皮苷 (quercitrin) 和牧荆素 (vitexin) 等化合物 (含量均≥98%) 从南京春秋生物工程有限公司购得; 甜菊醇葡糖醛酸结合物 (steviol glucuronide) (纯度 > 99%) 由上海泓博智源医药技术有限公司提供; 槲皮素 (quercetin) (含量≥98%) 从国药集团购得; 芦丁 (rutin) (含量≥98%) 和薯蓣皂素 (diosgenin) (含量≥98%) 从Adamas公司购得; 绿原酸 (chlorogenic acid) 由中国食品药品检定研究院提供。
仪器TECAN Infinite M1000 Pro全波长多功能酶标仪; 岛津Prominenece UFLC超快速液相色谱仪串联AB Sciex API 4000 QTRAP质谱仪, Analyst 1.1数据处理系统; 赛默Micro CL 21R高速离心机。
细胞及其培养中国仓鼠卵巢细胞 (CHO) 和稳定表达人OATP1B1的CHO细胞 (CHO-OATP1B1) 在含5% CO2的37 ℃培养箱中培养传代, CHO细胞所用培养基为含10% 胎牛血清、100 u·mL−1青霉素、100 μg·mL−1链霉素和50 μg·mL−1脯氨酸的DMEM低糖培养基。CHO-OATP1B1所用培养基和CHO相同, 但含有300 μg·mL−1潮霉素B。细胞培养试剂均从Hyclone购得。
细胞表面生物素化和免疫印迹分析CHO和CHO-OATP1B1细胞以每孔250 000种于6孔板中, 48 h后用5 mmol·L−1丁酸钠诱导细胞, 诱导24 h后进行细胞表面生物素化和免疫印迹实验。细胞表面生物素化实验用于提取膜蛋白, 具体步骤参见文献[9]。对分离得到的膜蛋白进行8% SDS-PAGE凝胶电泳和转膜。由于在OATP1B1的C末端加入了一个6×His标签, 因此检测OATP1B1的一抗为鼠抗6×His抗体, 二抗为辣根过氧化物酶 (HRP) 标记的山羊抗鼠免疫球蛋白G。检测质膜标志蛋白Na+/K+-ATPase的一抗为兔抗Na+/K+-ATPase α亚基抗体, 二抗为HRP标记的鼠抗兔免疫球蛋白G。免疫印迹用化学发光试剂在医用X射线胶片上显影, 曝光。
FMTX为底物的转运分析将CHO-OATP1B1细胞以每孔12 000个种在96孔板中, 48 h后用5 mmol·L−1丁酸钠诱导细胞, 诱导24 h后进行摄取实验。摄取实验过程: 首先用37 ℃的摄取缓冲液 (116.4 mmol·L−1 NaCl、5.3 mmol·L−1 KCl、1 mmol·L−1 NaH2PO4、0.8 mmol·L−1 MgSO4、5.5 mmol·L−1 D-葡萄糖和20 mmol·L−1 4-羟乙基哌嗪乙磺酸, 用Trizma碱将pH 值调到7.4) 清洗细胞3次, 然后加入含FMTX和天然产物的摄取缓冲液开始摄取实验, 其中FMTX浓度为5 μmol·L−1, 天然产物浓度为10和100 μmol·L−1 (菊花梗叶黄酮浓度为5和50 μg·mL−1), 孵育时间为30 min。天然产物的储备液均以DMSO为溶剂, 给药溶液的最终DMSO含量均为1%。以含有10和100 μmol·L−1利福平作为阳性对照。为了终止反应, 每孔用200 μL冰缓冲液洗4次。最后用含1% 曲拉通的磷酸盐缓冲液裂解细胞, 并使用多功能微孔板酶标仪, 在激发波长485 nm和发射波长528 nm的条件下检测荧光。每组实验均为4个复孔。此外, 为了测定天然产物对OATP1B1所介导FMTX的转运IC50值, 将底物FMTX和不同浓度的天然产物共同孵育测定转运功能。
氟伐他汀和罗伐他汀为底物的转运分析经过抑制剂筛选实验后, 得到了一些抑制活性好的化合物。为了确定它们的抑制作用是否存在底物依赖性, 测定了它们对OATP1B1介导的氟伐他汀和罗伐他 汀的转运的影响。摄取实验在24孔板上进行 (CHO- OATP1B1细胞在使用之前用5 mmol·L−1丁酸钠诱导24 h), 首先用37 ℃预热的缓冲液洗细胞3次, 然后 加入含底物和抑制剂的摄取缓冲液开始摄取实验, 其中底物浓度为5 μmol·L−1, 抑制剂浓度为10和100 μmol·L−1 (菊花梗叶黄酮浓度为5和50 μg·mL−1), 37 ℃反应2 min后, 吸去摄取缓冲液并用冰缓冲液洗4次以终止摄取。然后细胞用1 mol·L−1氢氧化钠溶液200 μL裂解1 h, 并用等体积1 mol·L−1盐酸中和, 超声破碎。取100 μL细胞裂解液, 加入含内标的甲醇100 μL沉淀蛋白, 离心, 上清液用LC-MS/MS测定氟伐他汀和罗伐他汀的含量。剩下的样品用BCA试剂盒测蛋白浓度。每组实验均为3个复孔。
氟伐他汀和罗伐他汀LC-MS/MS检测方法色谱柱为艾杰尔公司的Venusil XBP C18柱 (2.1 mm × 50 mm; 5 μm), 流动相由0.1% 甲酸的水溶液 (A相) 和0.1% 甲酸的甲醇溶液 (B相) 组成。氟伐他汀的洗脱梯度为: 0~0.5 min, 25% B; 1.5 min, 90% B; 1.5~4.5 min, 90% B; 4.6~6 min, 25% B。罗伐他汀的洗脱梯度为: 0~0.5 min, 15% B; 2.5 min, 95% B; 2.5~4.5 min, 95% B; 4.6~6 min, 15% B。流速0.3 mL·min−1, 柱温40 ℃, 时长6 min。
质谱离子源为电喷雾离子化源 (ESI), 采用多反应监测模式 (MRM)。氟伐他汀采用负离子模式检测, 离子对为m/z 410.3 → 348.2, 内标阿托伐他汀的离子对为m/z 557.0 → 397.0; 罗伐他汀采用正离子模式检测, 离子对为m/z 482.2 → 258.1, 内标阿托伐他汀的离子对为m/z 559.4 → 440。
统计学处理所有实验结果均以平均值±标准差表示, 并采用GraphPad Prism 5.0软件对数据进行统计学分析。天然产物抑制能力筛选试验采用One-way ANOVA (单因素方差分析) 分析, P < 0.05即认为具有显著性差异; IC50值由剂量反应抑制模型非线性拟合得到。
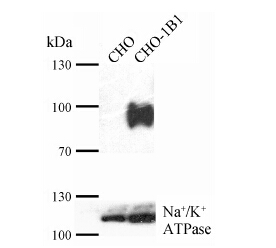
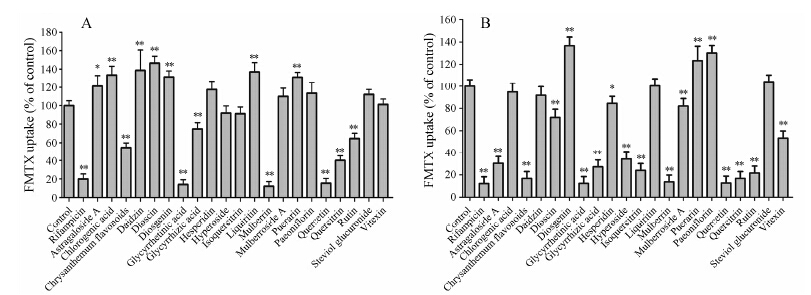
结果 1 天然产物对OATP1B1介导的FMTX摄取的影响用细胞表面生物素化法和Western blot对稳定表达OATP1B1的CHO细胞进行了表征, 其中细胞表 面生物素化法用于提取细胞的膜蛋白。如图 1所示, OATP1B1特异性地表达在CHO-OATP1B1的细胞膜上。为了研究天然产物对人的摄取转运体OATP1B1的转运活性的影响, 本实验比较了在加或不加天然产物时转运体对FMTX的吸收值 (图 2)。利福平是阳性对照, 在10和100 μmol·L−1两个浓度下对OATP1B1的转运均有明显抑制。当天然产物的浓度为10 μmol·L−1 (菊花梗叶黄酮为5 μg·mL−1) 时, 抑制最强的是桑皮黄素、甘草次酸和槲皮素, 抑制率分别为88%、86% 和85%; 抑制较强的有槲皮苷、菊花梗叶黄酮、芦丁和甘草酸, 抑制率分别为60%、46%、36% 和26% (图 2A)。当天然产物的浓度增加到100 μmol·L−1 (菊花梗叶黄酮为50 μg·mL−1) 时, 除了前面所述的有较强抑制的天然产物抑制强度增强之外, 黄芪甲苷、金丝桃苷和异槲皮苷也产生了70% 左右的强抑制活性 (图 2B)。其他的化合物对OATP1B1的活性基本不抑制。
|
Figure 1 Western blot analysis of CHO cells stably expressing OATP1B1. Membrane proteins were isolated by surface biotinylation and subjected to SDS-polyacrylamide gel electrophoresis and immunoblot analysis. OATP1B1 was detected with a mouse anti-His tag antibody. Plasma membrane marker Na+/K+-ATPase was detected with a rabbit anti-Na+/K+-ATPase α subunit antibody and served as a control |
|
Figure 2 Effect of natural products on OATP1B1-mediated FMTX uptake in CHO-OATP1B1 cells. Uptake of FMTX was measured after the incubation of FMTX (5 μmol·L−1) in the absence (control) or presence of rifampicin (positive control) and 21 natural compounds or extracts at concentrations of 10 μmol·L−1 (5 μg·mL−1 for chrysanthemum flavonoids) (A) and 100 μmol·L−1 (50 μg·mL−1 for chrysanthemum flavonoids) (B) for 30 min in the cells. n = 4, x± s. P < 0.05, **P < 0.01 vs control |
选择抑制剂浓度为100 μmol·L−1 (菊花梗叶黄酮为50 μg·mL−1) 时, 抑制强度大于50% 的天然产物: 菊花梗叶黄酮、甘草酸、甘草次酸、槲皮素、槲皮苷、桑皮黄素、芦丁、黄芪甲苷、金丝桃苷和异槲皮素, 分析这些天然产物对OATP1B1活性的浓度依赖性抑制 (表 1)。其中桑皮黄素、甘草次酸、槲皮苷、槲皮素和菊花梗叶黄酮对OATP1B1介导FMTX摄取的抑制最强, IC50值分别是 (3.4 ± 1.2)、(4.0 ± 1.2)、(4.1 ± 1.1)、(4.6 ± 1.3) μmol·L−1和 (5.3 ± 1.2) μg·mL−1; 芦丁、甘草酸、异槲皮苷和金丝桃苷对OATP1B1有较强的抑制作用, IC50值分别是 (15.0 ± 1.1)、(15.7 ± 1.1)、(18.7 ± 1.1) 和(22.0 ± 1.0) μmol·L−1; 黄芪甲苷A抑制最弱, IC50值为 (30.4 ± 1.1) μmol·L−1。
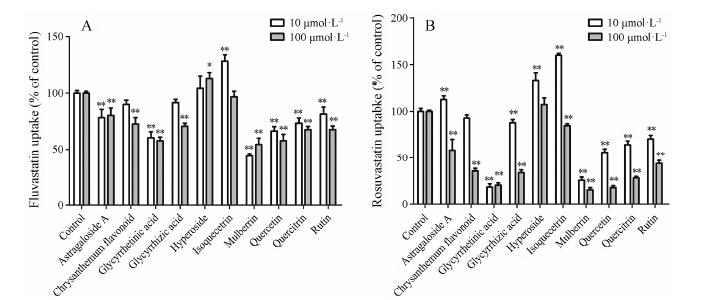
3 天然产物对OATP1B1抑制作用的底物依赖性研究为了考察天然产物对OATP1B1的抑制作用是否存在底物依赖性, 选择对FMTX摄取有较强抑制作用的天然产物桑皮黄素、甘草次酸、槲皮素、槲皮苷、菊花梗叶黄酮、芦丁、甘草酸、异槲皮素、金丝桃苷和黄芪甲苷, 测定它们是否抑制OATP1B1对他汀类药物氟伐他汀和罗伐他汀的转运, 结果如图 3所示。对于OATP1B1所介导的氟伐他汀的转运, 所选用的抑制剂浓度为10 μmol·L−1时, 只有桑皮黄素产生了50% 左右的抑制; 而抑制剂浓度为100 μmol·L−1时, 也只有桑皮黄素、甘草次酸和槲皮素产生了50% 左右的抑制 (图 3A)。因此对氟伐他汀的抑制作用并没有表现出明显的浓度依赖性。对于OATP1B1介导的罗伐他汀的转运, 当抑制剂浓度为10 μmol·L−1时, 桑皮黄素和甘草次酸表现出了较强的抑制作用, 分别抑制了OATP1B1转运功能的80% 和69%, 其他化合物的抑制作用较弱, 抑制率均小于50%; 而抑制剂浓度为100 μmol·L−1时, 桑皮黄素、甘草次酸、槲皮素、槲皮苷、菊花梗叶黄酮、芦丁和甘草酸均抑制了50%以上 (图 3B)。因此对罗伐他汀的抑制作用表现出了明显的浓度依赖性。与氟伐他汀相比, OATP1B1对罗伐他汀的转运受抑制剂的影响更为显著, 即天然产物对OATP1B1的抑制作用有明显的底物依赖性。10、100 μmol·L−1的桑皮黄素对于氟伐他汀和罗素伐他汀均有50% 以上的抑制作用, 所以在口服这两类他汀药物时应避免食用含桑皮黄素的食物或中草药。
|
Figure 3 Effect of selected natural compounds on OATP1B1-mediated uptake of fluvastatin (A) and rosuvastatin (B) in CHO- OATP1B1 cells. Uptake was measured for 5 μmol·L−1 fluvastatin and rosuvastatin in the absence (control) or presence of 10 natural compounds at concentrations of 10 μmol·L−1 (5 μg·mL−1 for chrysanthemum flavonoids) and 100 μmol·L−1 (50 μg·mL−1 for chrysanthemum flavonoids) for 2 min in the cells. n = 3, x± s. P < 0.05, **P < 0.01 vs control |
|
|
Table 1 IC50 values of selected natural products on OATP1B1- mediated fluorescein methotrexate (FMTX) uptake. CHO- OATP1B1 cells were incubated with 5 μmol·L−1 FMTX in the absence and presence of increasing concentrations of astragaloside A, chrysanthemum flavonoids, glycyrrhetinic acid, glycyrrhizic acid, hyperoside, isoquercitrin, mulberrin, quercetin, quercitrin, and rutin for 30 min at 37 ℃. Uptake of FMTX in the absence of natural compound was set to be 100%. aμg·mL−1. n = 4, x± s |
药物及食物诱导或抑制OATP1B1的功能, 可能改变OATP1B1底物药物的代谢形式甚至造成不良反应。已有文献[3,4,5,6,7]证实, 一些天然产物对肝摄取转运体OATP1B1的功能存在影响。为了鉴定天然产物中更多的OATP1B1调节剂, 从而避免潜在的不良药物−药物和药物−食物相互作用, 本文研究了21种天然产物对OATP1B1的作用。结果表明, 一些黄酮类化合物 (槲皮素、槲皮苷、芦丁、菊花梗叶总黄酮和桑皮黄素) 和三萜类化合物 (甘草次酸和甘草酸) 在体外对肝药摄取转运体OATP1B1的功能有显著抑制。这些天然产物可能通过改变OATP1B1的功能而影响人体对药物的代谢和处置。
槲皮素 (3, 3', 4', 5, 7-五羟基黄酮) 是一种广泛 分布在水果、蔬菜、叶子和谷物等植物中的黄酮。文献[10]报道, 人们日常生活中平均摄取的黄酮类化合物如槲皮素和山柰酚大约为28.55 mg·d−1。有研究表明槲皮素及其衍生物对OATP1B1的功能有抑制作 用[11], 本实验的结果与文献报道一致。然而, 大多数从膳食中摄入的槲皮素类黄酮为槲皮素糖苷类化 合物, 目前人们对该类化合物对OATP1B1功能的影响仍然了解不多。因此, 本文考察了4个槲皮素糖苷类化合物, 即槲皮苷、异槲皮苷、金丝桃苷和芦丁对OATP1B1功能的影响。总的来说, 槲皮素的抑制活性比其糖苷强。槲皮苷是槲皮素3位氧原子上结合 了一分子鼠李糖, 其活性与槲皮素相当; 而当3位氧原子上的糖基为葡萄糖 (异槲皮苷) 和半乳糖 (金丝桃苷) 时, 其IC50值增加了3~4倍。金丝桃苷和异槲皮苷中的糖基分别为半乳糖和葡萄糖, 两者互为差向异构体, 实验结果表明它们对FMTX、氟伐他汀和罗伐他汀的抑制活性相近。当异槲皮苷的葡萄糖基上再连上一分子鼠李糖 (芦丁) 之后, 其抑制能力增强。上述结果表明, 槲皮素3位氧原子上糖的结构及糖链的长度对其抑制能力有显著影响。
菊花梗叶总黄酮是从杭白菊茎叶中提取的黄酮类混合物, 结果表明它对OATP1B1介导的FMTX和他汀类药物的转运具有强的抑制作用。当患者服用OATP1B1的底物药物时应尽量避免菊花茶的摄入, 以防止潜在的药物−食物相互作用。
甘草根的主要生物活性成分是五环三萜糖苷甘草酸及其苷元和主要代谢产物甘草次酸, 它们具有抗炎、抗变应性炎症的活性[12, 13]。甘草酸是甘草次酸的二糖苷形式, 由于空间位阻增加使得它对活性位点的亲和力降低。甘草次酸对OATP1B1的抑制活性是甘草酸的4倍左右。甘草次酸和甘草酸对OATP1B1介导的他汀类药物也有显著抑制作用。临床研究[14]表明, 在志愿者口服0.5~1.5 g剂量的甘草次酸之后, 甘草次酸的血药浓度可达4.5~9.0 mg·L−1 (9.6~19.2 μmol·L−1)。在另外几个临床研究和病例报道中, 健康受试者和患者每天所接受的甘草次酸的剂量为300~500 mg[15,16,17], 根据上面的数据, 估计该剂量下甘草次酸的血药浓度应在5 μmol·L−1以上。因此, 甘草次酸对OATP1B1抑制的IC50值(4.0 μmol·L−1) 与其体内血药浓度相当, 意味着它可能引起OATP1B1介导的药物−药物相互作用。
综上所述, OATP1B1是人体内重要的肝摄取转运蛋白, 对药物在体内的处置和代谢起着非常重要的作用。人们日常服用的草药、食物、饮料和膳食补充剂中存在的各类天然成分有可能改变OATP1B1的功能, 从而引起OATP1B1介导的药物−药物和药物−食物相互作用。本文考察了21种常见天然化合物和提取物对OATP1B1的影响, 结果表明黄酮苷元比其糖苷对OATP1B1的抑制作用更强。此外, 天然产物对OATP1B1的抑制作用具有底物依赖性, 本实验所用的OATP1B1的3个底物受天然产物抑制的强弱顺序为: FMTX > 罗伐他汀 > 氟伐他汀。甘草次酸的IC50值与其临床血药浓度相当, 预示当甘草次酸与OATP1B1的底物药物同时服用时, 有可能导致不良的药物相互作用。本研究为预测和避免潜在的OATP1B1介导的不良药物−药物和药物−食物相互作用提供了参考。
| [1] | Hagenbuch B, Gui C. Xenobiotic transporters of the human organic anion transporting polypeptides (OATP) family [J]. Xenobiotica, 2008, 38: 778-801. |
| [2] | Zhang S, Yang X, Morris ME. Flavonoids are inhibitors of breast cancer resistance protein (ABCG2)-mediated transport [J]. Mol Pharmacol, 2004, 65: 1208-1216. |
| [3] | Wang X, Wolkoff AW, Morris ME. Flavonoids as a novel class of human organic anion-transporting polypeptide OATP1B1 (OATP-C) modulators [J]. Drug Metab Dispos, 2005, 33: 1666-1672. |
| [4] | Fan L, Zhang W, Guo D, et al. The effect of herbal medicine baicalin on pharmacokinetics of rosuvastatin, substrate of organic anion-transporting polypeptide 1B1 [J]. Clin Pharmacol Ther, 2008, 83: 471-476. |
| [5] | Roth M, Timmermann BN, Hagenbuch B. Interactions of green tea catechins with organic anion-transporting polypeptides [J]. Drug Metab Dispos, 2011, 39: 920-926. |
| [6] | Roth M, Araya JJ, Timmermann BN, et al. Isolation of modulators of the liver-specific organic anion-transporting polypeptides (OATPs) 1B1 and 1B3 from Rollinia emarginata Schlecht (Annonaceae) [J]. J Pharmacol Exp Ther, 2011, 339: 624-632. |
| [7] | Wu LX, Guo CX, Qu Q, et al. Effects of natural products on the function of human organic anion transporting polypeptide 1B1 [J]. Xenobiotica, 2012, 42: 339-348. |
| [8] | Gui C, Obaidat A, Chaguturu R, et al. Development of a cell-based high-throughput assay to screen for inhibitors of organic anion transporting polypeptides 1B1 and 1B3 [J]. Curr Chem Genomics, 2010, 4: 1-8. |
| [9] | Gui C, Hagenbuch B. Amino acid residues in transmembrane domain 10 of organic anion transporting polypeptide 1B3 are critical for cholecystokinin octapeptide transport [J]. Biochemistry, 2008, 47: 9090-9097. |
| [10] | Cao J, Zhang Y, Chen W, et al. The relationship between fasting plasma concentrations of selected flavonoids and their ordinary dietary intake [J]. Br J Nutr, 2010, 103: 249-255. |
| [11] | Zhang Y, Hays A, Noblett A, et al. Transport by OATP1B1 and OATP1B3 enhances the cytotoxicity of epigallocatechin 3-O-gallate and several quercetin derivatives [J]. J Nat Prod, 2013, 76: 368-373. |
| [12] | Nafisi S, Manouchehri F, Bonsaii M. Study on the interaction of glycyrrhizin and glycyrrhetinic acid with RNA [J]. J Photochem Photobiol B, 2012, 111: 27-34. |
| [13] | Zhang M, Shen Y. Advances in studies on Glycyrrhizae Radix et Rhizoma and its active components in anti-inflammation and mechanism [J]. Drugs Clin (现代药物与临床), 2011, 26: 261-268. |
| [14] | Krahenbuhl S, Hasler F, Frey BM, et al. Kinetics and dynamics of orally administered 18β-glycyrrhetinic acid in humans [J]. J Clin Endocrinol Metab, 1994, 78: 581-585. |
| [15] | MacKenzie MA, Hoefnagels WH, Jansen RW, et al. The influence of glycyrrhetinic acid on plasma cortisol and cortisone in healthy young volunteers [J]. J Clin Endocrinol Metab, 1990, 70: 1637-1643. |
| [16] | Al-Dujaili EA, Kenyon CJ, Nicol MR, et al. Liquorice and glycyrrhetinic acid increase DHEA and deoxycorticosterone levels in vivo and in vitro by inhibiting adrenal SULT2A1 activity [J]. Mol Cell Endocrinol, 2011, 336: 102-109. |
| [17] | Farese RV Jr, Biglieri EG, Shackleton CH, et al. Licorice-induced hypermineralocorticoidism [J]. N Engl J Med, 1991, 325: 1223-1227. |
 2015, Vol. 50
2015, Vol. 50


