杨梅 (Myrica ruba (Lour.) Sieb.et Zucc.) 系杨梅科杨梅属植物,常绿乔木,主产于江苏、浙江、台湾、江西、湖南、贵州、四川、广西和广东等省,日本、朝鲜和菲律宾也有分布[1]。树皮味苦、性温,具有散瘀止痛、止血的功效,在我国民间常用作收敛剂,治疗烧烫伤及皮肤病等,在日本传统医药中被用作解毒剂和止泻药物[2]。现代研究表明杨梅树皮提取物具有抗氧化[3]、心血管保护[4]、抗肿瘤[5, 6]、神经细胞保护[7]等多种活性。杨梅树皮主要含有黄酮[6,7,8]、二苯基庚烷[6, 7, 9]以及三萜类[6, 7]成分,为了进一步阐明杨梅树皮具有各种生物活性的物质基础,本文采用多种色谱技术从杨梅树皮甲醇提取物中得到14个化合物,并通过化合物的理化性质和NMR、MS等波 谱数据进行结构鉴定,其中二苯基庚烷类化合物4个、黄酮类化合物3个、三萜及甾醇类化合物7个,分别为: 3,5-二甲氧基-4-羟基杨梅醇 (1)、杨梅醇 (2)[6]、杨梅酮 (3)[6]、myricanol11-sulfate (4)[9]、杨梅苷 (5)[10]、槲皮素 (6)、槲皮苷 (7)[8]、柽柳醇 (8)[11]、熊果醇 (9)[12]、熊果酸 (10)[13]、蒲公英赛醇 (11)[14]、杨梅萜二醇 (12)[14]、β-谷甾醇 (13) 和β-胡萝卜苷 (14)。其中化合物1为新化合物,化合物8、9为首次从该属植物中分离得到。
结果与讨论化合物1白色无定形粉末,易溶于甲醇。10% 硫酸乙醇溶液显紫色,三氯化铁-铁氰化钾反应阳性,提示结构中存在酚羟基。HR-ESI-MS给出其准分子离子峰 [M+Na]+ 峰m/z: 381.166 7,确定其分子式为C21H26O5。红外光谱中νmax 3 350、2 934、1 614、1 587、1 505 cm-1处有强吸收,提示结构中可能存在一个羟基化的芳香环系统; 紫外光谱中在214 (logε 4.1)、259、297 nm有最大吸收,提示为联苯型二苯基庚烷类化合物[6]。1H NMR (600 MHz,CD3OD) (表 1) 显示分子中有两个甲氧基质子信号: δH 3.89 (3H,s)、3.85 (3H,s); 4个芳基质子信号δH 7.15 (1H,d,J = 1.8 Hz)、7.02 (1H,dd,J = 1.8,8.4 Hz)、6.83 (1H,s)、6.79 (1H,d,J = 8.4 Hz),其中苯环B上有一组ABX自旋系统质子信号: δH7.15 (1H,d, J = 1.8 Hz,H-18)、7.02 (1H,dd,J = 1.8,8.4 Hz,H-15)、6.79 (1H,d, J = 8.4 Hz,H-16),苯环A上有一组单芳香氢信号: δH6.83 (1H,s,H-19); 13C NMR(150 MHz,CD3OD) 谱显示结构中存在21个碳信号,包括两个甲氧基信号δC 61.9、61.7; 12个芳香碳信号δC152.9 (C-17)、150.5(C-4)、148.6 (C-5)、141.2 (C-3)、134.8 (C-18)、132.1 (C-14)、130.8,130.6 (C15,19)、126.8 (C-1)、124.6 (C-2)、124.2 (C-6)、117.5 (C-16) 和一个7碳脂肪链δC 69.4 (C-11)、40.7 (C-10)、35.8 (C-12)、28.2 (C-13)、27.2 (C-7)、26.8 (C-8)、24.3 (C-9),且其波谱数据与杨梅醇 (化合物2) 非常相似[6],根据HR-ESI-MS结果m/z 381.166 7 [M+Na]+ 推断其分子式为C21H26O5与杨梅醇 (化合物2) 相同,不同之处仅在于化合物1和2的结构在苯环A上的取代基顺序不同。比较化合物1与化合物2的13C NMR谱数据,δC (C-3、C-4、C-5) 向低场移动 (+δC 4.8)。HMBC谱显示 (图 1),δH 6.83(1H,s,H-19) 与δC 148.6 (C-5)、141.2(C-3) 存在相关,δH 2.53 (1H,m,H-7) 与δC 148.6 (C-5) 存在相关,δH 3.89(3H,s,5-OCH3) 与δC148.6 (C-5) 存在相关; δH3.85 (3H,s,3-OCH3) 与δC 141.2 (C-3) 存在相关,提示化合物1的C-4位为羟基取代,C-5为甲氧基取代。进一步分析HMBC谱发现,提示该结构的B环为ABX系统,且C-17位存在羟基取代。另根据化合物1的比旋光度[α]20 D = -89.2 (c2.65,CHCl3) 与杨梅醇 (化合物2) [α]20 D = -65.6 (3.0,CHCl3)[9]相似,可确定化合物1中C-11的绝对构型为R。综合以上信息,最终确定化合物1的结构为3,5-二甲氧基-4-羟基杨梅醇,该化合物为一新化合物。
|
|
Table 1 NMR spectral data ofcompound 1 in CD3OD (600 MHz for 1H and 150 MHz for 13C) |
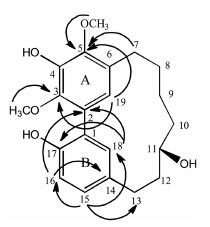
|
Figure 1 Structure and key HMBCcorrelations of compound 1 |
Bruker AM-600型核磁共振仪 (德国Bruker公司); LTQ-Obitrap XL质谱仪 (美国Thermo公司); 正相色谱用硅胶、薄层色谱硅胶板GF254(青岛海洋化工厂); SephadexLH-20凝胶 (美国GE公司); 中压液相色谱仪 (美国Waters公司); 分析纯试剂均购买自北京化工厂,色谱纯试剂均购买自Karl Fischer。
药材杨梅树皮于2012年9月购于宁波德康生物制品有限公司,经中国医学科学院药用植物研究所张本刚教授鉴定为杨梅科杨梅属植物杨梅 (Myrica ruba (Lour.) Sieb. et Zucc.) 的干燥树皮。
1 提取分离干燥的杨梅树皮6 kg经甲醇提取后,浓缩得到总浸膏400 g,得率为6.67%,将其与100~200目硅胶拌样,依次用二氯甲烷、乙酸乙酯、甲醇洗脱,收集洗脱液,60 ℃以下减压浓缩得到3个部分,对其中2个部分进行系统分离。二氯甲烷部分(47.7 g) 经正相硅胶色谱柱分离,石油醚-乙酸乙酯 (50∶1→0∶1) 梯度洗脱,以TLC硅胶G板检查,合并相同流分,得到6个组分 (Fr.1~6)。Fr.1 (6.7 g) 经正相硅胶色谱柱分离,石油醚-乙酸乙酯 (50∶1→10∶1) 不同比例洗脱,经石油醚-乙酸乙酯重结晶,得化合物11 (565 mg)、13 (20 mg)。Fr. 2 (5.2 g) 经正相硅胶色谱柱分离,石油醚-乙酸乙酯 (50∶1→0∶1)洗脱,再经多次硅胶柱分离,得到化合物8 (11 mg)、9 (24 mg)、12 (823 mg)、10 (32 mg)。Fr. 4 (30.6 g) 经正相硅胶色谱柱分离,石油醚-乙酸乙酯 (15∶1→0∶1)洗脱,再经多次硅胶柱分离,Sephadex LH-20凝胶、制备色谱分离纯化得到化合物1 (24 mg)、2 (543 mg)、3 (375 mg)。Fr.6 (3.0 g) 经正相硅胶色谱柱分离,石油醚-乙酸乙酯 (10∶1→2∶1)不同比例洗脱,得到化合物4 (234 mg)、14 (20 mg)。乙酸乙酯部分 (128.8 g) 经正相硅胶色谱柱分离,乙酸乙酯-甲醇 (50∶1→ 2∶1)(含1% 乙酸) 梯度洗脱以TLC硅胶G板检查,合并相同流分,得到4个组分 (Fr. 7~10)。Fr.7 (3.2 g) 经正相硅胶色谱柱分离,不同比例二氯甲烷-甲醇 (20∶1→0∶1)洗脱,再经Sephadex LH-20凝胶、制备色谱分离纯化得到化合物7 (68 mg)。Fr.8 (46.4 g) 经聚酰胺柱色谱,不同比例水-甲醇 (10∶1→0∶1)梯度洗脱,再经Sephadex LH-20凝胶、制备色谱分离纯化得到化合物5 (36.8 g)、6 (3.2 g)。
2 结构鉴定化合物1 白色无定形粉末 (甲醇),[α]20 D = -89.2(c 2.65,CHCl3); UV (MeOH) λmaxnm (logε)214 (4.1); IR (KBr) νmax 3 350、2 934、1 614、1 587、1 505、1 495、1 456、1 408、1 231 cm-1。HR-ESI-MS m/z 381.166 7 [M+Na]+,确定化合物1的分子式为C21H26O5。1H NMR (600 MHz,CD3OD) 和13C NMR (150 MHz,CD3OD) 数据见表 1。
| [1] | Editorial Board of Flora Reipublicae Poplularis Sinicae, Chinese Academy of Sciences. Flora Reipublicae Popularis Sinicae: Vol 21 (中国植物志: 第21卷) [M]. Beijing: Science Press, 1979: 004. |
| [2] | Nanjing University of Chinese Medicine. The Dictionary of Traditional Chinese Medicine (中药大辞典: 上册) [M]. Shanghai: Shanghai Science and Technology Press, 2000: 1042. |
| [3] | Wang ZH, Ah Kang K, Zhang R, et al. Myricetin suppresses oxidative stress-induced cell damage via both direct and indirect antioxidant action [J]. Environ Toxicol Pharmacol, 2010, 29: 12-18. |
| [4] | Sun GB, Qin M, Luo Y, et al. Protect effects and the underlying mechanisms of myricitrin against vascular endothelial cells apoptosis induced by oxidative stress [J]. Acta Pharm Sin (药学学报), 2013, 48: 615-620. |
| [5] | Akazawa H, Fujita Y, Banno N, et al. Three new cyclic diarylheptanoids and other phenolic compounds from the bark of Myrica rubra and their melanogenesis inhibitory and radical scavenging activities [J]. J Oleo Sci, 2010, 59: 213-221. |
| [6] | Matsuda H, Morikawa T, Tao J, et al. Bioactive constituents of Chinese natural medicines. VII. Inhibitors of degranulation in RBL-2H3 cells and absolute stereostructures of three new diarylheptanoid glycosides from the bark of Myrica rubra [J]. Chem Pharm Bull, 2002, 50: 208-215. |
| [7] | Shimmyo Y, Kihara T, Akaike A, et al. Three distinct neuroprotective functions of myricetin against glutamate-induced neuronal cell death: involvement of direct inhibition of caspase-3 [J]. J Neurosci Res, 2008, 86: 1836-1845. |
| [8] | Wang DY, Liu EG, Feng YJ. Study on the flavonoid constituents from the bark of Myrica ruba [J]. Lishizhen Med Mater Med Res (时珍国医国药), 2008, 19: 1149-1150. |
| [9] | Yoshimura M, Yamakami S, Amakura Y, et al. Diarylheptanoid sulfates and related compounds from Myrica rubra bark [J]. J Nat Prod, 2012, 75: 1798-1802. |
| [10] | Fu Y, Li Z, Si J, et al. Separation and purification of myricitrin from bayberry tree bark by high-speed counter-current chromatography [J]. J Liq Chromatogr Relat Technol, 2013, 36: 1503-1512. |
| [11] | Jiang QY, Zuo CX. Study of chemical constituents from Tamarix chinensis Lour. [J]. Acta Pharm Sin (药学学报), 1988, 23: 749-755. |
| [12] | Luo L, Li ZQ, Zhang LL, et al. The chemical constituents from Pittosporum kerrii Craib (Ⅰ) [J]. J Yunnan Univ (Nat Sci) (云南大学学报: 自然科学版), 2013, 35: 83-86. |
| [13] | Zhang QJ, Yang XS, Zhu HY, et al. Chemical constituents of Glechoma longituba [J]. Nat Prod Res Dev (天然产物研究与开发), 2006, 18: 55-57. |
| [14] | Nobuko S, Yoshikatsu Y, Takao I. Triterpenoids from Myrica rubra [J]. Phytochemistry, 1987, 26: 217-219. |
 2015, Vol. 50
2015, Vol. 50


