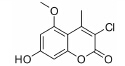
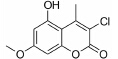
随着人口老龄化、环境污染和精神压力等问题的不断恶化,脑卒中、阿尔茨海默病 (AD)、帕金森病 (PD)、抑郁症和精神分裂症等脑重大疾病发病率不断攀升,成为严重危害人类健康的重大问题,受到高度重视。目前临床应用对抗这类疾病的药物种类繁多,但由于存在疗效不够好或严重不良反应等问题而限制了应用。因此开发有效治疗脑部重大疾病的药物意义重大。
基于神经保护作用的研究,是抗脑部重大疾病的药物研发主要策略之一。香豆素是广泛存在于自然界中的一种内酯类化合物,已有研究发现,许多香豆素衍生物具有神经保护作用[1, 2, 3],如七叶亭[4]、瑞 香素[5]、蛇床子素[6]等。因此,对于香豆素类衍生物的神经保护作用的筛选可能对于研究或治疗脑部重大疾病具有重要意义。本文选择一系列香豆素衍生 物,对其进行了体外神经保护活性评价及作用机制初步研究。
材料与方法 药品与试剂化合物1~10由中国医学科学院药物研究所合成。脂多糖 (LPS)、四甲基偶氮唑蓝 (MTT)、鱼藤酮、连二亚硫酸钠(Na2S2O4)、多聚赖氨酸 (PLL) 购自Sigma公司; Aβ25-35购自上海研生生化试剂有限公司。DMEM培养基、DMEM低糖培养基、胎牛血清、马血清购自Gibco公司。小鼠TNF-α和IL-1β ELISA检测试剂盒购自欣博盛生物科技有限公司。羟自由基及超氧阴离子自由基试剂盒购自南京建成生物工程研究所。其他试剂均为国产分析纯。
仪器设备SpectraMax全自动酶标仪,2K15型台式低温离心机,Thermo Forma 3110型二氧化碳培养箱,Nikon ECLIPSE Ti-U倒置显微镜。
细胞及培养大鼠肾上腺嗜铬瘤细胞 (PC12细胞,模拟神经元),由本室留存。培养条件: 含灭活5% 胎牛血清、5% 马血清,100 u·mL-1青霉素,100 μg·mL-1链霉素的DMEM完全培养基中,37 ℃,5% CO2、饱 和湿度、无菌条件下培养。取对数生长期细胞,以每毫升5×104个细胞,每孔100 μL接种于预先用PLL (0.1 mg·mL-1)处理过的96孔培养板中,培养24 h备用。小鼠小胶质瘤细胞 (BV2细胞,模拟脑小胶质细胞) 购自北京协和医学院细胞中心。培养条件: 含灭活10% 胎牛血清,其他同上。取对数生长期细胞,以2×104/mL密度,每孔100 μL接种于预先用PLL处理过的96孔培养板中,培养24 h备用。
MTT法检测细胞活力实验分为空白组、模型组和加药组。空白组给予完全培养基; 鱼藤酮造模组是加入终浓度为4 μmol·L-1鱼藤酮的完全培养基作用细胞48 h (模拟PD模型); 氧糖剥夺 (oxygen-glucose deprivation,OGD) 组是采用低糖完全培养基及加入终浓度为5 mmol·L-1连二亚硫酸钠作用细胞24 h (模拟脑缺血模型); Aβ25-35造模组是加入终浓度为20 μmol·L-1Aβ25-35的完全培养基作用细胞24 h (模拟AD模型); LPS造模组是加入终浓度为100 ng·mL-1LPS作用24 h; 给药组是在造模的同时加入受试化合物。细胞增殖实验是除空白组外,加药组加入受试化合物的完全培养基作用24h,然后加入5 mg·mL-1 MTT 10 μL,4 h后去上清液,加入DMSO100 μL,10 min后,于550 nm吸光度值评价细胞活力。各组取平均值后按下式计算细胞相对存活率。细胞相对存活率 (%) = (OD实验/OD对照)×100 (以不含细胞的培养液为空白调零)。
细胞形态学观察细胞培养及处理方式同上。采用倒置相差显微镜观察各组细胞的形态,照相记录。
炎症因子检测各组BV2细胞经LPS或/和化合物3作用24h后,取培养基,离心取上清液,采用酶联免疫吸附法 (ELISA),按照试剂盒说明书方法检测细胞培养基中炎症因子TNF-α和IL-1β的含量。
超氧阴离子自由基清除能力的测定此反应模拟机体中黄嘌呤与黄嘌呤氧化酶反应系统,产生超氧阴离子自由基O2-,后者可还原氮蓝四唑 (NBT),使之转化为有色物质,使反应体系呈现紫红色。抗超氧阴离子的物质可抑制该反应使O2- 减少,故比色时颜色变浅,530 nm处吸收度降低。依据吸收度计算出抑制O2- 的能力强弱。计算公式: 超氧阴离子自由基抑制率 (%) = (OD对照 - OD测定)/OD对照×100。
羟自由基清除能力测定Fenton反应是最常见的产生羟自由基的化学反应,H2O2的量和Fenton反应产生的OH- 量成正比,当给予电子受体后,用Griess试剂显色,形成红色物质,该物质在550 nm处有最大吸收,其呈色与OH- 的多少呈正比关系。计算公式同超氧阴离子自由基抑制率的计算。
统计学分析数据以Mean ± SD表示,各组间的差异比较采用SPSS软件的One-Way ANOVA分析方法,以P < 0.05认为存在显著性差异。
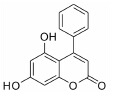
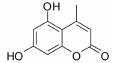
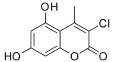
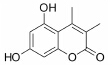
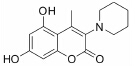
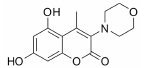
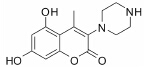
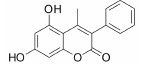
结果 1 10种香豆素衍生物对PC12细胞损伤的影响通过OGD、Aβ25-35和鱼藤酮造成的PC12细胞损伤模型,对所合成的10个香豆素衍生物进行了神经保护作用的体外筛选。从表 1可知,香豆素4位甲基取代较苯基取代活性增强; 香豆素3位被氯取代后显示出明显的神经保护活性; 而香豆素3位被烷基、芳基、杂环取代后活性有所降低; 香豆素5位或7位羟基被甲基化后神经保护活性消失。化合物3对正常PC12细胞的存活无影响,而在OGD、Aβ25-35和鱼藤酮3种毒性模型中均体现出较好的神经保护作用。因此,对化合物3进行进一步研究。
2 化合物3抑制神经毒性剂所致PC12细胞损伤由图 1形态学观察可见,空白组PC12细胞胞体多呈现梭形、三角形或类圆形,胞体饱满,折光度好,胞浆均匀、透亮、大多数伸出微小的突起,直径15~20 μm,倾向于小团簇状生长。缺糖缺氧造模后,细胞胞体缩小,部分呈圆形,透光性降低; 给予20 μmol·L-1 Aβ25-35造模后,细胞胞体萎缩、呈颗粒状,透光度差,胞浆外泌,突触较长; 给予4 μmol·L-1鱼藤酮造模后,细胞多呈圆形,胞体萎缩、呈颗粒状,胞浆外泌,突触消失。造模同时给予10 μmol·L-1化合物3对这3种毒性损伤所致PC12细胞形态变化均可显著缓解。与表 1中MTT结果相辅相成。即化合物3能显著改善多种神经毒性剂所导致的神经细胞损伤。
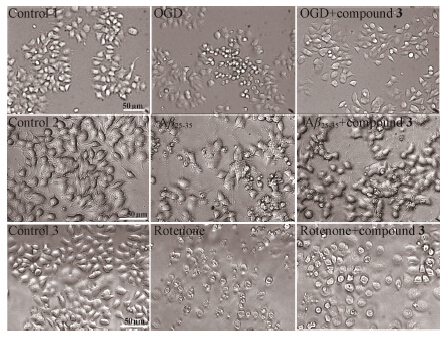
|
Figure 1The effect ofcompound 3 in oxygen-glucose deprivation (OGD),Aβ25-35 and rotenone-induced injury onPC12. Phase-contrast micrographs of PC12 cells exposed to OGD (lowsugar and 5 mmol·L-1 Na2S2O4 culture medium),Aβ25-35 (20 μmol·L-1) or rotenone (4 μmol·L-1) with or without compound 3administration |
|
|
Table 1 Neuroprotection effect ofcoumarin derivatives at a single dose (10 μmol·L-1) on damaged ratpheochromocytoma PC12 cells. Cell viability was measured by the MTTassay. aCell proliferation was performed in a full-culturemedium and 10 mmol·L-1 tested compounds.bCells were treated with low-glucose medium and 5 mmol·L-1sodium dithionite for 24 h. cCells were treated with20 μmol·L-1 Aβ25-35 for 24 h. dCellswere treated with 4 μmol·L-1 rotenone for 48 h. eAfull-culture medium was used for the control group. n = 6,x± s. P < 0.05,**P < 0.01 vs model group; ###P < 0.001 vs control group |
由图 2可见,空白组BV2细胞胞体多呈现圆形或椭圆形,分布较分散,给予100 ng·mL-1 LPS作用24 h,细胞胞体变大,分支增多并延长,呈阿米巴状小胶质细胞激活状态。给予1 μmol·L-1和10 μmol·L-1化合物3可剂量依赖性改善这种变化,改善小胶质细
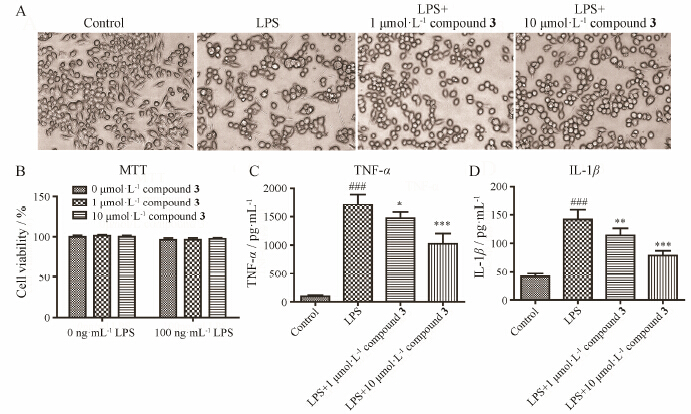
|
Figure 2The effect of compound 3 in LPS-induced BV2 microglia activation. A: Phase-contrast micrographsof BV2 cells exposed to 100 ng·mL-1 LPS with or without compound 3 administration. B: Cellviability was measured by MTT assay. C,D: The releaseof TNF-α and IL-1β of inflammatory factor in medium. n = 4,x± s. P < 0.05,**P < 0.01,***P < 0.001 vs LPS group; ###P < 0.001 vs controlgroup |
胞激活状态。MTT法测细胞存活率结果显示,给予100 ng·mL-1LPS或同时给予1或10 μmol·L-1化合物3对BV2细胞存活率无显著影响。另外,ELISA法测培养基中炎症因子发现,100 ng·mL-1 LPS作用24 h,炎症因子TNF-α升高了17.9倍,IL-1β升高了3.5倍,给予化合物3可剂量依赖性抑制BV2细胞释放炎症因子。其中10 μmol·L-1剂量化合物3可将TNF-α及IL-1β分别降低为空白组的10.7倍和1.9倍。即化合物3对正常及激活状态下的BV2细胞存活率均无显著影响,但能够抑制LPS所致BV2细胞激活,改善炎症状态,抑制BV2细胞释放炎症因子TNF-α及IL-1β。
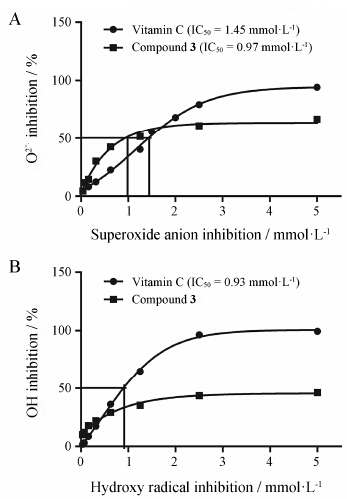
4 化合物3对自由基的清除能力由于化合物3对多种神经毒性剂所造成的细胞损伤均显示出明显的保护作用,因此本文对其可能的作用机制进行了简单研究。结果显示,化合物3能够直接清除超氧阴离子自由基 (图 3A) 和羟自由基
|
Figure 3 Antioxidativeactivity of compound 3. A: Scavenging on superoxide anion; B: Scavenging onhydroxy radical |
(图 3B),而且其对超氧阴离子的清除能力与维生素C基本一致 (化合物3 IC50 = 0.97 mmol·L-1;维生素C IC50 = 1.45mmol·L-1)。结果表明化合物3具有较强的自由基清除能力。
讨论神经保护剂能减少神经细胞在病理状况下的应激反应,降低炎症损伤,抑制神经细胞凋亡,促进神经细胞再生和修复,从而挽救神经细胞,保护大脑结构和功能,治疗和改善脑重大疾病[7, 8, 9, 10]。已有研究[2, 3, 4, 5]发现,多种香豆素类衍生物具有显著的神经保护作用。本文研究的10种新型香豆素衍生物中,香豆素4位甲基取代较苯基取代活性增强,香豆素3位被氯取代后显示出明显的神经保护活性; 而香豆素3位被烷基、芳基、杂环取代后活性有所降低; 香豆素5位或7位羟基被甲基化后神经保护活性消失。即香豆素4位甲基取代、3位氯取代、5位和7位羟基取代的化合物3具有最好的生物活性。它对OGD、Aβ25-35及鱼藤酮所致PC12细胞损伤及LPS所致BV2小胶质细胞激活均有显著的改善作用。
谷氨酸拮抗剂、抗炎因子、自由基清除剂、NMDA受体拮抗剂、GABA受体拮抗剂、胆碱酯酶抑制剂等均是目前主要研究的神经保护剂[2, 8, 11, 12, 13, 14, 15]。本研究发现,化合物3具有清除超氧阴离子和羟自由基的能力,是一种良好的自由基清除剂,清除超氧阴离子的IC50与维生素C相当。这可能是其神经保护作用的重要机制之一。
新型香豆素类化合物3具有显著的体外神经保护活性,其神经保护机制与其自由基清除活性密切相关。另外,化合物3是由我国科学家合成发现的结构全新小分子化合物。作为治疗脑部重大疾病的先导物,对于其研究有利于开发我国自主知识产权的药物,值得进一步研究。
| [1] | Kang SY, Kim YC. Neuroprotective coumarins from the root of Angelica gigas: structure-activity relationships [J]. Arch Pharm Res, 2007, 30: 1368-1373. |
| [2] | Sun M, Hu J, Song X, et al. Coumarin derivatives protect against ischemic brain injury in rats [J]. Eur J Med Chem, 2013, 67: 39-53. |
| [3] | Venugopala KN, Rashmi V, Odhav B. Review on natural coumarin lead compounds for their pharmacological activity [J]. Biomed Res Int, 2013, 2013: 963248. |
| [4] | Wang C, Pei AJ, Chen J, et al. A natural coumarin derivative esculetin offers neuroprotection on cerebral ischemia/reperfusion injury in mice [J]. J Neurochem, 2012, 121: 1007-1013. |
| [5] | Yang L, Yang Q, Zhang K, et al. Neuroprotective effects of daphnetin against NMDA receptor-mediated excitotoxicity [J]. Molecules, 2014, 19: 14542-14555. |
| [6] | Chao XD, Zhou J, Chen T, et al. Neuroprotective effect of osthole against acute ischemic stroke on middle cerebral ischemia occlusion in rats [J]. Brain Res, 2010, 1363: 206-211. |
| [7] | Youdim MB, Kupershmidt L, Amit T, et al. Promises of novel multi-target neuroprotective and neurorestorative drugs for Parkinson's disease [J]. Parkinsonism Relat Disord, 2014, 20 Suppl 1: S132-136. |
| [8] | Ling LL, Wang D. Research progress of clinical transformation status on neuroprotective agents [J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2013, 29: 869-871. |
| [9] | Schmidt A, Minnerup J, Kleinschnitz C. Emerging neuroprotective drugs for the treatment of acute ischaemic stroke [J]. Expert Opin Emerg Drugs, 2013, 18: 109-120. |
| [10] | Hurley LL, Tizabi Y. Neuroinflammation, neurodegeneration, and depression [J]. Neurotox Res, 2013, 23: 131-144. |
| [11] | Blasco H, Mavel S, Corcia P, et al. The glutamate hypothesis in ALS: pathophysiology and drug development [J]. Curr Med Chem, 2014, 21: 3551-3575. |
| [12] | Shichita T, Ago T, Kamouchi M, et al. Novel therapeutic strategies targeting innate immune responses and early inflammation after stroke [J]. J Neurochem, 2012, 123 Suppl 2: 29-38. |
| [13] | Pochwat B, Palucha-Poniewiera A, Szewczyk B, et al. NMDA antagonists under investigation for the treatment of major depressive disorder [J]. Expert Opin Investig Drugs, 2014, 23: 1181-1192. |
| [14] | Oberman LM. mGluR antagonists and GABA agonists as novel pharmacological agents for the treatment of autism spectrum disorders [J]. Expert Opin Investig Drugs, 2012, 21: 1819-1825. |
| [15] | Franchi C, Lucca U, Tettamanti M, et al. Cholinesterase inhibitor use in Alzheimer's disease: the EPIFARM-Elderly Project [J]. Pharmacoepidemiol Drug Saf, 2011, 20: 497-505. |
 2015, Vol. 50
2015, Vol. 50