2. 中国药科大学 中药学院, 江苏 南京 210009
2. Department of Chinese Medicine, China Pharmaceutical University, Nanjing 210009, China
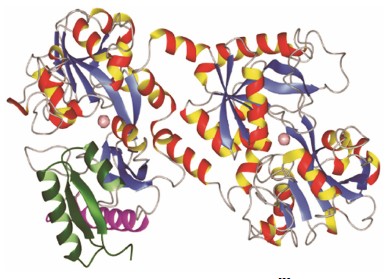
乳铁蛋白 (lactoferrin, Lf) 又称为乳铁传递蛋白(lactotransferrin), 是一条单链的铁结合糖蛋白[1], 其分子质量为80kDa, 由约690个氨基酸残基构成, 属于转铁蛋白 (transferrin, Tf) 家族的成员。Sorensen等于1939年首次从牛奶中分离得到一种红色的蛋白质, 后来研究发现该蛋白质能结合两个三价铁离子, 从而表现出红色的外观, 于是在1961年将其正式命名为乳铁蛋白[2] (图 1)。Lf主要存在于哺乳动物乳汁中, 在泪液、胆汁等组织分泌液中也有分布, 现多从牛乳中提取获得, 来源广泛。
|
Figure 1 3D Structure of human lactoferrin[2] |
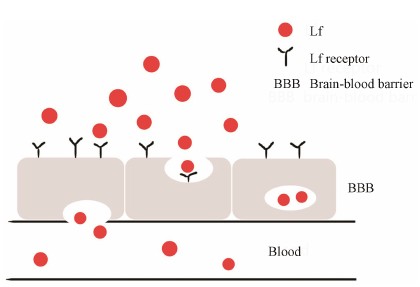
Lf等电点约为8.7, 属于碱性蛋白质。分子结构为非球形单链, N端和C端折叠成两个叶片状区域, 分别为N-环和C-环, 两环之间通过α-螺旋连接, 其分子内具有两个铁结合位点, 能可逆地结合环境中的铁离子, 铁的结合和释放伴随着结构域的变化, 并受两环之间的协同作用影响[3]。研究表明, Lf具有广泛的生理功能[2]: 作为铁结合蛋白, Lf不仅能参与铁吸收代谢, 还能通过夺取环境中的铁离子或直接通过N端与细菌作用抑制细菌生长, 具有广谱抗菌、消炎和抗病毒作用; Lf能够对抗辐射并具有抗过敏的 功效; 同时它还能抑制多种肿瘤细胞, 具有抗癌作用; Lf还能促进骨骼成长, 帮助伤口愈合以及提高造血功能; 此外, Lf能活化先天和适应性免疫应答, 因此, Lf被认为是一种极具开发潜力的食品、化妆品添加剂, 目前在一些食品如配方奶粉中添加, 美国FDA 2001年已允许乳铁蛋白作为食品添加剂使用[4]。随着对乳铁蛋白研究的深入, 发现Lf是一个极具潜力的靶向配体, 其受体在各组织中的分布有迹可循, 在某些癌变组织中有过度表达现象。Lf能与包括低密度脂蛋白相关受体在内的多重受体结合[5], 且由于Lf结构与Tf高度相似, 在较高浓度下可通过Tf受体介导入胞[6]。Kanwar等[7]充分研究了Lf纳米粒的入胞机制, 提出Lf可通过Tf受体及Lf受体 (主要是低密度脂蛋白受体) 入胞 (图 2), 这些受体在癌变组织中往往存在过度表达现象, 利于靶点的设计。此外, 血浆中内源性Lf的浓度极低, 避免了内源性Lf与Lf修饰的载药系统之间对受体的竞争性抑制作用[8], 比Tf具有更高的靶向效率。

|
Figure 2 Mechanism involved ininternalization of lactoferrin nanocarrier. TfR: Transferrinreceptor; LfR: Lactoferrin receptor; NC: Lactoferrin nanocarrier |
因此, 有关利用Lf的靶向配体将其修饰于载体表面实现靶向给药或将Lf直接制备成纳米载体而给药的研究越来越多, 下面将通过Lf具体的靶向部位简述其作为药物载体的进展。
1 Lf修饰的脑靶向递药系统血脑屏障 (blood-brain barrier, BBB) 能保护大脑内环境的相对稳定, 阻止血液循环中有害物质对脑组织的侵害, 对中枢神经系统生理功能和状态的维持意义重大。然而, 对于如阿尔茨海默病 (AD)、帕金森病 (PD) 之类的中枢神经系统疾病而言, 血脑屏障却成了药物治疗的主要障碍。血脑屏障对药物的阻碍作用主要有3方面[8]: ① 构成血脑屏障的毛细血管内皮细胞之间连接紧密, 成为一道机械屏障以防止极性分子通过。② 毛细血管内皮细胞表达以ATP结合盒转运蛋白为主的外排转运子, 将包括药物分子在内的外来物质外排, 构成一道转运屏障。③ 包括碱性磷酸酶、γ-谷氨酰转肽酶在内的多种酶类引起血液中的神经活性物质代谢, 防止许多物质转运入脑, 构成了一道代谢屏障。正是由于这些生理屏障的存在, 常规的给药方式难以将药物送达颅内, 要达到有效的治疗浓度则必须加大药物剂量, 但这无疑放大了药物毒性, 甚至有可能对其他器官造成损害。
Lf作为载体为药物跨越血脑屏障提供了一条新途径。研究表明, BBB的内吞机制有如下几种[9]: ① 受体介导的胞吞作用, 即经配体修饰的系统能与该配体的同源受体结合, 从而引起细胞跨膜递送。② 吸附性内吞作用, 即药物递送系统通过非特异性机制, 如静电相互作用结合在细胞表面引起细胞内吞。③ 巨胞饮。其中,第1种被证明是最有效可行的方法。BBB的表面存在大量Lf受体, 能够介导Lf经胞吞作用转运进入脑组织到达靶点[10] (图 3)。因此, Lf作为药物载体在脑部靶向递药方面拥有巨大潜力, 同时, 这也是目前Lf作为药物载体研究最为广泛深入的一个领域。目前, 国内外研究的Lf修饰的脑靶向载药系统有纳米粒、脂质体、自组装胶束及高分子囊泡等,研究主要涉及大脑肿瘤及中枢神经系统相关疾病。
|
Figure 3 Lf-LfR mediatedtranscytosis |
帕金森病 (Parkinson’s disease, PD) 是一种神经退行性疾病, 患病率随年龄增长而上升, 在全球65岁以上的人群中发病率约为1.5%[11]。有研究报道, 大鼠脑内6-羟多巴胺 (6-OHDA) 能诱导PD的形成, 而颅内注射尿皮激素 (urocortin, UCN) 能抑制6-OHDA形成, 但UCN本身不能穿越BBB进入脑内发挥作用。Hu等[12]将Lf与PEG-PLGA结合制成纳米粒 (Lf-NP), 与未经Lf修饰的纳米粒 (NP) 相比, 前者在大脑皮层、大脑黑质及纹状体浓度更高。用Lf-NP作为载体能顺利地将UCN递送进入脑组织, 并能明显减弱由6-OHDA引起的纹状体病变。
海洋甾体YC1 (24-亚甲基-胆甾-3β, 5α, 6β, 19-四醇)是一种南沙群岛唇软珊瑚中提取的氧代固醇类化合物, 具有神经元保护作用[13], 但其水溶性低, 难以进入大脑。Zheng等[14]根据“相似相溶”原理, 将具有与YC1相同甾体母核结构的胆固醇与海藻酸钠反应, 制备两亲性海藻酸钠−胆固醇衍生物 (SACDs), 经Lf修饰SACDs制得Lf-SACDs, 将YC1和载体分散于四氢呋喃中, 搅拌下逐滴加入蒸馏水至四氢呋喃完全挥发, 通过微相分离制得载有YC1的自组装纳米胶束, 此胶束大大提高了YC1的载药量, 具有缓释性、药物保护性及脑靶向作用, Lf对胶束的修饰提高了YC1在脑内的浓度, 是一种良好的高载药量的脑靶向递药系统。
1.2 阿尔茨海默病靶向治疗阿尔茨海默病 (Alzheimer’s disease, AD)是另一种重要的神经退行性疾病, 截至2010年, 全球范围内患病人数超过3 500万, 到2012年, 仅美国的AD患者已达到540万[15], 开发安全有效的药物递送系统是AD治疗的研究重点之一。
赵子明等[16]用Lf修饰两亲性的季铵盐−十四烷酸−壳聚糖 (QMC) 制成阳离子壳聚糖纳米粒 (Lf-QMC), 并将经油酸改性的四氧化三铁(OA-Fe3O4) 通过溶剂挥发法荷载至此纳米载体中, 使之带有磁性,在外加磁场和Lf的双重靶向作用下, 纳米粒在脑内分布显著增加, 且对海马神经细胞活性无显著影响, 有望作为治疗AD的新载体。
Liu等[17]利用鼻内给药无首过效应、吸收迅速及可绕过血脑屏障到达中枢神经系统等优点[18], 用Lf修饰PEG-PCL纳米粒。此纳米粒在小鼠大脑嗅束、嗅球、海马体等区域分布均提高1~2倍; 用此纳米粒作为载体, 以8个氨基酸长度的神经保护性短肽NAP[19]作为模型药物在小鼠体内进行实验, 结果表明药物的神经保护作用及记忆力提升作用得到了提高。
β-淀粉样蛋白 (β-amyloidpeptide, Aβ) 是39~43个氨基酸组成的多肽, 由脑神经细胞中淀粉样前体蛋白裂解产生, 是诱导AD发生的重要因素[20]。神经生长因子 (neuron growth factor, NGF)可以消除Aβ, 此外, 还具有保护基底前脑胆碱能神经元抵抗变性以及提高神经元活性等作用[21], 但却难以透过BBB。Kuo等[22]用Lf修饰的脂质体递送NGF通过人脑微血管内皮细胞 (human brain-microvascular endothelial cells, HBMECs), 观察其对Aβ沉积的神经元样SK- N-MC细胞的作用。结果表明, Lf/NGF脂质体有效地抑制了Aβ的神经毒性, 经其处理后的细胞能耐受更高的Aβ浓度, 为AD的治疗提供了一种潜在的药物途径。
Yu等[23]用丙酮作为溶剂, 通过自组装的方法将PEG-PLGA制得可生物降解的聚合物囊泡 (POS), 用Lf修饰制得Lf-POS使其具有脑靶向性。Humanin是一种24个氨基酸长度的神经保护肽, 能抑制Aβ沉积和FAD基因突变引起的神经毒性, 防止神经细胞凋亡[24]。用Lf-POS作为载体递送Humanin成功跨越BBB, 对Aβ沉积的大鼠海马神经元细胞起到明显的防护作用, 且提高了胆碱酯酶的活性。结果表明, Lf修饰的聚合物囊泡作为一种新型药物载体, 能有效介导大脑主动靶向, 为AD的治疗提供了又一条可行途径。
1.3 脑胶质瘤靶向治疗脑胶质瘤为颅内恶性肿瘤, 在成人中, 胶质瘤占脑肿瘤发病率的29%, 儿童也有患病风险[25]。手术切除、放疗及化疗等常规治疗手段具有易复发、毒性大等突出缺点,因此靶向药物治疗的研究意义重大[26]。
Su等[27]用Lf和mPEG2000修饰牛血清白蛋白纳米粒 (BSA-NPs) 作为载体装载阿霉素 (doxorubicin, DOX), 结果表明此纳米粒在大鼠体内的长循环作用时间更长, 提高了大脑毛细血管内皮细胞 (BCECs) 及胶质瘤细胞 (C6) 对DOX的摄取量,并提高了靶向性。此外, DOX对C6的细胞毒性随着Lf修饰量的增加而增大。多形性胶质母细胞瘤 (GBM) 是脑胶质瘤的一种, 是最常见且最具侵略性的原发性脑肿瘤[28]。Kuo等[29]利用肿瘤细胞表面叶酸受体过度表达的特点[30], 设计了Lf和叶酸 (FA) 修饰的PLGA纳米粒 (Lf/FA/PLGA NPs), 与未经修饰的纳米粒相比, 此纳米粒穿透BBB的能力提高了两倍, 且具有极高的靶向性, 能降低治疗GBM的给药剂量, 减少药物毒性。
前体阳离子脂质体 (procationic liposomes,PCL) 是利用CHETA (C36H61N3O4S2)作为脂质体骨架材料代替传统的胆固醇制成的脂质体, 在生理pH条件下呈中性或负电性, 当其到达细胞表面时, 细胞膜上存在的酶将CHETA中的二硫键还原而引起断裂, 导致脂质体所带电荷反转, 成为阳离子脂质体, 能通过吸附介导进行脑部转运[31]。Chen等[32]用Lf修饰PCL, 提高了其在脑毛细血管内皮细胞 (brain capillaryendothelial cells, BCECs) 内的吸收分布, 穿越BBB的能力以及脑内药物积累量均得到提高, 此外还降低了细胞毒性, Lf修饰的PCL达到了吸附介导和受体介导的双重脑靶向效果。利用Lf修饰PCL作为脑靶向递药系统递送DOX能提高BCECs和C6对DOX的吸收率、抑制C6生长、提高DOX药效, 且经大鼠生存分析研究表明能显著延长生存时间, 为脑胶质瘤的化学疗法提供了一个有效的途径[33]。
肖衍宇等[34]利用带正电荷的Lf通过静电吸附作用修饰负电荷的纳米脂质载体构建脑靶向递药系统, 避免了靶向载体设计中的化学合成过程, 工艺简单, 且降低了药物毒性, 具有较好的发展前景, 小鼠活体成像实验表明载体具有良好的脑靶向性, 有利于脑胶质瘤的治疗。
研究者们对于Lf修饰的脑靶向递药系统的设计、机制及作用具有一定的认识, 并通过Lf修饰药物载体优化药物利用度。Ye等[35]以难溶性的IR-775氯作为模型药物, 载入Lf与β-环糊精 (β-CD)通过NHS-PEG-MAL结合制成的Lf-CD纳米粒, 在提高药物溶解度的同时使得模型药物血脑屏障的转运率得到了极大的提高, AUC0−2 h值比未用Lf-CD作为载体的模型药物提高了7倍, 为难溶性药物的脑内递送提出了一条解决方案。将脂质体表面用聚乙二醇 (PEG) 修饰而形成亲水保护层, 增大空间位阻, 从而阻止脂质体被清除, 大大延长其血循环时间, 提高所载药物疗效[36]。然而, PEG化脂质体透过BBB的能力却并不理想。Huang等[37]用Lf作为配体修饰PEG化脂质体, 用锝 (99mTc) 标记的N, N-双 (2-巯乙基)-N ', N '-二乙基乙二胺(99mTc-BMEDA) 分别从体外和体内两方面评价Lf修饰PEG化脂质体的效果。结果表明, 经Lf修饰后, PEG化脂质体的大脑摄取率在体外提高了3倍、体内提高了2倍。
大部分实验者通过体外实验和动物体内实验得出了Lf修饰的递药系统对药物跨越BBB进入CNS的能力具有不同程度提升的结果, 部分实验者对其设计的递药系统的药效进行了评估。虽然Lf修饰的脑靶向递药系统在治疗AD、PD、脑胶质瘤等疾病上具有很大的潜力, 但要将其应用于临床还需进一步研究。
2 Lf修饰的肝肿瘤靶向递药系统肝细胞癌 (hepatocellular carcinoma, HCC)是全球范围内第三大导致人类死亡的癌症。在亚洲和非洲, 近80% HCC患者是因为感染了乙型肝炎病毒 (HBV), 而在南美洲则多是由丙型肝炎病毒 (HCV) 引发[38]。研究表明, 在癌化肝组织表面有一些过度表达的受体, 针对这些受体对纳米粒进行功能化改性, 能起到优先定位的效果, 增加药物的疗效[39]。越来越多的研究表明, 引起HCC的因素之一是肝细胞摄入了过量的铁, 而铁在血浆中与转铁蛋白结合, 因此细胞对铁的摄取量取决于转铁蛋白受体 (transferrinreceptors, TfR) 的数量[40], 在肝癌细胞中TfR存在过度表达现象。因此, 可用Lf作为配体修饰递药系统, 通过过度表达的TfR将药物送入癌细胞实现肝靶向。
Golla等[41]用DOX和Lf制成纳米粒 (lactodoxonano), 通过静脉给药注入大鼠体内, 结果表明, 用纳米制剂处理的大鼠肝结节明显减少, DOX在肝内的积累量得到明显提升, 靶向性增强。通过纳米制剂递送DOX使其血浆清除率降低, 即增加了DOX的生物利用度。通过安全性分析, DOX在心脏的积累量降低, 从而具有较低的心血管毒性。
Wei 等[42]通过碳二亚胺偶联反应将Lf通过酰胺键结合到PEG化脂质体表面, 制得长循环靶向脂质体 (Lf-PLS), Lf-PLS对肝癌细胞具有显著的亲合力和特异性, 对靶向部位正常细胞的毒性低, 能提高药物在肝脏肿瘤部位的积累量, 是一种可用于肝癌化疗的主动靶向给药系统。
3 Lf修饰的肺肿瘤靶向递药系统在大多数国家的癌症人群中, 肺癌是引起死亡的头号原因, 2014年, 仅美国就有约159 260人死于肺癌[43], 非小细胞肺癌(non-small cell lung carcinoma, NSCLC) 约占所有肺癌的80%, 5年后患者的总生存率低于10%[44]。研究表明, 正常肺组织中TfR呈阴性或低表达, 阳性表达主要存在于支气管黏膜上皮细胞, 而在NSCLC中TfR的阳性表达率较正常肺组织提升了4倍左右[45], 因此, 可将其作为一个潜在的靶点设计靶向递药系统。
Kurmi等[46]合成了5.0G聚丙烯亚胺 (5.0G PPI) 树枝状大分子, 再由碳二亚胺偶联反应将Lf与之结合后载入氨甲喋呤 (methotrexate, MTX) 制得肺靶向载药系统。该载体载药量大, 药物封装能力强, 提高了药物滞留时间及靶向组织中的分布, 将MTX的肺靶向性提高了2.5倍。此外, 经Lf修饰后, PPI的细胞毒性也得到了显著降低。
Pandey等[47]通过碳二亚胺偶联反应将Lf与载有紫杉醇(paclitaxel, PTX) 的固体脂质纳米粒 (SLNs) 耦合, 制得用于治疗支气管癌的肺靶向载体, 并与未经Lf修饰的SLNs及PTX直接给药进行对比。结果表明, 经Lf修饰后药物的肺靶向性得到提高, 支气管上皮细胞内PTX的含量增加, 且降低了PTX对正常细胞的伤害, 是一项值得继续深入研究的肺癌化疗手段。
根据不同器官组织TfR的表达情况可以为靶点构建靶向制剂, 癌细胞由于其无限增殖等特点, 往往存在某些受体高度表达的现象, TfR在HCC和NSCLC中存在过度表达现象已被研究, 但在其他类型的癌组织中是否也高度表达, 能否设计出相应的靶向制剂等问题还需进一步探索。
4 乳铁蛋白口服递药系统研究表明, Lf在61 ℃和93 ℃时会发生热变性, 可通过控制温度和热处理时间来获得不同尺寸的Lf纳米粒, 该纳米粒在pH 3~11及0~200 mmol·L−1 NaCl离子强度内保持稳定, 可用于封装和递送生物活性化合物[48]。有研究证明, Lf在胃肠道中具有一定程度的抗蛋白水解作用[49]。因此, 可以将Lf用于口服药物载体, 提高患者顺应性。
Zhang等[50]利用Lf富含二硫键的特点, 制备了藤黄酸乳铁蛋白纳米粒, 用于口服给药,通过胃肠道内的乳铁蛋白受体介导入胞发挥疗效。结果表明, 乳铁蛋白纳米粒极大地提高了藤黄酸的抗肿瘤活性, 显示了Lf作为药物载体用于口服途径的可行性。
Golla等[51]在对静脉注射lactodoxonano治疗HCC的安全性及有效性进行研究后, 将给药方式由静脉注射改成口服给药, 并以大鼠作为模型进行体内实验。经口服纳米制剂给药的大鼠, 体重未出现明显变化, 肝结节减少量大于93%, 与口服DOX大鼠对照组相比, 肝靶向效率和安全性均得到显著提高。
Tokle等[52]运用静电逐层沉积的方法将阳离子蛋白质Lf和阴离子蛋白质β-乳球蛋白依次逐层包覆在脂滴表面形成包衣, 制得用于口服递送生物活性物质的载体。将其依次通过模拟口腔、胃及小肠环境, 以考察其稳定性及药物释放性。结果表明, 蛋白质纳米层包衣能提高载体在胃肠道内的稳定性, 有望作为口服药物应用。此外, Tokle等[53]还研究发现, Lf包裹的脂滴在pH 7条件下加热到60 ℃, 由于蛋白质热变性作用导致载体稳定性大幅降低, 容易发生沉积。而添加低甲氧基果胶 (LMP) 等阴离子多糖能大幅提高载体在不同温度和pH条件下的耐受力, 但在高离子浓度 (如钙离子, 钠离子) 和特定的pH条件下, 阴离子多糖的添加会对载体稳定性起反作用。
口服递药系统具有给药方便和患者顺应性高等优点。Lf作为口服递药系统具有广阔的前景, 但目前国内外研究较少, 是一个值得探索开发的新领域。
5 结论与展望乳铁蛋白本身具有广泛的生理功能, 将其作为药物载体更是拥有某些高分子材料所不具有的优势。乳铁蛋白作为转铁蛋白家族的一员, 能顺利通过受体介导胞吞进入细胞内, 这在跨越血脑屏障中作用尤其突出。将乳铁蛋白作为配体修饰载药系统, 能够实现脑靶向性, 成功透过血脑屏障将药物递送进入中枢神经系统, 有利于中枢神经系统疾病以及脑肿瘤的治疗。此外, 转铁蛋白受体在肝脏和肺部癌化细胞中存在过度表达现象, 利于乳铁蛋白药物载体的优先定位, 实现肝、肺的靶向治疗。乳铁蛋白作为药物载体还可应用于口服递药系统, 虽然目前研究较少, 但由于口服给药的良好顺应性和安全性等优点, 特别是抗癌药物类毒性大、口服生物利用度低等药物的载体值得深入研究。乳铁蛋白新器官靶点的开发、口服递药系统及将乳铁蛋白药物载体从实验室转向临床可能是今后研究的方向。
| [1] | Huang RQ, Ke WL, Qu YH, et al. Characterization of lactoferrin receptor in brain endothelial capillary cells and mouse brain [J]. J Biomed Sci, 2007, 14: 121-128. |
| [2] | Vogel H. Lactoferrin, a bird's eye view [J]. Biochem Cell Biol, 2012, 90: 233-244. |
| [3] | Baker EN, Baker HM. Molecular structure, binding properties and dynamics of lactoferrin [J]. Cell Mol Life Sci, 2005, 62: 2531-2539. |
| [4] | Environ International Corporation. Generally recognized as safe (gras) notification for bovine lactoferrin as a component of a spray to prevent microbial contamination of beef products [G/OL]. Arlington, Virginia. 2001. http://www.fda.gov/ucm/groups/fdagov-public/@fdagov-foods-gen/documents/document/ucm258379.pdf |
| [5] | Mehra NK, Mishra V, Jain NK. Receptor-based targeting of therapeutics [J]. Ther Deliv, 2013, 4: 369-394. |
| [6] | Amini AA, Nair LS. Evaluation of the bioactivity of recombinant human lactoferrins toward murine osteoblast-like cells for bone tissue engineering [J]. Tissue Eng Part A, 2013, 19: 1047-1055. |
| [7] | Kanwar JR, Mahidhara G, Roy K, et al. Fe-bLf nanoformulation targets survivin to kill colon cancer stem cells and maintains absorption of iron, calcium and zinc [J]. Nanomed, 2015, 10: 35-55. |
| [8] | Rempe R, Cramer S, Qiao RR, et al. Strategies to overcome the barrier: use of nanoparticles as carriers and modulators of barrier properties [J]. Cell Tissue Res, 2014, 355: 717-726. |
| [9] | Huang RQ, Ke WL, Han L, et al. Brain-targeting mechanisms of lactoferrin-modified DNA-loaded nanoparticles [J]. J Cerebr Blood F Met, 2009, 29: 1914-1923. |
| [10] | Mazibuko Z, Choonara Y, Kumar P, et al. A review of the potential role of nano-enabled drug delivery technologies in amyotrophic lateral sclerosis: lessons learned from other neurodegenerative disorders [J]. J Pharm Sci, 2015, 104: 1213-1229. |
| [11] | Blesa J, Przedborski S. Parkinson's disease: animal models and dopaminergic cell vulnerability [J]. Front Neuroanat, 2014, 8: 155. |
| [12] | Hu KL, Shi YB, Jiang WM, et al. Lactoferrin conjugated PEG-PLGA nanoparticles for brain delivery: preparation, characterization and efficacy in Parkinson's disease [J]. Int J Pharm, 2011, 415: 273-283. |
| [13] | Yan GM, Qiu PX, Huang YJ, et al. Application of oceanic steroidal compounds in preparing neuron lesion theraputic agents: China, CN200610036926 [P]. 2008-04-23. |
| [14] | Zheng SJ, Xie YQ, Li Y, et al. Development of high drug-loading nanomicelles targeting steroids to the brain [J]. Int J Nanomed, 2014, 9: 55-66. |
| [15] | Firoz CK, Jabir NR, Khan MS, et al. An overview on the correlation of neurological disorders with cardiovascular disease [J]. Saudi J Biol Sci, 2015, 22: 19-23. |
| [16] | Zhao ZM, Qi DS, Sun Y, et al. Synthesis and characterization of lactoferrin modified chitosan magnetic nanoparticles and its uptake by HT-22 hippocampal cells [J]. Central South Pharm (中南药学), 2014, 12: 1175-1178. |
| [17] | Liu ZY, Jiang MY, Kang T, et al. Lactoferrin-modified PEG-co-PCL nanoparticles for enhanced brain delivery of NAP peptide following intranasal administration [J]. Biomaterials, 2013, 34: 3870-3881. |
| [18] | Djupesland PG, Messina JC, Mahmoud RA. The nasal approach to delivering treatment for brain diseases: an anatomic, physiologic, and delivery technology overview [J]. Ther Deliv, 2014, 5: 709-733. |
| [19] | Magen I, Gozes I. Microtubule-stabilizing peptides and small molecules protecting axonal transport and brain function: focus on davunetide (NAP) [J]. Neuropeptides, 2013, 47: 489-495. |
| [20] | Zhao MS, Chen JR, Zheng YJ, et al. Protective effect of genistein on Aβ25-35-induced PC12 cells injury [J]. J China Pharm Univ (中国药科大学学报), 2014, 45: 227-231. |
| [21] | Böttger D, Ullrich C, Humpel C. Monocytes deliver bioactive nerve growth factor through a brain capillary endothelial cell-monolayer in vitro and counteract degeneration of cholinergic neurons [J]. Brain Res, 2010, 1312: 108-119. |
| [22] | Kuo YC, Wang CT. Protection of SK-N-MC cells against β-amyloid peptide-induced degeneration using neuron growth factor-loaded liposomes with surface lactoferrin [J]. Biomaterials, 2014, 35: 5954-5964. |
| [23] | Yu Y, Pang ZQ, Lu W, et al. Self-assembled polymersomes conjugated with lactoferrin as novel drug carrier for brain delivery [J]. Pharm Res, 2012, 29: 83-96. |
| [24] | Chai GS, Duan DX, Ma RH, et al. Humanin attenuates Alzheimer-like cognitive deficits and pathological changes induced by amyloid β-peptide in rats [J]. Neurosci Bull, 2014, 30: 923-935. |
| [25] | Dubois LG, Companati L, Righy C, et al. Gliomas and the vascular fragility of the blood brain barrier [J]. Front Cell Neurosci, 2014, 8: 418. |
| [26] | Taylor TE, Furnar FB, Cavenee WK. Targeting EGFR for treatment of glioblastoma: molecular basis to overcome resistance [J]. Curr Cancer Drug Targets, 2012, 12: 197-209. |
| [27] | Su ZG, Xing L, Chen YN, et al. Lactoferrin-modified poly (ethylene glycol)-grafted bsa nanoparticles as a dual-targeting carrier for treating brain gliomas [J]. Mol Pharm, 2014, 11: 1823-1834. |
| [28] | Chou YC, Chang MY, Wang MJ, et al. PEITC induces apoptosis of human brain glioblastoma GBM8401 cells through the extrinsic-and intrinsic-signaling pathways [J]. Neurochem Int, 2015, 81: 32-40. |
| [29] | Kuo YC, Chen YC. Targeting delivery of etoposide to inhibit the growth of human glioblastoma multiforme using lactoferrin-and folic acid-grafted poly(lactide-co-glycolide) nanoparticles [J]. Int J Pharm, 2015, 479: 138-149. |
| [30] | Assaraf YG, Leamon CP, Reddy JA. The folate receptor as a rational therapeutic target for personalized cancer treatment [J]. Drug Resist Updat, 2014, 17: 89-95. |
| [31] | Chen HL, Wu MJ, Wang X, et al. Construction and characterization of lactoferrin modified procationic liposomes [J]. Central South Pharm (中南药学), 2010, 8: 81-84. |
| [32] | Chen HL, Tang L, Qin Y, et al. Lactoferrin-modified procationic liposomes as a novel drug carrier for brain delivery [J]. Eur J Pharm Sci, 2010, 40: 94-102. |
| [33] | Chen HL, Qin Y, Zhang QY, et al. Lactoferrin modified doxorubicin-loaded procationic liposomes for the treatment of gliomas [J]. Eur J Pharm Sci, 2011, 44: 164-173. |
| [34] | Xiao YY, Chen X, Zou L, et al. Preparation of lactoferrin-modified nanostructured lipid carriers and evaluation of its brain targeting efficiency [J]. Chin Pharm J (中国药学杂志), 2013, 48: 1755-1760. |
| [35] | Ye YJ, Sun Y, Zhao HL, et al. A novel lactoferrin-modified β-cyclodextrin nanocarrier for brain-targeting drug delivery [J]. Int J Pharm, 2013, 458: 110-117. |
| [36] | Fan Y, Yang JM, Li JJ. Preparation of novel gypenosides long-circulating liposomes consisted by sphingomyelin and β-sitosterol modified by PEG [J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 997-1001. |
| [37] | Huang FYJ, Chen WJ, Lee WY, et al. In vitro and in vivo evaluation of lactoferrin-conjugated liposomes as a novel carrier to improve the brain delivery [J]. Int J Mol Sci, 2013, 14: 2862-2874. |
| [38] | Kondo Y, Kimura O, Shimosegawa T. Radiation therapy has been shown to be adaptable for various stages of hepatocellular carcinoma [J]. World J Gastroenterol, 2015, 21: 94-101. |
| [39] | Bae S, Ma K, Kim TH, et al. Doxorubicin-loaded human serum albumin nanoparticles surface-modified with TNF-related apoptosis-inducing ligand and transferrin for targeting multiple tumor types [J]. Biomaterials, 2012, 33: 1536-1546. |
| [40] | Kew MC. Hepatic iron overload and hepatocellular carcinoma [J]. Liver Cancer, 2014, 3: 31-40. |
| [41] | Golla K, Cherukuvada B, Ahmed F, et al. Efficacy, safety and anticancer activity of protein nanoparticle-based delivery of doxorubicin through intravenous administration in rats [J]. PLoS One, 2012, 7: e51960. |
| [42] | Wei MY, Xu YH, Zou Q, et al. Hepatocellular carcinoma targeting effect of PEGylated liposomes modified with lactoferrin [J]. Eur J Pharm Sci, 2012, 46: 131-141. |
| [43] | Rolfo C, Passiglia F, Ostrowski M, et al. Improvement in lung cancer outcomes with targeted therapies: an update for family physicians [J]. J Am Board Fam Med, 2015, 28: 124-133. |
| [44] | Stojsic J, Stankovic T, Stojkovic S, et al. Prolonged survival after neoadjuvant chemotherapy related with specific molecular alterations in the patients with nonsmall-cell lung carcinoma [J]. Exp Mol Pathol, 2014, 98: 27-32. |
| [45] | Zhu H. The Investigation For Transferrin Receptor Expression And Its Mechanism In The Non Small Cell Lung Cancer (转 铁蛋白受体在非小细胞肺癌中的表达及其机制的研究) [D]. Changsha: Central South University, 2014. |
| [46] | Kurmi BD, Gajbhiye V, Kayat J, et al. Lactoferrin-conjugated dendritic nanoconstructs for lung targeting of methotrexate [J]. J Pharm Sci, 2011, 100: 2311-2320. |
| [47] | Pandey V, Cajbhiye KR, Soni V. Lactoferrin-appended solid lipid nanoparticles of paclitaxel for effective management of bronchogenic carcinoma [J]. Drug Deliv, 2015, 22: 199-205. |
| [48] | Abd El-Salam MH, El-Shibiny S. Formation and potential uses of milk proteins as nano delivery vehicles for nutraceuticals: a review [J]. Int J Dairy Technol, 2012, 65: 13-21. |
| [49] | Jiang R, Du X, Lönnerdal B. Comparison of bioactivities of talactoferrin and lactoferrins from human and bovine milk [J]. J Pediatr Gastroenterol Nutr, 2014, 59: 642-652. |
| [50] | Zhang ZH, Wang XP, Ayman WY, et al. Studies on lactoferrin nanoparticles of gambogic acid for oral delivery [J]. Drug Deliv, 2013, 20: 86-93. |
| [51] | Golla K, Bhaskar C, Ahmed F, et al. A target-specific oral formulation of doxorubicin-protein nanoparticles: efficacy and safety in hepatocellular cancer [J]. J Cancer, 2013, 4: 644-652. |
| [52] | Tokle T, Mao YY, McClements DJ. Potential biological fate of emulsion-based delivery systems: lipid particles nanolaminated with lactoferrin and β-lactoglobulin coatings [J]. Pharm Res, 2013, 30: 3200-3213. |
| [53] | Tokle T, Lesmes U, McClements DJ. Impact of electrostatic deposition of anionic polysaccharides on the stability of oil droplets coated by lactoferrin [J]. J Agric Food Chem, 2010, 58: 9825-9832. |
 2015, Vol. 50
2015, Vol. 50


