2. 中国科学院上海药物研究所, 上海 201203;
3. 湖北中医药大学, 湖北 武汉 430065;
4. 中国药科大学, 江苏 南京 210009
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. Hubei University of Chinese Medicine, Wuhan 430065, China;
4. China Pharmaceutical University, Nanjing 210009, China
细菌感染严重威胁人类健康,是导致人类死亡的主要疾病之一。2010年卫生部耐药菌株监测结果表明,革兰阴性菌占73.8%,其中包括多药耐药的鲍曼不动杆菌、铜绿假单胞菌、肺炎克雷伯菌和大肠杆菌,对亚胺培南的耐药率分别高达72.9%、40.4%、6.4% 和14.5%,是导致细菌感染死亡人数居高不下的重要原因。
多粘菌素E (polymyxin E,PME) 是从多粘杆菌培养液中获得的一种多肽抗生素,能有效杀伤临床上常见的革兰阴性菌,20世纪80年代因为其具有较严重毒副作用被弃用。近年来研究发现,PME对广泛流行的多耐药性革兰阴性菌具有明显的杀伤作用,因此PME作为耐药菌治疗的最后防线被重新应用于临床[1]。由于PME分子较小,经肾快速排泄,从而引起血清肌酐、尿素氮等指标升高,甚至出现急性肾小管坏死或急性肾衰竭,因此降低其肾毒性成为首先需要解决的难题[1, 2]。
成熟的聚乙二醇 (PEG) 技术有望克服上述难题。将修饰活化后的PEG分子共价结合到蛋白质多肽类药物上,形成稳定的PEG化药物。PEG化后药物分子量成倍增加,能有效降低单位时间内肾脏的滤过作用,以达到降低肾脏毒性的目的[3, 4, 5]。本研究以抗菌药物PME为模型药物,设计合成了一种mPEG2K修饰的PME,以期在保留抗菌活性基础上,降低药物对肾脏的毒性作用。
材料与方法 主要试剂和仪器多粘菌素E原料药 (含量 > 99.8%,上海新亚药业有限公司); 聚乙二醇2000单甲醚 (methoxypolyethylene glycols 2000,mPEG2K,含量 > 99.5%,江苏海安石油化工厂); N,N '-二琥珀酰亚胺碳酸酯 (N,N '-disuccinimidyl carbonate,DSC,纯度: 99%),4-& lt; /span>二甲氨基吡啶 (4-dimethylaminopyridine,DMAP,纯度: 99%) (国药集团化学试剂有限公司); 小鼠肿瘤坏死因子检测试剂盒 (TNF-α ELISAKit,美国BioLegend公司); 胎牛血清 (FBS,杭州四季青生物工程材料有限公司); DMEM/F-12培养基 (美国Gibico公司); 超纯水 (MiliQ); 真空干燥箱 (上海益恒实验仪器有限公司); 磁力搅拌器、旋转蒸发仪 、 恒温摇床 (德国IKA公司); 紫外分光光度计 (北京普析通用仪器有限责任公司); 全自动血样分析仪 (德国Siemens公司); 荧光倒置显微镜 (德国Leica公司)。
细胞模型人肾小管上皮细胞株 (HK-2,上海研谨生物科技有限公司) 培养于含10% 胎牛血清DMEM/F-12培养液中,在37 ℃、5% CO2孵育箱中孵育,每1~2天更换一次培养液。
实验菌株及动物大肠杆菌 (Escherichia coliATCC25922),购于中国医学菌种保藏中心,培养于MH肉汤培养基。
SPF级雄性昆明小鼠,体重18~22 g,由中国科学院上海药物研究所实验动物中心提供,合格证号: 2007000568827。
mPEG2K-PME的制备将mPEG2K 1.8 g完全溶解于2 mL乙腈中,称取0.46 g DSC和适量DMAP分别缓慢加入到反应体系中,搅拌过夜。体系中加入适量乙醚,抽滤,收集析出的固体,异丙醇重结晶后抽滤,收集滤渣,真空干燥后得中间产物聚乙二醇2000琥珀酰亚胺碳酸酯 (mPEG2K-SC) 约0.9 g[6, 7]。将所得mPEG-SC溶于2 mL PBS (pH 9.5) 中,溶解完全后加入PME 0.64 g,室温下搅拌过夜,二氯甲烷萃取,收集有机层,吹干,得mPEG2K-PME[6, 7, 8] (合成路线1)。
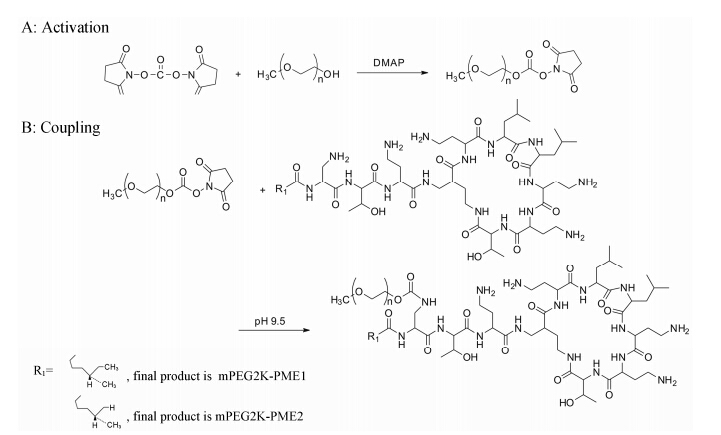 |
Scheme 1 Synthetic route of mPEG2K-SC (A) and mPEG2K-PME (B) conjugates. mPEG2K: Methoxypolyethylene glycols 2000; SC: Succinimidyl carbonate; PME: Polymyxin E |
从大肠杆菌的琼脂平板上挑取1~2个单菌落,加至10 mL MH肉汤培养基的锥形瓶中,37 ℃恒温振摇4 h后,MH肉汤培养基稀释大肠杆菌菌悬液稀释至约5×105 cfu·mL-1,稀释后大肠杆菌菌悬液接种到96孔板中,每孔190 μL。配制梯度浓度含PME和mPEG2K-PME溶液,每孔添 加10 μL相应溶液,药物终浓度分别为68.96、34.48、17.24、8.62、4.31和1.07 μmol·L-1,对照孔中添加等体积的生理盐水,加药完毕后96孔板置于37 ℃恒温摇床上孵育24 h。600 nm波长下检测不同时间点各孔的光密度 (OD值),绘制时间-杀菌曲线[9, 10, 11]。SPSS软件统计分析,计算两组药物的半数抑菌浓度 (IC50)[10, 11]。
体外细胞毒性检测采用MTT法[12]检测mPEG2K-PME的体外细胞毒性,并以游离的PME 作为对照。将HK-2细胞以1×104个/孔接种于96孔板中,培养48 h。 以含10% 胎牛血清培养基配制制剂,mPEG2K-PME和游离PME梯度浓度分别为8.62、43.10、86.21、172.41、344.82、689.65和1 379.31 μmol·L-1,每个浓度梯度设5个复孔,分别处理细胞48 h。孵育结束后,每孔加入新鲜配制的MTT溶液 (0.5 mg·mL-1) 100 μL,孵育4 h; 弃去上清液,每孔加入DMSO 150 μL,置37 ℃摇床中振荡溶解紫色结晶产物,于540 nm处检测吸收度值。
腹腔感染模型的建立及给药将增菌培养后的大肠杆菌菌液离心,收集细菌,生理盐水洗涤3次后重悬菌液浓度至约2×107 cfu·mL-1。给药组小鼠分别腹腔注射大肠杆菌菌悬液0.4 mL,4 h后经尾静脉采血50 μL,稀释处理后全自动血样分析仪进行白细胞计数检测,以白细胞总数降至正常值20% 左右作为小鼠急性腹腔感染模型,正常组不做任何处理[13,14]。取 24只小鼠随机分为4组,每组6只。分别为mPEG2K- PME组、游离的PME组、生理盐水 (NS) 组和正常组。分组完成后每8 h经尾静脉注射给药一次,持续治疗7天[15, 16, 17],剂量为5 mg·kg-1 (按PME计算)。
白细胞检测分别于各时间点取血50 μL,EDTA- K2抗凝后生理盐水稀释处理,全自动血样分析仪进行白细胞计数 (WBC),计算相对白细胞数。相对白细胞数 = 白细胞实测值/正常白细胞值。考察各组小鼠在168 h内白细胞波动的频率及波动的幅度,并绘制波动曲线。
肿瘤坏死因子(TNF-α)表达水平4组小鼠于不同时间点取血50 μL,EDTA-K2抗凝后,4 000 r·min-1离心10 min后取上清液。按TNF-α试剂盒使用说明书操作: 洗板4次,拍干,取50 μL稀释好的标准品溶液和待测样品至对应的孔中,孵育2 h; 加入detection antibody solution 100 μL,盖上膜板,轻轻振荡混匀,37 ℃温育1 h; 去除孔内液体,洗板4次,拍干,每孔加入Avidin—HRP B 100 μL,轻轻振荡混匀,37 ℃温育30 min; 再去除孔内液体,洗板 5次,拍干,每孔加入substrate solution D 100 μL,避光,37 ℃温育15 min; 每孔加入stop solution 100 μL后于540和570 nm处检测光密度 (OD值),根据标准曲线计算各孔中肿瘤坏死因子的表达量。
菌落计数选取给药后24、96和168 h,分别经尾静脉采血50 μL,无菌生理盐水按10倍递增稀释血液,将稀释好的血液样本各取100 μL均匀涂板在MH琼脂平板上,于37 ℃恒温培养箱中孵育48 h,计算平均菌落数。
体重检测开始实验后,所有小鼠每12小时称重一次,计算相对体重。相对体重 (ralative body weight) = 实测体重/起始体重×100%。以时间为横坐标,相对体重为纵坐标,绘制4组小鼠7天内的时 间-体重波动曲线。
腹腔解剖观察给药后72 h,药物治疗组和正常组每组各取3只小鼠,解剖观察并收集腹腔积液,测定积液体积。
脾脏重量、肾系数、尿量测定及肾组织切片在给药期间,收集144~168 h内各组小鼠的尿液并测定其体积。给药7天后处死小鼠,取小鼠脾脏和双侧肾脏,生理盐水清洗3遍后擦干、称重,并计算肾系数: 肾系数 = 肾脏质量 / 体重 × 100%。肾组织经4% 多聚甲醛溶液固定后,再经过脱水、透明、透腊和包埋、切片、脱蜡、染色等过程,制备石蜡切片,倒置显微镜下观察各组制剂对肾脏的损伤程度。
数据处理实验数据均以x± s的形式表示,如果数据符合正态分布,统计方法采用双侧t检验 (α = 0.05); 如数据不符合正态分布,则采用F检验。
结果 1 mPEG2K-PME核磁表征和质谱参数mPEG2K-PME的1H NMR图谱见图 1。1H NMR (D2O): c 4.52 (m,10H),d 2.31 (m,10H),e 2.08 (m,14H),f 1.67 (m,5H),g 1.28 (m,4H),h 0.93 (m,18H) 为PME的骨架峰; b 3.69(m,≈180H),a 3.37 (s,3H) 为PEG的骨架峰,该聚合物同时具备PME和PEG的特征峰。mPEG2K端甲基信号积分为3,PME脂肪链端2个亚甲基信号积分为4,一个PEG上封端有一个甲基 (氢数为3),则PEG分子为3/3/1 = 1,一个多粘菌素脂肪链上有2个亚甲基 (氢数为4),则多粘菌素分子为4/2/2 = 1,即每个多粘菌素分子上平均偶联1个PEG分子。
 |
Figure 1 1H NMR spectrum of mPEG2K-PME |
mPEG2K与多粘菌素E1 (相对分子质量1 170) 和多粘菌素E2 (相对分子质量1 155) 连接后的质谱参数见表 1。mPEG2K分子中重复的结构单元n取值不同,其相对分子质量约为1 800~2 200,对应的n值为40~49,mPEG2K与多粘菌素E1和E2相连后,相对分子质量分别为2 970~3 370和2 955~3 355左右。当n = 40~49时,mPEG2K-polymyxin E1和mPEG2K- polymyxin E2主要质谱参数如表 1所示。
|
|
Table 1 Typical mass spectrum parameters of mPEG2K-polymyxin E1 and mPEG2K-polymyxin E2,separately. n: Number of cycle structure “-O-CH2-CH2-” in mPEG2K |
PME和mPEG2K-PME分别在高、低浓度下与大肠杆菌菌悬液共孵育,时间-杀菌曲线如图 2所示。当两者同为低浓度 (17.24 μmol·L-1) 时,2 h内mPEG2K- PME组、PME组及NS组大肠杆菌生长均缓慢,处于细菌生长的延滞期,三组之间并无显著性差异 (P > 0.05); 在2~8 h之间,NS组大肠杆菌快速增殖,而mPEG2K-PME组和PME组由于添加了抗生素,细菌增殖受到抑制,增长速度明显低于NS组 (P < 0.05); 在10~24 h之间,PME组抗菌活性显著优于mPEG2K- PME组(P < 0.01)。当PME和mPEG2K-PME均为高浓度 (68. 96 μmol·L-1) 时,PME组抗菌活性亦显著优 于mPEG2K-PME组(P < 0.01)。mPEG2K-PME浓度由低浓度提高3倍达到高浓度时,其抗菌活性也增大,呈明显的剂量依赖关系,两组之间有显著性差异 (P < 0.01)。经SPSS软件曲线拟合计算后,mPEG2K-PME和PME的半数抑菌浓度IC50值分别为65.80和20.93 μmol·L-1。以上两组数据均表明mPEG2K-PME在体外具有显著的抗菌活性 (P < 0.05),但其活性低于游离的PME,这可能与PME的杀菌机制有关: 当PEG与PME上氨基连接后,一方面导致其 正 电荷减少,另一方面可能存在PEG分子影响PME的空间结构,最终导致PEG化后的多粘菌素E对细菌杀伤力降低。
 |
Figure 2 Typical microbiological responses observed in vitro pharmacokinetic model using Escherichia coli after treated with PME and mPEG2K-PME for 24 h at low dose (17.24 μmol·L-1) and high dose (68.96 μmol·L-1),separately. n = 5,x± s. **P < 0.01 vs PME low dose group |
MTT法测定不同浓度下mPEG2K-PME对人肾小管上皮细胞 (HK-2) 的损伤程度,并以游离的PME作为阳性对照,结果如图 3所示。当药物浓度为8.62、43.1和86.2 μmol·L-1时,mPEG2K-PME组和游离的PME组无显著差异 (P & lt; span lang="EN-US" style='color:black' xml:lang="EN-US">> 0.05),两者细胞活性均在80% 以上; 当药物浓度在172.4、344.8、689.6和1 379.2 μmol·L-1时,mPEG2K-PME组的细胞毒性显著低于游离的PME组 (P < 0.01),且随着浓度的增大,两组药物的细胞毒性越强,呈剂量依赖关系。体外细胞 毒 性实验结果表明,在治疗细菌感染时,mPEG2K-PME相比于游离的PME,其安全剂量范围更大,毒性更低。
 |
Figure 3 Cytotoxicity of PME and mPEG2K-PME against HK-2 cells during 48 h with the concentrations of 8.62,43.1,86.2,172.4,344.8,689.6 and 1 379.2 μmol·L-1. n = 5,x± s. **P < 0.01 vs PME group |
腹腔注射大肠杆菌菌液0.4 mL后,小鼠急性腹腔感染,外周血白细胞数量急剧下降,4 h左右达到最低点,与正常值之比约为0.2。给药7天后,NS组小鼠感染严重,24 h时白细胞数急剧下降至0.02,36 h内所有小鼠全部死亡; PME组和mPEG2K-PME生存 时间明显延长。白细胞波动结果显示 ,在达到稳定状态之前,PME组经历了4次较大波动,而mPEG2K- PME组经历了3次波动; PME组和mPEG2K-PME组波动幅度分别为 (0.230 ± 0.005)~(1.081 ± 0.021) 和 (0.210 ± 0.012)~(0.921 ± 0.025),mPEG2K-PME组的波动幅度显著低于PME组 (P < 0.05)。另外,PME组和mPEG2K-PME组达到稳定状态的时间分别为 (144 ± 6) 和(120± 8) h,mPEG2K-PME组到达稳定状态所需时间显著低于PME组(P < 0.05) (图 4)。
 |
Figure 4 White blood cells count after an intra-abdominal infection model established. Mice were administered with PME and mPEG2K-PME with the concentration of 5 mg·kg-1 and normal saline (NS) for 168 h every 8 hours via iv injection by cauda vein |
TNF-α的表达水平结果如图 5所示。NS组小鼠急性腹腔感染时,TNF-α快速上升,24 h达到 (451 ± 30) pg·mL-1,36 h内NS组所有小鼠均死亡; PME组和mPEG2K-PME组给药后,24 h时TNF-α表达量分别为 (180 ± 15) 和 (139 ± 10) pg·mL-1,均显著低于NS组 (P < 0.05); 7天后TNF-α分别降低到 (34 ± 8) 和 (42 ± 7) pg·mL-1,与正常组 [(28 ± 4) pg·mL-1]无显著性差异 (P > 0.05)。
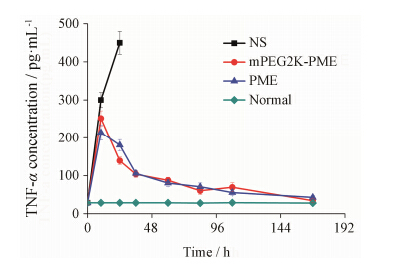 |
Figure 5 The level of TNF-α at different times in a bacteremia model induced by Escherichia coli. Mice were treatment with PME (5 mg·kg-1) and mPEG2K-PME (5 mg·kg-1) and NS for 7 days every 8 hours via iv injection. n = 6,x± s |
选择24、96、168 h取血涂板,结果如图 6所示。NS组在24 h时,血液中细菌超过1×108 cfu·mL-1,小鼠感染严重,36 h内小鼠全部死亡; PME组和mPEG2K- PME组在24、96和168 h时,mPEG2K-PME组计数结果与PME组均存在显著性差异 (P < 0.05)。
 |
Figure 6 Blood bacterial counts in a bacteremia model induced by the Escherichia coli at 24,96 and 168 h. Mice received treatment with PME (5 mg·kg-1),mPEG2K-PME (5 mg·kg-1) and NS for 7 days every 8 hours,separately. n = 6,x± s. P < 0.05 vs PME group |
腹腔注射菌液后4 h,各组给予相应的药物治疗,每12小时监测一次体重,体重波动情况如图 7所示。NS组小鼠感染严重,食量减少,24 h时相对体重迅 速下降到87%,36 h内全部死亡; PME组小鼠给药后36 h左右相对体重降低至88.4%,36 h后随着小鼠采食行为的增加,相对体重逐渐上升,96 h恢复到96%; mPEG2K-PME组给药后24 h时相对体重降至89.8%,24 h后小鼠食量有所增加,体重上升,96 h时恢复至98.2%。mPEG2K-PME组与PME组相比无显著性差异 (P > 0.05)。
 |
Figure 7 Body weight change after the bacteremia model induced by the Escherichia coli established. Mice were treated with PME (5 mg·kg-1) and mPEG2K-PME (5 mg·kg-1) and normal saline (NS) for 7 days every 8 hours,separately. n = 6,x± s |
PME组平均脾重为 (523 ± 20) mg,mPEG2K- PME组平均脾重 (378 ± 15) mg,两者之间有显著性差异 (P < 0.05)。见图 8。
 |
Figure 8 Efficacy of PME and mPEG2K-PME in the bacteremia model induced by the Escherichia coli. Mice were treatment for 7 days with PME (5 mg·kg-1),mPEG2K-PME (5 mg·kg-1) and NS via iv injection,then the spleens were harvested. n = 6,x± s. P < 0.05 vs PME group |
PME组腹腔有血性渗出,腹膜和肠壁充血、粘 连,肝脏表面颜色变暗,积液体积为 (1.22 ± 0.25) mL; mPEG2K-PME组腹腔和肠壁充血、粘连,腹腔内有血性积液渗出和炎症细胞浸润,积液体积为 (0.83 ± 0.13) mL; 正常组腹腔内腹膜和肠壁未见充血,肝脏颜色呈红色,无明显 积液。其中,mPEG2K-PME组积液体积显著低于PME组 (P < 0.05)。
10 肾系数、尿量测定及肾组织切片正常组、PME组和mPEG2K-PME组的肾系数分别为 (1.14 ± 0.04) %、(1.28 ± 0.08) % 和(1.13 ± 0.02) %,PME组与正常组具有显著性差异 (P < 0.05)。正常组、PME组和mPEG2K-PME组最后24 h的尿量分别为 (1.63 ± 0.46)、(0.37 ± 0.26) 和 (1.51 ± 0.32) mL,其中mPEG2K-PME组与PME组相比具有显著性差异 (P < 0.01)。7天后各组小鼠取肾脏行病例切片结果见图 9。从图中可见,正常组未见明显损伤,肾组织结构完整清晰; mPEG2K-PME组出现少许管型扩张 (图 9中黄色箭头),有少量细胞核突出 (图 9中红色箭头),组织结构基本完整; 而PME组肾小管上皮细胞水肿扩张严重,坏死较多,管型结构大量出现 (图 9中黄色箭头),毛细血管腔明显狭窄,肾间质出现不同程度充血、水肿及炎细胞浸润和核固缩 (图 9中红色箭头)。
 |
Figure 9 Representative histopathological images. (A) Normalgroup; (B) Treated with mPEG2K-PME (5 mg·kg-1) for 7 days every 8 hours; (C) Treated with PME (5 mg·kg-1) for 7 days every 8 hours |
由于多耐药革兰阴性菌感染在全球范围内广泛流行,其引发的败血症、伤口感染、尿路感染和呼吸系统感染病例迅速增大,使多粘菌素E的应用日益广泛,与之相关的多粘菌素E的肾毒性研究也逐渐丰富。成熟的PEG技术在增强疗效和减低毒性方面具有独特的优势,且目前已有很多类似的PEG药物上市,如PEG-胰岛素、PEG-天冬酰胺酶等。从类似的药物着手,本实验合成了mPEG2K修饰的PME。体外抗菌结果表明,mPEG2K修饰后的PME在体外环境下具有良好的抗菌活性,浓度越大,抗菌效果越好。但mPEG2K修饰后PME的活性低于游离的PME。这可能与PME分子上 -NH2减少和PEG分子的空间位阻有关。有研究[18]表明,PEG修饰剂会影响蛋白质或多肽的空间结构最终导致其活性降低,与本文结论吻合。
在考察mPEG2K-PME的体外活性后,本文同时还建立了急性腹腔感染的动物模型,并给予了相应的药物治疗。结果发现,在相同剂量下mPEG2K-PME在体外的活性虽低于PME,但在体内环境下其治疗效果优于PME。腹腔积液越多说明感染越严重,而PEG2K-PME组腹腔积液显著少于PME组; 白细胞作为免疫细胞,在机体发生炎症时血液内的白细胞总数会变化,给予相应的抗菌药物后,随着感染的治愈白细胞逐步恢复到正常水平,而mPEG2K-PME白细胞计数波动幅度较小,波动次数少; 于不同的时间点取血稀释后涂板结果显示,mPEG2K-PME组的细 菌远低于PME组; 脾脏是脊椎动物体内最大的免疫器官,含有大量淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心。当细菌感染时,随着脾脏功能亢进,脾脏肿大,mPEG2K-PME组脾重远低于PME组。TNF-α是由巨噬细胞对细菌感染或其他免疫源反应自然产生的细胞因子,同时也是一种重要的炎症因子,它还能诱导产生白细胞介素2和6共同对抗细菌感染。文中结果显示,肿瘤坏死因子虽无显著差异,但不能孤立的看待该指标,应结合上述其他指标。PEG修饰后的药物,其半衰期会随着PEG相对分子质量的增大而延长,这可能是导致mPEG2K-PME在体外活性低于PME,而动物水平其治疗效果强于PME的原因。
综上,多粘菌素E经PEG修饰后能增强对大肠杆菌引发的急性腹腔感染的治疗效果,同时能降低对肾组织的损伤,具有广泛应用前景。但目前该研究还不够完善,PEG相对分子质量的选择、药动学、组织分布以及毒理学等方面均有待进一步研究。
| [1] | Evans ME, Feola DJ, Rapp RP. Polymyxin B sulfate and colistin: old antibiotics for emerging multiresistant gram- negative bacteria [J]. Ann Pharmacother, 1999, 33: 960-967. |
| [2] | Li J, Nation RL, Turnidge JD, et al. Colistin: the re- emerging antibiotic for multidrug-resistant gram-negative bacterial infections [J]. Lancet Infect, 2006, 6: 589-601. |
| [3] | Yamaoka T, Tabata Y, Ikada Y. Distribution and tissue uptake of polyethylene glycol with different molecular weights after intravenous administration to mice [J]. Pharm Sci, 1994, 83: 601-606. |
| [4] | Bailon P, Berthold W. Polyethylene glycol-conjugated pharmaceutical proteins [J]. Pharm Sci Technol Today, 1998, 1: 352-356. |
| [5] | Harris JM, Chess RB. Effect of pegylation on pharmaceuticals [J]. Nat Rev Drug Discov, 2003, 2: 214-221. |
| [6] | Zalipsky S, Brandeis E, Newman MS, et al. Long circulating, cationic liposomes containing amino-PEG-phosphatidylethanolamine [J]. FEBS Lett, 1994, 353: 71-74. |
| [7] | Zalipsky S. Synthesis of an end-group functionalized polyethylene glycol-lipid conjugate for preparation of polymer- grafted liposomes [J]. Bioconjug Chem, 1993, 4: 296-299. |
| [8] | Miron T, Wilchek M. A simplified method for the preparation of succinimidyl carbonate polyethylene glycol for coupling to proteins [J]. Bioconjug Chem, 1993, 4: 568-569. |
| [9] | Owen RJ, Li J, Nation RL, et al. In vitro pharmacodynamics of colistin against Acinetobacter baumannii clinical isolates [J]. Antimicrob Chemother, 2007, 59: 473-477. |
| [10] | Bergen PJ, Bulitta JB, Forrest A, et al. Pharmacokinetic/ pharmacodynamic investigation of colistin against pseudomonas aeruginosa using an in vitro model [J]. Antimicrob Agents Chemother, 2010, 54: 3783-3789. |
| [11] | Walkty A, DeCorby M, Nichol K, et al. In vitro activity of colistin (polymyxin e) against 3 480 isolates of gram-negative bacilli obtained from patients in Canadian hospitals in the CANWARD Study, 2007-2008 [J]. Antimicrob Agents Chemother, 2009, 53: 4924-4926. |
| [12] | Ferguson EL, Azzopardi E, Roberts JL, et al. Dextrin- colistin conjugates as a model bioresponsive treatment for multidrug resistant bacterial infections [J]. Mol Pharm, 2014, 11: 4437-4447. |
| [13] | Li SA, Lee WH, Zhang Y. Efficacy of OH-CATH30 and its analogs against drug-resistant bacteria in vitro and in mouse models [J]. Antimicrob Agents Chemother, 2012, 56: 3309- 3317. |
| [14] | Malaviya R, Abraham SN. Role of mast cell leukotrienes in neutrophil recruitment and bacterial clearance in infectious peritonitis [J]. Leukocyte Biol, 2000, 67: 841-846. |
| [15] | Ekwo E, Peter G. Effect of clindamycin on aminoglycoside activity in a murine model of invasive Escherichia coli infection [J]. Antimicrob Agents Chemother, 1976, 10: 893-898. |
| [16] | Yousef JM, Chen G, Hill PA, et al. Melatonin attenuates colistin-induced nephrotoxicity in rats [J]. Antimicrob Agents Chemother, 2011, 55: 4044-4049. |
| [17] | Dai C, Li J, Tang S, et al. Colistin-induced nephrotoxicity in mice involves the mitochondrial, death receptor, and endoplasmic reticulum pathways [J]. Antimicrob Agents Chemother, 2014, 58: 4075-4085. |
| [18] | Xie L, Cullen C, Bradshaw S, et al. Biological characterization of pegylated interferons:a case study [J]. Methods Mol Boil, 2005, 308: 319-335. |
 2015, Vol. 50
2015, Vol. 50



