款冬花,又称冬花,为菊科款冬属植物款冬 (Tussilago farfara L.) 的干燥花蕾,即花序芽。款冬 花始载于《神农本草经》,列为中品[1]。款冬花为常用中药,具有润肺下气、止咳化痰的功效,中医临床上主要用于新久咳嗽、喘咳痰多、劳嗽咳血等症[2]。除具有止咳化痰作用外,现代研究发现款冬花提取物还有抗氧化、抗菌、α-葡萄糖苷酶抑制、神经保护等作用[3,4]。近年来大量化学研究显示款冬花含有三萜皂苷、倍半萜、黄酮、生物碱、色原酮、绿原酸、挥发油等化学成分[5]。
款冬植物主要分布于河北、山西、内蒙古、陕西等省,商品的款冬花药材来源包括野生和栽培品两种,通过对药材市场的调查,发现栽培品款冬花目前主要产于甘肃的漳县、陇西、渭源,河北蔚县以及内蒙古通辽等地; 而野生品主要分布于山西北部、甘肃等地。近年来由于款冬花药材价格上涨,野生品被大面积采挖导致野生资源枯竭,因此,目前商品药材主要来源于栽培品。
针对栽培品和野生品存在的质量差异,已有研究以槲皮素[6]、芦丁[7]、总多糖[8]、微量元素[9]等指标对款冬花的栽培品和野生品进行了比较,结果显示两者存在一定差异。然而,款冬花化学成分非常复杂,有限的指标成分和大类成分无法全面表征款冬花野生品和栽培品的化学差异。植物代谢组学技术可对植物提取物中代谢组进行无差别代谢成分全分析的高通量分析,近年来已经成功的用于多种中药的质量分析,如黄芪[10,11]、款冬花[12]、厚朴[13]、人参[14]、地黄[15]、远志[16]等。它不仅可以反映不同样品之间的相似性,而且可以确定不同样本的差异性,为中药质量控制提供了一种有别于指纹图谱的整体性分析方法。本研究收集了21份不同产地款冬花药材,拟采用基于NMR的代谢组学技术对栽培和野生的款冬花药材进行整体化学比较。
材料与方法 仪器与材料Bruker 600-MHz AVANCE III NMR Spectrometer (600.13 MHz质子频率,德国布鲁克公司600兆核磁仪); 重水 (Norell,Landisville,美国),氘代甲醇、氘代氯仿 (99.8%,德国Merck公司),氘代氢氧化钠 (Armar,瑞士),3-三甲基硅基 [2,2,3,3-d4] 氘代丙酸钠 (TSP,Cambridge Isotope Laboratories Inc.,MA)。款冬花药材来自内蒙古、河北、山西、甘肃、青海和河南6个省共21份 (表 1),经山西大学秦雪梅教授鉴定为菊科款冬属植物款冬 (Tussilago farfara L.) 的干燥花蕾。标本保存在山西大学中医药现代研究中心。
|
|
Table 1 Farfarae Flos samples from different regions and the content of senkirkine. Samples baked with honey; aWild samples; bCultivated samples. n = 3,x± s |
样品制备方法参照本课题组之前报道的方法进行[17]。精密称取款冬花样品粉末200 mg,分别加蒸馏水及甲醇1.5 mL、氯仿3 mL,涡旋混匀后超声提取25 min,以室温离心 (3 500 r·min-1),提取液分为两层 (上层为水溶性部分即甲醇水相,下层为有机部分即氯仿相),分别减压浓缩蒸干。于测定前用NMR试剂溶解,其中氯仿相部分用CDCl3 800 μL溶解,甲醇水相部分用氘代甲醇400 μL与缓冲重水 (KH2PO4溶于D2O中,以1 mol·L-1氘代氢氧化钠溶液调至pH 6.0,含0.05% TSP) 400 μL溶解 ,以13 000 r·min-1转速离心10 min,移取上清液600 μL于5 mm核磁管中。
1H NMR测定样品在25 ℃下于600 MHz NMR仪上测定,测定频率为600.13 MHz,扫描次数为64,谱宽12 345.679 Hz,傅里叶变换0.188 Hz,脉冲间隔D1为1 s,延迟时间为5.0 s,手动进行相位、基线调节及峰校正。含水甲醇提取物核磁测定采用noesyppr 1D序列压制水峰,用氘代甲醇进行锁场,内标为TSP。氯仿相提取物核磁测定采用zg30序列,用氘代氯仿锁场,内标为TMS。
数据分析核磁图谱采用MestReNova (version 8.0.1,西班牙Mestrelab Research公司) 进行处理。以δ 0.04积分段对化学位移区间δ 0.54~10.02进行分 段积分。甲醇水相核磁图谱中δ 4.70~5.02 (残余水 峰) 和δ 3.30~3.38 (残余甲醇峰) 不进行积分,氯仿相核磁图谱中δ 7.22~7.30 (残余氯仿峰) 不进行积分。积分数据进行面积归一化后,采用SIMCA-P 13.0 (瑞典Umetrics,umea) 软件进行主成分分析 (principal component analysis,PCA) 和偏最小二乘法判别分析 (partial least squares discriminant analysis,PLS-DA) 找出差异代谢产物。再将该积分数据作为X变量,肾形千里光碱含量作为Y变量,进行偏最小二乘法分析 (partial least squares analysis,PLS),通过PLS loading plot找出与生物碱含量相关的代谢产物。最后,将不同产地款冬花中生物碱含量导入SPSS 16.0中做散点图,同时对生物碱含量与代谢产物做Pearson相关分析,以期找出生物碱含量与次级代谢产物之间的相关性。
肾形千里光碱含量测定供试品制备方法及色谱分析方法均参照本课题组之前报道[18]的方法进行。
结果 1 水相的多元统计分析水相提取物的主成分分析 (PC1: 43.7%,PC2: 33.0%) 显示,21批样品可大致分为3类: 1~7号样本位于PC1的负半轴,分布较离散; 15和16号样本位于散点图的右下部,其余样本位于PC1的正半轴。通过分析样本药材来源信息发现,1~7号为野生样本,15和16号为蜜制样本,其余为栽培 样本,可见栽培品与野生品存在较大差异,蜜制样本与生品也有较大差异。
采用偏最小二乘判别分析方法 (PLS-DA) 确定野生和栽培品的化学差异。PLS-DA (R2X: 47.1%,R2Y: 95.0%,Q2: 78.9%) 的使用必须以模型通过验证为基础,排列实验结果显示左端任何一次随机排列产生的R2、Q2均小于右端,表明原始模型的预测能力大于任何一次随机排列Y变量的预测能力,说明模型有效。PLS-DA分析可见,栽培品与野生品的差异主要体现在PC1轴,因此通过PC1轴的载荷图确定两者差异。柱状载荷图中的正信号对应的化合物在野生品中含量较高,负信号对应的化合物在栽培品中含量较高。与栽培品比较,野生品中乙酸、脯氨酸、谷氨酸、柠檬酸、葡萄糖、咖啡酸、绿原酸、芦丁等化合物含量较高; 缬氨酸、苏氨酸、苹果酸、天冬氨酸、胆碱、蔗糖等化合物含量较低。
2 有机相的多元统计分析有机相提取物的PCA (PC1: 39.2%,PC2: 23.9%) 和PLS-DA(R2X: 68.2%,R2Y: 72.8%,Q2: 54.4%) 分析显示,21批款冬花药材中,野生品与栽培品可以区分开。有机相提取物的分类结果与水相一致,即野生品和栽培品存在一定差异,而蜜制品与生品有较大差异。通过相应的PLS-DA分析确定野生品中甲基丁酸-3,14-Z-去氢款冬素酯 (EMDNT)、款冬酮、款冬巴耳二醇、β-谷甾醇、谷甾酮含量较高,而栽培品中脂肪酸类化合物含量较高。
3 肾形千里光碱含量测定肾形千里光碱为款冬花中具有肝毒性的吡咯里西啶生物碱,因其含量较低,在NMR谱 (图 1) 中难以检测到,因此采用HPLC对其进行含量测定。21份不同款冬花样品的肾形千里光碱含量测定结果见表 1。结果可见肾形千里光碱在野生品中分布较均匀,而在栽培品种中随产地的不同而差异较大。本研究中的栽培品来源于河北、甘肃、河南等多个产地,说明肾形千里光碱的含量随种植地的不同变化较大。由于栽培品是目前商品款冬花药材的主要来源,因此在款冬花种植的产地适宜性考察中应考虑毒性成分的含量。此外,两份蜜制品中肾形千里光碱的含量也较低,是否蜜制可以降低肾形千里光碱的含量值得进一步考察。
 |
Figure 1 1H NMR spectra of aqueous extracts (A) and organic extracts (B) of Farfarae Flos. 1: Isoleucine; 2: Leucine; 3: Valine; 4: 1-O-ethyl-β-D-glucoside; 5: Threonine; 6: Alanine; 7: Acetic acid; 8: Proline; 9: Glutamine; 10: Succinic acid; 11: Marlic acid; 12: Citrate; 13: Aspartate; 14: Ethanolamine; 15: Choline; 16: Phosphatidylcholine; 17: Creatine; 18: β-Glucose; 19: α-Glucose; 20: Sucrose; 21: Maleic acid; 22: Fumaric acid; 23: 4,5-O-dicaffeoylquinic acid; 24: Caffeic acid; 25: Chlorogenic acid; 26: Sinapic acid; 27: 3,5-O-dicaffeoylquinic acid; 28: 3,4- O-dicaffeoylquinic acid; 29: Rutin; 30: Kampferol analogue; 31: p-Hydroxybenzoic acid; 32: Adenine; 33: Adenosine; 34: Formic acid; 35: 7-(3'-ethylcrotonoyloxy)-1α-(2'-methyl-butyryloxy)-3,14- dehydro-Z-notonipetranone (EMDNT); 36: Tussilagone; 37: Bauer-7-ene-3β,16α-diol; 38: β-Sitosterol; 39: Sitosterone; 40: Fatty acid |
为了分析款冬花中毒性成分和其他代谢产物的相关性,以核磁代谢图谱积分区段为自变量X,以肾形千里光碱含量为因变量Y,进行偏最小二乘法 (PLS) 分析,分别得到有机相和水相的载荷图。在载荷图中,距离Y变量近的X变量与其相关性较大。由图 2可见,肾形千里光碱与水相提取物中的马来酸、富马酸、3,5-二咖啡酰基奎尼酸、3,4-二咖啡酰基奎尼酸、4,5-二咖啡酰基奎尼酸、芦丁、山柰酚类似物,以及有机相提取物中的β-谷甾醇、谷甾酮具有正相关,而与柠檬酸、丁二酸、乙醇胺、脂肪酸等成分负相关。然后分别计算核磁图谱中13个次级代谢产物与肾形千里光碱含量的Pearson相关系数 (表 2)。可见,肾形千里光碱与3,5-二咖啡酰基奎尼酸、3,4-二咖啡酰基奎尼酸、4,5-二咖啡酰基奎尼酸、芦丁、山柰酚类似物、β-谷甾醇等成分存在正相关,且其相关性具有统计学意义 (图 3)。
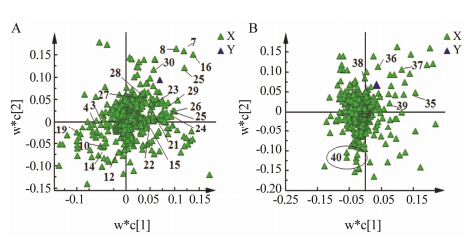 |
Figure 2 PLS loading plots of NMR data from aqueous extracts (A) and chloroform extracts (B) of Farfarae Flos. Y variables are the content of senkirkine. The numbers here have the same meaning in Figure 1 |
|
|
Table 2 The correlation between the secondary compounds and senkirkine of Farfarae Flos. Correlation is significant at the 0.05 level (2-tailed). **Correlation is significant at the 0.01 level (2-tailed) |
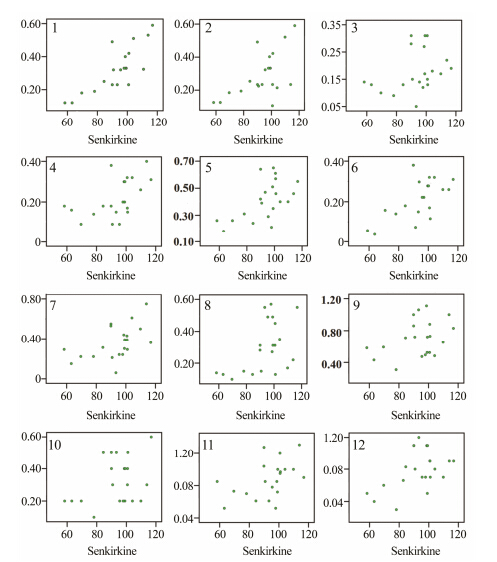 |
Figure 3 Scatter plots of correlation coefficient between the secondary compounds and senkirkine of Farfarae Flos. 1: β- Sitosterol; 2: 3,4-O-dicaffeoylquinic acid; 3: Sinapic acid; 4: Rutin; 5: 3,5-O-dicaffeoylquinic acid; 6: Caffeic acid; 7: Kampferol analogues; 8: 4,5-O-dicaffeoylquinic acid; 9: Tussilagone; 10: Sitosterone; 11: Chlorogenic acid; 12: EMDNT |
本研究采用代谢组学技术结合HPLC含量测定对21份款冬花药材进行了质量比较,结果显示不同来源款冬花药材存在显著化学差异,野生品中芦丁、绿原酸等次级代谢产物含量高于栽培品,这与传统经验认为的野生品质量较优一致。此外,肝毒性吡咯里西啶生物碱senkirkine的含量在不同来源款冬花药材中也存在较大差异,但在野生品中含量分布较均一。款冬花是中医临床和中药工业的常用药材,但由于生长环境、采集加工方式等导致的不同来源药材之间的化学差异性客观存在。药材所含的化学成分是中药发挥药效的物质基础,这种化学差异性为临床用药的安全有效带来一定隐患。因此,后续的工作应对款冬花药材的化学差异性评价开展系统研究。
相关性分析结果显示3,5-二咖啡酰基奎尼酸、3,4-二咖啡酰基奎尼酸、4,5-二咖啡酰基奎尼酸、芦丁、山柰酚类似物、β-谷甾醇等次级代谢产物含量与肝毒性吡咯里西叮生物碱senkerkine的含量存在一定正相关。本课题组前期研究提示,款冬花止咳化痰活性与芦丁、3,5-二咖啡酰基奎尼酸等成分密切相关[19],而这些成分与senkerkine的含量存在正相关,说明款冬花中毒性成分和活性成分存在一定相关性。另有文献[20]报道senkirkine对豚鼠离体器官条痉挛具有一定的抑制作用,该生物碱除具有肝脏毒性外,亦能松弛器官平滑肌,具有解痉作用,即可能也是款冬花镇咳平喘的功效相关成分。下一步本课题组将对款冬花肝毒性生物碱与活性成分和款冬花传统功效的相关性进行深入研究。
3,5-二咖啡酰奎尼酸、咖啡酸等苯丙素类和芦丁、山柰酚类似物等黄酮类物质具有共同的生物合成前体苯丙氨酸,并受到苯丙氨酸解氨酶和肉桂酸4-羟化酶的催化[21]。吡咯里西啶生物碱 (PAs) 在结构上由双稠吡咯环 (次碱) 和植物中的有机酸 (次酸) 酯化形成。次碱由鸟氨酸脱羧后在高精脒合成酶及联氨氧化酶的催化下形成,而次酸是由支链氨基酸,如异亮氨酸,氧化脱羧形成[22, 23, 24]。下一步将采用高通量测序及转录组技术对款冬花药材中活性和毒性成分的生物合成进行研究,进一步揭示毒性和活性成分在生物合成途径中的相关性。
| [1] | Xiao PG. Modern Chinese Material Medica (新编中药志) [M]. Beijing: Chemical Industry Press, 2003: 802-806. |
| [2] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People' Republic of China (中华人民共和国药典) [S]. 2010 ed. Beijing: China Medical Science Press, 2011. |
| [3] | Gao H, Huang YN, Gao B, et al. α-Glucosidase inhibitory effect by the flower buds of Tussilago farfara L. [J]. Food Chem, 2008, 106: 1195-1201. |
| [4] | Park HR, Yoo MY, Seo JH, et al. Sesquiterpenoids isolated from the flower buds of Tussilago farfara L. inhibit diacylglycerol acyltransferase [J]. J Agric Food Chem, 2008, 56: 10493-10497. |
| [5] | Liu YF, Yang XW. HPLC fingerprint of chemical constituents of Flos Farfarae [J]. Acta Pharm Sin (药学学报), 2009,44: 510-514. |
| [6] | Guo M, Gao HQ, Yu XH, et al. Comparative study on quality of the wild and cultivated Tussilago fafara L. of Gansu province [J]. J Chin Med Mater (中药材), 2001, 24: 787-788. |
| [7] | Lu PL, Lan Y, Hou J, et al. Comparative study on quality of Tussilago fafara L. from different areas of Gansu province [J]. China Pharm (中国药师), 2008, 11: 1307-1308. |
| [8] | Lv PL, Jin L, Zheng MX. Determination of polysaccharide of Farfarae Flos from different regions [J]. Mod J Integr Tradit Chin Western Med (现代中西医结合杂志), 2009, 18: 1758- 1759. |
| [9] | Lv PL, Li S, Li CY, et al. Determination of trace elements content of Farfarae Flos from different regions [J]. China Pharm (中国药业), 2010, 19: 26-27. |
| [10] | Tian D, Li ZY, Fan SC, et al. NMR-based analysis of water soluble extracts of different Astragali Radix [J]. Acta Pharm Sin (药学学报), 2014, 49: 89-94. |
| [11] | He P, Li ZY, Fan SC, et al. Differences between Hengshanhuangqi and Chuanhuangqi based and metabolomics and ITS2 sequences [J]. Acta Pharm Sin (药学学报), 2013, 48: 1595- 1601. |
| [12] | Mi X, Li ZY, Qin XM. Monitoring of chemical components with different color traits of Tussilago farfara using NMR- based metabolomics [J]. Acta Pharm Sin (药学学报), 2013, 48: 1692-1697. |
| [13] | Jiang Y, Vaysse J, Gilard V, et al. Quality assessment of commercial Magnoliae officinalis Cortex by 1H NMR-based metabolomics and HPLC methods [J]. Phytochem Anal, 2012, 23: 387-395. |
| [14] | Yang SO, Shin YS, Hyun SH, et al. NMR-based metabolic profiling and differentiation of ginseng roots according to cultivation ages [J]. J Pharm Biomed Anal, 2012, 58: 19-26. |
| [15] | Chang WT, Chio YH, Hhijden RV, et al. Traditional processing strongly affects metabolite composition by hydrolysis in Rehmannia glutinosa roots [J]. Pharm Soc Japan, 2011, 59: 546-552. |
| [16] | Wang XJ, Li ZY, Xue SY, et al. Quality control over different processed products of Polygalae Radix based on plant metabolomics [J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 1727-1737. |
| [17] | Zhi HJ, Qin XM, Sun HF, et al. Metabolic fingerprinting of Tussilago farfara L. using 1H NMR spectroscopy and multivariate data analysis [J]. Phytochem Anal, 2012, 23: 492-501. |
| [18] | Zhang LZ, Mi X, Xue SY, et al. Comparative analysis on the metabolic compositions of flower bud and rachis of Tussilago farfara based on GC-MS fingerprinting approach [J]. Bull Bot Res (植物研究), 2014, 34: 258-265. |
| [19] | Li ZY, Zhi HJ, Zhang FS, et al. Metabolomic profiling of the antitussive and expectorant plant Tussilago farfara L. by nuclear magnetic resonance spectroscopy and multivariate data analysis [J]. J Pharm Biomed Anal, 2013,75: 158-164. |
| [20] | Wu D, Zhang M, Zhang CF. Flavonoids and phenolic acid derivatives from Flos Farfarae [J]. China J Chin Mater Med (中国中药杂志), 2010, 35: 1142-1144. |
| [21] | Liu XF. Molecular Cloning and Transformation of Genes Involved in the Biosynthetic Pathways of Flavonmis of Ginkgo biliba L. (银杏黄酮相关基因的克隆及转化) [D]. Shanghai: Fudan University, 2006. |
| [22] | Robins DJ. Biosynthesis of pyrrolizidine alkaloids [J]. Chem Soc Rev, 1989, 18: 375-408. |
| [23] | Freer KA, Matheson JR, Robins DJ. Senecio spp: Biochemistry of the formation of pyrrolizidine alkaloids in root cultures [J]. Experientia, 1991, 47: 1118-1122. |
| [24] | Spenser ID. Stereochemical aspects of the biosynthetic routes leading to the pyrrolizidine and the quinolizidine alkaloids [J]. Pure Appl Chem, 1985, 57: 453-470. |
 2015, Vol. 50
2015, Vol. 50


