肿瘤坏死因子相关凋亡诱导配体 (tumor necrosis factor-related apoptosis-inducing ligand, TRAIL) 属于肿瘤坏死因子 (tumor necrosis factor, TNF) 家族成员, 又称为凋亡素2 (Apo2 ligand, Apo2L), 是机体自身合成的一种细胞因子。TRAIL蛋白表达于少数淋巴细胞表面, 也以可溶的游离形式存在, 其生理功能主要是调节机体的免疫反应, 参与免疫监视以及抑制肿瘤发生、转移[1]。通过与死亡受体 (death receptor 4/5, DR4/DR5) 相互作用, TRAIL能够选择性地诱导多种肿瘤细胞凋亡。整合素在细胞识别、迁移、分化等过程中发挥重要作用, RGD肽 (精氨酸-甘氨酸-天冬氨酸) 是整合素与其配体蛋白相互识别的位点。RGD肽能够特异结合整合素αvβ3和αvβ5, 肿瘤新生血管和一些肿瘤细胞表面高表达αvβ3和αvβ5, 可将药物靶向运输到肿瘤组织, 且研究表明RGD肽能够直接活化caspase-3, 引起细胞凋亡[2]。多靶点药物是抗肿瘤药物研究的热点, 构建和表达RGD与TRAIL组成的融合蛋白, 具有靶向整合素和死亡受体的双特异性,对某些肿瘤细胞的杀伤作用强于TRAIL, 而TRAIL蛋白正处于临床试验Ⅱ期, 因而RGD-TRAIL融合蛋白具有很好的开发前景。
蛋白质类药物主要利用基因工程技术进行生产, 表达系统的选择对重组蛋白尤为重要, 主要有原核的大肠杆菌表达系统和真核的酵母表达系统、昆虫或动物细胞表达系统等。大肠杆菌表达系统应用最为广泛, 具有操作简单、成本低、繁殖快和表达量高等优点, 但是缺乏完善的翻译后加工修饰体系, 部分蛋白以包涵体形式表达, 导致纯化困难, 表达产物生物活性低。哺乳动物细胞表达系统表达的蛋白质接近天然状态, 但操作复杂、表达量低。酵母表达系统既具有操作简单、生长速度快等优点, 同时具有对表达产物加工修饰能力。同种目的蛋白由大肠杆菌和毕赤酵母表达其活性往往不同, 例如β-1,4-endoglucanase在大肠杆菌中表达其活性较强, 原因可能为该酶被毕赤酵母糖基化后更不稳定易被降解[3]; 毕赤酵母表达的11β-HSD 1 [4]、P. abyssi AP[5]和PDC1[6]活性较强。尽管RGD与TRAIL的重组蛋白已有文献[7, 8]报道, 但都是采用原核生物作为表达体系。因此, 本文将采用毕赤酵母表达RGD-TRAIL蛋白并研究这种真核表达蛋白的生物学活性。
材料与方法 质粒、菌株和细胞株表达质粒pET-30a、pHBM与毕赤酵母GS115, 人胚肾细胞HEK293, 人胰腺癌细胞MIA PaCa-2、BxPC-3, 人纤维肉瘤细胞株HT1080、人肺癌细胞株A549、H460均由本实验室保存; 菌株Transetta (DE3) (北京全式金公司)。
试剂限制性内切酶NdeⅠ、XhoⅠ、SnaBⅠ、NotⅠ、SalⅠ、T4 DNA Ligase (New England Biolabs公司); 质粒小提试剂盒、DNA凝胶回收试剂盒 (Omega公司); DH5α感受态 (GeneStar公司); Histrap预装柱 (GE公司); 十二烷基磺酸钠 (SDS)、咪唑 (Sigma公司); 精氨酸、异丙基硫代半乳糖甘 (IPTG, Merck公司); 超滤离心管和PVDF膜 (Millipore公司); 脱脂奶粉 (BD公司); anti-His·tag小鼠单抗 (Abmart公司); PARP、caspase-3兔多抗 (Cell Signaling Technology公司); DR4小鼠单抗 (Diaclone公司); DR5兔多抗 (ProSci公司); β-actin小鼠单抗、HRP标记羊抗小鼠IgG、HRP标记羊抗兔IgG (中杉金桥公司); BCATM Protein Assay Kit (Pierce公司); 显影液 (Millipore公司); 改良型RPMI-1640培养液 (Hyclone公司); 胎牛血清 (FBS, Gibco公司); 其他试剂均为市售分析纯。
RGD-TRAIL基因的构建融合蛋白的RGD序列采用一个RGD-4C (ACDCRGDCFC), TRAIL序列为完整TRAIL蛋白的114~281位氨基酸序列, RGD与TRAIL间通过一个GGGGS连接肽连接。RGD- TRAIL全序列由金斯瑞公司根据酵母表达系统优化并合成。根据RGD-TRAIL基因序列设计引物如下: P1 (SnaBⅠ), TCTGTACGTAGCTTGTGATTGTAGAGG AG; P2 (NotⅠ), ATAAGAATGCGGCCGCTTAGTG GTGGTGGTGGTGGTGACCAACCAAAAAGGC; P3 (NdeⅠ), GGGAATTCCATATGGCTTGTGATTGTAG; P4 (XhoⅠ), CCGCTCGAGACCAACCAAAAAGGC。以公司提供的pUC57-rgd-trail为模板, 分别以P1、P2和P3、P4为引物, 进行PCR扩增。P1、P2扩增产物经过SnaBⅠ和NotⅠ双酶切连接至pHBM; P3、P4扩增产物经过NdeⅠ和XhoⅠ双酶切连接至pET30a。将两种重组质粒分别转化DH5α感受态, 分别对多个克隆进行菌体PCR鉴定, 提取质粒进行双酶切验证, 并进行测序。
表达菌株的构建与筛选pHBM-rgd-trail表达载体经SalⅠ酶切线性化, 电转化毕赤酵母GS115感受态细胞, 涂布MD平板; 菌体PCR鉴定, 接种阳性单克隆进行诱导表达48 h, 上清液采用SDS-PAGE检测目的蛋白的表达情况。pET30-rgd-trail转化Transetta (DE3) 感受态细胞, 菌体PCR筛选阳性克隆, IPTG诱导后SDS-PAGE检测目的蛋白的表达情况。
重组蛋白RGD-TRAIL的分离纯化采用0.45 μm滤膜过滤发酵液上清, 加入1/4体积的5×结合缓冲液 (100 mmol·L-1磷酸缓冲液、2.5 mol·L-1 NaCl、100 mmol·L-1咪唑, pH 7.4) 混匀后经用1×结合缓冲液 (20 mmol·L-1磷酸缓冲液、0.5 mol·L-1 NaCl、20 mmol·L-1咪唑, pH 7.4) 平衡后的Histrap预装柱, 依次用10倍体积的洗脱液Ⅰ (即1×结合缓冲液) 和6~10倍体积的洗脱液Ⅱ (40 mmol·L-1咪唑) 进行洗脱, 最后用10倍体积的溶解液I (250 mmol·L-1咪唑) 溶解, 用超滤管进行浓缩并用PBS进行缓冲液的置换, 纯化后的蛋白进行SDS-PAGE及Western Blotting分析。大肠杆菌表达的RGD-TRAIL以包涵体形式存在, 按照文献[9]方法分离纯化, 为了进行区分, 各溶液名称如下: 洗脱液A (8 mol·L-1尿素, 20 mmol·L-1 Tris- HCl, 0.1 mol·L-1 NaCl, 20 mmol·L-1咪唑, pH 7.4), 洗脱液B (8 mol·L-1尿素, 20 mmol·L-1 Tris-HCl, 0.1 mol·L-1 NaCl, 40 mmol·L-1咪唑, pH 7.4), 溶解液A (8 mol·L-1尿素, 20 mmol·L-1 Tris-HCl, 0.1 mol·L-1 NaCl, 250 mmol·L-1咪唑, pH 7.4)。将纯化后的蛋白 进行SDS-PAGE及Western Blotting分析。
MTT法测定RGD-TRAIL对细胞增殖的影响对数生长期的肿瘤细胞以细胞数3 000个/孔接种96孔板, 每孔100 μL, 37 ℃培养24 h后按倍比稀释加入RGD-TRAIL, 每个重组蛋白浓度设3个平行孔, 同时设对照组和空白组, 37 ℃继续培养48 h。每孔加入5 mg·mL-1 MTT 20 μL, 37 ℃继续培养4 h。小心吸尽孔内的液体, 每孔加入DMSO 150 μL, 置摇床上室温低速震荡10 min溶解结晶。用酶标仪在570 nm 处测定每个孔的吸光度值 (A)。按公式计算细胞的存活率: 存活率= (AT - AB) / (AC - AB) × 100%, 其中AB、AC和AT分别代表空白组、对照组和重组蛋白组的平均吸光值。
ELISA法测定RGD-TRAIL与肿瘤细胞的亲和力肿瘤细胞以细胞数1×104个/孔接种于96孔板, 37 ℃培养24 h, 用0.05% 戊二醛固定细胞, 1% BSA/ PBS溶液进行封闭, 每孔加入倍比稀释的重组蛋白RGD-TRAIL 50 μL, 每个浓度设3个平行孔, 37 ℃孵育2 h, PBST润洗3次后, 每孔加入一抗anti-His·tag小鼠单抗50 μL (1∶2 000稀释), 37 ℃孵育2 h, PBST润洗3次后, 每孔加入HRP标记的羊抗鼠IgG抗体50 μL (1∶2 500稀释), 37 ℃孵育2 h, PBST润洗5次后, 每孔加入HRP底物100 μL, 室温避光反应10 min。每孔加入2 mol·L-1 H2SO4 100 μL终止反应。酶标仪测定450 nm处的吸光度值, 扣除对照值后, 以吸光度值为纵坐标, RGD-TRAIL浓度为横坐标作剂量反应曲线。
划痕法检测RGD-TRAIL对A549、HT1080迁移的影响收集细胞, 以细胞数1×105个/孔接种24孔板, 每孔1 mL, 37 ℃培养24 h。用200 μL枪头在每个孔中划痕, PBS润洗3次, 在倒置显微镜下记录痕宽。加入相应浓度的RGD-TRAIL作用一定时间后, 再于原位拍照。
Transwell检测RGD-TRAIL对A549、HT1080迁移的影响Transwell小室用无血清1640培养液 于37 ℃平衡1 h。A549、HT1080细胞分别以细胞数80×104个/mL、50×104个/mL悬于无血清1640培养液中, 取细胞悬液90 μL、RGD-TRAIL 10 μL加入小室, 外室分别加入含20% 和10% FBS及相应浓度RGD-TRAIL的1640培养液0.6 mL, 37 ℃培养24 h, 弃掉小室内的培养液, 用预冷的甲醇固定10 min, 0.1% 结晶紫染色液室温染色10 min, 用棉签擦拭小室上层未迁移的细胞, 镜下拍照, 并将滤膜剪下于96孔板中, 用33% 醋酸溶解结晶紫, 酶标仪测定A570。
Hoechst 33342荧光染色检测细胞凋亡将处于对数生长期的H460、A549和HT1080细胞接种于24孔板中, 37 ℃培养24 h使肿瘤细胞贴壁, 加入RGD- TRAIL后继续培养24 h, PBS润洗3次, 用0.05% 戊二醛固定30 min后, 再用PBS润洗3次, 每孔加入Hoechst 33342染液200 μL, 室温染色10 min, PBS润洗3次, 荧光显微镜下观察染色质凝集并照相。
Western blotting分析凋亡相关蛋白的表达对数生长期的H460、A549和HT1080细胞接种于6孔板, 细胞贴壁后, 用RGD-TRAIL处理24 h, 将细胞刮下, PBS洗涤1次, 加入适量RIPA裂解液, 4 ℃裂解10 min, 12 000 r·min-1、4 ℃离心15 min, 收集上清液。BCA法测定蛋白浓度, 取40 μg进行SDS-PAGE电泳并转至PVDF膜上, 5% 脱脂牛奶封闭, 随后进行相关抗体孵育, 凝胶成像系统拍照。
统计学分析所有实验数据采用均数 ± 标准差 (x± s) 表示, 使用SPSS 19.0软件作Probit分析计算IC50值, t检验分析组间差异显著性。
结果 1 RGD-TRAIL基因构建RGD-TRAIL蛋白表达基因由金斯瑞公司根据毕赤酵母表达体系优化合成, 其中RGD肽序列为ACDCRGDCFC, TRAIL采用其114~281氨基酸序 列, RGD肽与TRAIL序列之间经过GGGGS连接肽连接。以该公司提供的pUC57-rgd-trail质粒为模板, 分别以P1、P2为引物和以P3、P4为引物进行PCR扩增, 扩增产物经酶切分别连接到pHBM、pET30a载体上, 转化DH5α感受态。挑选单克隆培养, 提取质粒, 分别进行SnaBⅠ、NotⅠ和NdeⅠ、XhoⅠ酶切鉴定, 酶切图谱显示两种重组质粒中均含有587 bp大小的RGD-TRAIL基因片段, 结果见图 1。阳性克隆进行DNA测序, 选择序列正确的菌株。
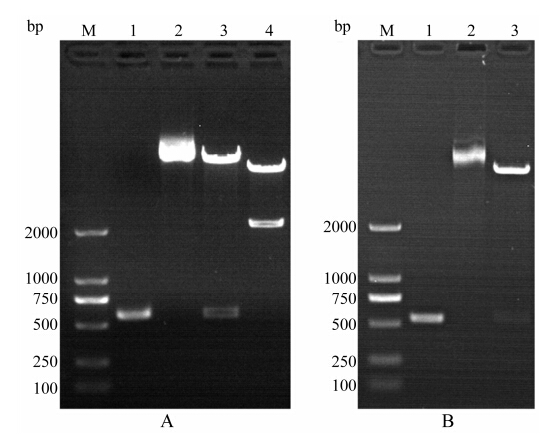 |
Figure 1 Restriction enzyme analysis of recombinant plasmid pHBM-rgd-trail (A) and pET30-rgd-trail (B). M: Marker; (A) 1: PCR product of RGD-TRAIL for construction of pHBM-rgd-trail; 2: Recombinant plasmid pHBM-rgd-trail; 3: pHBM-rgd-trail digested with SnaBⅠ and NotⅠ; 4: pHBM-rgd-trail digested with SalⅠ. (B) 1: PCR product of RGD-TRAIL for construction of pET30-rgd-trail; 2: Recombinant plasmid pET30-rgd-trail; 3: pET30-rgd-trail digested with NdeⅠ and XhoⅠ |
pHBM-rgd-trail质粒用SalⅠ酶切, 胶回收分子量大的线性化片段, 电转化GS115感受态细胞, 涂布MD平板; 重组质粒pET30-rgd-trail转化表达菌Transetta (DE3)。菌体PCR鉴定筛选阳性单克隆, 将阳性单克隆进行诱导表达。
毕赤酵母表达RGD-TRAIL的纯化: 诱导培养基诱导培养48 h后, 收集上清, 用Ni离子亲和层析柱分离纯化目的蛋白, 重组蛋白产量约1.2 mg·L-1, 酵母表达蛋白的纯化情况见图 2A。大肠杆菌表达RGD- TRAIL的纯化: 1 mmol·L-1 IPTG诱导4 h后, 收集菌体, 超声提取包涵体, 用含8 mol·L-1尿素缓冲液溶解, Ni离子亲和层析柱对重组蛋白进行纯化。纯化的重组蛋白经过透析复性, 产量约为1 mg·L-1, 细菌表达蛋白的纯化情况见图 2B。经Western blotting检测两种表达体系表达的重组蛋白RGD-TRAIL具有His-tag和TRAIL结构 (图 2)。
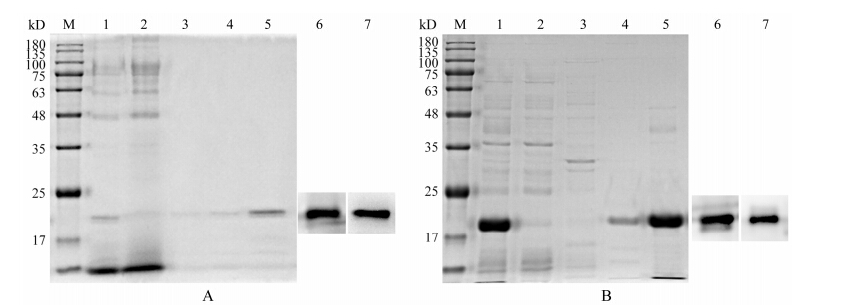 |
Figure 2 The purification of RGD-TRAIL protein in Pichia pastoris (A) and E.coli (B) by Ni2+ affinity chromatography. 1: Supernatant of GS115/pHBM-rgd-trail after induction (A), protein of inclusion bodies (B); 2: Proteins unbound with Ni2+ column; 3: Proteins washed with washing bufferⅠ (A), protein washed with washing buffer A (B); 4: Proteins washed with washing bufferⅡ (A), proteins washed with washing buffer B (B); 5: RGD-TRAIL protein eluted with elution bufferⅠ (A), RGD-TRAIL protein eluted with elution buffer A (B); 6: Western blotting by His-tag antibody; 7: Western blotting by TRAIL antibody |
据文献[10]报道, 非小细胞肺癌H460对TRAIL敏感, 因此本文利用MTT法测定不同表达系统表达的RGD-TRAIL对H460细胞增殖抑制作用 (图 3), 不同表达系统获得的融合蛋白均能剂量依赖性地抑制H460细胞增殖, 其中大肠杆菌表达的RGD-TRAIL对H460细胞的IC50值为0.768 μmol·L-1; 毕赤酵母 表达的RGD-TRAIL对H460细胞的IC50值为0.126 μmol·L-1, 活性明显强于大肠杆菌表达的融合蛋白, 两组比较有显著性差异 (P < 0.01)。
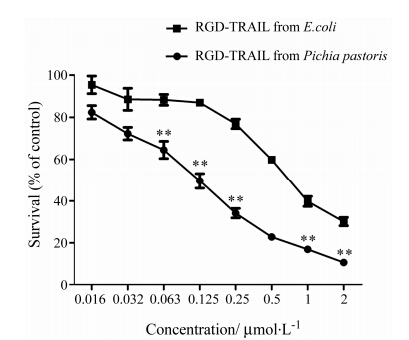 |
Figure 3 Effect of RGD-TRAIL from E.coli and Pichia pastoris on cell growth of H460 cells. Cells were treated with RGD- TRAIL for 48 h and cell viability was determined by MTT assay. n = 3, x± s. **P < 0.01 vs RGD-TRAIL from E.coli group |
采用Western blotting检测了6种对人可溶性TRAIL敏感性不同的肿瘤细胞表面DR4、DR5和αv表达情况, 其中DR4和DR5是TRAIL的受体、αv是RGD的受体 (图 4A)。H460、A549和HT1080三种肿瘤细胞均表达上述受体, αv的表达量在H460细胞中最高; DR4的表达量也以H460细胞最高, HT1080最低; DR5的表达量高低依次为H460、A549和HT1080。尽管这三株细胞表达的受体量不同, 但由于均表达以上三种受体, 因此选用这三种细胞进行后续实验。细胞ELISA检测毕赤酵母表达的重组蛋白与肿瘤细胞结合能力, 见图 4B。RGD-TRAIL对三种肿瘤细胞都呈现出较强的亲和活性, 由于针对不同细胞的ELISA实验的吸光值与细胞数相关, 因此只能说明融合蛋白与这些细胞具有亲和活性, 不能说明融合蛋白与不同细胞的亲和力强弱。
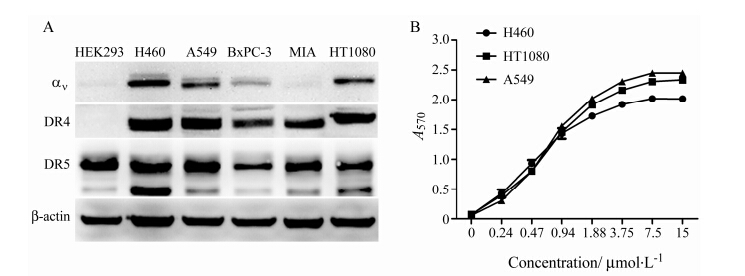 |
Figure 4 The binding affinity of RGD-TRAIL with different cancer cell lines. (A) Expression of αv, DR4 and DR5 on cancer cells; (B) The binding affinity of RGD-TRAIL purified from Pichia pastoris with H460, A549 and HT1080 cells analyzed by ELISA |
MTT法检测结果表明, 由毕赤酵母表达的RGD- TRAIL对肿瘤细胞A549和HT1080的增殖具有浓 度依赖性抑制作用, IC50值分别为0.966和3.208 μmol·L-1, 表明该融合蛋白对这两种肿瘤细胞增殖抑制作用显著, 且A549细胞对RGD-TRAIL较HT1080细胞敏感 (图 5)。
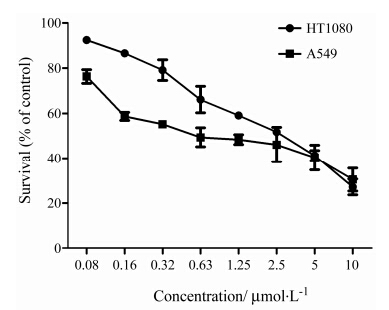 |
Figure 3 Effect of RGD-TRAIL from Pichia pastoris on cell growth of A549 and HT1080 cells. Cells were treated with RGD-TRAIL for 48 h and cell viability was determined by MTT assay. n = 3, x± s |
由MTT实验结果可知, HT1080和A549细胞对RGD-TRAIL敏感性不同。因此, 选取RGD-TARIL的作用浓度分别为0.5和0.08 μmol·L-1, 结合两种肿瘤细胞的生长速度情况, RGD-TRAIL的处理时间分别为8和24 h。与对照组相比, RGD-TRAIL可明显抑制HT1080和A549细胞的迁移作用 (图 6A)。Transwell实验结果 (图 6B) 显示, 与对照组相比, 0.5和0.08 μmol·L-1 RGD-TRAIL分别作用后的HT1080和A549细胞, 细胞迁移数明显减小 (P < 0 .01)。
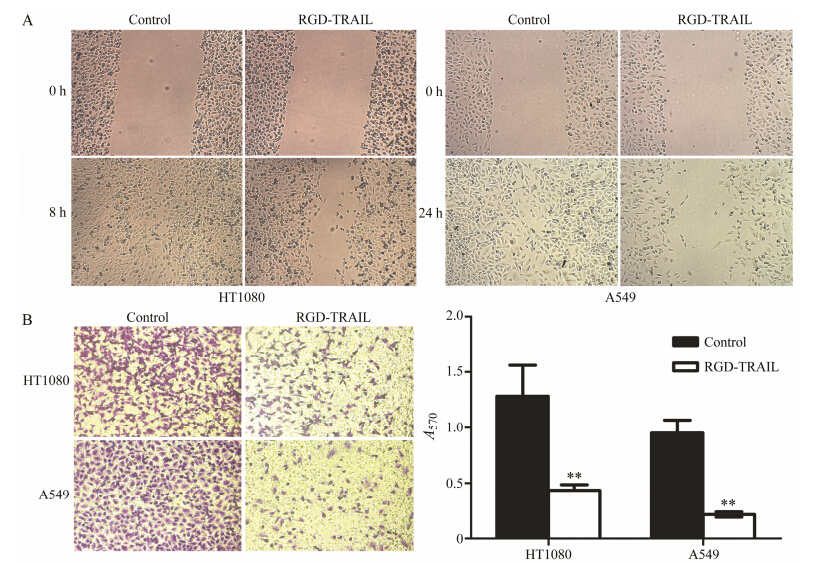 |
Figure 6 Effect of RGD-TRAIL on migration of A549 and HT1080 cells. (A) Effect of RGD-TRAIL purified from Pichiap astoris on migration of HT1080 and A549 measured by wound healing assay. Cells were treated with 0.5 and 0.08 μmol·L-1 RGD-TRAIL for HT1080 and A549 cells, respectively; (B) Effect of RGD-TRAIL purified from Pichia pastoris on migration of HT1080 and A549 measured by transwell assay. n = 3, x± s. **P < 0.01 vs control group |
肿瘤细胞经RGD-TRAIL作用24 h后, 用Hoechst 33342荧光染料染色, 固定后于荧光显微镜下观察。如图 7A所示, 未经RGD-TRAIL作用的对照组细胞核着色均匀, 无异常; 而H460经0.04 μmol·L-1 RGD- TRAIL、A549经过0.08 μmol·L-1 RGD-TRAIL作用后, 出现典型凋亡细胞形态变化, HT1080细胞经0.5 μmol·L-1 RGD-TRAIL作用后也出现同样的变化。进一步使用Western blotting检测RGD-TRAIL对H460、A549和HT1080凋亡信号通路相关蛋白的表达 (图 7B)。当RGD-TRAIL浓度为0.08 μmol·L-1时, 可明显检测到H460、A549细胞中的cleaved-PARP和cleaved-caspase-3, 表明该蛋白激活了肿瘤细胞凋亡信号通路, 对相对不敏感的HT1080细胞, 0.5 μmol·L-1 RGD-TRAIL也有相似的结果。
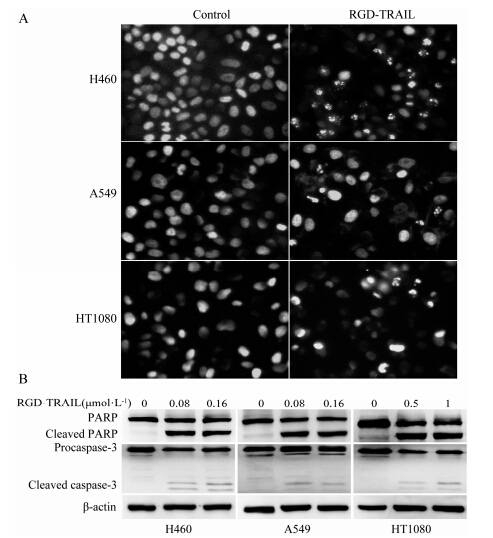 |
Figure 7 RGD-TRAIL induced apoptosis of cancer cells. (A) RGD-TRAIL induced apoptosis detected by Hoechst 33342 straining. Cells were treated with 0.04, 0.08 and 0.5 μmol·L-1 RGD-TRAIL for 24 h for H460, A549 and HT1080 cells, respectively, and then stained with Hoechst 33342. (B) Effect of RGD-TRAIL on expression of apoptosis-associated proteins. Cells were treated with RGD-TRAIL for 24 h and then western blotting was used to detect the levels of proteins |
人可溶性TRAIL, 即TRAIL蛋白的114~281氨基酸片段, 具有完整TRAIL蛋白的活性, 可以诱导多种肿瘤细胞发生凋亡, 而靶向特异性使其对正 常细胞几乎没有毒性作用[11]。研究表明, 人可溶性TRAIL (rhTRAIL) 及靶向TRAIL受体的激动剂型抗体具有很好的抗肿瘤活性, 并在临床试验中取得很大进展, 但耐药性的产生以及个体差异等是TRAIL及靶向TRAIL受体的激动剂型抗体在临床应用的 最大难题[12]。由噬菌体展示技术得到的RGD-4C对αvβ3具有特异的选择性及很强的亲和力, 已被用于 药物靶向运输, 且非常适合与蛋白质连接[13, 14], 如与RGD-4C重组的TNF-α[15]、IL-12[16], 抗肿瘤活性均 有显著提高。
RGD肽与TRAIL融合得到的重组蛋白通过RGD肽靶向作用, 提高重组蛋白在细胞周围的局部浓度, 使得TRAIL部分作用于临近的死亡受体, 激活凋亡通路, 从而呈现出比sTRAIL更强的肿瘤细胞增殖抑制作用, 且重组蛋白对正常细胞几乎没有杀伤[17]。已有报道[18, 19] TRAIL的重组蛋白多由大肠杆菌表达, 但表达产物以包涵体为主, 存在复性困难的缺点, 且缺乏对重组蛋白的翻译后加工修饰作用。毕赤酵母表达属于真核表达体系, 与原核表达体系比较, 具有分泌表达及翻译后加工修饰等优点, 因此本研究分别利用大肠杆菌和毕赤酵母表达重组蛋白RGD-TRAIL, 在大肠杆菌中以包涵体形式表达, 在毕赤酵母中分泌表达。通过镍离子亲和层析纯化后, 利用MTT比较活性差异, 结果表明, 由毕赤酵母表达的RGD-TRAIL对H460细胞IC50明显低于由大肠杆菌表达的RGD-TRAIL, 这可能由于大肠杆菌表达过程无加工修饰作用, 表达的RGD-TRAIL融合蛋白为包涵体, 复性时蛋白折叠不充分, 影响融合蛋白正确空间构象的形成, 活性效果不理想; 融合蛋白经毕赤酵母分泌表达, 纯化过程不涉及融合蛋白的复性, 确保了融合蛋白正确空间构象的形成。因此真核表达系统更适合于重组蛋白RGD-TRAIL。对毕赤酵母表达的RGD-TRAIL进行体外活性分析, 重组蛋白与高表达整合素αv、死亡受体DR4和DR5的肿瘤细胞具有较强的亲和力, 表明该融合蛋白具有较强的靶向作用。MTT显示RGD-TRAIL能明显抑制A549和HT1080细胞增殖, 发挥杀伤活性, 其中RGD-TRAIL对HT1080的杀伤活性较A549弱, 可能与HT1080细胞表面的DR4、DR5和αv的表达量相关。细胞划痕和Transwell结果显示, RGD-TRAIL能显著抑制A549和HT1080细胞的迁移, 表明RGD-TRAIL中的RGD肽与整合素相互作用, 抑制了肿瘤细胞的迁移。Hoechst 33342染色法表明RGD-TRAIL可诱导肿瘤细胞发生凋亡, Western blotting检测RGD-TRAIL可激活caspase依赖的细胞凋亡途径。因此, 作者构建的融合蛋白同时具有RGD和TRAIL的生物学活性。
本研究表明, 与大肠杆菌比较, 毕赤酵母更适合于重组蛋白RGD-TRAIL的表达, 毕赤酵母表达的RGD-TRAIL既能发挥TRAIL诱导凋亡作用, 也呈现出RGD肽的靶向作用及细胞迁移抑制作用, RGD- TRAIL的生物学活性提示该融合蛋白具有进一步研究的前景。
| [1] | Wang S. The promise of cancer therapeutics targeting the TNF-related apoptosis-inducing ligand and TRAIL receptor pathway [J]. Oncogene, 2008, 27: 6207-6215. |
| [2] | Buckley CD, Pilling D, Henriquez NV, et al. RGD peptides induce apoptosis by direct caspase-3 activation [J]. Nature, 1999, 397: 534-539. |
| [3] | Zhao XH, Wang W, Wang FQ, et al. A comparative study of b-1, 4-endoglucanase (possessing β-1, 4-exoglucanaseactivity) from Bacillus subtilis LH expressed in Pichia pastoris GS115 and Escherichia coli Rosetta (DE3) [J]. Bioresour Technol, 2012, 110: 539-545. |
| [4] | Blum A, Martin HJ, Master E. Human 11β-hydroxysteroid dehydrogenase 1/carbonyl reductase: recombinant expression in the yeast Pichia pastoris and Escherichia coli [J]. Toxicology, 2000, 144: 113-120. |
| [5] | Zappa S, Hasche A, Boudrant J. Expression of Pyrococcusabyssi recombinant alkaline phosphatase: influences of Escherichia coli rare codens and secretion by the methylotrophic yeast Pichia pastoris [J]. Enzyme Microb Tech, 2003, 32: 751-756. |
| [6] | Kant P, Liu WZ, Pauls P. PDC1, a corn defensin peptide expressed in Escherichia coli and Pichia pastoris inhibits growth of Fusarium graminearum [J]. Peptides, 2009, 30: 1593-1599. |
| [7] | Cao L, Du P, Jiang SH, et al. Enhancement of antitumor properties of TRAIL by targeted delivery to the tumor neovasculature [J]. Mol Cancer Ther, 2008, 7: 851-861. |
| [8] | Yao RY, Sui AH, Wang ZL, et al. Induction of non-small cell lung carcinoma apoptosis using soluble RGD-TRAIL by targeting the integrin receptor of tumor cells [J]. Mol Med Rep, 2012, 6: 1355-1360. |
| [9] | Zhu DQ, Wang XF, Shang Y, et al. A bispecific fusion protein and a bifunctional enediyne-energized fusion protein consisting of TRAIL, EGFR peptide ligand, and apoprotein of lidamycin against EGFR and DR4/5 show potent antitumor activity [J]. Anticancer Drugs, 2015, 26: 64-73. |
| [10] | Yang J, Chen SZ. Synergistic effect and its possible mechanisms of lidamycin in combination with TRAIL in NSCLS [J]. Acta Pharm Sin (药学学报), 2010, 45: 1247- 1253. |
| [11] | Ashkenazi A, Pai RC, Fong S, et al. Safety and antitumor activityof recombinant soluble Apo2 ligand [J]. J Clin Invest, 1999, 104: 155-162. |
| [12] | Dimberg LY, Anderson CK, Camidge R, et al. On the TRAIL to successful cancer therapy? Predicting and counteracting resistance against TRAIL-based therapeutics [J]. Oncogene, 2013, 32: 1341-1350. |
| [13] | Arap W, Pasqualini R, Ruoslahti E. Cancer treatment by targeted drug delivery to tumorvasculature in a mouse model [J]. Science, 1998, 279: 377-380. |
| [14] | Temming K, Schiffelers RM, Molema G, et al. RGD-based strategies forselective delivery of therapeutics and imaging agents to the tumor vasculature [J]. Drug Resist Updates, 2005, 8: 381-402. |
| [15] | Curnis F, Gasparri A, Sacchi A, et al. Coupling tumornecrosis factor-α with αv integrin ligands improves its antineoplastic activity [J]. Cancer Res, 2004, 64: 565-571. |
| [16] | Dickerson EB, Akhtar N, Steinberg H, et al. Enhancement of the antiangiogenic activity of interleukin-12 by peptide targeted delivery of the cytokine to αvβ3 integrin [J]. Mol Cancer Res, 2004, 2: 663-673. |
| [17] | Wang QH, Gao LL, Liang HC, et al. Research advances of the influence factors of high level expression of recombinant protein in Pichia pastoris [J]. Acta Pharm Sin (药学学报), 2014, 49: 1644-1649. |
| [18] | Xia XX, Shen YL, Wei DZ. Purification and characterization of recombinant sTRAIL expressed in Escherichia coli [J]. Acta Biochim Biophys Sin, 2004, 36: 118-122. |
| [19] | Gasparian ME, Ostapchenko VG, Yagolovich IN, et al. Overexpression and refolding of thioredoxin/TRAIL fusion from inclusion bodies and further purification of TRAIL after cleavage by enteropeptidase [J]. Biotechnol Lett, 2007, 29: 1567-1573. |
 2015, Vol. 50
2015, Vol. 50


