2. 广州新济药业科技有限公司, 广东 广州 510006;
3. 中山大学广东省创新药物制剂工程技术研究开发中心, 广东 广州 510006
2. Guangzhou Neworld Pharmaceutical Ltd. Co., Guangzhou 510006, China;
3. Research and Development Center of Pharmaceutical Engineering, Sun Yat-sen University, Guangzhou 510006, China
在新药开发中,40%~70% 新化合物实体的溶解度较低。由于水溶性差,药物在胃肠道中的溶出不完全,导致药物吸收不规则,生物利用度低。因此,提高药物体外溶出速率对改善其体内生物利用度具有重要意义。目前,提高难溶性药物体外溶出速率的方法有: ① 制备成盐类或合成水溶性前体药物; ② 合成脂质类复合物; ③ 制备成乳剂; ④ 制备成固体分散体; ⑤ 制备成环糊精包合物等。近年来,纳米技术作为一种新型的、提高难溶性药物体外溶出速率的药剂学方法引起了广泛的关注。
纳米技术主要包括两个策略: 一是将药物本身的粒径减小至纳米级别,如纳米晶[1,2,3]; 二是采用一定的载体制备纳米粒[4,5,6],如多聚物。但是纳米技术在取得巨大进展的同时也面临一定的挑战,例如其工业化生产的设备繁琐、成本高,纳米粒包封率低、长期稳定性差,多聚物以及表面活性剂也存在安全性问题等[7,8]。介孔二氧化硅作为一种具有纳米孔道结构的新型无机材料,在提高难溶性药物溶出速率方面具有独特的优势。介孔二氧化硅具有较大比表面积及孔容,能装载大量药物分子,载药量较大[9]。药物载入孔道后,由于空间阻碍作用,孔道中药物重结晶被有效抑制,药物以高能量的无定形形式存在,自由能大,易溶于溶出介质[10,11]。介孔硅胶巨大的比表面积对药物有极强的分散作用,能明显增加药物与溶出介质的接触面积,有利于溶出介质的渗透。此外,介孔二氧化硅表面具有丰富的硅醇基,为亲水性载体,能够提高难溶性药物的润湿性。
介孔氧化硅SBA-15 (Santa Barbara Amorphous- 15) 具有载药量大、合成简单且水、热稳定性好的特点,常作为口服给药载体用于改善难溶性药物的溶出。但目前载药SBA-15一般为速释制剂,不适用于半衰期短、服用频繁的难溶性药物。若采用一定的制剂技术,将速释的载药SBA-15制备为缓释制剂,则既可以达到提高难溶性药物体外溶出的目的,也可以使药物释放更平稳,延长药物作用时间,同时减少服药次数,增加患者的顺应性。而热熔挤出 (hot-melt extrusion technology,HME) 作为一种新型的制剂技术,根据所用载体的性质,HME既可以用于制备缓 控释和肠溶制剂提高其生物利用度[12,13],也可以用 于制备固体分散体以提高难溶性药物体外溶出速 率[14,15,16]。相对于其他制剂技术,HME具备熔融和机械制备的诸多优势,其自动化程度高,工艺简单,可以连续化操作,具有较高的生产效率,且融合了制剂加工的两个主要目的——改性与成型[17]。此外,HME整个工艺制备过程持续时间很短且无须加入水或有机溶剂,不易发生水解问题,重现性良好。且HME制备的骨架型缓释制剂,与其他方法制备的缓释制剂相比,具有较高的均匀性和致密性[18]。
本研究拟采用HME技术将介孔二氧化硅给药 系统和缓控释技术联合应用,研究开发新型给药系统,既充分发挥介孔二氧化硅提高难溶性药物体外溶出速率及稳定无定型药物的作用,同时能延长半衰期短的药物作用时间,减少服药次数,增加患者顺应性。此新型给药系统为半衰期短的难溶性药物剂 型的研究和开发提供了新思路。本研究以非诺贝特 (fenofibrate,FNB) 作为难溶性药物的代表,以乙基纤维素 (ethylcellulose,EC) 为缓释材料,采用HME制备介孔二氧化硅/乙基纤维素缓释骨架。但仅以EC为缓释材料的热熔挤出制剂一般孔隙率低,药物多数释放不完全,常需加入致孔剂或溶胀剂以改善药物的释放情况。因此在本研究中拟定黄原胶 (xanthan gum,XG) 作为调释剂,用以调节缓释骨架中的药物释放。
材料与方法 材料非诺贝特 (fenofibrate,FNB,香港先进技术工业有限公司); 乙基纤维素 (ethylcellulose,EC,美国卡乐康公司); 黄原胶 (xanthan gum,XG ,天津市福晨化学试剂厂); 聚乙烯醚-聚丙烯醚-聚乙烯 (PEO- PPO-PEO,P123,Sigma公司); 正硅酸乙酯(tetraethyl orthosilicate,TEOS,天津市福晨化学试剂厂,分析纯); 无水乙醇 (天津市富宇精细化工有限公司,分析纯)。
仪器HAAKE Mini CTW双螺杆微型混合器 (德国Thermo Scientific公司); D-MAX 2200 VPC X-射线衍射仪 (日本Rigaku公司); DSC 200 F3 Maia型差热分析联用仪 (德国耐驰公司); JEM 1400透射电镜 (日本电子株式会社); JSM-6330F冷场发射扫描电镜 (日本电子株式会社); ASAP 2020C型比表面积全自动吸附仪 (美国Micromeritics公司); TU-1901双光束紫外可见光光度仪 (北京普析通用仪器有限责任公司); ZRS-8G智能溶出试验仪 (天大天发科技有限公司)。
介孔硅胶SBA-15的制备参考有关文献[19]的合成方法,以P123为模板,TEOS为硅源,在酸性条件下合成SBA-15。具体合成步骤如下: 称取一定量P123,溶于盐酸溶液,40 ℃下搅拌直至形成淡蓝色透明均一体系。缓慢逐滴加入TEOS,持续搅拌24 h后,反应物移至反应釡中100 ℃晶化48 h。各试剂的摩 尔比为n (TEOS)∶n (P123)∶n(H2O)∶n (HCl) = 1∶0.013 8∶139∶4.8。将所得产物取出,冷却,离心收集,水洗至中性后,在40 ℃下真空干燥,经550 ℃煅烧 6 h以除去模板剂P123,即得SBA-15。
药物装载将适量FNB溶于无水乙醇中,加入一定量的介孔二氧化硅SBA-15,药物与载体的比例为1∶4、1∶2.3和1∶1.5,磁力搅拌6 h,旋转蒸发除去乙醇即得载药介孔二氧化硅。通过DSC及XRD等手段表征并确定最佳载药量。
样品表征取少量样品,经涂膜喷金处理后,进行扫描电镜观察,测试加速电压为20 kV; 取少量样品,用无水乙醇超声分散,滴在铜网上,进行透射电镜观察,所用电子束电压为120 kV; X-射线衍射采用CuKα射线,波长为0.154 nm,管电压40 kV,管电流26 mA,小角扫描范围为0.6°~5°,广角扫描范围为5°~40°; DSC升温范围为30~110 ℃,升温速率为 10 ℃·min-1,N2吹扫速率为30.0 mL·min-1; N2吸附-脱附测量在77 K液氮条件下进行,所有样品均在40 ℃脱气12 h,比表面积和孔径分布分别由BET (Brunauer- Emmett-Teller) 及BJH (Barrett-Joyner-Halenda) 方程计算所得。
缓释骨架的制备固定载药介孔二氧化硅 (FNB-SBA-15) 的比例为50%,加入一定量的EC和释放调节剂XG ,物料混合后加入到双螺杆挤出机中,以挤出温度为130 ℃,螺杆转速为80 r·min-1挤出。挤出物于室温冷却,截成5 mm长的缓释骨架,用于后续研究,其处方设计如表 1所示。
|
|
Table 1 Formulation for preparing mini-matrices by hot melt extrusion. FNB: Fenofibrate; SBA-15: Santa Barbara Amorphous-15; EC: Ethylcellulose; XG: Xanthan gum |
精密称取FNB约10 mg置于100 mL量瓶中,甲醇稀释定容,作为储备液。分别精密量取储备液0.2、0.4、0.6、0.8、1.0、1.2和1.5 mL于10 mL量瓶中,甲醇稀释定容,于286 nm处测定吸光度值,以浓度对吸光度进行线性回归绘制标准曲线,得回归方程C = 0.055 79 X - 0.015 86,R2 = 0.999 5,FNB吸光度值与浓度的线性关系良好。
体外溶出度测定 载药介孔二氧化硅的体外溶出实验精密称取约相当于20 mg FNB样品,根据《中国药典》2010版 (二部) 附录X C桨法规定进行药物溶出实验,溶出介质为900 mL含有0.3% (w/v) SDS (sodium dodecyl sulfate) 的去离子水,温度为 (37 ± 0.5) ℃,搅拌桨转速为100 r·min-1。分别于5、10、20、30、45和60 min取样5 mL,取出样品液经0.22 µm微孔滤膜过滤,并迅速补加5 mL新鲜的溶出介质。续滤液经过适当稀释后,通过紫外检测方法进行药物含量测定,并计算药物的累积释放量。
热熔挤出缓释骨架体外释放实验通过设置不同搅拌桨转速和搅拌装置,考察水流剪切力对F8缓 释骨架中药物释放速率的影响。采用中国药典2010版二部附录X C第一法和第二法,即桨法和篮法。转篮的转速为100 r·min-1,桨叶的转速设置为50、100、200 r·min-1,释放介质为900 mL含有1% (w/v) SDS的去离子水,温度为 (37 ± 0.5) ℃,取样、样品处理方法同前所述。
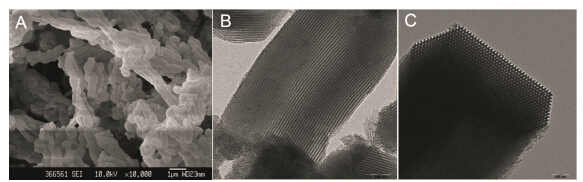
结果与讨论 1 透射电镜与扫描电镜采用扫描电镜和透射电镜分别对合成的SBA-15外观形貌及孔道结构进行表征。在图 1中,A图为SBA-15的扫描电镜结果,B图与C图分别为平行及垂直于孔轴的透射电镜结果。由A图可见,SBA-15形貌为蠕虫样条状,微粒之间相互黏结,尺寸均匀,约为1 μm。SBA-15透射电镜图中明视野表示孔道,稍暗视野表示硅壁; 由B图可见,SBA-15的孔道分布均匀并且长程规则; 而从C图可见,完美的蜂窝状六方孔道结构。初步结果表明所得SBA-15具有有序二维六方相介孔结构。
|
Figure 1 SEM image of SBA-15 (A) and TEM images of SBA-15 at parallel orientation (B) and at vertical orientation (C) |
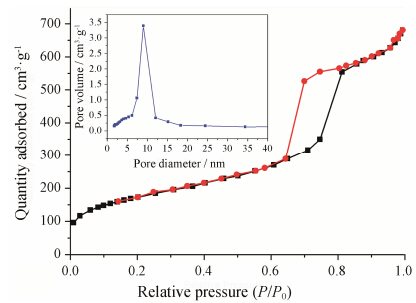
为进一步得到样品的孔径分布、孔容和比表面积,采用N2吸附-脱吸附对合成的SBA-15进行表征。其N2吸附-脱吸附等温曲线及孔径分布曲线如图 2所示。从曲线形状可以看出,SBA-15具有典型的IV型吸附-脱吸附等温线,吸附与脱吸附等温线在P/P0为0.6~0.8之间互不重合,形成明显的H1型滞留回环,表明SBA-15的介孔孔道规则有序,孔径大小均匀。通过计算,SBA-15的比表面积为680.55 m2·g-1,孔容积为3.39 cm3·g-1,孔径集中在7~12 nm之间,平均孔径为9.0 nm。合成的SBA-15具有较大的比表面积、孔容积与孔径,为装载大量药物提供了可能。
|
Figure 2 N2 adsorption-desorption isotherms and pore size distribution (insert) of SBA-15 |
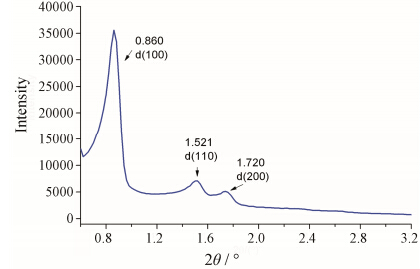
采用小角X-射线衍射进一步表征SBA-15的孔道结构特征,结果见图 3。在SBA-15的小角X射线粉末衍射图中,低衍射角处 (2θ = 0.860°) 衍射峰尖锐且强度较高 (d = 100),表明SBA-15孔道高度有序。此外,在高衍射角处 (2θ = 1.521°,1.720°) 出现了两个强度比较弱的衍射峰d110和d200。这3个特征衍射峰的出现,表明合成样品具有二维p6mm六方结构。
|
Figure 3 The small-angle XRD pattern of SBA-15 |
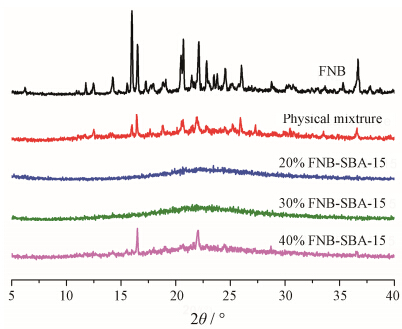
为了考察FNB被装载后的物理状态,分别对FNB原料药、SBA-15与FNB物理混合物及不同载药量的FNB-SBA-15进行广角X射线衍射扫描,结果见图 4。FNB原料药为晶体结构,在11.86°、14.38°、
|
Figure 4 The wide-angle XRD patterns of crystalline FNB,physical mixture and drug loaded SBA-15 |
16.61°、20.79°、22.15°、24.62°、26.17°和36.72°等位置具有较强的特征衍射峰。FNB与SBA-15的物理混合物衍射图出现了与原料药类似的特征衍射峰,表明FNB的结构并没有改变。20% 和30% 载药量的衍射图谱中,FNB的特征衍射峰消失,表明FNB经SBA-15吸附后,FNB是以无定形或分子态形式存在。当载药量为40% 时,衍射图谱中则出现了FNB的特征衍射峰,表明药物已经过载。
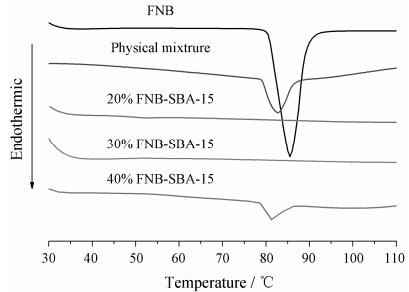
4 差示热扫描量热法测试样品的DSC曲线见图 5。由图可见,FNB原料药在85 ℃附近出现了明显的吸热峰,为FNB的熔点峰。物理混合物DSC曲线中,药物的吸热峰依然存在,但强度变弱。当FNB载入SBA-15后,20%和
|
Figure 5 The thermal behaviors of crystalline FNB,physical mixture and drug loaded SBA-15 |
30% 载药量的样品在85 ℃附近的吸热峰消失,表明FNB以无定形或分子态存在。而40% 载药量的样品则在药物熔点峰处出现了较小的吸热峰,表明在该载药量下药物出现过载现象。DSC的结果与广角XRD结果一致,因此,以30% 载药量作为最大载药量用于后续实验研究。
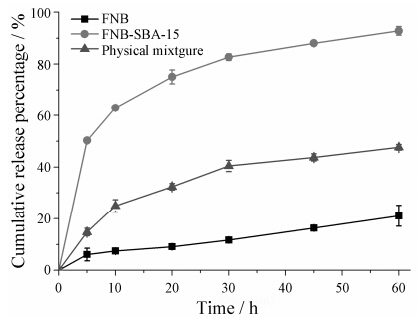
5 FNB-SBA-15体外溶出FNB原料药、SBA-15与FNB物理混合物及载药介孔二氧化硅的累积释放曲线见图 6。FNB原料 药在60 min内药物的累积释放总量仅为 (21.06 ± 4.04) %。相对于原料药、物理混合物中的药物溶出有一定的提高,60 min内药物累积释放总量达到了 (47.60 ± 1.10) %。可能原因是介孔二氧化硅比表面积大,在溶出介质中充当了分散作用,防止药物聚集。也可能与介孔二氧化硅的亲水性有利于水分子与FNB相互作用有关[20]。相对于原料药及物理混合物,载药介孔二氧化硅中药物的释放速率明显增高,10 min前累积释放率为 (63.01 ± 1.11) %,60 min的累积释放量达 (92.79 ± 1.70) %。其原因主要为以下几点:
|
Figure 6 Dissolution profiles of drug loaded mesoporous silica (n = 3) |
① 介孔二氧化硅具有较大的比表面积,对药物有较强的分散作用,同时增加了药物与溶出介质的接触面积,有利于溶出介质的渗透,从而增快药物的溶解,该结论与文献[21]报道的纳米多孔ZnO增加药物分散性结果相似; ② FNB被吸附后,以无定形形式存在。无定形态的药物自由能大,溶出无需克服晶格能,所以更易溶于溶出介质; ③ 介孔二氧化硅表面含有丰富的硅醇基而具有亲水性,能够增加疏水性药物的润湿性。
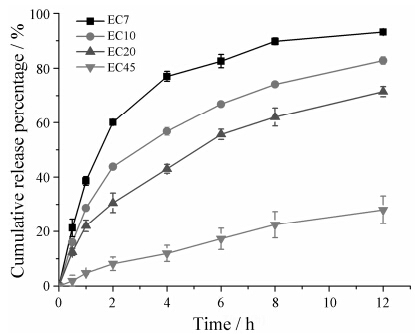
6 EC缓释骨架体外释放 6.1 EC黏度的影响以不同黏度EC作为骨架材料制备缓释骨架,其药物释放结果如图 7所示,随着EC黏度增大,药物释放减慢。这可能与EC黏度对EC缓释骨架的制备工艺影响有关,随着黏度级别越大,EC的链段越长,在热熔挤出过程中,链段的缠绕越厉害,形成较高黏度的热溶体[22]。而二氧化硅作为一种刚性的无机材料,本身热塑性很差,在用于载药的同时可以充当增加热熔挤出物硬度的材料,当介孔二氧化硅与EC混合物加入热熔挤出机中,EC在高于其Tg的温度下形成玻璃态黏流体包裹刚性的介孔二氧化硅,EC黏度级别越大,链段缠绕越厉害,其包裹介孔二氧化硅的能力越强,使得药物无法从介孔二氧化硅中释放,因此释放速率慢,且释放不完全。而EC黏度减小,包裹介孔二氧化硅的能力变弱,水分渗入缓释骨架中,XG吸水膨胀,骨架崩解完全,药物从介孔二氧化硅中释放速率快,且释放完全。采用黏度级别大的EC制备缓释骨架,存在药物释放慢且释放不完全的现象,因此后续实验中均以EC7作为缓释材料。
|
Figure 7 Effect of viscosity of EC on FNB release (n = 3) |
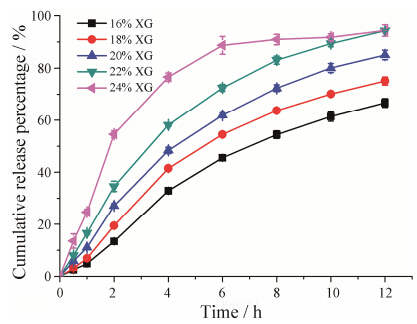
固定FNB-SBA- 15的比例不变,调节XG用量,考察XG的含量对药物释放的影响,结果见图 8。由图 8显示,随着XG含量增大,药物释放增快。当XG含量较低时,药物无法释放完全,而当XG含量达到24% 时,则出现突释现象。XG能够调节药物释放的原因在于XG是一种亲水性的多聚物,具有较强的吸水性、膨胀性及溶蚀性能。XG吸水膨胀,使缓释骨架水化崩解,药物随之释放,而药物的释放使亲脂的EC骨架中孔道增多,从而促使药物进一步释放。药物释放速率随XG浓度增大而加快的原因可能是: 随着XG浓度增大,缓释骨架的亲水性增加,更有利于溶出介质的渗入。此外,XG含量增加,缓释骨架的膨胀性能增加,骨架吸水崩解的时间变短,药物释放增快。而另一方面,亲脂性EC含量的减少也削弱了其包裹载药介孔二氧化硅的能力。XG含量为22% 时,药物释放完全且缓释效果良好,故后续实验均采用22% XG含量的缓释骨架 (表 1中F8)。
|
Figure 8 Effect of amount of XG on FNB release (n = 3) |
热熔挤出制备3批F8缓释骨架,通过药物体外释放,考察不同批次之间制备工艺的重现性,结果见图 9。采用不同批次两两之间的f2值评价不同批次缓释骨架中药物释放行为的相似程度,如果50 ≤ f2 ≤ 100,则表示释放行为相似。实验结果显示,不同批次两两之间的f2值均大于50 (表 2),表明3批FNB缓释骨架释放行为无显著性差异。此结果表明制备的3批样品的批间重复性较高,热熔挤出处方工艺较为合理可靠。
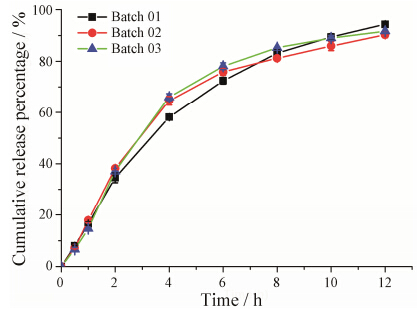
|
Figure 9 Three batches of in vitro release behavior (n = 3) |
|
|
Table 2 The f2-values of F8 calculated by comparing the dissolution profiles of mini-matrix obtained at three different batches or two different test conditions |
水流剪切力对以扩散为主的释放体系几乎没有影响,但是对以溶蚀为主的体系则影响较大[23]。设置不同搅拌桨的转速 (50、100、200 r·min-1) 和搅拌装置,考察水流剪切力对F8中药物释放的影响,结果见图 10。由图可见,随着搅拌桨的转速增快,药物释放增快。而同等转速 (100 r·min-1) 下,相对于篮法,采用桨法装置药物释放速率稍快。然而采用相似因子f2值评价不同装置及不同搅拌转速下的药物释放行为的相似程度发现,不同搅拌速度之间以及桨法与篮法之间的f2值均大于50 (表 2),表明装置以及转速对药物释放行为的影响无显著性差异。因此,经过优化的F8缓释骨架中药物释放受水流剪切力影响小,可以认为其释放机制主要以扩散为主。采用Ritger-Peppas模型对F8进行拟合,n值为0.596 4 (表 3),表明缓释骨架中释放机制为不规则释放,以扩散为主,同时也受溶蚀影响。
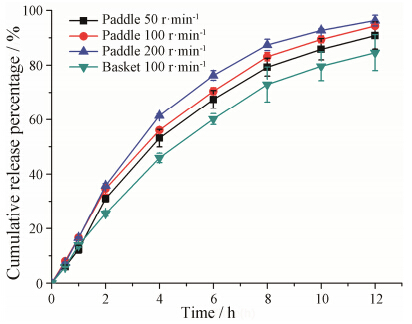
|
Figure 10 The dissolution experiments of F8 in different dissolution apparatuses and at different stirring rates (n = 3) |
|
|
Table 3 Kinetic data from regression fitting of dissolution profiles to several kinetic (Zero order,First order and Higuchi) and the Ritger-Peppas model |
对热熔挤出制备的缓释骨架 (表 1) 的释药过程进行模型拟合,采用相关系数评价拟合程度,结果见表 3。拟合结果显示所有处方均较符合一级动力学模型。根据Ritger- Peppas模型拟合,考察缓释骨架中药物的释放机制。从拟合结果看,EC黏度增大,n值随之增大,释放机制由Fick扩散向不规则释放转变,骨架中溶蚀作用机制随着EC黏度增大而有所增加,这可能与不同黏度的EC制备的缓释骨架具有不同吸水性能及溶蚀性能有关[24]。相反的,XG含量增加,n值减小,且n值介于0.45~0.89,表明骨架中的药物释放以不规则释放为主,且随着XG含量增加,骨架中扩散机制的作用增强,这可能与XG含量增加,骨架亲水性增加、膨胀性能增加,使得骨架水化崩解程度增大及崩解时间变短有关。
结论本研究采用水热法合成了SBA-15。表征结果显示SBA-15具有蠕虫状的形貌、二维六方有序的介孔结构以及较大的孔径、孔容积以及比表面积。载药后,难溶性药物非诺贝特以无定形形态或分子态存在,药物的溶出速率明显提高。采用热熔挤出技术,以EC作为缓释骨架,以XG作为调释剂,将速释的载药介孔二氧化硅制备成缓释骨架。当XG含量为22% 时,缓释骨架具有良好的缓释效果,且重复性良好。缓释骨架中药物释放符合一级动力学模型,释放机制为不规则释放。受扩散和溶蚀机制共同影响,随着EC黏度增加,溶蚀机制增强; 但XG含量的增加,扩散机制增强。
| [1] | Tran TTD, Tran KA, Tran PHL. Modulation of particle size and molecular interactions by sonoprecipitation method for enhancing dissolution rate of poorly water-soluble drug [J]. Ultrason Sonochem, 2014, 24: 256-263. |
| [2] | Morakul B, Suksiriworapong J, Chomnawang MT, et al. Dissolution enhancement and in vitro performance of clarithromycin nanocrystals produced by precipitation-lyophilizationhomogenization method [J]. Eur J Pharm Biopharm, 2014, 88: 886-896. |
| [3] | Li F, Song SS, Liu Y, et al. Preparation of valsartan nanosuspensions and its in vitro dissolution [J]. Acta Pharm Sin (药学学报), 2013, 48: 1312-1318. |
| [4] | Wang K, Qi JP, Weng TF, et al. Enhancement of oral bioavailability of cyclosporine A: comparison of various nanoscale drug-delivery systems [J]. Int J Nanomed, 2014, 9: 4991-4999. |
| [5] | Cerpnjak K, Zvonar A, Gasperlin M, et al. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs [J]. Acta Pharm, 2013, 63: 427-445. |
| [6] | Huang YJ, Li YB, Yuan HL, et al. Preparation of enteric nanoparticles of Schisandra total lignanoids and preliminary study on its pharmacokinetics [J]. Acta Pharm Sin (药学学报), 2009, 44: 1046-1050. |
| [7] | Muller RH, Keck CM. Challenges and solutions for the delivery of biotech drugs-a review of drug nanocrystal technology and lipid nanoparticles [J]. J Biotechnol, 2004, 113: 151-170. |
| [8] | Gasco MR. Lipid nanoparticles: perspectives and challenges [J]. Adv Drug Deliv Rev, 2007, 59: 377-378. |
| [9] | Tang FQ, Li LL, Chen D. Mesoporous silica nanoparticles: synthesis, biocompatibility and drug delivery [J]. Adv Mater, 2012, 24: 1504-1534. |
| [10] | Zhang P, Forsgren J, Strømme M. Stabilization of amorphous ibuprofen in upsalite, a mesoporous magnesium carbonate, as an approach to increasing the aqueous solubility of poorly soluble drugs [J]. Int J Pharm, 2014, 472: 185-191. |
| [11] | Speybroeck MV, Mellaerts R, Mols R, et al. Enhanced absorption of the poorly soluble drug fenofibrate by tuning its release rate from ordered mesoporous silica [J]. Eur J Pharm Sci, 2010, 41: 623-630. |
| [12] | Vynckier AK, Dierickx L, Saerens L, et al. Hot-melt coextrusion for the production of fixed-dose combination products with a controlled release ethylcellulose matrix core [J]. Int J Pharm, 2014, 464: 65-74. |
| [13] | Almeida A, Brabant L, Siepmann F, et al. Sustained release from hot-melt extruded matrices based on ethylene vinyl acetate and polyethylene oxide [J]. Eur J Pharm Biopharm, 2012, 82: 526-533. |
| [14] | Zhao YM, Zhao HY, Ma C, et al. Preparation of nimesulide solid dispersion by hot melt extrusion technology [J]. Chin Pharm J (中国药学杂志), 2013, 48: 185-190. |
| [15] | Guo ZF, Li YC, Liu X, et al. Study on the preparation technology and quality evaluation of diflunisal solid dispersion [J]. Acad J Guangdong Coll Pharm (广东药学院学报), 2013, 29: 357-362. |
| [16] | Yun F, Kang A, Shan J, et al. Preparation of osthole-polymer solid dispersions by hot-melt extrusion for dissolution and bioavailability enhancement [J]. Int J Pharm, 2014, 465: 436-443. |
| [17] | Chen MW, Chen CW, Chen TK, et al. Application research of hot-melt extrusion in preparation of solid dispersion [J]. Acta Pharm Sin (药学学报), 2012, 47: 163-167. |
| [18] | Yang R, Wang YJ, Zheng X, et al. Preparation and evaluation of ketoprofen hot-melt extruded enteric and sustained-release tablets [J]. Drug Dev Ind Pharm, 2008, 34: 83-89. |
| [19] | Zhao DY, Feng JL, Huo QS, et al. Triblock copolymer syntheses of mesoporous silica with periodic 50 to 300 angstrom pores [J]. Science, 1998, 279: 548-552. |
| [20] | Quan GL, Chen B, Wang ZH, et al. Improving the dissolution rate of poorly water-soluble resveratrol by the ordered mesoporous silica [J]. Acta Pharm Sin (药学学报), 2012, 47: 239-243. |
| [21] | Gao B, Sun CS, Zhi ZZ, et al. Preparation of two poor water soluble drugs-nanoporous ZnO solid dispersions and the mechanism of drug dissolution improvement [J]. Acta Pharm Sin (药学学报), 2011, 46: 1399-1407. |
| [22] | Quinten T, Beer TD, Vervaet C, et al. Evaluation of injection moulding as a pharmaceutical technology to produce matrix tablets [J]. Eur J Pharm Biopharm, 2009, 71: 145-154. |
| [23] | Verhoeven E, Vervaet C, Remon JP. Xanthan gum to tailor drug release of sustained-release ethylcellulose mini-matrices prepared via hot-melt extrusion: in vitro and in vivo evaluation [J]. Eur J Pharm Biopharm, 2006, 63: 320-330. |
| [24] | Quinten T, Gonnissen Y, Adriaens E, et al. Development of injection moulded matrix tablets based on mixtures of ethylcellulose and low-substituted hydroxypropylcellulose [J]. Eur J Pharm Sci, 2009, 37: 207-216. |
 2015, Vol. 50
2015, Vol. 50


