齐墩果酸 (oleanolic acid,OA) 又名士当归酸,是从女贞子、青叶胆等天然植物中分离得到的一种具有齐墩果烷型骨架的五环三萜类天然产物[1]。研究表明,齐墩果酸具有多种重要的生物活性,如: 保肝、抗炎、抗肿瘤、降血糖及抗溃疡等作用[2,3,4,5,6]。Finlay等[7]将齐墩果酸C-3位羟基氧化成酮羰基得到3-氧代齐墩果酸衍生物,通过对前列腺细胞NRP152抑制 增长作用的研究,表明齐墩果酸及其3-氧代产物的IC50均大于5.0 μmol·L-1。Kashiwada等[8,9]将齐墩果酸C-3位羟基酰化、C-12位双键还原加氢,得到的3-烷酰氧基、C-12位饱和的齐墩果酸衍生物,具有很强的抗HIV作用。在五环三萜类化合物结构修饰的过程中,对羧基的修饰主要为羧基成酯和成酰胺的反应[10,11,12,13,14]。本文以齐墩果酸 (OA) 为先导化合物,在本课题组前期对五环三萜类化合物结构改造以及构效关系研究的基础上[15,16,17,18,19],保留五环三萜骨架,对其C-3、C-12、C-28位进行结构修饰,合成了13个新的齐墩果酸衍生物,并对化合物进行了体外抗肿瘤活性的研究。
以OA为原料,将C-3位羟基与对氯苯甲酸或呋喃甲酸反应成酯,同时C-28位羧基与相应的醇反应成酯,得到3个I系列3-O-对氯苯甲酰 (或呋喃甲酰)-齐墩果烷型-12-烯-28-羧酸酯类化合物。C-12位双键被间氯过氧苯甲酸氧化生成环氧化合物,然后在酸性条件下水解开环引入羟基,同时C-28位羧基与醇反应成酯,得到3个II系列3β,12α,13β-三羟基齐墩果烷-28-羧酸酯类化合物。将C-3位羟基氧化成羰基,然后与盐酸羟胺反应成肟,再与烟酸反应,同时将C-28位羧基与醇反应成酯或与胺反应成酰胺,得到7个III系列3-(N-烟酰氧基)亚氨基-齐墩果烷 型-12-烯-28-羧酸酯类化合物。目标化合物的合成见合成路线1。
结果与讨论 1 化学合成以齐墩果酸 (OA) 为起始原料,经过酰化、氧化、水解、酯化或酰胺化等反应得到13个目标化合物,目标化合物的结构经1H NMR、元素分析和MS确定,均为新化合物,数据见表 1和表 2。
|
|
Table 1 MS and elemental analysis data of target compounds |
|
|
Table 2 1H NMR data of target compounds |
以吉非替尼为阳性对照药,采用MTT法测试目标化合物体外抗肿瘤活性,活性数据见表 3。
|
|
Table 3 Inhibitory activity of the target compounds on the SGC7901,MCF-7 and A549 cells proliferation. *The concentration of the target compounds is 1×10-5 mol·L-1 and process- time is 72 h; nt: Not tested |
结果表明: 所测试的目标化合物对SGC7901、MCF-7和A549三种细胞生长均具有一定的抑制作 用,其中化合物II2和II3对SGC7901、MCF-7和A549三种细胞表现出很好的抑制活性,II2对SGC7901、MCF-7和A549细胞的抑制率分别为16.7%、32.7% 和42.4%; II3对SGC7901、MCF-7和A549细胞的抑制率分别为20.1%、38.2% 和53.8%,明显高于母体化合物OA,对MCF-7和A549细胞的抑制活性高于临床常用药物吉非替尼。化合物III5对A549细胞的抑制率为49.7%,高于OA和吉非替尼。III3对SGC7901和A549细胞的抑制率分别为25.3% 和30.4%,高于母体化合物OA,对A549细胞的抑制活性与吉非替尼相当。可以看出,在C-3位羟基酯化,C-12位双键氧化,同时在C-28位羧基成酯可以提高其抗肿瘤活性。
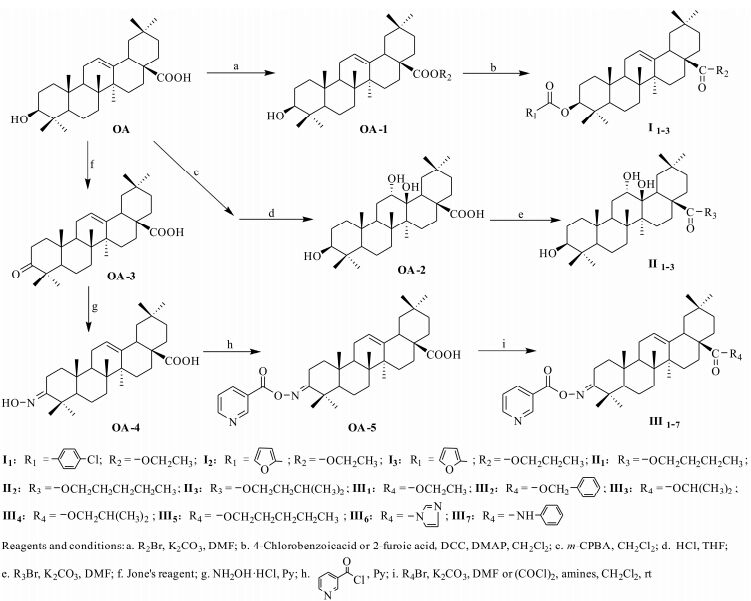
|
Scheme 1 Synthetic routes of target compounds |
实验结果说明,齐墩果酸C-3位羟基成酯所引入基团的结构与C-28位羧基所连接酯或胺的结构对抑制活性具有较大影响。C-12位双键氧化水解引入羟基,可能提高其抗肿瘤活性,这对进一步开展齐墩果酸的结构改造和抗肿瘤活性研究具有一定的指导意义。
实验部分Büchi B-540熔点测定仪 (温度未校正); BrukerARX-500型核磁共振分析仪,CDCl3为溶剂,TMS为内标; 热电-菲尼根LCQ型质谱仪; SPECTRA MAX plus型酶标仪; XDS-1B倒置显微镜; TGL-16B低速台式离心机。齐墩果酸(质量分数 > 98%) 购于西安小草天然产物有限公司; 薄层色谱硅胶GF254 (100~200目,青岛海洋化工厂),显色剂为10% 硫酸乙醇溶液; RPMI-1640培养基 (含10% 胎牛血清,100 u·mL-1青霉素,100 μg·mL-1链霉素)、溴化四氮唑盐 (MTT)、胰蛋白酶 (Trypsin) 和标准胎牛血清 (FBS)、SGC7901细胞、MCF-7细胞和A549细胞由沈阳药科大学药理教研室提供。所有试剂均为分析纯或化学纯。
1 化学合成 1.1 3β,12α,13β-三羟基-齐墩果烷-28-酸 (OA-2)将OA (100 mg,0.219 mmol) 与间氯过氧苯甲酸 (74.8 mg,0.433 mmol) 溶于10 mL二氯甲烷中,室温搅拌过夜。减压蒸除溶剂,加入10 mL水,用二氯甲烷萃取 (10 mL×2)。合并有机相,用饱和碳酸氢钠水溶液洗涤2次,然后水洗至中性,无水硫酸镁干燥,减压蒸除溶剂,得到白色固体。将其溶于10 mL氯仿中,加入2 mL浓盐酸,室温搅拌6 h。加入10 mL水,用氯仿萃取 (10 mL×3),合并有机相,用饱和碳酸氢钠水溶液洗涤3次,然后水洗至中性,无水硫酸镁干燥,过滤,加压蒸除溶剂。粗品经柱色谱纯化,洗脱剂为石油醚-乙酸乙酯=5∶1,得到白色固体68.1 mg,产率63.4%,mp 153.2~154.6 ℃; ESI-MS (m/z): 491.3 [M+H]+。
1.2 3-氧代-齐墩果烷型-12-烯-28-羧酸 (OA-3)参照文献[15]方法制备3-氧代-齐墩果烷型-12-烯-28-羧酸(OA-3),白色固体90.5 mg,产率90.5%,mp 220.3~222.1 ℃; ESI-MS (m/z): 455.1 [M+H]+。
1.3 3-肟基-齐墩果烷型-12-烯-28-羧酸 (OA-4)参照文献[15]方法制备3-肟基-齐墩果烷型-12-烯-28-羧酸 (OA-4),白色固体88.1 mg,产率87.3%,mp 188.4~189.8 ℃; ESI-MS (m/z): 470.5 [M+H]+。
1.4 3-[N-烟酰氧基]亚氨基-齐墩果烷型-12-烯-28-羧酸 (OA-5)参照文献[15]方法通过烟酸 (163 mg,1.32 mmol) 制备3-[N-烟酰氧基]亚氨基-齐墩果烷型- 12-烯-28-羧酸(OA-5),白色粉末状固体60.7 mg,产率62.1%,mp 144.6~146.6 ℃; ESI-MS (m/z): 575.3 [M+H]+。
1.5 3-O-对氯苯甲酰-齐墩果烷型-12-烯-28-乙酯 (I1)将OA (50.0 mg,0.109 mmol) 和无水碳酸钾 (30.0 mg,0.217 mmol) 加入到5 mL DMF中,缓慢滴加3滴溴乙烷,室温下反应,TLC监测终点,反应完毕后,加入5 mL水,用乙酸乙酯萃取3次,合并有机相,无水硫酸镁干燥,减压蒸除溶剂得白色固体。将其溶解于5 mL二氯甲烷溶液中,加入少量DMAP、DCC和对氯苯甲酸 (20 mg,0.128 mmol),室温搅拌,TLC监测反应终点,反应完毕后,浓缩得到粗品,经硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (10∶1),得白色固体40.7 mg,产率59.7%,mp 146.3~147.5 ℃。
1.6 3-O-呋喃甲酰-齐墩果烷型-12-烯-28-乙酯 (I2)按照化合物I1的合成方法,与呋喃甲酸 (23 mg,0.205 mmol) 在室温条件下反应,粗品经硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (12∶1),得白色固体44.8 mg,产率70.7%,mp 172.6~174.1 ℃。
1.7 3-O-呋喃甲酰-齐墩果烷型-12-烯-28-正丙酯 (I3)按照化合物I1的合成方法,将得到的呋喃甲酰化合物与溴代正丙烷在室温下反应,粗品经硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (10∶1),得白色固体36.5 mg,产率56.2%,mp 167.0~169.3 ℃。
1.8 3β,12α,13β-三羟基-齐墩果烷-28-正丁酯 (II1)将OA-2 (100 mg,0.204 mmol) 和无水碳酸钾 (60 mg,0.434 mmol) 加入到5 mL DMF中,缓慢滴加3滴溴正丁烷,室温反应5 h。浓缩,加入5 mL水,用乙酸乙酯萃取 (4 mL×3),合并有机相,饱和NaCl水洗3次,无水硫酸镁干燥,抽滤,减压蒸除溶剂,粗品经硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (7∶1),得白色晶体58.7 mg,产率52.7%,mp 186.0~196.7 ℃。
1.9 3β,12α,13β-三羟基-齐墩果烷-28-正戊酯 (II2)按照制备II1的方法,由中间体OA-2 (100 mg,0.204 mmol) 与1 mL溴正戊烷反应,经硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (8∶1),得白色晶体60.2 mg,产率52.7%,mp 146.6~152.5 ℃。
1.10 3β,12α,13β-三羟基-齐墩果烷-28-异戊酯 (II3)按照制备II1的方法,由中间体OA-2 (100 mg,0.204 mmol) 与1 mL溴异戊烷反应,经硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (6∶1),得白色晶体59.8 mg,产率52.3%,mp 161.1~165.7 ℃。
1.11 3-(N-烟酰氧基)亚氨基-齐墩果烷型-12-烯-28-羧酸乙酯 (III1)将OA-5 (100 mg,0.174 mmol) 和无水碳酸钾 (57.0 mg,0.412 mmol) 加入到5 mL DMF中,缓慢滴加3滴溴乙烷,室温反应5 h。浓缩,然后加入5 mL水,用乙酸乙酯萃取3次,合并有机相,饱和NaCl水洗3次,无水硫酸镁干燥,抽滤,浓缩,得白色固体,粗品用硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (7∶1),得白色粉末状固体74.3 mg,产率72.5%,mp 80.6~83.8 ℃。
1.12 3-(N-烟酰氧基)亚氨基-齐墩果烷型-12-烯-28-羧酸苄酯 (III2)按照化合物III1的合成方法,由化合物OA-5 (100 mg,0.174 mmol) 与溴化苄 (116 mg,0.678 mmol) 反应得到粗品,用硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (7∶1),得白色粉末状固体42.1 mg,产率37.2%,mp 83.7~86.7 ℃。
1.13 3-(N-烟酰氧基)亚氨基-齐墩果烷型-12-烯-28-羧酸异丙酯 (III3)按照化合物III1的合成方法,由化合物OA-5 (100 mg,0.174 mmol) 与溴代异丙烷 (103 mg,0.682 mmol) 反应得到粗品,用硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (7∶1),得白色粉末状固体77.8 mg,产率74.2%,mp 90.8~94.6 ℃。
1.14 3-(N-烟酰氧基)亚氨基-齐墩果烷型-12-烯-28-羧酸异丁酯 (III4)按照化合物III1的合成方法,由化合物OA-5 (100 mg,0.174 mmol) 与溴代异丁烷 (93.2 mg,0.680 mmol) 反应得到粗品,用硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (7∶1),得白色粉末状固体72.5 mg,产率67.6%,mp 84.1~86.5 ℃。
1.15 3-(N-烟酰氧基)亚氨基-齐墩果烷型-12-烯-28-羧酸正戊酯 (III5)按照化合物III1的合成方法,由化合物OA-5 (100 mg,0.174 mmol) 与溴代正戊烷 (103 mg,0.682 mmol) 反应得到粗品,用硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (7∶1),得白色粉末状固体77.9 mg,产率71.1%,mp 80.5~83.7 ℃。
1.16 N-[3-(N-烟酰氧基)-齐墩果烷型-12-烯-28-羰基]咪唑 (III6)将OA-5 (100 mg,0.174 mmol) 溶解于10 mL二氯甲烷中,加入适量草酰氯,室温搅拌20 h,生成3-(N-烟酰氧基)亚氨基-齐墩果烷型-12-烯-28-酰氯,减压蒸除溶剂,加入2 mL环己烷,减压蒸除环己烷,反复操作2次。将得到的酰氯溶于5 mL二氯甲烷,加三乙胺调pH 9~10,搅拌5 min后,加入咪唑 (46.3 mg,0.680 mmol),室温下反应,TLC监测反应终点。反应结束后,减压蒸除溶剂,然后加入3 mL水,以2 mol·L-1盐酸调pH 3~4,析出白色固体,抽滤,水洗滤饼至中性。得白色固体,粗品用硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (2∶1),得白色粉末状固体68.7 mg,产率64.7%,mp 158.1~160.2 ℃。
1.17 N-苯基-3-(N-烟酰氧基)亚氨基-齐墩果烷型- 12-烯-28-酰胺 (III7)按照化合物III6的合成方法,由化合物OA-5 (100 mg,0.174 mmol) 与苯胺 (63.3 mg,0.680 mmol) 反应得到粗品,用硅胶柱色谱纯化,洗脱剂为石油醚-乙酸乙酯 (6∶1),得白色粉末状固体27.1 mg,产率24.5%,mp 106.8~108.7 ℃。
2 初步体外细胞毒活性测试以阿霉素和吉非替尼为阳性对照药,采用MTT法对合成的目标化合物进行体外抗肿瘤活性测试,所选用的肿瘤细胞为人胃癌细胞 (SGC7901)、人乳腺癌细胞 (MCF-7) 和人非小细胞肺癌细胞 (A549)。对数生长期肿瘤细胞培养于96孔培养板内,每孔100 μL (大约含4 000个细胞),置37 ℃、5% CO2温箱中培养,培养24 h后,给药组加入含有浓度为1×10-5 mol·L-1的测试物,至少设3个平行孔,阴性对照组加入与给药组等体积的溶剂,并设只加培养基的空白对照组,置37 ℃、5% CO2温箱中培养,48 h后弃培养液,每孔加入MTT溶液 (5 mg·mL-1) 20 μL,37 ℃孵育3 h,弃上清液,每孔加入100 μL DMSO溶解甲臜颗粒,轻度振荡溶解。在酶标仪波长490 nm条件下测定光密度值 (OD),计算所测化合物对细胞的抑制率和IC50值。试验重复3次,结果取平均值。
| [1] | Zhang SY, Li Z. Progress in oleanolic acid research [J]. Food Ferm Tech (食品与发酵科技), 2010, 46: 20-24. |
| [2] | Ma XH, Zhao YC, Yin L, et al. Studies on the effect of oleanolic acid on experimental liver injury [J]. Acta Pharm Sin (药学学报), 1982, 17: 93-97. |
| [3] | Tang C, Chen Y, Bai S, et al. Advances in the study of structural modification and biological activities of oleanolic acid [J]. Chin J Org Chem (有机化学), 2013, 33: 46-65. |
| [4] | Liu D, Meng YQ, Zhao J. Recent advance in the study on derivatives of oleanolic acid and ursolic acid [J]. Chemistry (化学通报), 2007, 70: 14-20. |
| [5] | Zhao LX, Tian MZ, Jin LJ, et al. Synthesis and characterization of derivatives of asiatic acid and primary study on anti-cancer activity [J]. Chin J Org Chem (有机化学), 2011, 31: 646-652. |
| [6] | Li WL, Chen J, Ma L, et al. Synthesis and evaluation of α-glucosidase inhibitory activity of oleanic acid derivatives [J]. Chin J Med Chem (中国药物化学杂志), 2014, 24: 7-13. |
| [7] | Finlay HJ, Honda T, Gribble GW, et al. Novel a-ring cleaved analogs of oleanolic and ursolic acids which affect growth regulation in NRP152 prostate cells [J]. Bioorg Med Chem Lett, 1997, 7: 1769-1772. |
| [8] | Kashiwada Y, Wang H, Nagao T, et al. Anti-AIDS agents and anti-HIV activity of oleanolic acid, pomolic acid, and structurally related triterpenoids [J]. J Nat Prod, 1998, 61: 1090-1095. |
| [9] | Zhu YM, Shen JK, Wang HK, et al. Synthesis and anti-HIV activity of oleanolic acid derivatives [J]. Bioorg Med Chem Lett, 2001, 11: 3115-3118. |
| [10] | Shen LH, Lai YS, Zhang YH, et al. Synthesis and anti-tumor activities of nitrate derivatives of glycyrrhetinic acid [J]. J Chin Pharm Univ (中国药科大学学报), 2008, 39: 103-107. |
| [11] | Meng YQ. Studies on Chemical Modification of Boswellic Acids and Their Anti-tumor Activity (乳香酸类化合物的结构改造及其抗癌活性的研究) [D]. Shenyang: Shenyang Pharmaceutical University, 2004. |
| [12] | Meng YQ, Liu D, Li DD, et al. Chemical modification of an antitumor activity of ursolic acid amine. CN, 101161670B [P]. 2011-07-27. |
| [13] | Zhao LX, Park HG, Jew SS, et al. Modification of C11, C28, C2, 3, 23 or C2, 23, 28 functional groups on asiatic acid and evaluation of hepatoprotective effects [J]. Bull Korean Chem Soc, 2007, 28: 970-976. |
| [14] | Chen L, Shang J, Wang ZF, et al. Synthesis and biological evaluation of nitrate-oleanolic acid hybrids as inhibitors of HepG2 cell apoptosis [J]. Acta Pharm Sin (药学学报), 2010, 45: 1516-1522. |
| [15] | Meng YQ, Nie HH, Wang XC, et al. Synthesis and antitumor activity of oleanolic acid derivatives [J]. Acta Pharm Sin (药学学报), 2011, 46: 1215-1220. |
| [16] | Meng YQ, Liu D, Cai LL, et al. The synthesis of ursolic acid derivatives with cytotoxic activity and the investigation of their preliminary mechanism of action [J]. Bioorg Med Chem, 2009, 17: 848-854. |
| [17] | Liu D, Meng YQ, Zhao J, et al. Synthesis and anti-tumor activity of novel amide derivatives of ursolic acid [J]. Chem Res Chin Univ, 2008, 24: 42-46. |
| [18] | Meng YQ, Liu D, Bai ZW, et al. Synthesis and anti-tumor activity of ursolic acid derivatives [J]. Acta Pharm Sin (药学学报), 2011, 46: 556-560. |
| [19] | Meng YQ, Xue J, Liu FX, et al. Synthesis and anti-tumor activity of oleanolic acid derivatives [J]. Chemistry (化学通报), 2013, 76: 265-269. |
 2015, Vol. 50
2015, Vol. 50


