人类细胞色素P450 (CYP450) 酶中的CYP2D6主要在肝脏中表达,含量虽比其他CYP450亚家族低,但参与了市场上20%~25% 临床药物的代谢,包括精神安定药、抗心律失常药、镇痛药、抗抑郁药、止吐药以及一些抗癌药等[1]。虽然CYP2D6代谢的底物性质各不相同,但他们几乎都在距氧化位点0.57 nm有一个氮原子[2]。对CYP2D6酶活性的影响,比如遗传因素、年龄、身体状况、饮食习惯、联合用药等,可导致该酶活性的降低或增高,从而影响其底物药物的代谢而发生药物相互作用。
冰片是传统中药,具有开窍醒神、清热止痛的功效,广泛用于临床,尤其是心脑血管疾病。2010年版的中国药典中收录含有冰片的成药有20余种,如安宫牛黄丸、复方丹参滴丸、牛黄降压丸等。近年来有许多文献报道冰片不仅能明显松弛细胞间紧密连接,抑制细胞膜P-糖蛋白 (P-gp) 功能,影响双分子层脂质膜的渗透性[3,4,5],还可促进其他药物进入各种生物脂质膜,如皮肤[6]、血脑屏障[7,8]、角膜[9]、肠道上皮膜[10,11]等。随着冰片联合用药应用越来越广泛,其可能带来的药物相互作用风险也随之增大。目前关于冰片对肝脏CYP450酶活性的影响鲜有报道。本文以Wistar雄性大鼠为实验动物,研究了冰片连续灌胃给药一周对大鼠肝脏CYP2D表达与活性的影响,研究结果为冰片的临床合理用药提供了有益参考。
材料与方法 实验动物SPF级6周龄Wistar雄性大鼠,体重200~250 g,湖北省实验动物研究中心提供,许可证号: SCXK (鄂) 2008-0005。
主要试剂和仪器合成冰片 (中国Alfa Aesar公司,含量≥ 98%); 右美沙芬 (英国LKT Laboratories公司); 去甲右美沙芬 (加拿大Toronto Research Chemicals公司); 硝西泮 (中国食品药品检定研究院); 质谱纯甲醇、乙腈 (德国Merck KGaA公司); TRIZOL (美国Ambion公司); 琼脂糖 (美国GibcoTM Invitrogen Corporation公司); 分析纯焦碳酸二乙酯 (DEPC)、Tween 20和质谱纯甲酸 (美国SIGMA公司); RIPA裂解液、显影液、定影液和6x SDS上样缓冲液 (中国碧云天公司); 脱脂奶粉 (中国内蒙古伊利集团股份有限公司); 逆转录试剂盒、荧光定量PCR试剂盒 (中国东洋纺上海生物科技有限公司); PCR引物 (中国上海桑尼生物科技有限公司); 小鼠抗β-actin单克隆抗体(美国Santa Cruz Biotechnology Inc.公司); 兔抗大鼠CYP2D1抗体 (英国Abcam公司); 山羊抗兔荧光标记抗体 (美国KPL公司); PVDF膜(美国Merck Millipore公司)。
LCMS-8040三重四极杆液相色谱质谱联用仪,包括LC-20A泵,SIL-20AHT自动进样器,CTO-20A柱温箱,DGU-20A3R脱气机和Lab Solustion数据处理系统 (日本SHIMADZU公司)。BIO-RAD iMARKTM酶标仪、CFX ConnectTM实时荧光定量PCR仪 (美国BIO-RAD公司); Alpha Imager 2000凝胶成像分析仪及软件 (美国Alpha Innotech公司); DYY-6C型电泳仪、DYC-40A型垂直电泳槽和DYC-40A电转仪 (中国北京市六一仪器厂)。
实验动物分组与给药方法雄性Wistar大鼠随机分为低、中、高剂量 (33、100和300 mg·kg-1·d-1) 冰片 (混悬溶于0.5% CMC-Na溶液中) 给药组和对照组 (灌胃等体积0.5% CMC-Na溶液),每组6只。大鼠给药剂量参考中国药典规定的人口服冰片剂量 (0.15~0.3 g/60 kg体重),根据人和大鼠体表面积比例换算得到。给药前大鼠禁食12 h,每日于同一时间点灌胃给药 (灌胃体积小于2.0 mL),连续给药7天。末次给药后1 h处死大鼠,取出肝脏组织,用预冷的生理盐水冲洗后擦干,-80 ℃保存备用。
冰片对CYP2D探针底物右美沙芬体内药动学的影响雄性Wistar大鼠随机分成冰片预给药组和对照组,每组6只。预给药组连续灌胃高剂量冰片7天后,静脉注射等体积右美沙芬 (8mg·kg-1) 一次; 对照组灌胃等体积0.5% CMC-Na溶液7天后,静脉注射等体积右美沙芬 (8mg·kg-1) 一次。给药后于10、30、60、120、180、300、480、600和720 min眼眶取血约0.4 mL,置肝素钠处理过的离心管中,4 ℃、3 500 r·min-1离心10 min取血浆,-80 ℃保存备用。
大鼠肝微粒体CYP2D活性测定方法采用CaCl2沉淀法制备每只大鼠肝微粒体[12]。以大鼠肝微粒体温孵体系中CYP2D探针底物右美沙芬的代谢产物 去甲右美沙芬的生成量表示CYP2D活性。温孵反应体系包括大鼠肝微粒体蛋白0.25 mg·mL-1、MgCl2 5 mmol·L-1、PBS 0.1 mol·L-1、右美沙芬2.5 µmol·L-1,总反应体积0.5 mL。37 ℃预温孵3 min后,加入 1 mmol·L-1 NADPH启动反应,25 min后加入乙酸乙酯0.8 mL终止反应,并于10 000×g离心10 min取上清液。上清液经真空冷冻挥干,残余物用流动相600 µL复溶后进LC-MS检测[13]。色谱条件: Shim-pack Column Holder保护柱 (2 mm × 5 mm,4.6 µm); SHIMADZU VP-ODS柱 (2.0 mm × 150 mm,4.6 µm); 以含0.1% 甲酸的水溶液 (A相) 和甲醇 (B相) 为流动相进行线性梯度洗脱,梯度洗脱程序为: 0~5 min,35% → 75% B; 5~6 min,75% B; 6~12 min,35% B; 流速0.2 mL·min-1; 柱温40 ℃; 进样量10 µL。质谱条件: 雾化器3 L·min-1; 干燥气15.0 L·min-1; 离子喷雾电压4.5 kV; 碰撞气压力230 kPa; DL管温度和加热模块温度分别为250 ℃和400 ℃。扫描方式为多反应检测 (MRM),去甲基右美沙芬定量分析的离子对为m/z 258→157,Q1预杆电压 -17.0 V,碰撞能量 -39.0 V,Q3预杆电压 -29.0 V。
实时荧光定量PCR检测CYP2D1 mRNA表达每只大鼠称取肝组织100 mg,按Trizol试剂盒说明书提取各组总RNA。用0.8% 琼脂糖凝胶电泳检测RNA的完整性,用核酸蛋白测定仪检测RNA的纯度。取100 µg总RNA按照东洋纺逆转录试剂盒说明稀释后逆转录成cDNA,-20 ℃保存备用。
从基因库中获取大鼠GAPDH与CYP2D1基因 序列,并用Primer 5.0分析软件设计引物序列如下: GAPDH (GenBank No.: NC_005103.4): Forward AGG GCTGCCTTCTCTTGTGAC,Reverse TGGGTAGAAT CATACTGGAACATGTAG; CYP2D1 (GenBank No.: NC_005106.4): Forward ACGCATCACGAGTTGTAC ATT,Reverse AGACGGTCTCATCCTTCAGCAC。定量PCR实验条件为: 94 ℃变性15 s,62 ℃退火30 s,72 ℃延伸30 ℃,38个循环,反应体系为20 µL。基因表达水平的比较采用2-ΔΔCt法计算[14]。
Western blotting检测CYP2D1蛋白表达将肝组织加入裂解液中冰浴匀浆,离心取上清液检测样品蛋白含量。 蛋白 (70 μg) 经10% 分离和4.5% 浓缩SDS- PAGE后转移到PVDF膜上,用5% 的脱脂牛奶封闭1.5 h后与一抗 (小鼠抗β-actin单克隆抗体,1∶1 000稀释; 兔抗大鼠CYP2D1抗体,1∶1 000稀释) 温孵过夜。洗涤后与二抗 (山羊抗兔荧光标记抗体,1∶5 000稀释) 温孵1.5 h。使用ECL化学发光液显影定影后,根据扫描条带大小与强度分析蛋白表达情况。
右美沙芬药动学每只大鼠每个时间点取血浆100 µL,加入内标溶液硝西泮 (1 mmol·L-1) 10 µL和乙酸乙酯200 µL,漩涡混合3 min,12 000 r·min-1离心 10 min取上清液100 µL,经真空冷冻挥干后用流动相500 µL复溶,进LC-MS检测右美沙芬含量。右美沙芬定量离子对为m/z 272→171,Q1预杆为 -19.0 V,碰撞能量为 -39.0 V,Q3预杆为 -17.0 V。内标硝西泮定量离子对为m/z 282→236,Q1预杆为 -17.0 V,碰撞能量为 -39 V,Q3预杆为 -19 V。其他同上述去甲基右美沙芬检测条件。绘制血浆中右美沙芬平均药时曲线,利用DAS 3.0软件 (中国药理学会数学药理专业委员会) 采用非房室模型分析右美沙芬的药动学参数。
结果 1 方法学考察根据考察结果,本方法对血浆中右美沙芬、大鼠肝微粒体中去甲基右美沙芬的检测线性关系良好,日内和日间相对回收率在98%~110% 之间,标准偏差RSD值均在±10% 以内。
2 冰片对大鼠肝微粒中CYP2D酶活性的影响大鼠灌胃给药后按钙沉淀低速离心法制备肝微粒体,以大鼠肝微粒体温孵体系中CYP2D探针底物右美沙芬的代谢产物去甲基右美沙芬的生成量表示CYP2D活性,结果见表 1。
|
|
Table 1 Effect of borneol on CYP2D activity in RLM in vivo (n = 6,x± s). P < 0.05,**P < 0.01 vs control |
大鼠灌胃给药后按大鼠血浆处理方法制备样品,检测右美沙芬的浓度,以时间 (t) 为横坐标,血药浓度 (C) 为纵坐标,绘制平均药时曲线见图 1。采用非房室模型经DAS3.0软件分析,右美沙芬的主要药动学参数见表 2。

|
Figure 1 Mean dextromethorphan concentration-time curves of rat plasma after intravenous administration of dextromethorphan (8 mg·kg-1) to control (△) and borneol-pretreatment rats (■). n = 6,x± s |
|
|
Table 2 Pharmacokinetic parameters of dextromethorphan in control and borneol-pretreatment rats after intravenous administration of dextromethorphan (8 mg·kg-1). n = 6,x± s. **P < 0.01 vs control |
与对照组相比,冰片预给药组右美沙芬的达峰浓度Cmax (mg·L-1) 和曲线下面积AUC0-∞ (ng·h·mL-1) 分别减少了10.6% (P > 0.05) 和27.5% (P < 0.01),清除率CL/F (L·h-1·kg-1) 和表观分布容积Vz/F (L·kg-1) 增大了41.1% (P < 0.01) 和23.1% (P > 0.05)。结果表明冰片预给药对右美沙芬大鼠体内药动学有明显影响,且主要发生在消除相,即冰片预给药能增加CYP2D探针底物右美沙芬的体内清除。
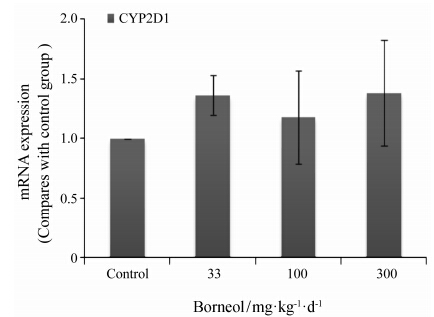
4 冰片对大鼠肝脏CYP2D1 mRNA表达的影响给大鼠灌胃低、中、高剂量冰片7天后,荧光定量PCR检测大鼠肝脏CYP2D1 mRNA的表达量 (图 2)。结果表明,给药后CYP2D1 mRNA的表达量较空白组上调作用不明显 (P > 0.05),且无剂量依赖性。
|
Figure 2 Effect of borneol on CYP2D1 mRNA expression after oral administration of borneol (33,100 and 300 mg·kg-1·d-1) for seven consecutive days (n = 6,x± s) |
给大鼠灌胃低、中、高剂量冰片7天后,Western blotting检测大鼠肝脏CYP2D1的蛋白表达量 (图 3)。结果表明,冰片对大鼠肝脏CYP2D1蛋白的表达没有明显影响。

|
Figure 3 Effect of borneol on CYP2D1 protein expression after oral administration of borneol (33,100 and 300 mg·kg-1·d-1) for seven consecutive days |
冰片连续灌胃给药7天对大鼠肝脏CYP2D1 mRNA和蛋白的表达没有明显影响,但对CYP2D活性有明显诱导作用。体内药动学研究表明,冰片预给药一周能显著加速CYP2D探针底物右美沙芬的体 内清除,表明冰片预给药可以诱导大鼠肝脏CYP2D活性。
大鼠CYP2D1主要存在于肝脏、小肠和脑组织中[15,16],是大鼠与人CYP2D6同源性最高的一种酶[17]。人脑中CYP2D6的表达模式[18]不同于龋齿类动物[19]。吸烟者脑部CYP2D6的表达与活性均高于不吸烟者,且尼古丁能诱导猴大脑中CYP2D的表达与活性,但对大鼠和猴肝脏中CYP2D的表达与活性却无明显影响,可能尼古丁对CYP2D的调控源于转录后修饰,亦有可能尼古丁对肝外CYP2D的调控方式不同于肝内[20]。虽然人肝CYP2D6很难被其他CYP450亚型酶诱导剂 (如苯巴比妥) 诱导[21,22],但缬草和银杏提取物可以诱导人原代肝细胞CYP2D6活性[23]。研究表明CYP2D的转录可能被核激素受体 (NHR) 表达、NHR配体活性改变或表观遗传调控[24,25]。CYP2D mRNA表达水平的降低与几种NHR (如RARa、RXRa、HNF1和HNF3b) mRNA的水平一致,但与通常调控CYP450酶的NHR (如PXR、CAR和HNF4a) 的mRNA水平不一致[26]。
本实验发现冰片诱导了大鼠肝脏CYP2D活性,但对其mRNA和蛋白表达水平却没有显著影响,这可能是因为CYP2D是肝药酶中最具有遗传多态性 的代谢酶[27],冰片对大鼠肝脏中不同CYP2D亚型酶 (如CYP2D1和2D2等) 的影响不同所致; 也可能是由于本文检测的表达是CYP2D1,而活性检测的是CYP2D所致。同时,实验结果也提示冰片对大鼠肝脏CYP2D的调控可能主要在转录后水平[19]。由于人肝脏CYP2D6参与了市场上20%~25% 药物的代谢,冰片对大鼠肝脏CYP2D活性的诱导作用,提示当冰片与CYP2D底物药物共用时,可能存在发生代谢性相互作用的风险。但人和大鼠存在种属差异,本研究结果并不能代表冰片对人肝脏CYP2D6活性的影响,还需利用人源性原代肝细胞等进一步研究冰片对人肝脏CYP2D6表达与活性的影响,才能更加准确预测冰片与CYP2D底物药物联合应用的临床安全性。
| [1] | Thshiro N, Norie M, Yamazaki H. Comparison of cytochrome P450 2D6 and variants in terms of drug oxidation rates and substrate inhibition [J]. Curr Drug Metab, 2011, 12: 412-435. |
| [2] | De Groot MJ, Bijloo GJ, Martens BJ, et a1. A refined substrate model for human cytochrome P450 2D6 [J]. Chem Res Toxicol, 1997, 10: 41-48. |
| [3] | Chen YM, Wang NS. Effect of borneol on the intercellular tight junction and pinocytosis vesicles in vitro blood-brain barrier model [J]. Chin J Integr Med (中国中西医结合杂志), 2004, 24: 632-634. |
| [4] | He H, Shen Q, Li J. Effects of borneol on the intestinal transport and absorption of two P-glycoprotein substrates in rats [J]. Arch Pharm Res, 2011, 34: 1161-1170. |
| [5] | Yu B, Ruan M, Dong X, et al. The mechanism of the opening of the blood-brain barrier by borneol: a pharmacodynamics and pharmacokinetics combination study [J]. J Ethnopharmacol, 2013, 150: 1096-1108. |
| [6] | Cui Y, Li L, Zhang L, et al. Enhancement and mechanism of transdermal absorption of terpene-induced propranolol hydrochloride [J]. Arch Pharm Res, 2011, 34: 1477-1485. |
| [7] | Cai Z, Hou S, Li Y, et al. Effect of borneol on the distribution of gastrodin to the brain in mice via oral administration [J]. J Drug Target, 2008, 16: 178-184. |
| [8] | Xiao YY, Ping QN, Chen ZP. A simple gas chromatographic method for the simultaneous determination and pharmacokinetic study of tetramethylpyrazine phosphate and borneol in mouse plasma and brain tissue after oral administration of the fufang tetramethylpyrazine phosphate tablets [J]. J Chromatogr Sci, 2008, 46: 395-400. |
| [9] | Liu J, Fu S, Wei N, et al. The effects of combined menthol and borneol on fluconazole permeation through the cornea ex vivo [J]. Eur J Pharmacol, 2012, 688: 1-5. |
| [10] | Zhou Y, Li W, Chen L, et al. Enhancement of intestinal absorption of akebia saponin D by borneol and probenecid in situ and in vitro [J]. Environ Toxicol Pharmacol, 2010, 29: 229-234. |
| [11] | Lai XJ, Zhang L, Li JS, et al. Comparative pharmacokinetic and bioavailability studies of three salvianolic acids after the administration of Salviae miltiorrhizae alone or with synthetical borneol in rats [J]. Fitoterapia, 2011, 82: 883-888. |
| [12] | Peng ZH, Song W, Han FM, et al. In vivo and in vitro study of papaverine and its major metabolites [J]. Acta Pharm Sin B, 2009, 44: 95-100. |
| [13] | Xiao RM, Wang JJ, Chen JY, et al. Effects of arecoline on hepatic cytochrome P450 activity and oxidative stress [J]. J Toxicol Sci, 2014, 39: 609-614. |
| [14] | Livak KJ, Schmittgen, TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method [J]. Methods, 2001, 25: 402-408. |
| [15] | Hiroi T, Imaoka S, Chow T, et al. Tissue distributions of CYP2D1, 2D2, 2D3 and 2D4 mRNA in rats detected by RT-PCR [J]. Biochim Biophys Acta, 1998, 1380: 305-312. |
| [16] | Miksys S, Rao Y, Sellers EM, et al. Regional and cellular distribution of CYP2D subfamily member in rat brain [J]. Xenobiotica, 2000, 30: 547. |
| [17] | Gonzalez FJ. The CYP2D subfamily [M] // Ioannides C. Cytochromes P450; Metabolic and Toxicological Aspects. Boca raton: CRC Press, 1996: 183-210. |
| [18] | Miksys S, Rao Y, Hoffmann E, et al. Regional and cellular expression of CYP2D6 in human brain: higher levels in alcoholics [J]. J Neurochem, 2002, 82: 1376-1387. |
| [19] | Yue J, Miksys S, Hoffmann E, et al. Chronic nicotine treatment induces rat CYP2D in the brain but not in the liver: an investigation of induction and time course [J]. J Psychiatry Neurosci, 2008, 33: 54-63. |
| [20] | Mann A, Miksys S, Lee A, et al. Induction of the drug metabolizing enzyme CYP2D in monkey brain by chronic nicotine treatment [J]. Neuropharmacology, 2008, 55: 1147-1155. |
| [21] | Rae JM, Johnson MD, Lippman ME, et al. Rifampin is a selective, pleiotropic inducer of drug metabolism genes in human hepatocytes: studies with cDNA and oligonucleotide expression arrays [J]. J Pharmacol Exp Ther, 2001, 299: 849-857. |
| [22] | Edwards RJ, Price RJ, Watts PS, et al. Induction of cytochrome P450 enzymes in cultured precision-cut human liver slices [J]. Drug Metab Dispos, 2003, 31: 282-288. |
| [23] | Hellum BH, Hu Z, Nilsen OG. The induction of CYP1A2, CYP2D6 and CYP3A4 by six trade herbal products in cultured primary human hepatocytes [J]. Basic Clin Pharmacol Toxicol, 2007, 100: 23-30. |
| [24] | Duncan SA, Navas MA, Dufort D, et al. Regulation of a transcription factor network required for differentiation and metabolism [J]. Science, 1998; 281: 692-695. |
| [25] | Cheung C, Akiyama TE, Kudo G, et al. Hepatic expression of cytochrome P450s in hepatocyte nuclear factor 1-alpha (HNF1 α)-deficient mice [J]. Biochem Pharmacol, 2003, 66: 2011-2020. |
| [26] | Dickmann LJ, Tay S, Senn TD. Changes in maternal liver Cyp2c and Cyp2d expression and activity during rat pregnancy [J]. Biochem Pharmacol, 2008, 75: 1677-1687 |
| [27] | Ingelman-Sundberg M, Sim SC, Gomez A, et al. Influence of cytochrome P450 polymorphisms on drug therapies: pharmacogenntic, pharmacoepigenetic and clinical aspects [J]. Pharmacol Ther, 2007, 116: 496-526. |
 2015, Vol. 50
2015, Vol. 50


