氧化应激 (oxidative stress) 是影响衰老和神经系统疾病的重要因素,氧化应激是由活性氧 (reactive oxygen species,ROS) 自由基介导的,包括超氧阴离子、过氧化氢 (hydrogen peroxide,H2O2) 和羟基自由基等。在正常生理条件下,ROS生成水平与机体抗氧化能力处于动态平衡状态; 当ROS的产生超过细胞抗氧化能力则会发生氧化应激 (oxidative stress),而大脑对氧化应激尤为敏感[1]。
神经退行性疾病是指由慢性进行性中枢神经组织退行性变性而产生的疾病总称,包括阿尔茨海默氏病 (Alzheimer’s disease,AD)、帕金森氏病 (Parkinson’s disease,PD)、亨廷顿氏病 (Huntington disease,HD)、肌萎缩性侧索硬化症 (amyotrophic lateral sclerosis,ALS) 和多发性硬化症 (multiple sclerosis,MS) 等,其发病机制可能与氧化应激及相应的损伤有关。这些疾病都有共同的病理特征: 组织氧化还原平衡发生改变并伴有胶质细胞的活化[2]。在治疗这些疾病的过程中,外源性小分子抗氧化剂仅取得了有限的治疗效果,所以研究者将研究方向转到激活中枢神经系统中的内源性抗氧化酶来降低ROS引起的损害[3]。
Nrf2在细胞抗氧化反应中发挥关键作用。研究表明,随着年龄增长,脑中Nrf2表达下降,导致氧化应激反应失衡,因此Nrf2信号通路可能是治疗神经退行性疾病潜在的研究方向[4]。本文主要阐述了Nrf2信号通路在神经退行性疾病中的作用。
1 Keap1-Nrf2-ARE信号通路及Nrf2诱导的内源性抗氧化酶
细胞内含有多种内源性抗氧化酶参与维持氧化还原平衡。当细胞周围环境中ROS升高时,通过在转录水平的调节能诱导这些细胞抗氧化酶的产生。编码这些抗氧化酶的基因都有共同的启动子元件,被称为抗氧化反应元件 (antioxidant response element,ARE)。ARE是一种顺式调控元件,能够调节Ⅱ相解毒酶等抗氧化酶的表达,机体主要通过激活转录因子Nrf2来调节ARE介导的基因转录。
Nrf2属于Cap'n'Collar碱性亮氨酸拉链家族,被认为是抗氧化防御系统的主控环节。Nrf2有7个保守结构域,即Neh1-Neh7,Nrf2 N末端的Neh2结构域是主要的调节结构域,Neh2含有7个赖氨酸残基 (主要负责泛素结合) 和两个结合位点: ETGE和DLG基序 (维持Nrf2的稳定性) (图 1A)。ETGE和DLG基序能与Keap1 (Kelch-like erythroid cell-derived protein with CNC homology[ECH]-associated protein 1) 蛋白相互作用,Keap1是Cullin3(Cul3)-E3泛素连接酶复合物的底物衔接蛋白,也是Nrf2在胞浆中的结合蛋白,能抑制Nrf2活性,促进Nrf2泛素化并被蛋白酶体降解。Keap1为同源二聚体,主要有3个功能结构域,包括BTB、IVR和Kelch/DGR结构域。N末端的BTB结构域与Cul3蛋白结合,对Keap1的二聚化非常重要; C末端的Kelch/DGR结构域与Nrf2的Neh2结构域结合,有助于维持Nrf2和Keap1的相互作用; IVR结构域含有半胱氨酸残基,能调节Keap1的活性,触发细胞内的氧化还原变化,在维持细胞的氧化还原平衡方面起到关键作用 (图 1A)。
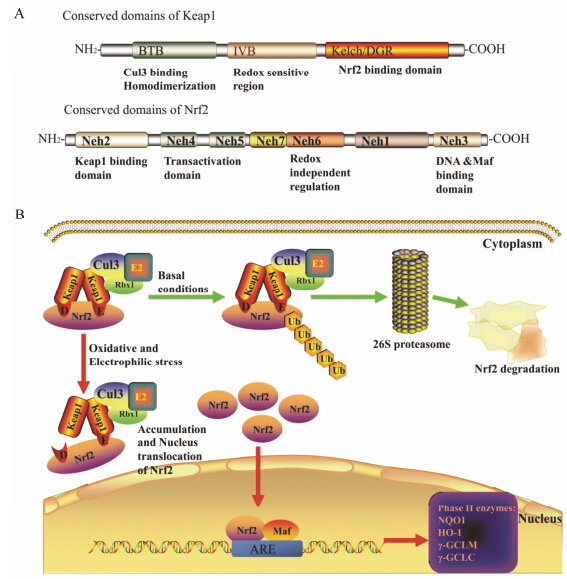
|
Figure 1 Domains of Keap1 and Nrf2 (A); Keap1-Nrf2-ARE signaling pathway (B). ARE: Antioxidant response element |
Nrf2的活性主要由Keap1负性调节。在正常的无应激条件下,大部分Nrf2以非活性状态储存于细胞质中,与Keap1相偶联,并能被泛素-蛋白酶体系统迅速降解,进而维持Nrf2的稳定表达并保持非活性状态。在氧化应激条件下,如亲电试剂、毒素或诱导剂存在时,Keap1与Nrf2的DLG基序解联,但仍与ETGE基序结合,Keap1构象的变化能抑制Nrf2泛素化,因此Keap1与Nrf2结合处于饱和状态且Keap1不能继续降解Nrf2,新合成的Nrf2转移到细胞核 内,与小Maf蛋白 (musculoaponeurotic fibrosarcoma oncogene homolog) 结合成异二聚体后识别并结合ARE,从而启动下游Ⅱ相解毒酶及抗氧化蛋白基因的转录,提高细胞的抗氧化能力。一旦细胞氧化还原平衡得以恢复,Nrf2从细胞核分离,随后转运出细胞核进入细胞质中被泛素化然后降解[5](图 1B)。
Nrf2调控的抗氧化酶主要有: 超氧化物歧化酶 (superoxide dismutase,SOD)、过氧化氢酶 (catalase,CAT)、硫氧还蛋白 (thioredoxin,TRX)、过氧化物氧化还原酶 (peroxiredoxin,PRDX)、谷胱甘肽过氧化物酶 (glutathione peroxidase,GPX)、谷胱甘肽还原酶 (glutathione reductase,GR)、谷氨酰胺半胱氨酸连接酶 (glutamine cysteine ligase,GCL) 和合成酶 (glutamine cysteine synthetase,GCS)、NAD(P)H醌氧化还原酶 [NAD(P)H quinine oxidoreductase,NQO1]、血红素加氧酶-1 (heme oxygenase-1,HO-1) 等。
含金属离子的SOD催化歧化超氧阴离子分解成分子氧和H2O2,构成第一道抗氧化应激防线。SODs包括铜锌超氧化物歧化酶 (SOD1)、锰超氧化物歧化酶 (SOD2) 和细胞外铜锌超氧化物歧化酶 (SOD3),其中SOD1主要在星形胶质细胞和神经元表达,而SOD2主要定位于神经元[6]。
CAT能催化H2O2转换为水和分子氧,然而大脑中CAT活性比外周组织低得多[7]。GPX是依赖还原型谷胱甘肽 (reduced glutathione,GSH) 代谢过氧化氢的另一种酶。作为内源性非酶抗氧化剂和氧自由基清除剂,GSH可以维持细胞内的氧化还原平衡,减缓ROS引起的氧化损伤[8]。同时,GSH能减少H2O2诱导产生的NO和ROS,并能增加Nrf2的水平,激活Nrf2介导的信号通路[9]。谷胱甘肽系统作为机体最重要的一个抗氧化系统,主要存在于星形胶质细胞中。当过氧化氢酶介导的过氧化氢清除过程被抑制时,谷胱甘肽系统表达上调[10]。
NQO1也是非常重要的抗氧化酶,利用NADH或NADPH作为还原辅因子。酚类和多环芳烃类等小分子可以诱导NQO1激活[11]。NQO1主要在星形胶质细胞和脑内皮细胞表达[12]。
HO-1属于热休克蛋白家族,与细胞色素P450催化降解有毒的血红素,产生胆绿素、铁离子和一氧化碳,随后胆绿素被转换成胆红素。胆绿素和胆红素都具有抗氧化和免疫调节特性。HO-1主要在能降解衰老红细胞的器官中表达较高,如脾脏、肝脏的网状内皮细胞和骨髓[13]。在AD、PD、ALS和MS等多种神经退行性疾病中HO-1表达都有增加[14],这可能是因为机体中HO-1在病理条件下试图恢复氧化还原状态或衰减炎症。Nrf2能调节HO-1的变化,保护细胞免受氧化损伤[15]。
2 Nrf2在神经系统疾病介导的神经保护作用
大量研究表明,在神经退行性疾病模型中激活Keap1-Nrf2-ARE信号通路 (Nrf2通路) 具有诱导细胞抗氧化保护作用、减轻神经损伤、延缓疾病进程等作用。激活神经元或星形胶质细胞中Nrf2都有一定的细胞保护作用,但与神经元相比,Nrf2通路在星形胶质细胞中更活跃,抗氧化能力更显著,激活星形胶质细胞的Nrf2能对周围神经元提供神经保护作用,使其免受氧化应激造成的损伤[16]。此外,星形胶质细胞中GSH的含量比神经元高,也提示星形胶质细胞在维持细胞氧化还原平衡起到了重要作用[17]。大多数研究都是针对星形胶质细胞,使其过表达Nrf2从而保护神经元,或是寻找能够调节内源性抗氧化酶的Nrf2小分子激活剂。
2.1 Nrf2在AD中的作用AD是一种进行性神经退行性疾病,是老年性痴呆最常见的形式。AD的主要病理特征是β-淀粉样蛋白 (β-amyloid protein,Aβ) 斑块沉积和神经纤维缠结(neurofibrillary tangles,NFTs)。AD的病因尚不明确,但氧化应激和线粒体功能障碍已被证实可能在其中发挥重要作用[18]。
AD患者脑中反应性胶质细胞增加,导致ROS 和活性氮 (reactive nitrogen species,RNS) 的产生增加及线粒体功能障碍,进一步引起脂质、DNA和蛋白质的氧化损伤[19]。在正常海马中,Nrf2主要在神经元的细胞质和细胞核中表达,其中细胞核中表达更突出; 而AD患者脑中Nrf2主要定位在海马神经 元的细胞质中,细胞核Nrf2表达水平较正常对照组明显下降[20]。在AD小鼠模型中,编码Nrf2、NQO1和GCL等抗氧化酶的mRNAs表达减少,Aβ沉积增加[21]。与非痴呆患者相比,AD患者颞叶皮层和海马组织中抗氧化酶HO-1表达显著升高。HO-1上调的潜在治疗靶点是通过激活泛素-蛋白酶体系统来清除Tau蛋白[22]。此外,NQO1在AD患者神经元和星形胶质细胞中表达增加[23],减少自由基产生,发挥抗氧化作用。
9月龄APP/PS1 AD转基因小鼠双侧海马注射编码Nrf2的慢病毒载体,6个月后发现小鼠空间学习记忆障碍明显改善,编码Nrf2、HO-1的mRNAs表达增加,提示Nrf2对于AD治疗具有巨大潜力[24]。在体外,采用野生型和Nrf2缺陷型小鼠的胚胎分别培养神经干细胞,并使野生型过表达Nrf2,Nrf2过表达能抑制Aβ1-42诱导的神经毒性和神经球的减少,而Nrf2缺陷则加重Aβ1-42诱导神经分化的减少。同时,Aβ1-40对野生型神经干细胞的增殖没有影响,而Nrf2过表达能促进其增殖,Nrf2缺陷则作用相反,表明Nrf2能调节神经干细胞分化和损伤引起的神经发生,对Aβ引起的神经干细胞和神经细胞毒性有保护作用[25]。研究还表明,Nrf2可以诱导自噬适配器蛋白NDP52的表达,NDP52过表达能促进磷酸化Tau蛋白的清除,在Nrf2-/-小鼠脑内,磷酸化和十二烷基肌氨酸钠不可溶的Tau蛋白累积增加[26]。这些都表明激活Nrf2- ARE通路可能是未来治疗AD的一个潜在目标。
2.2 Nrf2在PD中的作用PD是最常见的神经退行性疾病,其病理特征,如运动迟缓、震颤和强直,是由于黑质致密部丢失大于50% 的多巴胺能神经元和纹状体多巴胺水平降低80% 造成的。进一步的病理特征是α-突触核蛋白累积,路易氏小体出现,小胶质细胞和星形胶质细胞增生,神经炎症标志物增多[27]。
研究表明氧化应激对于PD的发生和发展有重要作用[28]。PD患者脑内ROS主要来自于线粒体复合物I的改变和多巴胺在黑质纹状体的氧化代谢,由于PD患者存在慢性神经炎症,活化的小胶质细胞也会产生ROS[29]。因此,以Nrf2为靶点来减轻氧化应激和神经炎症的治疗策略受到越来越多的关注。
DJ-1是与家族型PD有关的重要基因之一,Nrf2和DJ-1之间的分子连接已被阐明[30]。DJ-1有抗氧 化应激的神经保护作用,能阻止Nrf2与其阻遏蛋白Keap1结合以及随后的泛素化降解,从而使Nrf2稳定。DJ-1缺乏导致Nrf2蛋白不稳定,转录反应的基础值和诱导值都会下降。DJ-1缺陷小鼠体内一些抗氧化剂酶如NQO1表达水平降低[31]。
已有研究表明Nrf2对多巴胺能神经元有保护作用。在PD患者中,Nrf2转位到黑质多巴胺能神经元的细胞核中,与年龄匹配的正常对照组相比,胞核中Nrf2的表达量明显增加,这表明机体试图保持ROS的平衡[20]。
Nrf2+/+和Nrf2-/-小鼠注射1-甲基-4苯基-1,2,3,6-四氢吡啶 (MPTP) 后,Nrf2-/-小鼠纹状体的多巴胺转运体和多巴胺水平都低于Nrf2+/+小鼠,多巴胺能神经元损失增多,小胶质细胞浸润和神经炎症反应变强; 在相同的MPTP模型中,口服Nrf2激活剂3-氢-1,2-二硫杂环戊烯-3-硫酮 (1,2-disulfide-3-thione,D3T),激活Nrf2通路,对Nrf2+/+小鼠有神经保护作用,但对Nrf2-/-小鼠却没有保护作用[32]。Nrf2-/-小鼠对于6-羟基多巴胺 (6-OHDA) 模型的易感性可以得到相似的结果,而移植过表达Nrf2的星形胶质细胞可以减轻损伤[33]。
星形胶质细胞选择性表达Nrf2 (GFAP-Nrf2) 小鼠与神经元选择性表达人突变α-突触核蛋白SYN (hSYNA53T) 小鼠杂交,后代hSYNA53T小鼠星形胶质细胞中Nrf2表达增加,发病延迟且寿命延长,同时伴随着运动神经元数量增加、氧化应激减少、脊髓胶质细胞增生衰减以及在TRITON-不溶聚集物中的总hSYNA53T和磷酸化 (Ser129) hSYNA53T急剧减少; 此外,星形胶质细胞中Nrf2过表达能延迟分子伴侣介导的自噬和大自噬的功能障碍,对hSYNA53T诱导的神经毒性提供保护作用[34]。
越来越多的证据表明尿酸盐可能成为PD诊断的生物标记物和PD治疗的神经保护剂,研究发现尿酸盐能够保护SH-SY5Y细胞免受6-OHDA和H2O2引起的细胞损伤,其机制可能是通过减少Nrf2的泛素化和蛋白酶体降解,促进其核转位,增加抗氧化基因的转录和表达,为多巴胺细胞提供神经保护[35]。Nrf2诱导剂如天麻素能减轻MPTP诱导的神经毒性,降低MDA水平,增加HO-1、SODs和GSH的转录,增加小鼠纹状体中Nrf2的核转录,减缓氧化应激[36]。
上述研究都表明,氧化应激与帕金森病的发病机制是紧密相关的,而Nrf2通路是其中不可忽视的关键环节,尤其是在星形胶质细胞中Nrf2过表达取得了有效的治疗效果。如何在星形胶质细胞中激活Nrf2途径或寻找安全有效的Nrf2激活剂是治疗帕金森病的又一个亟需解决的问题。
2.3 Nrf2在HD中的作用HD是一个渐进的常染色体显性遗传的神经退行性疾病。由于一个编码亨 廷顿蛋白 (Huntingtin,Htt) 的基因突变引起CAG 序列过度扩张,导致亨廷顿蛋白氨基端的多聚谷氨酰胺膨胀和突变蛋白积累。HD病理特征是纹状体 (尾状核和壳核) 和大脑皮层退化,被认为是运动功能障碍的潜在原因,临床表现为不自主的肢体舞蹈样运动和肌张力障碍,伴随着认知功能减退和精神症状[37]。
相比正常对照组,HD患者白细胞中8-羟基脱氧鸟苷 (8-hydroxydeoxyguanosine,8-OHdG) 和血浆中丙二醛含量提高,红细胞中SOD1和GPX活性下降[38]。HD患者的纹状体中线粒体复合物II、III和IV缺陷引起线粒体功能障碍,因此,氧化应激可能是HD的发病机制之一[39]。
与Nrf2+/+小鼠相比,Nrf2-/-小鼠更容易受到线粒体复合物II抑制剂3-硝基丙酸 (3-nitro propionic acid,3-NP) 和丙二酸二乙酯的影响,移植过表达Nrf2的星形胶质细胞或用化学方法激活Nrf2,能够保护纹状体免受3-NP和丙二酸二乙酯引起的损伤[40]。
合成三萜类化合物能激活Nrf2,改善3-NP诱导的纹状体损伤,降低氧化应激标志物水平,恢复谷胱甘肽的动态平衡[41]。N171-82Q HD转基因小鼠长期给予含三萜类化合物的饲料能够改善运动功能和延长寿命,增加脑及外周组织中Nrf2诱导的抗氧化基因转录,减缓氧化应激和纹状体萎缩[42]。另一种Nrf2通路激活剂富马酸二甲酯 (dimethyl fumarate,DMF) 口服给予R6/2和YAC128 HD小鼠,小鼠神经元中Nrf2活性增加,运动功能显著改善,能维持运动皮层和纹状体的神经元活性[43]。经颅磁刺激 (TMS) 是用来治疗不同的神经精神病和退行性疾病的常用方法,最近的研究表明,给予3-NP诱导的HD大鼠模型经颅磁刺激治疗后,脑内Nrf2水平提高,提示TMS可以调节Nrf2的表达和核转位[44]。这些研究表明,通过小分子化合物干预或物理治疗方法激活Nrf2通路是未来治疗HD必须思考的问题。
2.4 Nrf2在ALS中的作用ALS是由于在脊髓、脑干、运动皮质的运动神经元发生进行性退变引起的神经退行性疾病,其特征是进行性的四肢无力、肌肉痉挛和肌萎缩。氧化损伤、神经炎症、线粒体功能障碍可能是ALS的致病因素。大部分ALS是散发性的,但病因尚不清楚。约5%~10% ALS是家族性的,其中约20% 家族性ALS案例与SOD1的错义突变相关联[45]。现已证明在啮齿动物模型中,突变的人类SOD1基因过表达能导致ALS样表型[46]。
在ALS患者和ALS啮齿动物模型中观察到,退化的运动神经元周围胶质细胞增生明显,氧化应激标志物增加[47]。氧化应激是最有可能影响ALS病程进展的因素。在ALS患者初级运动皮层区和脊髓中的神经元中,Nrf2的mRNAs和蛋白表达降低,而运动皮层中Keap1 mRNAs的表达含量增加[48]。运动神经元细胞NSC-34细胞转染hSOD1G93A基因后,胞体变圆,神经突起变少变短,Nrf2 mRNAs和蛋白表达减少,HO-1和NQO-1水平降低,氧化应激水平上升[49]。由此研究者推测,降低氧化应激的水平可能改善ALS病情。
过表达SOD1G93A的运动神经元中Nrf2表达减少,谷胱甘肽合成下降,导致神经生长因子NGF诱导的细胞凋亡增加; 反过来,提高Nrf2活性能对抗NGF诱导的凋亡[50]。在ALS小鼠与ARE-hPAP (人胎盘碱性磷酸酶) 小鼠杂交后发现,小鼠在发病前脊髓和肌肉中的ARE驱动基因的表达增加[51]。
从hSOD1G93A大鼠或小鼠上分离出来的星形胶质细胞对共培养的运动神经元有毒性效应,而Nrf2过表达可能降低毒性[52]。在ALS小鼠模型中,突变的hSOD1过表达可以引起运动神经元退变,通过胶质纤维酸性蛋白 (GFAP) 启动子使Nrf2基因在星形胶质细胞过表达可以逆转损伤[53]。GFAP-Nrf2小鼠 与ALS模型小鼠杂交后可以延迟后代ALS小鼠的 发病,并延长其寿命[54]。上述结果表明激活星形胶 质细胞中的Nrf2在治疗ALS时应该是一个合适的 靶标。
在症状发生前给予hSOD1G93A小鼠三萜类化合物,可以减缓小鼠体重降低,增强运动功能,延长寿命; 在小鼠症状开始发作时给予治疗,能延缓疾病进展,具有明显的神经保护作用[55]。这些也进一步表 明激活Nrf2通路的化合物可以作为潜在的ALS治 疗药物。
2.5 Nrf2在MS中的作用MS是一种中枢神经系统自身免疫性脱髓鞘疾病,其特征是促炎性T细胞介导的脱髓鞘,少突胶质细胞缺失,神经胶质瘢痕形成和随后的轴突和神经元损伤。目前MS的发病机制尚不完全清楚。近年来越来越多的研究表明: 氧化应激在神经系统炎症反应脱髓鞘及轴突损伤中发挥着重要的作用。MS患者及啮齿动物EAE (experimental autoimmune encephalomyelitis) 模型中存在氧化应激反应[56]。该研究表明,巨噬细胞、小胶质细胞和星形胶质细胞产生大量自由基,包括NO、ROS和RNS,ROS和RNS能导致神经元轴突、髓鞘和少突胶质 细胞损伤,直接或间接地引起线粒体损伤和兴奋性毒性[57]。
鉴于氧化应激在MS的发病机制中起重要作用,更多的研究方向指向Nrf2通路,通过激活Nrf2通路、降低ROS的产生,从而减缓炎症反应。各种离体和整体实验表明,多种化合物可以调节Nrf2通路。
萝卜硫素 (sulforaphane,SFP) 能显著抑制EAE小鼠的病程发展和病情严重程度,并能减轻炎性浸润和小鼠脊髓脱髓鞘。SFP能使claudin-5和紧密连接蛋白的分布显著改善,减少MMP-9的表达水平,并保护血-脑屏障。同时,SFP通过激活Nrf2通路及增加HO-1和NQO1的表达水平,降低小鼠脑内的氧化应激水平[58]。
大剂量依达拉奉能显著降低EAE大鼠的发病率及神经功能评分,其保护作用机制可能为: 通过上调Nrf2诱导抗氧化酶及解毒酶的表达,清除体内氧化应激产生的多余自由基,阻断氧化应激通路; 保护活化的小胶质细胞[59]。
延胡索酸酯 (fumaric acid esters,FAEs) 是一类综合性的安全化合物,DMF是其中最重要的形式,DMF有一个代谢产物,富马酸单甲酯 (monomethyl fumarate,MMF)。研究表明,FAEs能改善EAE小鼠的病程,保护髓鞘、轴突和神经元。在体外实验中,FAEs能增加小鼠神经元在氧化应激下的细胞存活率,并能保护人类或啮齿类动物的星形胶质细胞对抗氧化应激。最主要的机制可能是其代谢产物MMF改变了Keap1和Nrf2的相互作用,使Nrf2核转位从而启动下游编码抗氧化基因的转录和表达。DMF的口服形式BG-12,在MS治疗的第2、3期临床试验阶段,能减少模型大鼠的复发率,减缓MS患者脑损伤的发展。2013 年3月27日,美国食品药品监督管理局批准DMF (Tecfidera) 在美国治疗复发缓解型多发型硬化症 (relapsing-remitting,MS)。FAEs (或DMF) 是第1个以ROS引起的神经炎症为靶点,通过激活内源性抗氧化反应来治疗MS的上市药物,这表明寻找能激活内源性抗氧化反应用来治疗神经系统疾病的化合物具有广阔前景,而Nrf2就是其中最具代表意义的靶标[60, 61, 62, 63]。
3 Nrf2激活剂
除了神经退行性疾病,Nrf2通路在其他多种疾病病理机制中也都发挥着重要作用,如慢性肾病、糖尿病和肿瘤等,因此寻找安全有效的Nrf2激活剂,已经成为药物研发的新方向。
SFP在西兰花等十字花科蔬菜中大量存在,属于异硫氰酸盐,大量研究表明SFP是Nrf2通路的诱导剂。SFP激活Nrf2的机制主要是改变了Keap1半胱氨酸残基的构象,Nrf2入核积累并激活下游抗氧化酶的转录。SFP还能提高细胞内激酶活性从而使Nrf2磷酸化或调节Nrf2的活性[64],诱导II相酶的表达。SFP在多种体内外病理模型中都有一定的保护改善作用,如SFP能促进脑损伤大鼠和野生型小鼠模型中血肿的清除,但在Nrf2基因敲除小鼠中却没有改善作用[65]。在2型糖尿病诱导的心肌症模型中,SFP能上调Nrf2表达和下游NQO1和HO-1基因的转录[66]。SFP能逆转地塞米松引起的细胞凋亡,降低ROS的产生,增加Nrf2和下游HO-1等抗氧化酶的表达。导入小干扰RNA使Nrf2基因沉默,能阻断SFP的保护作用[67]。此外,在肾功能障碍、肝纤维化和肿瘤等模型中SFP均能减缓氧化应激,改善病情。临床研究显示,口服SFP能增加上呼吸道中抗氧化酶的表达,如NQO1、HO-1、GSTM1和GSTP1等[68]。SFP在多种模型中表现出较好的抗氧化作用,也使其成为研究最为透彻的Nrf2激活剂之一。
甲基巴多索隆 (bardoxolone methyl,BARD) 是齐墩果烷三萜类化合物,主要从齐墩果酸里提取,BARD能与Keap1的甲基半胱氨酸残基相互作用,抑制Nrf2泛素化,Nrf2入核并与ARE结合进而上调抗氧化基因的转录[69]。由于其具有激活Nrf2并能抑制NF-κB的药理特性,BARD是非常有潜力的抗氧化和抗炎药物。在对227名中度慢性肾病和2型糖尿病 的2期临床发现BARD能改善肾小球滤过率[70]。然而,在3期临床试验中,治疗组不良反应和死亡率增加,鉴于其高危险性而不得不延迟BARD的研究[71]。而最近对2 185名2型糖尿病和4期慢性肾病患者 临床研究表明,住院前就有心脏病风险和高于基础值的B-型钠尿肽患者每天服用BARD 20 mg,患心 脏病的风险增加了60%,而没有这些特征的患者服用BARD和服用安慰剂,患心脏病的风险没有差别,其他不良反应也是相似的结果[72]。这提示,在将来的临床试验中,应该认真挑选参与者并对药物反应进行精确的监控,才能更好地了解和控制不良反应。
特丁基对苯二酚 (tert-butylhydroquinone,tBHQ) 是合成多酚类抗氧化剂,tBHQ激活Nrf2通路,诱导II相解毒酶产生。其作用机制可能是促进ROS介导的Nrf2与Keap1的解离[73],维持Nrf2的稳定性,并激活PI3K/Akt通路和MAPK通路[74]。大鼠缺血再灌注24 h甚至1个月后,侧脑室或腹腔内给予tBHQ能减少皮质损伤和改善感觉运动障碍。单独摄入tBHQ后,大鼠和Nrf2+/+小鼠体内皮质谷胱甘肽水平显著增长,而在Nrf2-/-小鼠体内却没有变化。显微注射皮质内内皮素-1造成神经元死亡模型,摄入tBHQ可减轻Nrf2+/+小鼠体内症状,但在Nrf2-/-小鼠体内无变化[75]。虽然tBHQ在多种疾病模型中都有较好的疗效,但也有研究表明长期接触tBHQ能诱导癌变[76]。因此,更加深入了解tBHQ的作用机制才能更好的趋利避害。
白藜芦醇 (resveratrol) 是第二大植物代谢物,在葡萄、红酒和浆果中大量存在。白藜芦醇有多种药理学活性,如抗氧化、抗炎和抗癌等作用。最近研究表明白藜芦醇能调节Nrf2的表达,并增加HO-1等抗氧化酶的表达。白藜芦醇还能降低LPS诱导的小鼠心肌损伤和人源性心肌细胞凋亡,抑制炎症细胞因子的产生,提高心脏中Nrf2表达[77]。在培养的冠状动脉内皮细胞和高脂诱导的小鼠模型中,白藜芦醇能增加Nrf2的转录,增加Nrf2靶基因NQO1、γ-谷氨酸半胱氨酸合成酶和HO-1的表达[78]。
姜黄素 (curcumin) 是从姜黄里提取的多元酚,有研究表明姜黄素可以通过调节Nrf2来减缓氧化应激[79]。因此,它在多种疾病中都有保护作用,如内分泌、神经和肾脏等疾病及癌症等。研究发现,姜黄素可以降低LPS引起的炎症,增加HO-1表达,而对于Nrf2-/-小鼠则没有改善作用[80]。在局灶脑缺血模型中姜黄素可以激活Nrf2,增加SOD和GPX的活性,发挥神经保护作用[81]。
儿茶酚 (catechins) 是黄烷醇的单体复合物,其中最重要的组分是表没食子儿茶素没食子酸酯 (epigallocatechin gallate,EGCG)。EGCG能作用于Nrf2通路,降低ROS水平,诱导ARE介导的包括II相解毒酶在内的抗氧化基因表达,减缓氧化应激[82]。其激活Nrf2作用机制主要是: 氧化EGCG能与GSH结合,从而降低胞内GSH的水平,导致氧化还原稳态的失衡,触发Nrf2磷酸化。某些EGCG的活性形式能与Keap1的半胱氨酸残基直接作用,激活Nrf2。EGCG自氧化产生的ROS能激活上游激酶并氧化Keap1的半胱氨酸硫醇,Nrf2被磷酸化,促进Nrf2的核转位[83]。
除了这些化合物外,还有很多化合物都能影响Nrf2的转录和表达,大部分都是从天然产物中提取得到的,如天麻素、肉桂醛、大蒜素、番茄红素和黄芩苷等。这些化合物共同的调节机制是: 促进Nrf2的核转位,激活下游II相解毒酶的表达。但这些研究大都是通过离体或动物实验进行的,还缺乏临床试验的数据。相信随着研究的推进,这些Nrf2激活剂的作用机制将会更加准确和清晰。
4 小结在过去几十年中,通过激活Nrf2通路治疗神经退行性疾病已经取得了显著成果。越来越多的研究 探索了在不同的病理条件下Nrf2的保护作用,以及Nrf2参与对抗有毒试剂和氧化应激中的保护作用。更重要的是,大量研究证明,在整体和离体神经退行性疾病模型中上调Nrf2来驱动相应的抗氧化酶系统是有保护作用的。因此,Nrf2-ARE信号通路的激活可 能代表了许多中枢神经系统疾病的治疗靶标。Nrf2诱导剂代表了新一代药物,可以激活多种细胞防御效应。然而,关于Nrf2有效诱导剂的报道有限,有必要进一步解开这些诱导剂的作用机制和功能,为神经退行性疾病及其他中枢系统疾病的治疗提供参考 及帮助。不能忽略的是,目前关于Nrf2的激活能否 引起其他副反应的报道很少,只有更加全面深刻地研究Nrf2才能更有效地研发出治疗神经系统疾病 的新药。
| [1] | Dröge W, Schipper HM. Oxidative stress and aberrant signaling in aging and cognitive decline [J]. Aging cell, 2007, 6: 361-370. |
| [2] | Lobsiger CS, Cleveland DW. Glial cells as intrinsic components of non-cell-autonomous neurodegenerative disease [J]. Nat Neurosci, 2007, 10: 1355-1360. |
| [3] | Hardingham GE, Lipton SA. Regulation of neuronal oxidative and nitrosative stress by endogenous protective pathways and disease processes [J]. Antioxid Redox Signal, 2011, 14: 1421-1424. |
| [4] | Ungvari Z, Bagi Z, Feher A, et al. Resveratrol confers endothelial protection via activation of the antioxidant transcription factor Nrf2 [J]. Am J Physiol Heart Circ Physiol, 2010, 299: H18-H24. |
| [5] | Jaramillo MC, Zhang DD. The emerging role of the Nrf2-Keap1 signaling pathway in cancer [J]. Genes Dev, 2013, 27: 2179-2191. |
| [6] | Johnson F, Giulivi C. Superoxide dismutases and their impact upon human health [J]. Mol Aspects Med, 2005, 26: 340-352. |
| [7] | Ho YS, Xiong Y, Ma WC, et al. Mice lacking catalase develop normally but show differential sensitivity to oxidant tissue injury [J]. J Biol Chem, 2004, 279: 32804-32812. |
| [8] | Schulz JB, Lindenau J, Seyfried J, et al. Glutathione, oxidative stress and neurodegeneration [J]. Eur J Biochem, 2000, 267: 4904-4911. |
| [9] | Song J, Kang SM, Lee WT, et al. Glutathione protects brain endothelial cells from hydrogen peroxide-induced oxidative stress by increasing Nrf2 expression [J]. Exp Neurobiol, 2014, 23: 93-103. |
| [10] | Liddell JR, Dringen R, Crack PJ, et al. Glutathione peroxidase 1 and a high cellular glutathione concentration are essential for effective organic hydroperoxide detoxification in astrocytes [J]. Glia, 2006, 54: 873-879. |
| [11] | De Long MJ, Prochaska HJ, Talalay P. Induction of NAD(P)H: quinone reductase in murine hepatoma cells by phenolic antioxidants, azo dyes, and other chemoprotectors: a model system for the study of anticarcinogens [J]. Proc Natl Acad Sci USA, 1986, 83: 787-791. |
| [12] | Siegel D, Ross D. Immunodetection of NAD (P) H: quinone oxidoreductase 1 (NQO1) in human tissues [J]. Free Radic Biol Med, 2000, 29: 246-253. |
| [13] | Ryter S W, Alam J, Choi AMK. Heme oxygenase-1/carbon monoxide: from basic science to therapeutic applications [J]. Physiol Rev, 2006, 86: 583-650. |
| [14] | Cuadrado A, Rojo AI. Heme oxygenase-1 as a therapeutic target in neurodegenerative diseases and brain infections [J]. Curr Pharm Des, 2008, 14: 429-442. |
| [15] | Shih AY, Imbeault S, Barakauskas V, et al. Induction of the Nrf2-driven antioxidant response confers neuroprotection during mitochondrial stress in vivo [J]. J Biol Chem, 2005, 280: 22925-22936. |
| [16] | Vargas MR, Johnson JA. The Nrf2-ARE cytoprotective pathway in astrocytes [J]. Expert Rev Mol Med, 2009, 11: e17. |
| [17] | Shih AY, Johnson DA, Wong G, et al. Coordinate regulation of glutathione biosynthesis and release by Nrf2-expressing glia potently protects neurons from oxidative stress [J]. J Neurosci, 2003, 23: 3394-3406. |
| [18] | Bertram L, Tanzi RE. Thirty years of Alzheimer's disease genetics: the implications of systematic meta-analyses [J]. Nat Rev Neurosci, 2008, 9: 768-778. |
| [19] | Shaftel SS, Griffin WS, O'Banion MK. The role of interleukin-1 in neuroinflammation and Alzheimer disease: an evolving perspective [J]. J Neuroinflammation, 2008, 5: 7. |
| [20] | Ramsey CP, Glass CA, Montgomery MB, et al. Expression of Nrf2 in neurodegenerative diseases [J]. J Neuropathol Exp Neurol, 2007, 66: 75-85. |
| [21] | Kanninen K, Malm TM, Jyrkkänen HK, et al. Nuclear factor erythroid 2-related factor 2 protects against beta amyloid [J]. Mol Cell Neurosci, 2008, 39: 302-313. |
| [22] | Schipper HM, Song W, Zukor H, et al. Heme oxygenase-1 and neurodegeneration: expanding frontiers of engagement [J]. J Neurochem, 2009, 110: 469-485. |
| [23] | Wang YX, Santa-Cruz K, DeCarli C, et al. NAD(P)H: quinone oxidoreductase activity is increased in hippocampal pyramidal neurons of patients with Alzheimer's disease [J]. Neurobiol Aging, 2000, 21: 525-531. |
| [24] | Kanninen K, Heikkinen R, Malm T, et al. Intrahippocampal injection of a lentiviral vector expressing Nrf2 improves spatial learning in a mouse model of Alzheimer's disease [J]. Proc Natl Acad Sci USA, 2009, 106: 16505-16510. |
| [25] | Kärkkäinen V, Pomeshchik Y, Savchenko E, et al. Nrf2 regulates neurogenesis and protects neural progenitor cells against Aβ toxicity [J]. Stem Cells, 2014, 32: 1904-1916. |
| [26] | Jo C, Gundemir S, Pritchard S, et al. Nrf2 reduces levels of phosphorylated tau protein by inducing autophagy adaptor protein NDP52 [J]. Nat Commun, 2014, 5: 3496. |
| [27] | Moore DJ, West AB, Dawson VL, et al. Molecular pathophysiology of Parkinson's disease [J]. Annu Rev Neurosci, 2005, 28: 57-87. |
| [28] | Jenner P. Oxidative stress in Parkinson's disease [J]. Ann Neurol, 2003, 53: S26-36. |
| [29] | Lee JK, Tran T, Tansey MG. Neuroinflammation in Parkinson's disease [J]. J Neuroimmune Pharmacol, 2009, 4: 419-429. |
| [30] | Clements CM, McNally RS, Conti BJ, et al. DJ-1, a cancerand Parkinson's disease-associated protein, stabilizes the antioxidant transcriptional master regulator Nrf2 [J]. Proc Natl Acad Sci USA, 2006, 103: 15091-15096. |
| [31] | Malhotra D, Thimmulappa R, Navas-Acien A, et al. Expression of concern: decline in NRF2-regulated antioxidants in chronic obstructive pulmonary disease lungs due to loss of its positive regulator, DJ-1 [J]. Am J Respir Crit Care Med, 2008, 178: 592-604. |
| [32] | Burton NC, Kensler TW, Guilarte TR. In vivo modulation of the Parkinsonian phenotype by Nrf2 [J]. Neurotoxicology, 2006, 27: 1094-1100. |
| [33] | Jakel RJ, Townsend JA, Kraft AD, et al. Nrf2-mediated protection against 6-hydroxydopamine [J]. Brain Res, 2007, 1144: 192-201. |
| [34] | Gan L, Vargas MR, Johnson DA, et al. Astrocyte-specific overexpression of Nrf2 delays motor pathology and synuclein aggregation throughout the CNS in the alpha-synuclein mutant (A53T) mouse model [J]. J Neurosci, 2012, 32: 17775-17787. |
| [35] | Zhang N, Shu HY, Huang TT, et al. Nrf2 Signaling contributes to the neuroprotective effects of urate against 6-OHDA toxicity [J]. PLoS One, 2014, 9: e100286. |
| [36] | Wang XL, Xing GH, Hong B, et al. Gastrodin prevents motor deficits and oxidative stress in the MPTP mouse model of Parkinson's disease: involvement of ERK1/2-Nrf2 signaling pathway [J]. Life Sci, 2014, 114: 77-85. |
| [37] | Bates G. Huntingtin aggregation and toxicity in Huntington's disease [J]. Lancet, 2003, 361: 1642-1644. |
| [38] | Chen CM, Wu YR, Cheng ML, et al. Increased oxidative damage and mitochondrial abnormalities in the peripheral blood of Huntington's disease patients [J]. Biochem Biophys Res Commun, 2007, 359: 335-340. |
| [39] | Browne SE, Beal MF. Oxidative damage in Huntington's disease pathogenesis [J]. Antioxid Redox Signal, 2006, 8: 2061-2073. |
| [40] | Calkins MJ, Jakel RJ, Johnson DA, et al. Protection from mitochondrial complex II inhibition in vitro and in vivo by Nrf2-mediated transcription [J]. Proc Natl Acad Sci USA, 2005, 102: 244-249. |
| [41] | Yang LC, Calingasan NY, Thomas B, et al. Neuroprotective effects of the triterpenoid, CDDO methyl amide, a potent inducer of Nrf2-mediated transcription [J]. PLoS One, 2009, 4: e5757. |
| [42] | Stack C, Ho D, Wille E, et al. Triterpenoids CDDO-ethyl amide and CDDO-trifluoroethyl amide improve the behavioral phenotype and brain pathology in a transgenic mouse model of Huntington's disease [J]. Free Radic Biol Med, 2010, 49: 147-158. |
| [43] | Ellrichmann G, Petrasch-Parwez E, Lee DH, et al. Efficacy of fumaric acid esters in the R6/2 and YAC128 models of Huntington's disease [J]. PLoS One, 2011, 6: e16172. |
| [44] | Tasset I, Pérez-Herrera A, Medina FJ, et al. Extremely low-frequency electromagnetic fields activate the antioxidant pathway Nrf2 in a Huntington's disease-like rat model [J]. Brain Stimul, 2013, 6: 84-86. |
| [45] | Rowland LP, Shneider NA. Amyotrophic lateral sclerosis [J]. N Engl J Med, 2001, 344: 1688-1700. |
| [46] | Gurney ME, Pu H, Chiu AY, et al. Motor neuron degeneration in mice that express a human Cu, Zn superoxide dismutase mutation [J]. Science, 1994, 264: 1772-1775. |
| [47] | Barbeito LH, Pehar M, Cassina P, et al. A role for astrocytes in motor neuron loss in amyotrophic lateral sclerosis [J]. Brain Res Rev, 2004, 47: 263-274. |
| [48] | Sarlette A, Krampfl K, Grothe C, et al. Nuclear erythroid 2-related factor 2-antioxidative response element signaling pathway in motor cortex and spinal cord in amyotrophic lateral sclerosis [J]. J Neuropathol Exp Neurol, 2008, 67: 1055-1062. |
| [49] | Wang F, Lu Y, Qi F, et al. Effect of the human SOD1-G93A gene on the Nrf2/ARE signaling pathway in NSC-34 cells [J]. Mol Med Rep, 2014, 9: 2453-2458. |
| [50] | Pehar M, Vargas MR, Robinson KM, et al. Mitochondrial superoxide production and nuclear factor erythroid 2-related factor 2 activation in p75 neurotrophin receptor-induced motor neuron apoptosis [J]. J Neurosci, 2007, 27: 7777-7785. |
| [51] | Kraft AD, Resch JM, Johnson DA, et al. Activation of the Nrf2-ARE pathway in muscle and spinal cord during ALS-like pathology in mice expressing mutant SOD1 [J]. Exp Neurol, 2007, 207: 107-117. |
| [52] | Nagai M, Re DB, Nagata T, et al. Astrocytes expressing ALS-linked mutated SOD1 release factors selectively toxic to motor neurons [J]. Nat Neurosci, 2007, 10: 615-622. |
| [53] | Vargas MR, Pehar M, Díaz-Amarilla PJ, et al. Transcriptional profile of primary astrocytes expressing als-linked mutant SOD1 [J]. J Neurosci Res, 2008, 86: 3515-3525. |
| [54] | Vargas MR, Johnson DA, Sirkis DW, et al. Nrf2 activation in astrocytes protects against neurodegeneration in mouse models of familial amyotrophic lateral sclerosis [J]. J Neurosci, 2008, 28: 13574-13581. |
| [55] | Neymotin A, Calingasan NY, Wille E, et al. Neuroprotective effect of Nrf2/ARE activators, CDDO ethylamide and CDDO trifluoroethylamide, in a mouse model of amyotrophic lateral sclerosis [J]. Free Radic Biol Med, 2011, 51: 88-96. |
| [56] | LeVine SM, Chakrabarty A. The role of iron in the pathogenesis of experimental allergic encephalomyelitis and multiple sclerosis [J]. Ann N Y Acad Sci, 2004, 1012: 252-266. |
| [57] | Arnold P, Mojumder D, Detoledo J, et al. Pathophysiological processes in multiple sclerosis: focus on nuclear factor erythroid-2-related factor 2 and emerging pathways [J]. Clin Pharmacol, 2014, 6: 35-42. |
| [58] | Li B, Cui W, Liu J, et al. Sulforaphane ameliorates the development of experimental autoimmune encephalomyelitis by antagonizing oxidative stress and Th17-related inflammation in mice [J]. Exp Neurol, 2013, 250: 239-249. |
| [59] | Zhang QL, Guo L, Hu YF, et al. The dynamic expression of Nrf2 and HO-1 in spinal cord tissues of experimental antoimmune encephalomyelitis of rats and the mechanism underlying neuroprotective effect of edaravone [J]. Chin J Immunol (中国免疫学杂志), 2010, 26: 514-519. |
| [60] | Linker RA, Lee DH, Ryan S, et al. Fumaric acid esters exert neuroprotective effects in neuroinflammation via activation of the Nrf2 antioxidant pathway [J]. Brain, 2011, 134: 678-692. |
| [61] | Nicholas JA, Boster AL, Imitola J, et al. Design of oral agents for the management of multiple sclerosis: benefit and risk assessment for dimethyl fumarate [J]. Drug Des Devel Ther, 2014, 8: 897-908. |
| [62] | Fox RJ, Miller DH, Phillips JT, et al. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis [J]. N Engl J Med, 2012, 367: 1087-1097. |
| [63] | Gold R, Kappos L, Arnold DL, et al. Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis [J]. N Engl J Med, 2012, 367: 1098-1107. |
| [64] | Keum YS. Regulation of the Keap1/Nrf2 system by chemopreventive sulforaphane: implications of posttranslational modifications [J]. Ann NY Acad Sci, 2011, 1229: 184-189. |
| [65] | Zhao XR, Sun GH, Ting SM, et al. Cleaning up after ICH: the role of Nrf2 in modulating microglia function and hematoma clearance [J]. J Neurochem, 2014, doi: 10.1111/jnc.12974. |
| [66] | Zhang Z, Wang S, Zhou S, et al. Sulforaphane prevents the development of cardiomyopathy in type 2 diabetic mice probably by reversing oxidative stress-induced inhibition of LKB1/AMPK pathway [J]. J Mol Cell Cardiol, 2014, 77: 42-52. |
| [67] | Lin H, Wei B, Li G, et al. Sulforaphane reverses glucocorticoidinduced apoptosis in osteoblastic cells through regulation of the Nrf2 pathway [J]. Drug Des Devel Ther, 2014, 8: 973-982. |
| [68] | Riedl MA, Saxon A, Diaz-Sanchez D. Oral sulforaphane increases Phase II antioxidant enzymes in the human upper airway [J]. Clin Immunol, 2009, 130: 244-251. |
| [69] | Cleasby A, Yon J, Day PJ, et al. Structure of the BTB domain of KEAP1 and its interaction with the triterpenoid antagonist CDDO [J]. PLoS One, 2014, 9: e98896. |
| [70] | Pergola PE, Raskin P, Toto RD, et al. Bardoxolone methyl and kidney function in CKD with type 2 diabetes [J]. N Engl J Med, 2011, 365: 327-336. |
| [71] | de Zeeuw D, Akizawa T, Audhya P, et al. Bardoxolone methyl in type 2 diabetes and stage 4 chronic kidney diseasec [J]. N Engl J Med, 2013, 369: 2492-2503. |
| [72] | Chin MP, Wrolstad D, Bakris GL, et al. Risk factors for heart failure in patients with type 2 diabetes mellitus and stage 4 chronic kidney disease treated with bardoxolone methyl [J]. J Card Fail, 2014, 20: 953-958. |
| [73] | Hahn ME, McArthur AG, Karchner SI, et al. The transcriptional response to oxidative stress during vertebrate development: effects of tert-butylhydroquinone and 2,3,7,8-tetrachlorodibenzop-dioxin [J]. PLoS One, 2014, 9: e113158. |
| [74] | Gharavi N, Haggarty S, El-Kadi AO. Chemoprotective and carcinogenic effects of tert-butylhydroquinone and its metabolites [J]. Curr Drug Metab, 2007, 8: 1-7. |
| [75] | Shih AY, Li P, Murphy TH. A small-molecule-inducible Nrf2-mediated antioxidant response provides effective prophylaxis against cerebral ischemia in vivo [J]. J Neurosci, 2005, 25: 10321-10335. |
| [76] | Li YB, Seacat A, Kuppusamy P, et al. Copper redox-dependent activation of 2-tert-butyl (1, 4) hydroquinone: formation of reactive oxygen species and induction of oxidative DNA damage in isolated DNA and cultured rat hepatocytes [J]. Mutat Res, 2002, 518: 123-133. |
| [77] | Hao EK, Lang FF, Chen Y, et al. Resveratrol alleviates endotoxin-induced myocardial toxicity via the Nrf2 transcription factor [J]. PLoS One, 2013, 8: e69452. |
| [78] | Ungvari Z, Bagi Z, Feher A, et al. Resveratrol confers endothelial protection via activation of the antioxidant transcription factor Nrf2 [J]. Am J Physiol Heart Circ Physiol, 2010, 299: H18-H24. |
| [79] | Ye SF, Hou ZQ, Zhong LM, et al. Effect of curcumin on the induction of glutathione S-transferases and NADP(H): quinone oxidoreductase and its possible mechanism of action [J]. Acta Pharm Sin (药学学报), 2007, 42: 376-380. |
| [80] | Boyanapalli SS, Paredes-Gonzalez X, Fuentes F, et al. Nrf2 Knockout attenuates the anti-inflammatory effects of phenethyl isothiocyanate and curcumin [J]. Chem Res Toxicol, 2014, 27: 2036-2043. |
| [81] | Yang CH, Zhang XJ, Fan HG, et al. Curcumin upregulates transcription factor Nrf2, HO-1 expression and protects rat brains against focal ischemia [J]. Brain Res, 2009, 1282: 133-141. |
| [82] | Sahin K, Tuzcu M, Gencoglu H, et al. Epigallocatechin-3-gallate activates Nrf2/HO-1 signaling pathway in cisplatininduced nephrotoxicity in rats [J]. Life Sci, 2010, 87: 240-245. |
| [83] | Na HK, Surh YJ. Modulation of Nrf2-mediated antioxidant and detoxifying enzyme induction by the green tea polyphenol EGCG [J]. Food Chem Toxicol, 2008, 46: 1271-1278. |
 2015, Vol. 50
2015, Vol. 50


