2. 中国药科大学药学院, 江苏 南京 210009
2. College of Pharmacy, China Pharmaceutical University, Nanjing 210009, China
液相色谱-串联质谱 (LC-MS/MS) 技术因具有高灵敏度和高选择性的特点,广泛应用于生物样品中药物或代谢产物的定量分析[1]。与HPLC-UV方法不同,LC-MS/MS方法在生物样品分析时面临的技术挑战之一是基质效应。美国[2]、欧盟[3]和我国[4]在生物分析方法验证的指导原则中均明确指出,LC-MS/ MS方法在整个分析过程中需通过适当的方法减少基质效应的影响,以保证方法的精密度与准确度。通过选择合适的样品预处理方法、优化色谱分离条件可以有效地克服基质效应,但这往往需要花费较长的时间。待测物的结构类似物,特别是稳定同位素内标,由于与待测物有着相似的物理化学性质、色谱保留时间和质谱裂解方式一致,可以有效地校正基质效应,保证分析结果的准确性和重现性[5,6,7,8,9]。近年来随着稳定同位素在LC-MS/MS方法的应用,人们逐渐意识到同位素内标纯度和待测物的同位素分布对测定的影响[10,11],但缺少有效的评价系统。本文以伊伐布雷定人血浆样品LC-MS/MS分析方法为例,探讨同位素内标对测定结果的影响。
伊伐布雷定 (ivabradine,结构见图 1A) 是首个特异性减慢心率的药物,主要用于治疗对β受体阻断剂禁忌或不能耐受的稳定型心绞痛[12,13,14,15]。N-去甲基伊伐布雷定 (N-demethylivabradine,结构见图 1B) 是其主要的活性代谢产物[16]。目前市售盐酸伊伐布雷定片需每日服用2次,血药浓度波动较大,可能影响疗效或增加药物不良反应发生率。将伊伐布雷定制成缓释制剂后,可减少给药次数,并使血药浓度较长时间保持在有效范围内。因此,伊伐布雷定缓释制剂的开发具有重要的临床意义。进行伊伐布雷定缓释片人体药动学研究的关键是对血浆样品中伊伐布雷定及活性代谢物浓度进行测定。目前,已有文献[17,18,19,20]报道采用LC-MS/MS法测定血浆中伊伐布雷定或其代谢物。伊伐布雷定分子中含有27个碳原子,其同位素峰 [M+H+3]+ 丰度比为0.75%,可能会干扰市售的稳定同位素内标d3-伊伐布雷定测定。
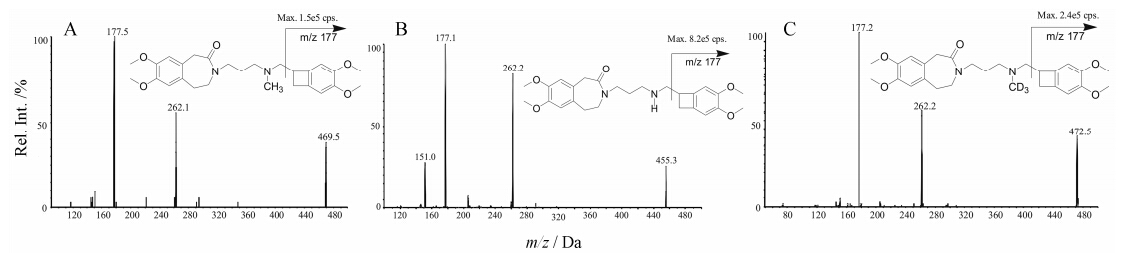 |
Figure 1 Product ion mass spectra of protonated molecules obtained from ivabradine (A),N-demethylivabradine (B),and IS d3-ivabradine (C) |
硫酸氢伊伐布雷定对照品 (含量100%,批号RS0804120228)、N-去甲基伊伐布雷定 (含量97.6%,批号2013041102)、硫酸氢伊伐布雷定缓释片 (规格: 10 mg/片,批号P02080413021951) 均由江苏恒瑞医药股份有限公司提供; 盐酸伊伐布雷定片 (规格: 5 mg/片,批号: 145953) 购自法国Les Laboratoires Servier; d3-伊伐布雷定 (化学纯度98.0%,同位素纯度98.8%,批号4-AKT-77-1) 购自加拿大TRC公司; 甲醇 (美国Sigma公司)、乙腈 (德国Merck公司)、醋酸铵 (美国ROE公司) 均为色谱纯; 去离子水由Millipore纯水仪制备。 仪器
美国Applied Biosystems公司的API 4000型三重四极杆串联质谱仪; 配备电喷雾电离源 (ESI源); 日本岛津公司的岛津液相色谱系统,包括LC- 20AD型二元液相泵,SIL-HTA型自动进样器和美国Agilent公司的Agilent 1100柱温箱。 色谱条件
分析柱: Capcell PAK C18色谱柱 (100 mm × 4.6 mm,5 μm,日本资生堂公司); 预柱: C18保护柱 (4.0 mm x 3.0 mm,5 μm,美国Phenomenex公司); 流动相: 甲醇-5 mmol·L-1醋酸铵水溶液,梯度洗脱 (0~2.0 min,甲醇45%~85%; 2.0~4.5 min,甲醇85%; 4.5~5.0 min,甲醇85%~45%; 5.0~5.5 min,甲醇45%); 流速: 0.6 mL·min-1; 柱温: 40 ℃; 进样量: 10 μL。 质谱条件
离子源为ESI源; 正离子模式检测; 源喷射电压为5 kV; 离子源温度为450 ℃; 离子源气体1 (N2) 压力为40 psi (1 psi ≈ 6.9 kPa); 离子源气体2 (N2) 压力为40 psi; 气帘气体 (N2) 压力为10 psi; 扫描方式为多反应监测; 各待测物的离子反应分别为: m/z 469.2 → m/z 177.2 (伊伐布雷定)、m/z 455.1 → m/z 177.2 (N-去甲基伊伐布雷定)、m/z 472.5 → m/z 177.2 (d3-伊伐布雷定 )。 标准系列样品和质控样品的制备
分别精密称取伊伐布雷定和N-去甲基伊伐布雷定对照品各两份,一份用于标准系列样品的制备,一份用于质控样品的制备。分别以甲醇溶解并定容至10 mL,分别获得浓度均为1.00 mg·mL-1左右的储备液,以空白血浆稀释各储备液,获得一定浓度的标准系列样品和质量控制 (QC) 样品。本实验标准系列样品中伊伐布雷定/ N-去甲基伊伐布雷定质量浓度分别为: 0.100/0.050 0、0.300/0.100、1.00/0.300、3.00/1.00、10.0/3.00、20.0/10.0和60.0/20.0 ng·mL-1。QC样品中伊伐布雷定/N-去甲基伊伐布雷定的质量浓度分别为: 0.100/0.050 0 ng·mL-1 (定量下限)、0.300/0.150 ng·mL-1 (低浓度)、8.00/1.00 ng·mL-1 (中浓度) 和48.0/16.0 ng·mL-1 (高浓度)。 血浆样品预处理
向100 μL血浆中加入内标溶液 (10.0 ng·mL-1 d3-伊伐布雷定) 20.0 μL和乙腈300 μL,涡流1 min,离心5 min (11 000 r·min-1),取10.0 μL上清液进行LC-MS/MS分析。 稳定同位素内标和待测物相互影响考察
取定量上限 (ULOQ) 样品100 µL,除不加内标溶液外,按“血浆样品预处理”项下操作,进行6样本分析。同时另取空白样品100 µL,只加入内标溶液,按“血浆样品预处理”项下操作,进行6样本分析。以ULOQ样品中监测的内标峰面积的平均值与零点样品内标峰面积的平均值的比值作为伊伐布雷定对内标d3-伊伐布雷定影响的评定标准。以零点样品中待测物峰面积的平均值与定量下限 (LLOQ) 中待测物峰面积平均值的比值作为d3-伊伐布雷定对伊伐布雷定影响的评定标准。 方法学验证 选择性
取6个不同来源的人空白血浆样品和1份溶血的空白血浆样品以及相应人空白血浆配制的LLOQ样品进行LC-MS/MS分析,考察是否有干扰测定。 标准曲线
样品按“血浆样品预处理”项下操作,以每个待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,用加权 (W = 1/x2) 最小二乘法进行回归运算,求得的标准曲线的相关系数 (r2) 均大于0.99。 定量下限
取LLOQ血浆样品,进行6样本分析,连续测定3天,并根据当日标准曲线计算每一样本测得浓度,计算该浓度的日内和日间精密度。 精密度与准确度
取伊伐布雷定/N-去甲基伊伐布雷定低、中、高浓度的QC样品,按“血浆样品预处理”项下操作,每个浓度进行6样本分析,分别在3日内测试,测定日内、日间精密度和准确度。 回收率
取低、中、高三个浓度血浆样品,按“血浆样品预处理”项下操作,每一浓度进行六样本分析。同时另取人空白血浆100 µL,除不加内标溶液外,按“血浆样品预处理”项下操作,取全部上清液,加入相应浓度对照质控溶液 (伊伐布雷定/N-去甲基伊伐布雷定的溶液浓度分别为1.50/0.750、40.0/5.00、240/80.0 ng·mL-1) 和内标溶液,涡流混匀后进样分析,获得相应峰面积 (n = 3)。以提取后的色谱峰面积与未经提取获得的色谱峰面积之比计算处理回收率。 基质效应
取6个受试者空白血浆及1份溶血空白血浆100 μL,除不加内标溶液外,按“血浆样品预处理”项下操作,取全部上清液,加入相应浓度对照质控溶液 (伊伐布雷定/N-去甲基伊伐布雷定的溶液浓度分别为1.50/0.750和240/80.0 ng·mL-1) 和内标溶液,涡流混匀后进样分析,获得相应峰面积 (A)。同时另取100 μL水代替空白血浆,按上述方法处理,获得相应峰面积 (B)。以每一浓度两种处理方法的峰面积比值计算基质效应,计算公式为A/B × 100%。以分析物和内标的基质效应比值计算内标归一化的基质效应。 稳定性
考察了伊伐布雷定/N-去甲基伊伐布 雷定低、高两浓度血浆样品室温放置8 h,经历3次冷冻-解冻循环,-20 ℃放置49天和处理后室温放置24 h的稳定性。 人体药物动力学研究
临床试验经浙江大学医学院附属第一医院伦理委员会批准,选取20名健康成年受试者,签署知情同意书后,采取2周期随机交叉自身对照试验,每周期清洗期为6天。受试者随机分成受试制剂组 (10 mg/片,国内某公司)、参比制剂组 (5 mg/片,法国Les Laboratoires Servier公司)。分别口服受试制剂和参比制剂各10 mg,在服药前及服药后0.33、0.67、1.0、1.5、2.0、3.0、4.0、5.0、6.0、8.0、10、12、14、16、24、36和48 h采集静脉血3 ~5 mL于肝素管中,立即在3 500 r·min-1下离心10 min,获得的血浆样品于-20 ℃冷冻保存。采用Phoenix WinNonlin 6.1软件以非房室模型法计算各待测物的药动学参数。 结果 1 质谱分析
伊伐布雷定和其活性代谢物的结构中都含有碱性氮原子,质谱电离时易获得质子,优先选择正离子检测方式。在正离子检测模式下,伊伐布雷定、N-去甲基伊伐布雷定及内标d3-伊伐布雷定主要生成 [M+H]+ 峰,质荷比分别为m/z 469.2、m/z 455.1和m/z 472.5。选择性对 [M+H]+ 峰进行产物离子扫描分析,三者生成的主要碎片离子均为m/z 177.2和m/z 262.2,通过对碰撞能量和去簇电压的条件优化,选择m/z 177.2作为定量分析时监测的产物离子,各待测物及内标的 [M+H]+ 产物离子全扫描质谱图见图 1。伊伐布雷定和d3-伊伐布雷定的同位素峰分布见表 1,Q1全扫描质谱图见图 2。其中伊伐布雷定的同位素峰 [M+H+3]+ 丰度比为0.75%,其质荷比与内标d3-伊伐布雷定 [M+H]+ 峰相同。
|
|
Table 1 Mass and isotopic abundance of ivabradine and d3- ivabradine |
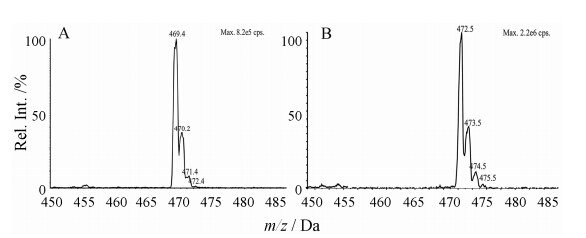 |
Figure 2 Q1 full scan of spectra of ivabradine (A) and d3- ivabradine (B) |
尽管d3-伊伐布雷定的同位素纯度为98.8%,但实验中发现当同位素内标的血浆浓度为10.0 ng·mL-1时,零点样品中检测到的伊伐布雷定的浓度为0.058 4 ng·mL-1,与伊伐布雷定定量下限浓度相当,导致低浓度测定结果相对偏差 > 41.6%。实验中将同位素内标血浆浓度分别降为6.00和2.00 ng·mL-1,零点样品中检测到的伊伐布雷定峰面积分别相当于LLOQ样品中伊伐布雷定峰面积的30.4% 和12.9% (图 3)。因此,选择2.00 ng·mL-1 d3-伊伐布雷定作为内标,方法的选择性、标准曲线各点的精密度和准确度均符合生物样品方法验证指导原则的相关规定[2,3,4]。因此,本实验最终选用d3-伊伐布雷定的血浆浓度为2.00 ng·mL-1。
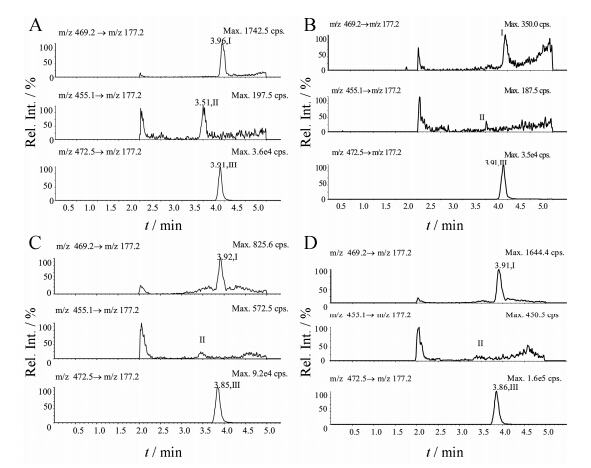 |
Figure 3 The effect of d3-ivabradine on ivabradine. A: Blank sample spiked with 0.100 ng·mL-1 ivabradine,0.0500 ng·mL-1 N-demethylivabradine and 2.00 ng·mL-1 IS; B: Blank plasma only with 2.00 ng·mL-1 IS; C: Blank plasma only with 6.00 ng·mL-1 IS; D: Blank plasma only with 10.0 ng·mL-1 IS. Peaks I,II and III refer to ivabradine,N-demethylivabradine,and d3- ivabradine,respectively |
参考文献[17,18,19,20],最初将伊伐布雷定的定量上限设为100 ng·mL-1,测定时发现高浓度点测定浓度偏低,准确度为91.8%,其内标的峰面积比其他浓度点高7.1%。在不加入内标的定量上限样品中检测 [M+H+ 3]+ → m/z 177.2,其响应为d3-伊伐布雷定响应的7.8%。降低伊伐布雷定定量上限至60.0 ng·mL-1,其响应为3.4%,低于其他标准曲线样品内标响应的5% (图 4),满足方法选择性接受标准[2,3,4]。
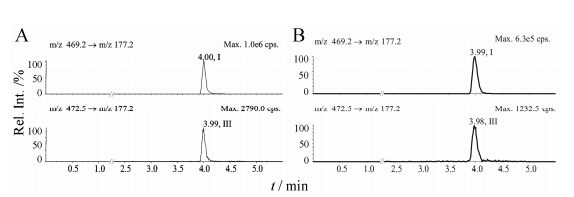 |
Figure 4 The effect of ivabradine on d3-ivabradine. A: Plasma concentration of 100 ng·mL-1 ULOQ sample without IS; B: Plasma concentration of 60.0 ng·mL-1 ULOQ sample without IS. Peaks I and II,refer to ivabradine and d3-ivabradine,respectively |
结果表明,空白血浆中的内源性物质不干扰伊伐布雷定、N-去甲基伊伐布雷定及内标d3-伊伐布雷定的测定。d3-伊伐布雷定不干扰伊伐布雷定、N-去甲基伊伐布雷定的测定。典型色谱图见图 5。
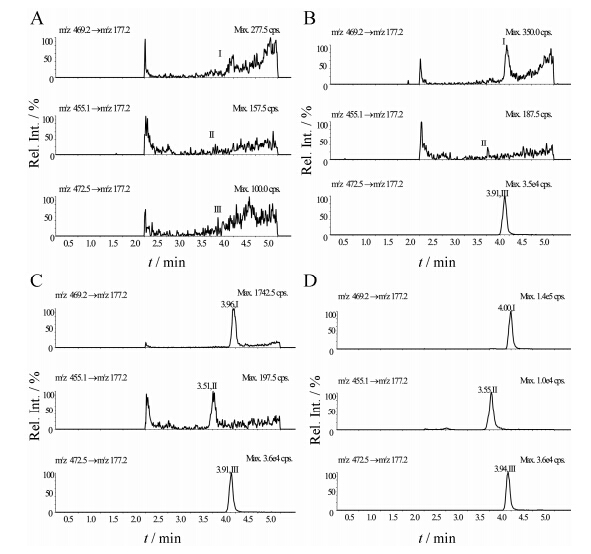 |
Figure 5 Typical MRM chromatograms of ivabradine,N- demethylivabradine,and IS d3-ivabradine. A: Human blank plasma; B: Blank plasma spiked with IS; C: LLOQ sample spiked with IS; D: Human plasma sample spiked with IS after an oral administration of one hydrogen sulfate sustained-release tablet of 10 mg; Peak I-III refer to ivabradine,N-demethylivabradine,and d3-ivabradine,respectively |
测定伊伐布雷定的线性范围为0.100~60.0 ng·mL-1,N-去甲基伊伐布雷定的线性范围为0.050 0~20.0 ng·mL-1。 4.3 定量下限
结果得LLOQ浓度伊伐布雷定的 日内精密度为5.9%,日间精密度为6.9%,准确度为99.5%; N-去甲基伊伐布雷定的日内精密度为11.5%,日间精密度为11.2%,准确度为98.7% (表 2)。该结果表明LC-MS/MS法测定血浆中伊伐布雷定和N-去甲基伊伐布雷定 定量下限分别可达0.100 ng·mL-1和0.050 0 ng·mL-1。
|
|
Table 2 The intra- and inter-day precision and accuracy values of the LLOQ and QC samples of ivabradine and N-demethylivabradine (n = 18) |
日内、日间精密度和准确度结果见表 2。伊伐布雷定每一浓度水平的QC样品的日内精密度均小于2.9%,日间精密度均小于4.5%,准确度在97.1%~104%之间; N-去甲基伊伐布雷定每一浓度水平QC样品的日内精密度均小于6.2%,日间精密度均小于5.9%,准确度在102%~104%。各待测物QC样品测试结果均符合生物样品测定有关要求[2,3,4]。 4.5 回收率
伊伐布雷定在低、中、高三浓度的回收率分别为 (88.4 ± 6.2) %、(91.0 ± 4.8) % 和 (90.1 ± 1.9) %; N-去甲基伊伐布雷定在低、中、高三浓度的回收率分别为 (91.6 ± 6.3) %、(100 ± 3.4) % 和 (97.1 ± 2.5) %。 4.6 基质效应
伊伐布雷定在低、高两浓度的基质效应分别为103% 和102%,相对标准差分别为1.5% 和1.3%; N-去甲基伊伐布雷定人血浆样品的低、高两浓度的基质效应分别为96.4% 和101%,相对标准差分别为2.4% 和1.1%; 内标d3-伊伐布雷定的基质效应为97.5%,相对标准差为1.5%。结果表明,待测物在本实验选择的色谱和质谱条件下,可忽略基质效应的影响。 4.7 稳定性
结果表明,在上述条件下,血浆样品中伊伐布雷定和N-去甲基伊伐布雷定均稳定,数据见表 3。
|
|
Table 3 Stability data of ivabradine and N-demethylivabradine in human plasma under various storage conditions (n = 3), |
此方法应用于硫酸氢伊伐布雷定缓释片的人体药物动力学研究。伊伐布雷定和N-去甲基伊伐布雷定单次给药后的药物-时间曲线见图 6。与普通片剂相比,硫酸氢伊伐布雷定缓释片达峰时间明显延长 (伊伐布雷定tmax从1.33 h延长到4.63 h,N-去甲基伊伐布雷定tmax从1.42 h延长到6.21 h),达峰浓度明显降低,但二者AUC均无显著性差异,表明受试制剂硫酸氢伊伐布雷定缓释片具有缓释特征。
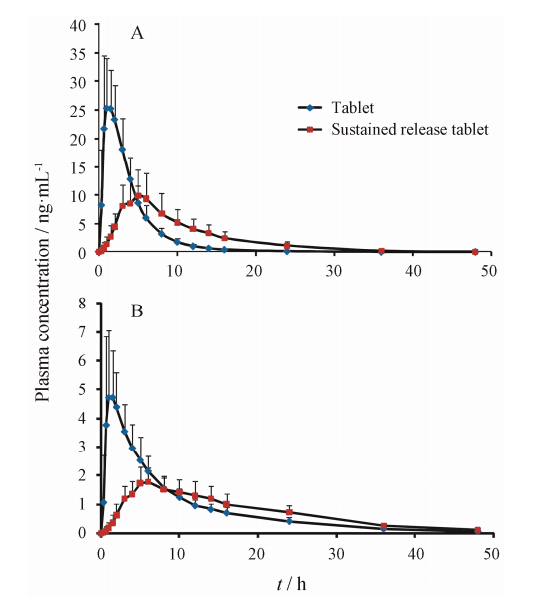 |
Figure 6 Mean plasma concentration-time curves of ivabradine (A) and N-demethylivabradine (B) in human plasma after a single oral dose of 10 mg extend-release tablet and ordinary tablets in Chinese healthy volunteers. n = 20,x± s |
稳定同位素内标由于与待测物具有几乎完全一致的化学性质,被认为是LC-MS/MS定量分析方法最理性的内标。稳定同位素内标可以校正待测物在样品提取和LC-MS/MS分析中引起的波动。但由于稳定同位素内标合成过程中不能达到100% 的同位素纯度,可能会影响待测物的测定。本实验中通过降低稳定同位素内标的浓度来减少同位素纯度不高的影响,但有时过低的内标浓度会影响方法的线性和准确度。因此,在同位素内标合成时应避免采用与待测物有关的物质作为合成稳定同位素内标的主要原料,以提高同位素纯度。
另外,在LC-MS/MS测定中,待测物的自然同位素分布对内标的干扰可能转化为内标,错误地增加内标峰面积,而伴随着待测物响应的相对减少。为了解决这一问题,本文提出3种改进措施: 一是调整待测物的定量上限或内标浓度; 二是采用同位素标记数更多的稳定同位素内标,如d4-伊伐布雷定。伊伐布雷定的同位素 [M+H+4]+ 丰度比仅为0.08%,因此即使伊伐布雷定和d4-伊伐布雷定血浆浓度相差100倍,进行MRM分析时伊伐布雷定同位素峰对d4-伊伐布雷定的影响也不足1%,基本可忽略; 三是采用稳定同位素内标的重元素峰 [M+H+1]+ 作为前体离子。在本实验中,若选择d3-伊伐布雷定的同位素峰 [M+H+1]+ (m/z 473.3) 作为内标定量反应的前体离子时,在不加内标的定量上限 (60.0 ng·mL-1) 样品中,检测到内标峰面积仅为2.00 ng·mL-1平均内标峰面积的1.1%,影响可忽略。
综上,选择稳定同位素作为内标建立LC-MS/MS生物样品定量分析方法时,除采用零点样品考察内标对待测物影响外,还应使用不加内标的定量上限 (60.0 ng·mL-1) 样品评价待测物同位素分布对内标的影响。
在方法开发初期,本实验也对色谱条件进行了优化,尝试采用不同配比的流动相考察对待测物色谱的影响。当以乙腈-5 mmol·L-1醋酸铵溶液 (40∶60) 为流动相,色谱柱选用XDB C18柱 (150 mm × 4.6 mm,5 μm) 时,待测物在死时间附近出峰,且有明显拖尾现象。流动相更换为甲醇-5 mmol·L-1醋酸铵溶液 (30∶70),色谱柱更换为Capcell PAK C18柱 (100 mm × 4.6 mm,5 μm),峰形得到明显改善。但伊伐布雷定仍接近死时间出峰。改用梯度洗脱后,伊伐布雷定与N-去甲基伊伐布雷定在色谱柱上有良好的分离,且在柱上有明显保留。
本实验成功建立了同时测定人血浆样品中的伊伐布雷定和N-去甲基伊伐布雷定的LC-MS/MS方法,并系统评价了稳定同位素内标与待测物之间的交叉影响。通过优化质谱条件、色谱条件和预处理方法,本实验在5.5 min内实现原形和代谢物同时分析,显著提高了分析通量。本文也报道了硫酸氢伊伐布雷定缓释片的人体药动学特征。
| [1] | Deng P, Chen XY, Zhong DF. Quantification of polar drugs in human plasma with liquid chromatography-tandem mass spectrometry [J]. Bioanalysis, 2009, 1: 187-203. |
| [2] | US Food and Drug Administration. Guidance for Industry: Bioanalytical Method Validation (draft) [S/OL]. Rockville, MD: FDA. 2013 [2014-09-23]. http://www.fda.gov/downloads/ Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM368107.pdf |
| [3] | European Medicines Agency. Guideline on Bioanalytical Method Validation [S/OL]. London: European Medicines Agency. 2011 [2014-09-23]. http://www.ema.europa.eu/docs/ en_GB/document_library/Scientific_guideline/2011/08/WC500109686.pdf |
| [4] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. Vol II. Beijing: China Medical Science Press, 2010: Appendix XIX B. |
| [5] | Kebarle P, Tang L. Dependence of ion intensity in electrospray mass-spectrometry on concentration of the analytes in the electrosprayed solution [J]. Anal Chem, 1993, 65: 972A. |
| [6] | Stockvis E, Rosing H, Beijnen JH. Stable isotopically labeled internal standards in quantitative bioanalysis using liquid chromatography/mass spectrometry: necessity or not? [J]. Rapid Commun Mass Spectrom, 2005, 19: 401-407. |
| [7] | Wang A, Cyronak M, Yang E. Does a stable isotopically labeled internal standard always correct analyte response? A matrix effect study on a LC/MS/MS method for the determination of carvedilol enantiomers in human plasma [J]. Pharm Biomed Anal, 2007, 43:701-707. |
| [8] | Koefeler HC, Rempel DL, Gross ML. Dual use of a stable isotope labeled caffeine as internal standard for quantification and mass accuracy on a Q-TOF [C]//Proc. 52nd ASMS Conf Mass Spectrometry and Allied Topics, Nashville, 2004. |
| [9] | Bergeron A, Furtado M, Garofolo F. Importance of using highly pure internal standards for successful liquid chromatography/ tandem mass spectrometric bioanalytical assays [J]. Rapid Commun Mass Spectrom, 2009, 23: 1287-1297 |
| [10] | Duxbury K, Owen L, Gillingwater S, et al. Naturally occurring isotopes of an analyte can interfere withdoubly deuterated internal standard measurement [J]. Ann Clin Biochem, 2008, 45: 210-212. |
| [11] | Aimin T, Isabelle AL, Isabelle ML, et al. Analyte and internal standard cross signal contributions and their impact on quantitation in LC-MS based bioanalysis [J]. J Chromatogr B, 2011, 879: 1954-1960. |
| [12] | DiFrancesco D, Camm JA. Heart rate lowering by specific and selective I(f) current inhibition with ivabradine: a new therapeutic perspective in cardiovascular disease [J]. Drugs, 2004, 64: 1757-1765. |
| [13] | Khawaja MZ, Walker DM. Ivabradine the beauty of a slow heart rate [J]. Int J Clin Pract, 2009, 63: 542-546. |
| [14] | Bucchi A, Baruscotti M, DiFrancesco D. Current-dependent block of rabbit sino-atrial node if channels by ivabradine [J]. Gen Physiol, 2002, 120: 1-13. |
| [15] | Prasad UK, Gray D, Purcell H. Review of the If selective channel inhibitor ivabradine in the treatment of chronic stable angina [J]. Adv Ther, 2009, 26: 127-137. |
| [16] | Ragueneau I, Laveille C, Jochemsen R, et al. Pharmaeokinetic-pharmacodynamic modeling of the effects of ivabradine, a direct sinus node inhibitor, on heart rate in healthy volunteers [J]. Clin Pharmacol Ther, 1998, 64: 192-203. |
| [17] | François-Bouchard M, Simonin G, Bossant MJ, et al. Simultaneous determination of ivabradine and its metabolites in human plasma by liquid chromatography-tandem mass spectrometry [J]. J Chromatogr B, 2000, 745: 261-269 |
| [18] | Vlase L, Muntean D, Leucuta AE, et al. High-throughput determination of ivabradin from human plasma by LC/MS/MS and its application to pharmarcokinetic studies [J]. Stud Univ Babes-Bolyai Chem, 2009, 2: 43-51. |
| [19] | Wang MM, Zhang R, Pan H, et al. Determination of ivabradine and its metabolite in human plasma and pharmacokinetic study [J]. Pharm Clin Res (药学与临床研究), 2013, 21: 210-214. |
| [20] | Zoerner AA, Schroeder C, Kayacelebi AA, et al. A validated, rapid UPLC-MS/MS method for simultaneous ivabradine, reboxetine, and metoprolol analysis in human plasma and its application to clinical trial samples [J]. J Chromatogr B, 2013, 927: 105-111. |
 2015, Vol. 50
2015, Vol. 50


