皮肤是保护身体免受外部伤害的天然屏障,一旦遭受损伤必须迅速修复,以预防细菌感染,并维持正常功能。成人皮肤伤口愈合过程由一系列相互重叠的事件组成: 即出血和凝血、炎症、再表皮化、形成肉芽组织和组织重塑。越来越多的证据表明,间隙连接蛋白43 (connexin43,Cx43) 是参与皮肤伤口愈合过程的一个重要蛋白[1]。在皮肤创伤初期 (24 h内),伤口边缘的角质形成细胞中Cx43蛋白水平迅速下降,角质形成细胞的表型改变为迁移型,但在伤口边缘之后的数列角质形成细胞,Cx43蛋白水平迅速增加,表型呈现为增殖型。与角质形成细胞类似,伤口边缘的成纤维细胞也下调Cx43的表达[2,3,4],迅速向伤口床迁移,并形成肉芽组织。但是,伤口周围的血管内皮细胞内Cx43表达却迅速上调,在整个炎症期均维持较高水平[5]。以Cx43的反义核酸处理新鲜伤口创面,可以显著下调角质形成细胞和成纤维细胞内Cx43表达,降低血管内皮细胞内Cx43表达的上升幅度,明显促进伤口愈合速率,改善愈合质量[6],表明短期抑制Cx43表达是促进伤口快速愈合的有效手段。
大量有关Cx43与伤口愈合分子机制的研究表 明,Cx43表达下调可加快成纤维细胞、角质形成细胞的迁移速率,提高其增殖能力及角化细胞的分化能力[5,7,8,9,10]。但对于血管内皮细胞,有关Cx43对其功能影响的研究则较少,已知的研究结果似乎彼此不一致。Wang等[11]研究了Cx43对人动脉血管内皮细胞功能的影响,发现以siRNA下调Cx43表达,损害了其增殖、生存及血管生成能力。而其他研究则发现,下调Cx43表达有利于肿瘤血管生成,上调Cx43表达可抑制肿瘤血管生成[12,13]。在皮肤伤口愈合实验中,Cx43反义核酸治疗组肉芽组织内血管的数量和质量明显优于模型组,说明下调Cx43表达有利于伤口愈合过程中的血管生成[5]。
新生血管形成是伤口愈合过程中非常重要的要素之一。基于目前下调Cx43对血管内皮细胞的功 能影响尚缺乏了解,且有关研究结果存在矛盾,本文以常用的血管内皮细胞,人脐静脉血管内皮细胞 (HUVEC) 为研究对象,采用siRNA下调Cx43表达,研究HUVEC与损伤修复相关的生物学功能变化,并探讨其与伤口愈合过程的相关性。 材料与方法
试剂、材料和仪器HUVEC购自中国科学院上海生命科学院细胞资源中心; LipofectamineTM 2000、OPTI-MEMI培养基 (Invitrogen公司); 兔抗人Cx43一抗、Lucifer yellow、Rhodamine B (Sigma公司); 小鼠抗人GAPDH一抗、大鼠抗小鼠二抗、山羊抗兔二抗、Western及IP细胞裂解液、DAPI试剂 (碧云天生物技术公司); EdU试剂盒 (广州市锐博生物科技有限公司); Cell Counting Kit-8 (CCK-8,日本同仁公司); RPMI-1640培养基、胎牛血清 (FBS,美国Gibco公司); 细胞爬片 (Nest公司); μ-Slide Angiogenesis (Ibidi公司); Matrigel (美国BD公司); siRNA由上海吉玛制药有限公司合成; Zeiss LSM710激光扫描共聚焦显微镜; 9602G酶标仪 (南京普朗医用设备有限公司); TE-2000U倒置荧光显微镜 (日本尼 康公司); Thermo快速转印仪、IncuCyte Zoom、细胞创伤划痕仪 (Thermo公司)。 细胞培养及转染
细胞常规培养于含10% 胎牛血清、100 u·mL-1青霉素和100 u·mL-1链霉素的EGM培养基中,37 ℃、5% CO2及饱和湿度条件下培养,取对数生长期细胞进行各项实验。 siRNA转染
用于siRNA转染的细胞,培养前不添加青霉素/链霉素。参照说明书以OPTI-MEMI培养基稀释脂质体,轻轻混匀,室温静止5 min,然后与溶解于OPTI-MEMI培养基的siRNA混匀,室温静止20 min,加入到细胞培养板中。细胞与脂质体共同孵育6 h后,更换含10% FBS的新鲜培养基,将细胞置于细胞培养箱中继续培养。实验中所用的siRNA序列见表 1。
|
|
Table 1 Sequences of the siRNA used for the experiment. Cx43: Connexin43 |
转染siRNA 24 h后,用市售试剂盒提取细胞总蛋白,BCA法测定蛋白含量。12% 聚丙烯酰胺凝胶电泳法分离蛋白,蛋白上样量40 μg。电泳结束后,用Thermo快速转膜 仪将蛋白转印到PVDF膜上。PVDF膜转移至5% 脱脂奶粉中室温封闭1 h,之后滴加兔抗人Cx43一抗 (1∶8 000),小鼠抗人GAPDH一抗 (1∶1 000),4 ℃孵育过夜。第2天,在脱色摇床上,用TBST溶液摇动洗涤3次,每次10 min。再滴加HRP标记的山羊抗兔的多克隆二抗 (1∶1 000)、HRP标记的大鼠抗小鼠的多克隆二抗 (1∶1 000),室温孵育1 h。孵育结束 后,用TBST溶液漂洗PVDF膜3次,每次10 min。以ECL曝光显色液进行曝光显色。Quantity one软件进行灰度分析,以G APDH作为内参。 创伤后Cx43表达经时分析
将对数生长期的HUVEC在60 mm培养皿中培养,待细胞融合后,在纵横两个方向,用20 μL移液枪头每隔3 mm进行划痕。创伤结束后立即以PBS清洗3遍,并更换新鲜 培养基。分别在划痕前、划痕0.5、1、3、6、12、24、32和48 h后提取细胞总蛋白,进行Western blot分析。 细胞免疫荧光染色
将HUVEC培养在无菌细胞爬片上,当细胞生长到对数生长期时,转染siRNA。转染后24 h,用新鲜配制的4% 多聚甲醛固定细胞 15 min,以PBS (pH 7.4) 冲洗3次。之后用0.1% Triton-X 100通透10 min,PBS洗涤3次。滴加兔抗人Cx43抗体 (1∶500),4 ℃孵育过夜。第2天,去除一抗,PBST洗涤3次,每次5 min,再滴加Alex 488荧光标记的山羊抗兔二抗室温孵育1 h,最后用DAPI核染,封片。共聚焦显微镜采集图像,用软件Image pro plus对采集的图像进行定量分析。
细胞间隙连接功能分析以划痕荷载染料转移技术 (scrape-loading and dye transfer,SLDT) 测定细胞间隙连接功能。细胞转染siRNA 24 h后,培养至完全汇合,以PBS (pH 7.4) 浸洗细胞3次,用手术刀片的刀刃划痕。将含0.2% 荧光黄和罗丹明B的PBS溶液加至划痕上,37 ℃黑暗处孵育5 min。以PBS (pH 7.4) 洗涤3次,去除游离的荧光染料。以4% 多聚甲醛固定细胞20 min,再用倒置显微镜采集相差图像和荧光图像。对结果进行半定量分析,评分标准: 0分为荧光黄只限于伤口前沿单列细胞; 1、2、3、4分分别为荧光黄从伤口前沿细胞传递至邻近1、2、3、4列细胞或更远。 细胞活力测定
将对数生长期HUVEC接种到96孔板中,每孔2×103个细胞。24 h后,转染siRNA,转染后6 h更换新鲜培养基。分别在转染后0、12、24、48和72 h,加入CCK-8溶液 (10 μL/孔),继续培养1 h。之后用酶标仪测定450 nm处吸光度。用实验组与对照组的比值计算细胞活力。 细胞增殖测定
取对数生长期HUVEC细胞,每孔2×103个细胞接种于96孔细胞培养板中。24 h后,转染siRNA。转染24 h后,用EdU试剂盒检测细胞增殖。倒置显微镜拍摄荧光图片,用软件Image pro plus对采集的图像进行定量分析。
细胞迁移能力测定取对数生长期HUVEC接种到96孔细胞培养板中,每孔1×104个细胞。第2天,转染siRNA,转染6 h后,更换新鲜的培养基。转染后24 h,细胞完全融合,用细胞创伤划痕仪进行划痕。弃培养基,用PBS洗涤3次,加入无血清培养 基。然后将96孔细胞培养板置于实时成像仪IncuCyte Zoom,设置参数,拍摄细胞迁移图片。用IncuCyte Zoom软件分析细胞迁移速率。 体外血管形成
取对数生长期HUVEC接种到细胞培养皿,第2天,转染siRNA。转染6 h后,更换新鲜的培养基。转染后24 h进行血管形成实验。实验的前一天,将Matrigel于4 ℃融化,灭菌10 μL枪头,μ-Slide冷藏备用。μ-Slide的每个孔中加入Matrigel 10 μL,置培养箱中30 min使胶凝固。在胶凝固的过程中准备细胞悬液,调整细胞悬液浓度到4×105个/mL。从培养箱中取出μ-Slide,每孔加入细胞悬液50 μL,置37 ℃培养箱培养。12 h后用倒置显微镜记录实验结果。 统计学分析
实验数据x± s表示,组间比较采用SPSS17.0软件进行t检验。
结果
1 创伤对HUVEC中Cx43表达的影响
通过Western blot分析创伤后HUVEC表达Cx43蛋白的经时变化过程。结果表明,创伤后1 h,细胞 中Cx43蛋白表达开始上调,3 h后上调极为显著,并维持到6 h,之后Cx43蛋白表达逐步下降,但一直到创伤后24 h仍高于对照组 (图 1)。由此可见,创
伤会引起HUVEC细胞中Cx43蛋白表达上调,并且在一定时间内维持较高水平。
依据Cx43的基因序列,设计靶向Cx43基因序列不同位置的3种siRNA序列(表 1)[14,15]。通过Western blot方法研究siRNA沉默HUVEC中Cx43表达的经时过程和最佳浓度,发现在转染细胞24 h后,Cx43沉默效率可达到最大,并有效维持最佳沉默效果达72 h以上。所使用的siRNA最佳浓度均在0.5 μmol·L-1左右。分别采用0.5 μmol·L-1的3种siRNA转染细胞24 h后,Cx43蛋白的相对表达水平分别为scrambled siRNA的 (18.9 ± 0.8) %、(35.5 ± 2.2) % 和 (34.4 ± 2.1) % (图 2A和B),其中siRNA1的Cx43沉默效果最佳。后续相关实验均采用siRNA1。同时采用细胞免疫荧光方法分析siRNA对Cx43的表达沉默效果 (图 2C和D),与Western blot结果一致。
间隙连接通道负责细胞间的信息传递及能量交换,对细胞的生长分化起到重要的调控作用[16]。荧光黄在细胞间的传递能力,是间隙连接通道交流功能的可靠表征指标。根据细胞间隙连接交流能力评分,可知Cx43表达下调后荧光黄的细胞传递列数下降到1.17 ± 0.11,与scrambled siRNA处理组的3.36 ± 0.25比较,具有显著性差异 (P < 0.05) (图 3)。结果表明,Cx43蛋白表达下调,可抑制HUVEC间隙连接的信号传递功能。
在转染siRNA前,实验组与对照组细胞之间活力基本相同。在转染Cx43 siRNA1 12 h后,细胞活 力出现下调,24 h、48 h和72 h后细胞活力明显低于scrambled siRNA处理组 (P < 0.05) (图 4A)。在转染Cx43 siRNA1 24 h后,处于增殖状态的HUVEC细 胞数量较scrambled siRNA处理组显著减少 (图 4B和C)。
为了排除细胞增殖对细胞迁移能力测定的影响,在划痕后换用无血清培养基,以抑制细胞增值。测定划痕12 h前后划痕间距,划痕间距的差别即细胞迁移距离。实验组细胞迁移距离与scrambled siRNA处理组之比值,即Cx43 siRNA组相对细胞迁移速率。从图 4D和E可见,Cx43蛋白下调显著降低HUVEC的迁移速率 (P < 0.05)。
5 Cx43对血管形成的影响
与scrambled siRNA处理组相比,Cx43 siRNA处理组下调后,血管分支数量减少,毛细血管的平均长度缩短,整个毛细血管的网络和模式变小,成管能力有所下降 (图 5)。所以,Cx43通过影响血管分支数量及分支长度来影响整个血管网络结构的精细程度。
本文以血管内皮细胞HUVEC为研究对象,系 统研究了损伤后Cx43表达变化以及Cx43表达下调对HUVEC活性的影响。结果表明,Cx43对于内皮细胞的生物学功能具有重要的调控作用,Cx43表达下调会抑制内皮细胞间信息传递、细胞活力、增殖、迁移和血管生成。通过siRNA下调Cx43蛋白表达后,新生毛细管的分支数量减少、毛细管的分支长度变短,血管新生能力受到抑制。其原因很可能是由于Cx43蛋白下调降低了内皮细胞间信号传递的能力。Gärtner等[14]利用间隙连接封闭剂棕榈油酸限制内皮细胞间信号传递,也造成血管形成受损,分支数量减少,分支长度缩短,说明细胞间信号传递对新生血管形成具有重要意义。
临床及临床前研究均表明,Cx43表达下调有利于促进皮肤及角膜创伤的愈合,其原因被归结为角质形成细胞和成纤维细胞的增殖和迁移能力增强。其实,新生血管形成也是创伤愈合的重要环节,是创伤愈合质量的标志。在创伤修复早期下调Cx43表达,减缓新生血管速度,降低肉芽组织内的新生血管密度,有利于抑制炎症反应的过度发生。近期研究认为,过度的炎性反应会损伤周围组织的正常细胞,促进过度纤维化及疤痕形成[17,18,19]。采用细胞珠蛋白等抗炎药物抑制炎性反应,有利于促进创伤愈合[20]。而新生血管因成熟度不足,呈泄漏等炎性性状,不利于愈合。因此,在创伤修复的早期短期抑制新生血管,可以抑制血管的渗透性,减少伤口处炎症细胞的募集及炎症因子的释放,从而降低炎症反应的强度,促进伤口愈合的速率,提高伤口愈合的质量。
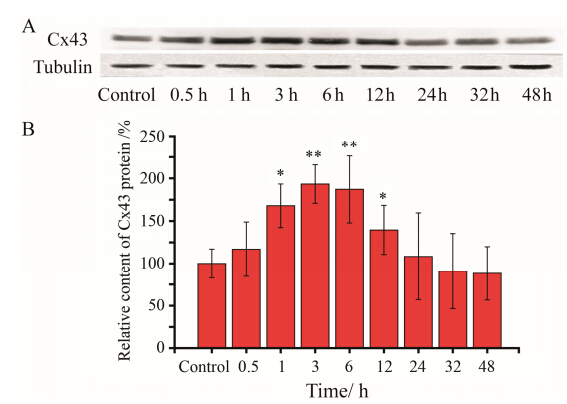
Figure 1 The effect of wounding on Cx43 expression in human umbilical vein endothelial cell (HUVEC). A: Western blot analysis of changes in Cx43 protein expression with the time of wounding in HUVEC. The house keeping gene β-tubulin was used for normalization. B: The quantitative results of Cx43 expression. n = 6,x± s. P < 0.05,**P < 0.01 vs control
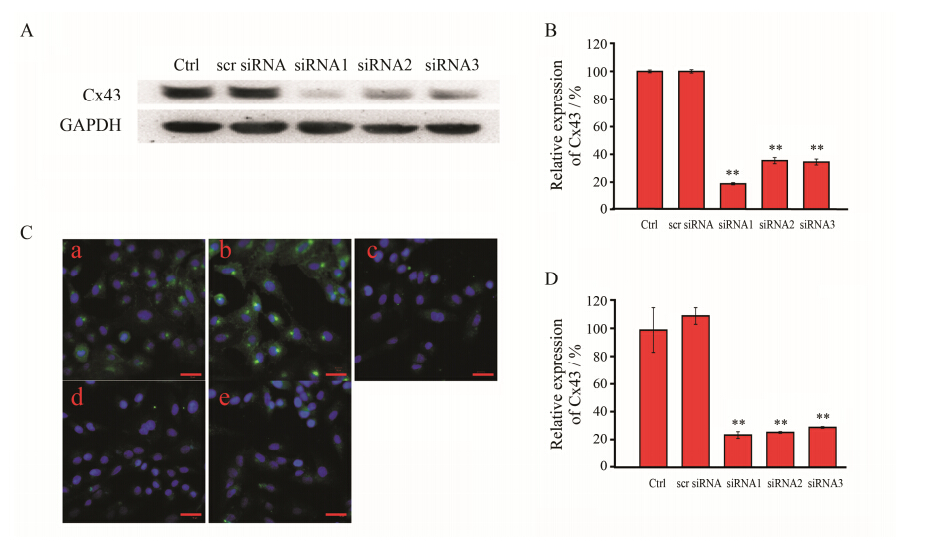
Figure 2 The effect of siRNA on Cx43 expression. A: Western blot analysis of downregulation of Cx43 after treatment with siRNA 24 h. The house keeping gene GAPDH was used for normalization. B: The quantitative results of Western blot. n = 3,x± s. **P < 0.01 vs scr siRNA. C: The abundant of Cx43 after treatment with siRNA (a: No siRNA; b: Scr siRNA; c: Cx43 siRNA1; d: Cx43 siRNA2; e: Cx43 siRNA3) 24 h in HUVEC determined by immunostaining analysis. Bar: 25 μm. D: The quantitative results of immunostaining. n = 6,x± s. **P < 0 .01 vs scr siRNA. Ctrl: Control; scr siRNA: Scrambled siRNA; siRNA1: Cx43 siRNA1; siRNA2: Cx43 siRNA2; siRNA3: Cx43 siRNA3
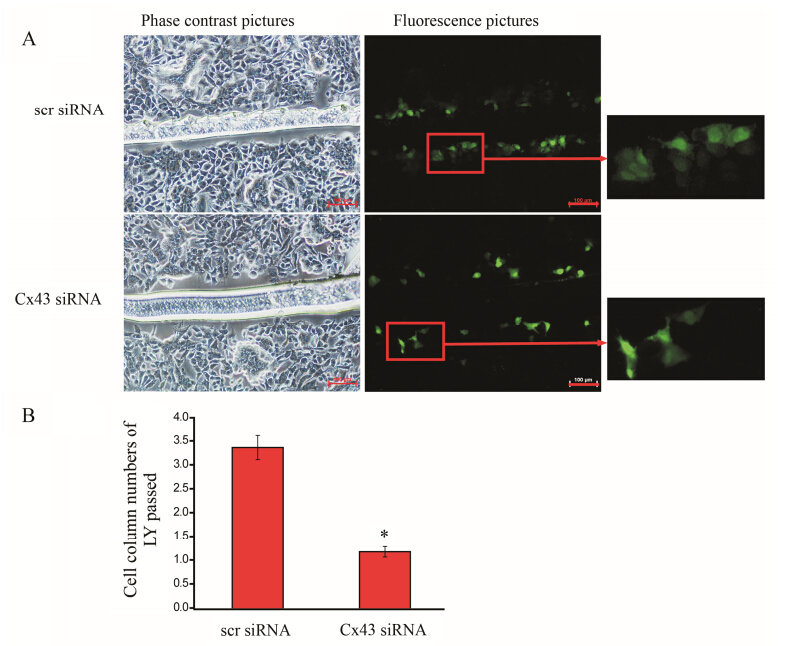
Figure 3 Junctional communication of HUVEC after transfected with siRNA 24 h as determined by scrape loading. A: Lucifer yellow (LY) has labeled several rows of cells transfected with scr siRNA on either side of the scrape line,whereas the fluorescent tracer labeled only one or no row of cells transfected with Cx43 siRNA. Bar: 100 μm. B: The quantitative results of Lucifer yellow labeled rows determined by a scoring. n = 6,x± s. P < 0.05 vs scr siRNA
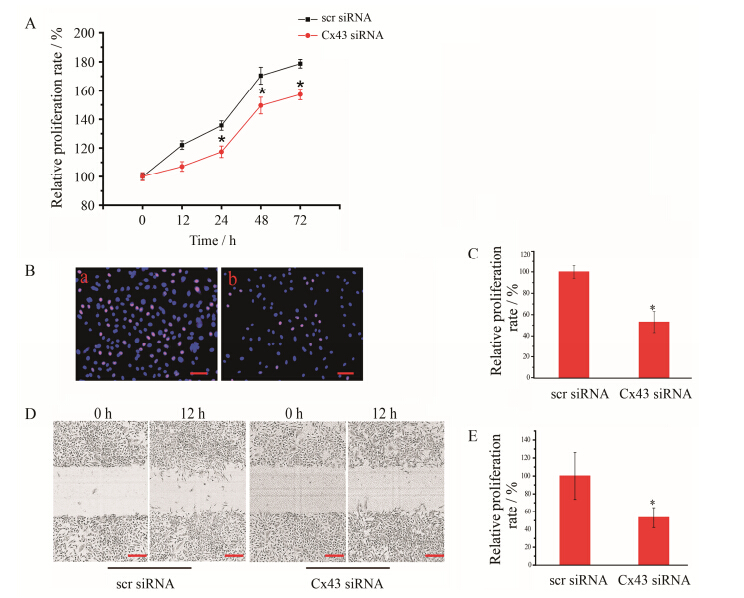
Figure 4 Effect of Cx43 downregulation on functions of HUVEC. A: Effect of Cx43 downregulation on HUVEC viability detected by CCK-8 kit. n = 18. B: Effect of Cx43 downregulation on HUVEC proliferation determined by EdU analysis. a: Group transfected with scrambled siRNA. b: Group transfected with Cx43 siRNA. Bar: 50 μm. C: The quantitative results of EdU labeling. n = 10. D: The phase contrast pictures of cells migration treated by siRNA. Bar: 100 μm. E: The quantitative results of migration rate. n = 6. x± s. P < 0.05 vs scr siRNA
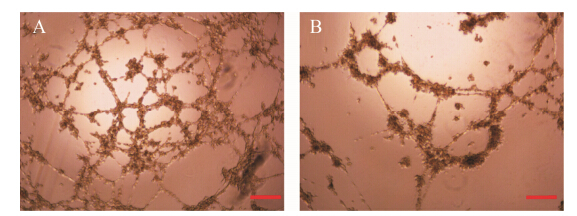
Figure 5 Inhibitory effect of connexin43 downregulation on capillary like network. A: Group treated by scrambled siRNA. B: Group treated by Cx43 siRNA. Bar: 250 μm
| [1] | Ongstad EL, O'Quinn MP, Ghatnekar GS, et al. A Connexin43 mimetic peptide promotes regenerative healing and improves mechanical properties in skin and heart [J]. Adv Wound Care, 2013, 2: 55-62. |
| [2] | Coutinho P, Qiu C, Frank S, et al. Dynamic changes in connexin expression correlate with key events in the wound healing process [J]. Cell Biol Int, 2003, 27: 525-541. |
| [3] | Goliger JA, Paul DL. Wounding alters epidermal connexin expression and gap junction-mediated intercellular communica tion [J]. Mol Biol Cell, 1995, 6: 1491-1501. |
| [4] | Saitoh M, Oyamada M, Oyamada Y, et al. Changes in the expression of gap junction proteins (connexins) in hamster tongue epithelium during wound healing and carcinogenesis [J]. Carcinogenesis, 1997, 18: 1319-1328. |
| [5] | Mori R, Power KT, Wang CM, et al. Acute downregulation of connexin43 at wound sites leads to a reduced inflammatory response, enhanced keratinocyte proliferation and wound fibroblast migration [J]. J Cell Sci, 2006, 119: 5193-5203. |
| [6] | Qiu C, Coutinho P, Frank S, et al. Targeting connexin43 expression accelerates the rate of wound repair [J]. Curr Biol, 2003, 13: 1697-1703. |
| [7] | Mendoza-Naranjo A, Cormie P, Serrano AE, et al. Targeting cx43 and N-cadherin, which are abnormally upregulated in venous leg ulcers, influences migration, adhesion and activation of rho GTPases [J]. PLoS One, 2012, 7: e37374. |
| [8] | Wright CS, van Steensel MA, Hodgins MB, et al. Connexin mimetic peptides improve cell migration rates of human epidermal keratinocytes and dermal fibroblasts in vitro [J]. Wound Repair Regen, 2009, 17: 240-249. |
| [9] | Mendoza-Naranjo A, Cormie P, Serrano AE, et al. Overexpression of the gap junction protein Cx43 as found in diabetic foot ulcers can retard fibroblast migration [J]. Cell Biol Int, 2012, 36: 661-667. |
| [10] | Langlois S, Maher AC, Manias JL, et al. Connexin levels regulate keratinocyte differentiation in the epidermis [J]. J Biol Chem, 2007, 282: 30171-30180. |
| [11] | Wang CM, Lincoln J, Cook JE, et al. Abnormal connexin expression underlies delayed wound healing in diabetic skin [J]. Diabetes, 2007, 56: 2809-2817. |
| [12] | McLachlan E, Shao Q, Wang HL, et al. Connexins act as tumor suppressors in three-dimensional mammary cell organoids by regulating differentiation and angiogenesis [J]. Cancer Res, 2006, 66: 9886-9894. |
| [13] | Shao Q, Wang H, McLachlan E, et al. Down-regulation of Cx43 by retroviral delivery of small interfering RNA promotes an aggressive breast cancer cell phenotype [J]. Cancer Res, 2005, 65: 2705-2711. |
| [14] | Gärtner C, Ziegelhöffer B, Kostelka M, et al. Knock-down of endothelial connexins impairs angiogenesis [J]. Pharmacol Res, 2012, 65: 347-357. |
| [15] | Nakano Y, Oyamada M, Dai P, et al. Connexin43 knockdown accelerates wound healing but inhibits mesenchymal transition after corneal endothelial injury in vivo [J]. Invest Ophthalmol Vis Sci, 2008, 49: 93-104. |
| [16] | Vinken M, Vanhaecke T, Papeleu P, et al. Connexins and their channels in cell growth and cell death [J]. Cell Signal, 2006, 18: 592-600. |
| [17] | Ashcroft GS, Yang X, Glick AB, et al. Mice lacking Smad3 show accelerated wound healing and an impaired local inflammatory response [J]. Nat Cell Biol, 1999, 1: 260-266. |
| [18] | Martin P, D'Souza D, Martin J, et al. Wound healing in the PU. 1 null mouse — tissue repair is not dependent on inflammatory cells [J]. Curr Biol, 2003, 13: 1122-1128. |
| [19] | Dovi JV, He LK, DiPietro LA. Accelerated wound closure in neutrophil-depleted mice [J]. J Leukoc Biol, 2003, 73: 448-455. |
| [20] | Li ZF, Zhang XF, Zhang TT. A preliminary study of anti- aging and wound healing of recombination cytoglobin [J]. Acta Pharm Sin (药学学报), 2012, 47: 51-57. |
 2015, Vol. 50
2015, Vol. 50


