2. 中国医学科学院、北京协和医学院药物研究所 药物晶型研究中心, 晶型药物研究北京市重点实验室, 北京 100050
2. Research Centre of Polymorphic Drugs, Beijing Key Laboratory of Polymorphic Drugs, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
多晶型是固体有机化合物普遍存在的一种现象。在临床医学实践中人们发现,同一药物不同厂家生产,或同一厂家不同批次生产,会发生稳定性和药效学差异,这是由固体药物晶型状态差异引起的[1]。药物晶型的差异不仅影响药物的稳定性、溶解度、溶出速度等理化性质,也会不同程度地影响药物临床应用时的生物利用度,从而影响药物治疗效果[2, 3, 4]。在意识到固体药物晶型状态的重要性之前,我国生产的利福平和氯霉素等药物均存在稳定性差、有效期无法保证等问题,通过对药物晶型的优化,国产利福平、氯霉素等药物稳定性和有效性得到了提升 和控制[5, 6]。研究药物晶型的理化性质和生物利用度,对提高药物稳定性、控制药品质量、保证药物的治疗效果有重要意义[7]。
奥扎格雷 (ozagrel,图 1) 是一种TXA2合成酶抑制剂,具有抗血小板聚集和解除血管痉挛的作用,临床用于蛛网膜下腔出血手术后血管痉挛及其并发脑缺血症状的改善[8, 9, 10]。本实验室在得到奥扎格雷两种晶型化合物的基础上[11],建立了SD大鼠血浆中奥扎格雷含量测定的反相高效液相色谱法,分析了不同晶型奥扎格雷固体经消化道给药后在大鼠体内药代动力学的差异。
|
Figure 1 Structure of ozagrel |
奥扎格雷晶型Ⅰ、Ⅱ (中国医学科学院药物研究所吕扬教授提供),对乙酰氨基酚 (Sigma- Aldrich公司,含量≥99%); 甲醇 (色谱纯)。
动物SPF级雄性SD大鼠,体重190~210 g (北京维通利华实验动物技术有限公司)。
仪器Agilent 1200高效液相色谱仪 (安捷伦科技公司,美国); 高速冷冻离心机 (Beckman,美国); Eppendorf离心机 (Eppendorf公司,德国)。
溶液配制对照品溶液: 精密称取奥扎格雷标准品1 mg,加入1 mL甲醇充分溶解并混匀,配成1 g·L-1的奥扎格雷母液,以流动相稀释成不同浓度的标准溶液。内标溶液: 精密称取对乙酰氨基酚1 mg,加入1 mL流动相充分溶解并混匀,配成1 g·L-1的对乙酰氨基酚母液,以流动相稀释成100 mg·L-1的内标工作液。
色谱条件[13, 14]色谱柱: Agilent SB-C18 (4.6 mm × 250 mm); 流动相: 甲醇-0.1% 磷酸 (22∶78); 流速: 1 mL·min-1; 柱温: 30 ℃; 进样量: 15 μL。检测波长: 奥扎格雷278 nm,参比波长360 nm,保留时间4.9 min; 内标对乙酰氨基酚244 nm,参比波长360 nm,保留时间5.9 min。每针分析时间为15 min。
血浆样品处理 空白血浆处理精密吸取大鼠血浆150 μL,置于1.5 mL离心管中,加入甲醇450 μL,涡旋振荡5 min,15 000 r·min-1离心15 min,吸取上清液置于新的离心管中,氮气挥干甲醇,加入流动相150 μL复溶残渣,涡旋振荡5 min,15 000 r·min-1离心15 min,吸取上清液用HPLC检测。
血样处理精密吸取大鼠血浆150 μL,置于1.5 mL离心管中,加入内标甲醇溶液15 μL,甲醇435 μL,然后按照“空白血浆处理”方法处理,进行HPLC分析。
方法学考察 标准曲线和线性范围取空白血浆150 μL,加入内标溶液 (100 mg·L-1对乙酰氨基酚甲醇溶液) 15 μL,精密加入奥扎格雷系列对照品甲醇溶液15 μL,使其终质量浓度分别为100、50、25、12.5、6.25、3.125、1.562 5、0.781 2、0.390 6、0.195 3和0.097 7 mg·L-1。向系列浓度对照液中加入甲醇420 μL,按照血浆样品处理方法操作,依法测定。以待测样品奥扎格雷和内标物对乙酰氨基酚的峰面积之比为纵坐标 (Y),奥扎格雷的浓度为横坐标 (X),使用加权最小二乘法进行回归计算,得回归方程为y = 0.168 3 x + 0.050 6,R2 = 0.999 5 (n = 5),线性范围是0.097 7~100 mg·L-1。
绝对回收率分别配制奥扎格雷浓度为50、12.5和0.781 2 mg·L-1的血浆样品,按照血样处理方法处理,进行HPLC分析,记录峰面积,与相应浓度奥扎格雷对照溶液进样所得到的峰面积相比,二者的比值即为绝对回收率。
相对回收率分别配制奥扎格雷浓度为50、12.5和0.7812 mg·L-1的血浆样品,按照血样处理方法处理,进行HPLC分析,记录峰面积,计算Ai/As,代入标准曲线得到奥扎格雷的检出量。检出量与加入量的比值即为相对回收率。
精密度分别配制奥扎格雷浓度为50、12.5和0.7812 mg·L-1的血浆样品,按照血样处理方法处理,进行HPLC分析。一天之内重复5次,连续测定3天。以测得的奥扎格雷浓度计算方法的精密度。
奥扎格雷不同晶型的吸收比较雄性SD大鼠10只,体重190~210 g,随机分为2组,每组5只,给药前禁食12 h,自由饮水。以150 mg·kg-1剂量经口给予奥扎格雷晶型Ⅰ、Ⅱ,分别于给药后5 min、10 min、15 min、30 min、1 h、1.5 h、2 h、3 h、4 h、6 h、8 h、10 h、12 h和24 h时眼眶取血0.5 mL,置于涂有肝素的离心管中,5 000 r·min-1离心10 min,分离血浆,按上述方法处理,测定。
主要药代动力学参数利用专业软件DAS 3.0.7,采用非房室模型对测得的血药浓度数据进行药代动力学参数的计算。
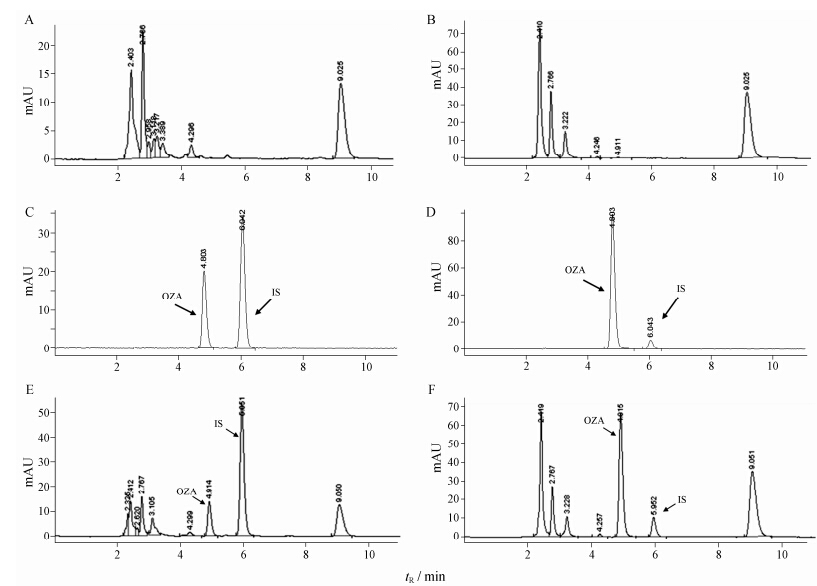
结果 1 HPLC法测定大鼠血浆中的奥扎格雷血浆中的奥扎格雷的色谱行为见图 2。奥扎格雷的保留时间为4.9 min,内标对乙酰氨基酚的保留时间为5.9 min。空白血浆在244 nm和278 nm两个波长下,在4.9和5.9 min处均无杂质峰干扰。
|
Figure 2 HPLC chromatograms of biological samples with ozagrel. A: Blank,244 nm; B: Blank,278 nm; C: Standard solution,244 nm; D: Standard solution,278 nm; E: Plasma sample,244 nm; F: Plasma sample,278 nm. IS: Internal standard |
在该方法下,奥扎格雷的绝对回收率、相对回收率及精密度均符合HPLC检测的要求,此方法稳定有效。结果见表 1。
|
|
Table 1 Recovery and precision of ozagrel detection (n = 5). aExtraction,bMethodology |
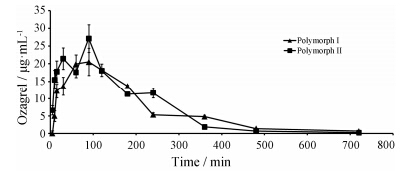
奥扎格雷晶型II口服后在大鼠体内的达峰时间和达峰浓度均大于晶型I (图 3)。
|
Figure 3 Blood concentration-time curves of ozagrel multi- polymorphs in SD rats after oral administration. n = 5,x± s |
拟合后两种晶型的药代参数见表 2,由表 2可见不同晶型奥扎格雷的代谢参数存在差异。
|
|
Table 2 Main pharmacokinetic parameters of ozagrel polymorphs in SD rat after orally administration. P < 0.05,**P < 0.01 vs Polymorph I |
本实验确定了高效液相色谱洗脱条件,通过双波长检测,可将待测药物奥扎格雷、内标对乙酰氨基酚以及动物血浆中的杂质区分开。所建立的方法分析时间短、峰形好、准确度高,可以灵敏、快速检测药物的体内吸收。
结果发现,奥扎格雷晶型I和晶型II制备的药物制剂存在有效浓度持续时间方面的差异。与晶型I相比,晶型II奥扎格雷固体口服给药在大鼠体内的达峰时间、药时曲线下面积和半衰期均明显大于晶型I,证明晶型II作为原料药可以增加药物的生物利用度,延长药物作用时间,临床应用时有可能减少用药次数,降低用药成本,为药物制剂的优势晶型。因此在药物生产中需要注意将奥扎格雷原料药的晶型控制为晶型II,从而延长药物有效作用时间,增强药效。以上对不同晶型的研究结果可以为奥扎格雷药物制剂的质量控制提供一些借鉴和参考。
| [1] | Huang LS, Gu YF, Li H. Advances in herbal volatile oil and aromatic herbs [J]. China J Chin Mater Med (中国中药杂志), 2009, 34: 1605-1611. |
| [2] | You J, Cui DF, Li QB, et al. Investigation and application of powdering technique on oily drug of the traditional Chinese medicine [J]. China J Chin Mater Med (中国中药杂志), 2004, 29: 7-10. |
| [3] | Zhang LF, Luo C, Wang H. Advance in pharmacological research of volatile oils in common southern medicinal plants [J]. Acad J Guangdong Coll Pharm (广东药学院学报), 2014, 30: 115-117. |
| [4] | Wu GT, Zhang XH, Li FQ. Advances in pharmaceutical studies on improvement of stability of volatile oils of Chinese material medica [J]. Pharm Care Res (药学服务与研究), 2008, 8: 197-199. |
| [5] | Liu HM, Jiang SH, Zhang ZJ. Optimization of the inclusion technology of volatile oil from Xianggui Huazhuo capsule by orthogonal experiment [J]. China Pharm (中国药房), 2010, 21: 4449-4450. |
| [6] | Zhang Y, Feng Y, Xu DS. Herbal volatile oil microcapsule advances in technology [J]. Chin Tradit Pat Med (中成药), 2006, 28: 412-415. |
| [7] | Shi F, Zhao JH, Guo T, et al. Research progress of tradi-tional Chinese medicine volatile oil nano drug delivery sys-tem [J]. China Pharm (中国药房), 2013, 24: 1429-1430. |
| [8] | He JJ, Chen Y, Du M, et al. Exploration of one-step preparation of Ganoderma lucidum multicomponent microemulsion [J]. Acta Pharm Sin (药学学报), 2013,48: 441-446. |
| [9] | Yao J, Gu XT, Zhou JP, et al. Distribution behavior of lipophilic drugs in the oil-in-water microemulsions [J]. Acta Pharm Sin (药学学报), 2007, 42: 768-773. |
| [10] | Liu JQ, Cui L, Losic D. Graphene and graphene oxide as new nanocarriers for drug delivery applications [J]. Acta Biomater, 2013, 9: 9243-9257. |
| [11] | Sun YB, Yang SB, Zhao GX, et al. Adsorption of polycyclic aromatic hydrocarbons on graphene oxides and reduced graphene oxides [J]. Chem Asian J, 2013, 8: 2755-2761. |
| [12] | Chen XZ, Zhou Y, Jiang ZX, et al. Study on graphene oxide in the function of drug delivery and biosafety [J]. BioMed Eng Clin Med (生物医学工程与临床), 2012, 16: 402-405. |
| [13] | Mao CQ, Yao Q, Tan XZ, et al. Simultaneous determina-tion of 3 components in inclusion complex of compound zedoary turmeric oil-β cyclodextrin by HPLC [J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 2011, 27: 372- 374. |
| [14] | Liu SJ, Lin ZT, Wang H, et al. Quantification of eugenol and bancroftione in Caryophylli Fructus using high-performance liquid chromatography [J]. J Chin Pharm Sci, 2010, 19: 459- 463. |
| [15] | Jin X, Wang JY, Zhang N, et al. Determination of entrap-ment efficiency of curcunol liposomes by minicolumn centrifugation-high performance liquid chromatography method [J]. Chin J Pharm, 2010, 8: 27-32. |
| [16] | Zhang C, Zhao Y, Guo C, et al. Solubility determination of two kinds of preparations containing clove oil [J]. J Bei-jing Coll Acup Orthoped (北京针灸骨伤学院学报), 2001, 8: 14-17. |
| [17] | Chung C, Kim YK, Shin D, et al. Biomedical applications of graphene and graphene oxide [J]. Acc Chem Res, 2013, 46: 2211-2224. |
 2015, Vol. 50
2015, Vol. 50


