2. 上海中医药大学中药研究所中药标准化教育部重点实验室暨上海市复方中药重点实验室, 上海 201203;
3. 中国科学院上海生命科学研究院生物化学与细胞生物学研究所分子生物学国家重点实验室, 上海 200031
2. The Ministry of Education Key Laboratory for Standardization of Chinese Medicines and Shanghai Key Laboratory of Compound Chinese Medicines, Institute of Chinese Materia Medica, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China;
3. The State Key Laboratory of Molecular Biology, Institute of Biochemistry and Cell Biology, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai 200031, China
脂质代谢紊乱导致的高脂血症是引起心血管疾病的一个重要危险因素,临床表现为高胆固醇血症和高甘油三酯血症或二者兼高[1, 2]。随着人们生活水平的提高,高脂血症的发病率逐渐增加。目前临床上降血脂药主要有: 他汀类药物、贝特类药物、烟酸类药物和胆固醇吸收抑制剂等[3],疗效明显,但长期服用有副作用,如肝毒性、肌病、胃肠道功能紊乱等[4, 5, 6]。因此寻找新的安全、有效的中药和治疗靶点是高脂血症研究领域的一大热点。
在哺乳动物中,胆固醇、脂肪酸和甘油三酯的生物合成由一类重要的转录因子家族-固醇调节元件结合蛋白 (SREBPs) 所调控[7]。SREBPs有3种异构体: SREBP-1a、SREBP-1c和SREBP-2。SREBP-1主要调控脂肪酸和甘油三酯的代谢,SREBP-2调控胆固醇的生物合成[8]。研究发现抑制SREBP表达可以降低血清总胆固醇 (TC) 和甘油三酯 (TG) 水平,在肥胖、动脉粥样硬化及脂肪肝中发挥重要作用[9, 10]。
传统中药大黄被广泛应用于中国、俄罗斯、印度、欧洲和北美洲[11],主要有效成分为蒽醌类化合物。已有的研究结果表明: 大黄醇提液可以降低血清TC和TG水平[12]; 大黄具有抑制胰脂肪酶活性的作用,减少机体对脂肪的吸收,从而降低胆固醇水平[13],提示大黄对于治疗高脂血症、脂肪肝和动脉粥样硬化等具有一定的作用。大黄酚 (chrysophanol) 为大黄的主要有效成分之一,具有抗菌、泻下和止血等多种生物活性[14],但对其是否能改善脂质代谢尚无报道。本研究通过探讨大黄酚对Huh-7细胞脂质代谢的影响并阐明其机制,为进一步进行体内研究和药物开发提供依据。
材料与方法 实验材料Huh-7细胞株购自中国科学院上 海细胞库; 大黄酚 (C15H10O4,MW 254.23) 购自上 海中药标准化研究中心,纯度 > 98%; 质粒pSRE- Luciferase、pEGFP-N1、G418由中国科学院上海生命科学院细胞生物研究所馈赠; RNA抽提试剂TRIzol、Lipofectamine 2000脂质体由Invitrogen公司提供; DMEM (Dulbecco’s Modified Eagles Medium) 培养基、胎牛血清 (fetal bovine serum,FBS) 和0.25% 胰酶-EDTA (0.25% Trypsion-EDTA) 均购自Gibco公司; 双荧光素酶报告基因检测试剂盒购自Promega公司; 总胆固醇和甘油三酯测定试剂盒购自南京建成生 物工程研究所; 反转录试剂盒及荧光定量PCR试剂盒由日本TaKaRa公司提供; PCR引物由上海捷瑞生物工程有限公司合成; CCK-8试剂盒 (Cell Counting Kit-8) 由日本同仁化学研究所 (Dojindo) 提供; BCA蛋白定量试剂盒购自北京鼎国昌盛生物技术有限责任公司。
细胞培养Huh-7细胞生长于含10% 胎牛血清、100 u·mL-1青霉素和链霉素的DMEM培养液中,在37 ℃、5% CO2饱和湿度的条件下贴壁培养,隔天换液,取对数生长期的细胞用于实验。
Huh-7/SRE-Luc转染细胞株的构建取对数生长期的Huh-7细胞,按细胞数1×104/孔接种至96孔培养板。转染时采用LipofectamineTM 2000介导的方法,将质粒pSRE-Luciferase、pEGFP-N1以5∶1的 比例转入Huh-7细胞株中,转染48 h后更换为含700 µg·mL-1 G418、10% 胎牛血清的DMEM培养基。每2~3天更换新鲜的培养基,直至2周后带有G418 抗性的细胞克隆形成。单克隆以克隆环进行分离,分离得到的细胞株命名为Huh-7/SRE-Luc[10]。Huh-7/ SRE-Luc细胞株于含10% 低脂蛋白血清 (LPDS)、洛伐他汀 (1 µmol·L-1)、甲羟戊酸 (10 µmol·L-1) 及100 u·mL-1青霉素和链霉素的DMEM培养基中培养。
大黄酚对SREBP的调控作用取生长状况良好的Huh-7/SRE-Luc细胞进行实验,按细胞数1×104/孔接种至96孔培养板,每孔200 μL。培养24 h后,弃去原培养基,加入含2.5、5、10、20、40、80及160 µmol·L-1大黄酚的完全培养基处理细胞16 h,每组平行3个复孔。各药物浓度处理组中的DMSO浓度控制为0.1%,同时设置仅含0.1% DMSO的空白对照组和含2.5 µmol·L-1 25-羟基胆固醇的阳性对照组。各组细胞按照双荧光素酶报告基因检测试剂盒提供的方法,分别测定萤火虫荧光素酶和海肾荧光素酶活性值。各处理组细胞的转染效率通过萤火虫荧光素酶活性值除以同一样品的海肾荧光素酶活性值进行校正。以含0.1% DMSO的空白对照组荧光素酶活性值作为基础表达 (以1表示),各组校正转染效率后的样品活性值与其的比值来反映诱导能力。
CCK-8检测细胞存活率取对数生长期的Huh-7细胞,以细胞数1×104/孔接种于96孔板中,每孔100 μL。培养24 h后,换成含20、40、80 µmol·L-1大黄酚的完全培养基,同时设置空白对照组,每组平行3个复孔。药物干预24 h后,每孔加入CCK-8试剂10 μL,孵育1 h,酶标仪测定吸光度值 (A,450 nm)。实验结果以细胞存活率表示,细胞存活率 = A实验组 / A对照组 × 100%。
细胞内TC、TG含量检测Huh-7细胞用含10% 胎牛血清的DMEM (含正常浓度葡萄糖: 5.5 mmol·L-1),在37 ℃、5% CO2培养箱中培养。取对数生长期的Huh-7细胞,以细胞数5×104/孔接种于6孔板中,培养24 h后,换用无血清的培养基培养12 h,加入高浓度葡萄糖 (30 mmol·L-1) 和大黄酚 (40 µmol·L-1) 预孵育24 h。Huh-7细胞用细胞裂解液 (20 mmol·L-1 Tris-HCl,pH 7.5,150 mmol·L-1 NaCl,1% Triton) 裂解,用BCA法测蛋白浓度,裂解液中加入等体积的氯仿混合,14 000 r·min-1 离心 (4 ℃) 15 min,取氯仿层,挥干,50 μL异丙醇复溶,按照总胆固醇和甘油三酯测定试剂盒操作步骤检测TC、TG含量。
荧光定量PCR检测Huh-7细胞内基因表达将Huh-7细胞接种于6孔板中,培养24 h后,换成含10% LPDS、洛伐他汀 (1 µmol·L-1) 和甲羟戊酸 (10 µmol·L-1) 的完全培养基,同时加入大黄酚 (40 µmol·L-1) 作用16 h。采用TRIzol试剂提取细胞总RNA,用Nanodrop检测RNA浓度。取RNA样本 1 μg,按照反转录试剂盒操作步骤合成cDNA。采用SYBR Green PCR试剂,用ABI Prism 7000 Sequence Detection System进行PCR扩增和检测。PCR反应 条件为95 ℃、10 min预变性,95 ℃、15 s变性,60 ℃、60 s退火,共40个循环。涉及的引物如表 1所示,每次扩增设置β-Actin基因内参照,用PCR仪自带软件进行荧光定量分析,得出Ct值,统计△△Ct值以比较各组mRNA的表达。
|
|
Table 1 The primer sequence of real-time PCR |
采用SPSS 18.0统计软件,实验数据以means ± SD表示,采用单因素方差分析 (One-way ANOVA) 及LSD检验进行统计学分析。
结果 1 大黄酚对SREBP转录活性的抑制作用双荧光素酶报告基因实验显示,不同浓度的大黄酚 (2.5、5、10、20、40、80及160 µmol·L-1) 对SREBP转录活性均有抑制作用,抑制倍数分别是空白对照组的0.16倍、0.12倍、0.25倍、0.33倍 (P < 0.05)、0.47倍 (P < 0.01)、0.49倍 (P < 0.01) 和0.54倍 (P < 0.01),呈剂量依赖性。用GraphPad Prism软件计算 出大黄酚对SREBP转录抑制作用的IC50值为20.22 µmol·L-1,结果见图 1。
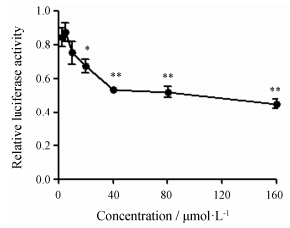
|
Figure 1 Transcription activity of chrysophanol (2.5,5,10,20,40,80 and 160 µmol·L-1) on sterol regulatory element promoter in Huh-7 cells. n = 4,x± s. P < 0.05,**P < 0.01 vs vehicle control group |
不同浓度的大黄酚 (20、40及80 µmol·L-1) 作用Huh-7细胞24 h后,细胞存活率呈减弱趋势,但与空白对照组相比无统计学差异 (图 2)。结果表明,大黄酚浓度在20、40、80 µmol·L-1时对Huh-7细胞没有细胞毒性。
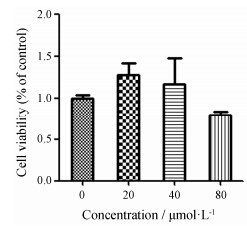
|
Figure 2 Effect of chrysophanol (20,40 and 80 µmol·L-1) on cell viability inHuh-7 cells. n = 3,x± s |
大黄酚 (40 µmol·L-1) 作用Huh-7细胞24 h后,细胞内TC、TG水平显著下降 (P < 0.05),见图 3。
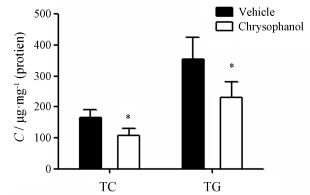
|
Figure 3 Effect of chrysophanol (40 µmol·L-1) on intracellular cholesterol (TC) and triglyceride (TG) levels in Huh-7 cells. n = 4,x± s. P < 0.05 vs vehicle control group |
SREBPs直接激活胆固醇、脂肪酸、甘油三酯合成和摄取的相关基因[15, 16],检测参与胆固醇代谢的11种基因,大黄酚显著下调SREBP-2、3-羟基-3-甲基戊二酰辅酶A合成酶 (3-hydroxy-3-methyl glutaryl coenzyme A synthetase,HMGCS)、3-羟基-3-甲基戊 二酰辅酶A还原酶 (3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMGCR)、法尼酯二磷酸合成酶 (farnesyl diphosphate synthetase,FDPS)、鲨烯合成酶 (squalene synthase,SS)、羊毛固醇合酶 (lanosterol synthasem,LSS)、甲基固醇羟化酶单加氧酶1 (sterol- C4-methyl oxidase-like,Sc4mol)、24-脱氢胆固醇还原酶 (24-dehydrocholesterol reductase,DHCR24)、DHCR7、甲羟戊酸激酶 (mevalonate kinase,MVK)、法呢基焦磷酸法尼基转移酶 (farnesyl diphosphate farnesyl transferase 1,FDFT1) mRNA的表达 (图 4A),同时,参与脂肪酸生物合成途径中的9种基因: SREBP-1、脂肪酸合成酶 (fatty acid synthetase,FAS)、乙酰辅酶A羧化酶1 (acetyl CoA carboxylase,ACC-1)、ACC-2、ATP柠檬酸裂解酶 (ATP citrate lyase,ACL)、硬脂酰辅酶A去饱和酶1 (stearoyl-coenzyme A desaturase,SCD-1)、脂肪酸去饱和酶1 (fatty acid desaturase,FADS1)、FADS2和甘油-3-磷酸O-酰基转移酶 (glycerol-3- phosphate O-acyltransferase,GPAT) mRNA的表达明显下调 (图 4B)。
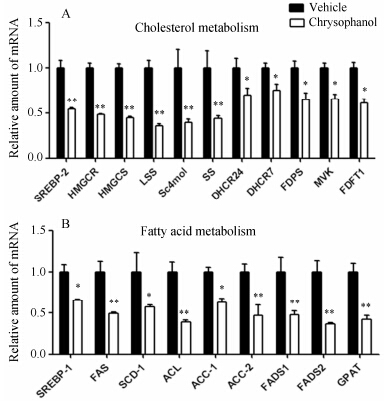
|
Figure 4 Effect of chrysophanol (40 µmol·L-1) on expressions of SREBPs target genes in Huh-7 cells. The mRNA expressions of cholesterol metabolism (A). The mRNA expressions of fatty acid metabolism (B). Expression was normalized to β-actin,and each bar represents the mean ± SD of triplicates of three independent experiments. P < 0.05,**P < 0.01 vs vehicle control group |
高脂血症是由体内血脂代谢异常所引起的全身慢性疾病,可引起动脉粥样硬化等心血管疾病,严重危害人类健康。积极降低TC、TG含量,是防治高脂血症的一项有效措施。大黄为我国传统中药,疗效广泛,具有泻下、抗菌及保肝利胆等作用[17, 18]。研究表明: 大黄可以降低血清胆固醇水平[12, 13]; 其蒽醌类成分大黄素和大黄酸对高脂饲料诱导的肥胖小鼠具有一定的改善作用[19, 20]。本研究证明了大黄酚能降低肝细胞内TC、TG水平,表明大黄酚能明显改善肝细胞脂质沉积,具有调血脂的作用。因此对改善脂质代谢紊乱导致的高脂血症、脂肪肝等代谢疾病的发生和发展具有重要意义。
SREBPs是调控肝脏脂质代谢的一个重要转录因子。SREBP-1是脂肪酸合成中至关重要的调控因子,主要激活FAS、ACC-1、ACC-2、ACL、SCD-1、FADS1、FADS2和GAPT的表达; SREBP-2则主要参与调节胆固醇的合成,调节HMGCS、HMGCR、FDPS、SS、LSS、Sc4mol、DHCR24、DHCR7、MVK和FDFT1的转录[7, 8]。SREBPs是从体外培养的人HeLa细胞核中抽提并纯化的,该蛋白属于碱性螺旋-环-螺旋-亮氨酸链 (bHLH-Zip) 转录因子家族[21],其合成产物为结合在内质网 (ER) 的无活性前体,它的活化转运需要其前体化合物裂解释放活性的氨基末端片段,而此过程受固醇的调控。当胞内固醇含量下降时,SREBP裂解活化蛋白 (SCAP) 将SREBP从内质网募集到高尔基体,被位点1、2蛋白水解酶水解,释放其氨基末端片段,进而进入核内与其靶基因启动子的固醇调节元件 (SREs) 结合,从而调节胞内的脂质水平[22, 23]。
HMGCR、HMGCS是调控细胞内胆固醇生物合成的关键限速酶,该酶基因的表达受到细胞内固醇含量的反馈调节,即表现出基因表达下调,胆固醇合成减少; 基因表达上调,胆固醇合成增加。本研究表明,大黄酚可以降低肝细胞内HMGCR和HMGCS mRNA水平,说明大黄酚降低肝细胞内TC含量可能是通过抑制HMGCR和HMGCS的表达引起的。
FAS是催化乙酰辅酶A和丙二酰辅酶A合成内源性长链脂肪酸的关键酶。近年发现FAS与肥胖密切相关,FAS在人的肝脏和脂肪组织中有较高的表 达,特别是肝脏。人类SCD主要有两种异构体,其中SCD-1大多数表达于成人组织 (主要在肝脏) 中,是单不饱和脂肪酸合成的关键酶。大黄酚组肝细胞内的FAS、SCD-1表达水平明显低于空白对照组,从而降低肝细胞内TG含量。
本研究证明了大黄酚对SREBP具有转录抑制 作用,同时能显著下调其靶基因包括FAS、ACC-1、ACC-2、ACL、SCD-1、FADS1、FADS2、GAPT、HMGCS、HMGCR、FDPS、SS、LSS、Sc4mol、DHCR24、DHCR7、MVK和FDFT1的表达。提示大黄酚可能通过抑制SREBP及靶基因表达,进而改善脂质代谢。因此,大黄酚可能是作为治疗高脂血症的一种潜在有效药物。本课题组将进一步在体内研究大黄酚对高脂饲料诱导的肥胖小鼠动物模型的保护或诱导作用,并从SREBP通路研究其相关作用机制。
综上所述,大黄酚可以改善Huh-7细胞的脂质水平,从而达到降脂作用,其作用机制可能与抑制SREBP及靶基因表达有关。然而调控肝细胞脂代谢通路涉及许多重要调控因子,SREBP的抑制是大黄酚的直接作用,还是大黄酚作用于其他重要靶点而产生的间接作用,仍需进一步研究。
| [1] | Grover SA, Dorais M, Coupal L. Improving the prediction of cardiovascular risk: interaction between LDL and HDL cholesterol [J]. Epidemiology, 2003, 14: 315-320. |
| [2] | Murray CJL, Lopez AD. Global mortality, disability, and the contribution of risk factors: Global Burden of Disease Study [J]. Lancet, 1997, 349: 1436-1442. |
| [3] | De D, Khanna I. Recent trends in HDL modulating thera-pies [J]. Ann Rep Med Chem, 2007, 42: 177-191. |
| [4] | Kashani A, Sallam T, Bheemreddy S, et al. Review of side-effect profile of combination ezetimibe and statin therapy in randomized clinical trials [J]. Am J Cardiol, 2008, 101: 1606-1613. |
| [5] | Robinson JG. Should we use PPAR agonists to reduce cardiovascular risk? [J]. PPAR Res, 2008, 2008: Article ID 891425. |
| [6] | Filippatos TD, Mikhailidis DP. Lipid-lowering drugs acting at the level of the gastrointestinal tract [J]. Curr Pharm Des, 2009, 15: 490-516. |
| [7] | Goldstein JL, DeBose-Boyd RA, Brown MS. Protein sen-sors for membrane sterols [J]. Cell, 2006, 124: 35-46. |
| [8] | Xiao X, Song BL. SREBP: a novel therapeutic target [J]. Acta Biochim Biophys Sin, 2013, 45: 2-10. |
| [9] | Moon YA, Liang GS, Xie XF, et al. The Scap/SREBP pathway is essential for developing diabetic fatty liver and carbohydrate-induced hypertriglyceridemia in animals [J]. Cell Metab, 2012, 15: 240-246. |
| [10] | Tang JJ, Li JG, Qi W, et al. Inhibition of SREBP by a small molecule, betulin, improves hyperlipidemia and insulin resistance and reduces atherosclerotic plaques [J]. Cell Metab, 2011, 13: 44-56. |
| [11] | Xiao PG, He LY, Wang LW. Ethnopharmacologic study of Chinese rhubarb [J]. J Ethnopharmacol, 1984, 10: 275-293. |
| [12] | Xu ZP, Lu ZJ, Chen JH, et al. The effect of rhubarb etha-nol-extracton hyperlipidemia and liver fatty in rabbits [J]. Chin J Appl Physiol (中国应用生理学杂志), 2007, 23: 375-380. |
| [13] | Abe I, Seki T, Noguchi H, et al. Galloy lesters from rhubarb are potent inhibitors of squalene epoxidase, a key enzyme in cholesterol biosynthesis [J]. Plant Med, 2000, 66: 753-754. |
| [14] | Xu X, Li BP, Zhang HF. Advancement of the study on rhubarb [J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2003, 37: 56-59. |
| [15] | Brown MS, Goldstein JL. The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor [J]. Cell, 1997, 89: 331-340. |
| [16] | Brown MS, Goldstein JL. A proteolytic pathway that controls the cholesterol content of membranes, cells, and blood [J]. Proc Natl Acad Sci USA, 1999, 96: 11041-11048. |
| [17] | Chen CH, Liu MZ, Su HL, et al. Studies on the Chinese rhubara Ⅴ. Antibacterial properties and stability of anthraquinone derivatives and the antagonism of some compounds to their inhibitory action [J]. Acta Pharm Sin (药学学报), 1964, 11: 258-265. |
| [18] | Zhuang JN. Advance in research of the principal components and clinical pharmacology of Rheum palmatum [J]. Trad Chin Med Guidance (中医药指南), 2009, 7: 41-42. |
| [19] | Tzeng TF, Lu HJ, Liou SS, et al. Emodin protects against high-fat diet-induced obesity via regulation of AMP-activated protein kinase pathways in white adipose tissue [J]. Planta Med, 2012, 78: 943-950. |
| [20] | Zhang Y, Fan SJ, Hu N, et al. Rhein reduces fat weight in db/db mouse and prevents diet-induced obesity in C57Bl/6 mouse through the inhibition of PPARγ signaling [J]. PPAR Res, 2012, 2012: Article ID 374936. |
| [21] | Horton JD, Goldstein JL, Brown MS. SREBPs: activators of the complete program of cholesterol and fatty acid syn-thesis in the liver [J]. J Clin Invest, 2002, 109: 1125-1131. |
| [22] | Brown AJ, Sun LP, Feramisco JD, et al. Cholesterol addi-tion to ER membranes alters conformation of SCAP, the SREBP escort protein that regulates cholesterol metabolism [J]. Mol Cell, 2002, 10: 237-245. |
| [23] | Espenshade PJ, Li WP, Yabe D. Sterols block binding of COPⅡ proteins to SCAP, thereby controlling SCAP sorting in ER [J]. Proc Natl Acad Sci USA, 2002, 99: 11694-11699. |
 2015, Vol. 50
2015, Vol. 50


