2. 军事医学科学院放射与辐射医学研究所, 北京 100850
2. Beijing Institute of Radiation Medicine, Beijing 100850, China
血脑屏障 (blood brain barrier,BBB) 对脑组织产生屏蔽作用,减少或消除血液中有害物质 (如毒素、病毒) 对脑组织可能产生的损害,但同时阻碍了药物进入脑组织,给脑部疾病治疗带来障碍[1]。如何通过药物载体或药物递送技术将药物有效穿透BBB到达靶区,成为药剂学研究和脑部疾病药物治疗的关注重点。最近,无创和有限开放BBB的研究受到关注,如低频聚焦超声联合微泡造影剂可开放BBB[2, 3],并且超声微泡已得到临床应用,其安全性和有效性已被证实,如已上市的微泡产品Definity、Optison、Imagent和全氟显。
超声破碎微泡可产生空化效应。虽有研究证明 低频聚焦超声联合微泡可开放BBB,但要做到高水平、无创可逆、靶向开放BBB,必须在大量实验基 础上针对具体微泡和超声条件,探讨最适宜实验参数,包括超声频率、功率、辐照时长和微泡剂量。低频 (1 MHz) 超声可有效发挥微泡的空化效应[4, 5],不仅能将大量微泡推送至对侧管壁,而且很少对微泡产生聚集作用[6, 7]。
本文通过固定超声频率、功率和微泡浓度剂量,改变辐照时长,确定无创可逆开放脑胶质瘤部位BBB的理想实验参数,并证明超声微泡可用于脑胶质瘤靶向药物递送。
材料与方法 材料脂质微泡按照文献[8]处方和工艺,在超声实验前制备。取大豆磷脂、吐温80、聚乙二醇1500 (4∶10∶100,w/w) 混合,加入10倍量的叔丁醇溶解,加热至65 ℃混匀,冷冻干燥24 h,得到脂质微泡冻干粉,充入全氟丙烷饱和,临用前加入注射用水2 mL,轻摇形成微泡混悬液。微泡大小均一,平均粒径约3.26 μm,生理盐水稀释后的浓度为5.8×108~6.7×108/mL,大鼠给药剂量为3 mL·kg-1。伊文思蓝 (Evans blue,EB,Sigma公司); 4% 多聚甲醛 (重庆市北碚化学试剂厂)。大鼠C6胶质瘤细胞株购于中国科学院上海细胞库。荷瘤雄性SD (Sprague-Dawley) 大鼠,体重为280~320 g,无特定病原体 (Specific pathogen Free,SPF) 级,温州医科大学实验动物中心。
仪器WDT-V型脑立体定向仪,小型颅钻,ST-III型三维手动推进仪 (西安西北光电医疗器械厂); Signa 3.0T磁共振成像仪 (GE公司); 大鼠扫描专用线圈 (上海晨光公司); 低功率聚焦超声治疗仪 (温州医科大学附属第二医院); UV300分光光度计 (上海元析仪器有限公司); BT01-100型恒流灌注泵 (保定兰格恒流泵有限公司); BMJ-Ⅲ型病理组织包埋机 (常州中威电子仪器有限公司); 旋转型石蜡切片机 (英国珊顿公司); PHY-Ⅲ病理组织漂烘仪 (常州中威医疗仪器有限公司); IX71倒置研究型显微镜 (日本 Olympus公司); ACAS ULTMA312型激光共聚焦显微镜 (美国Meridian公司)。
脑胶质瘤模型的建立调整C6细胞数为1×106/ 10 μL,用台盼蓝排斥实验检测细胞活力 > 95%。腹腔注射1% 戊巴比妥钠 (3 mL·kg-1) 麻醉大鼠,剪去头顶部毛,在内毗连线与头部矢状中线交汇处,纵向头皮切口约1 cm长分离,暴露颅骨。将头部固定在大鼠脑立体定位仪上,用碘酒、酒精顺序消毒,铺洞巾。选取大鼠右侧脑尾状核区为靶点,根据大鼠头部立体定向解剖图,确定对应于右脑尾状核的钻孔位置。用牙科钻钻直径约1 mm孔,深达硬脑膜表面但不刺破硬脑膜。用微量注射器吸取10 μL细胞悬液,调节定位仪上的针尖使其触及硬脑膜,进针6 mm,后退 1 mm,使针尖距硬脑膜为5 mm,将细胞缓慢注入脑内,注射速度约为2.5 μL·min-1,注完后留针约5 min,缓慢退针,用无菌骨蜡封闭骨孔,缝合皮肤,切口消毒。手术在无菌环境下操作。对照组大鼠以等体积的培养液替换细胞悬液。
BBB开放性检测 EB靶点染色EB静脉注射后可立即与血浆白蛋白结合,形成EB白蛋白复合物。复合物分子量大,不能透过完整BBB; 但BBB开放时复合物可渗透通过BBB,并且渗出量和BBB开放程度呈正相关。因此可根据脑实质EB染色程度推测BBB开放程度。大鼠超声辐照后立即尾静脉注射0.2% EB溶液,剂量为2 mL·kg-1,4 h后打开左侧胸腔,生理盐水灌注,至右心房流出灌注液变澄清,再用磷酸盐缓冲液 (pH 7.4) 灌注至动物出现肌肉抽搐后,再缓慢灌注30 min,然后处死大鼠,断头,取端脑,用4% 多聚甲醛溶液固定脑组织,72 h后切片。
荧光显微镜观察脑组织冰冻切片,在显微镜下观察超声辐照区及周围组织EB染色情况。
脑中EB定量检测大鼠超声辐照后尾静脉注射0.2% EB溶液,剂量为2 mL·kg-1,2 h后用生理盐水灌注,取脑,称重。将局部染色的脑组织按10 mL·g-1湿重浸入甲酰胺中,在60 ℃水浴中放置24 h,当甲酰胺溶液呈蓝色、脑组织呈无色透明状时,取甲酰胺溶液测定620 nm处的EB吸收度。EB的分光光度法测定线性范围为0.039~10 μg·mL-1。根据脑内EB浓度计算BBB的EB通透率 [μg (EB) /g (脑组织)]。
磁共振常规及增强扫描磁共振 (magnetic resonance imaging,MRI) 检查包括脑横断面及冠状面T1加权像 (T1 weighted imaging,T1WI)、T2加权像(T2 weighted imaging,T2WI) 及增强T1WI检查。增强检查是通过鼠尾静脉注射0.4 mmol·kg-1钆喷酸葡胺注射液 (gadolinium-diethylenetriaminepentaacetic acid,Gd-DTPA,广州先灵药业有限公司) 10 min后进行。扫描条件为T1WI TR 560 ms,TE 27 ms,激励次数 (NEX) 2,矩阵256 × 256; T2WI TR 2 300 ms,TE 110 ms,NEX 2,矩阵256 × 256; 扫描层厚2.4 mm,层间距2.9 mm,视野 (FOV) 56 mm × 70 mm。
超声参数设置超声探头前端有循环水囊,设置水温25 ℃。将低频聚焦超声探头连接信号发生器,调节相应电压参数,再连接信号放大器。参数设定为: 频率1.0 MHz、焦距5 cm、声强4 W/cm2和焦域2 mm。在大鼠颅顶均匀涂抹超声耦合剂,探头中心对准瘤体部位,眼耳连线中点交界处,建立从超声探头到鼠头的连续性通路。
超声时长的考察将接种脑胶质瘤细胞16天 的荷瘤鼠随机分为对照组和超声微泡组。对照组 (n = 5) 经尾静脉注射生理盐水; 超声微泡组经尾静脉注射脂质微泡,剂量为3 mL·kg-1,然后用超声经颅辐照大鼠。超声微泡组按超声辐照时间分为10 s组、30 s组和60 s组,每组10只。各组静注EB溶 液,解剖后观察脑组织染色情况。同时通过苏木精-伊红 (hematoxylin-eosin,HE) 染色观察有无组织出血坏死表现。
接种时间和超声时机的影响对接种脑胶质瘤细胞第9、16、23和30天的荷瘤鼠分组: 非超声静注EB组; 超声微泡静注EB组; 先超声微泡后静注MR造影剂 (Gd-DTPA) 组; 先静注MR造影剂组后超声微泡组。对各组进行解剖后观察或T1加权相增强扫描,测定各组脑瘤部位及脑瘤边缘2 mm内的EB浓度。
病理学观察取脑组织冠状切片,用常规石蜡包埋,HE染色,显微镜下观察有无组织出血坏死表现。
统计分析实验数据以均数±标准差 (x± s) 表示,两两比较采用方差齐性检验、t检验。多组间数据比较采用方差分析,方差分析中两组间均数比较采用SNK法检验。分析采用SPSS13.0软件包,以 P < 0.05 (差异有统计学意义) 表示。
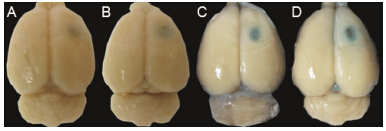
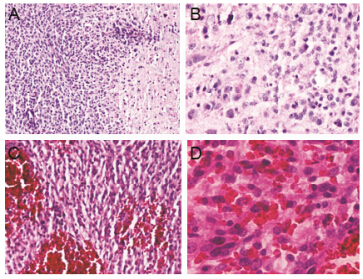
结果 1 超声时长对BBB开放的影响静脉注射EB后,发现对照组脑组织靶点 (瘤体) 表面呈极淡蓝色 (图 1A),说明脑胶质瘤可造成BBB微小开放。超声微泡组辐照区脑组织明显可见EB染色,随超声时间延长,染色程度也增强,其中60 s组 (图 1D) > 30 s组 (图 1C) >> 10 s组 (图 1B)。HE染色图中对照组、10 s组、30 s组显微镜下均未见明显异常,神经细胞包浆、核染色均匀,核仁清晰,核膜完整,血管结构尚完整,未见明显红细胞渗出,如30 s组,结果见图 2A、B; 但60 s组见明显异常,有明显红细胞渗出 (图 2C、D),即长时间超声可显著造成局部脑组织损伤。因此,综合BBB开放效果和组织损伤程度,确定超声时长为30 s。
|
Figure 1 EB staining states of mouse brains. A: Control; B: Ultrasound + microbubbles 10 s; C: Ultrasound + microbubbles 30 s; D: Ultrasound + microbubbles 60 s. EB: Evans blue |
|
Figure 2 Pictures of HE stained mouse brain slides. Group of ultrasound + microbubbles 30 s with 10×(A) and 20×(B); Group of ultrasound + microbubbles 60 s with 10×(C) and 20×(D). HE: Hematoxylin-eosin |
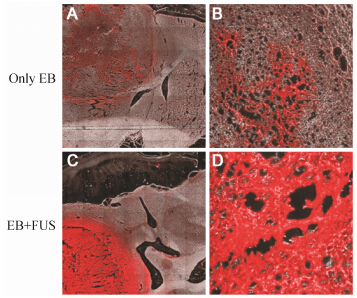
对移植脑瘤细胞30天的荷瘤鼠静注EB后超声辐照,并进行脑瘤组织切片,激光共聚焦显微镜下发现对照组 (注射EB) 仅见稀疏点状红色荧光 (图 3A、B),而超声微泡组 (30 s) 辐照区可见大量红色荧光(图 3C、D),证明超声微泡可促进EB渗透穿过BBB进入脑胶质瘤组织。
|
Figure 3 Confocal laser scanning microscopic images of tumor- bearing mouse brains. (A) and (B) represent the control group with only EB. (C) and (D) represent the ultrasound + microbubbles 30 s group. EB: Evans blue; FUS: Focused ultrasound with microbubbles |
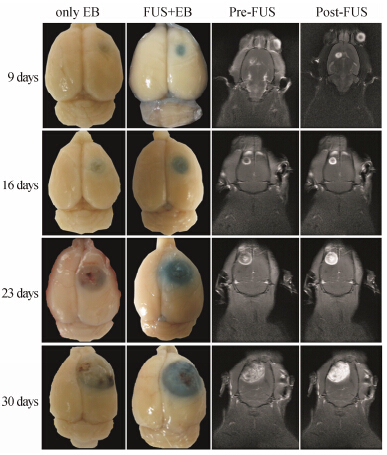
脑胶质瘤细胞移植后的不同时期,BBB通透性有较大差异。单独静注EB染色,脑瘤部位染色效果很不明显; 但超声微泡操作后,染色程度随脑瘤生长期延长明显加强 (图 4)。在超声条件下,静脉注射增强显影剂Gd-DTPA后,MR检查也呈现靶点BBB开放 (用MRI信号强度表示),具有脑瘤生长期依赖性。MRI结果表明,先超声再给造影剂后MRI脑瘤显影效果明显弱于先给造影剂再超声的情况(图 4),说明超声在造影剂到达靶部位表面时进行开放BBB效果最佳。超声时机和药物注射需进行合适的配合才能获得最强的BBB渗透。结果同时说明超声不会造成BBB长期损伤,超声停止后,BBB迅速恢复。
|
Figure 4 Effect of glioma growth time on the permeability of BBB. The left two columns are the pictures of EB stained mouse brains with only EB injection (the first column) and combination of ultrasound + microbubbles (the second column). The right two column are the MR images of EB stained mouse brains with the turn of ultrasound followed by Gd-DTPA injection (the third column) and the inversed turn (the fourth column). The lines indicate the various glioma growth days from 9,16,23 to 30 days. BBB: Blood-brain barrier; Gd-DTPA: Gadolinium-diethylenetriaminepentaacetic acid |
EB染色后在不同组织中浓度差异可定量判断BBB渗透性。在各时间点 (9、16、23和30天),超声微泡组脑瘤中EB一直维持较高浓度 (图 5),并且与超声微泡组瘤体边缘、对照组瘤体及瘤体边缘中EB浓度相比,差异均具有统计学意义 (P < 0.01)。超声微泡组瘤体边缘、对照组瘤体EB浓度一直保持接近,说明超声微泡可使BBB开放,促进EB进入脑瘤边缘; 而脑瘤本身也能造成BBB有限开放,但开放程度远小于超声微泡效应,并且EB很难进入脑瘤边缘部位。
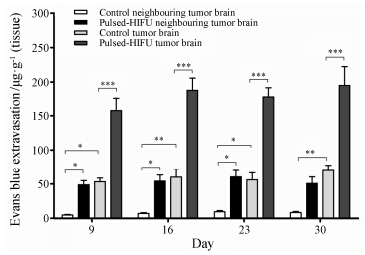
|
Figure 5 EB concentration in different tissues on different tumor growth days. n = 5. P < 0.05,**P < 0.01,***P < 0.001. HIFU: High intensity focused ultrasound |
检测无创性BBB开放的方法包括EB染色法、透射电镜检查法和影像学检查 (增强CT、增强MRI),最简便常用的是EB染料法[9]。本文充分利用EB染色的特点,从外观、红色荧光、定量检测方面系统考察了超声和脑胶质瘤对BBB开放的影响,准确判断出脑瘤、超声微泡、脑瘤附近神经组织中EB渗透情况和BBB开放程度。Gd-DTPA是水溶性分子,不能通过BBB,但BBB开放后可通过增强MR影像学,灵敏地显示BBB开放,并且可重复操作,没有破坏性。本文通过MRI检测,发现聚焦超声开放BBB的速度非常快,几乎是即时开放,并且呈可逆性。这与超声照射5 min后电镜下观察毛细血管内皮细胞紧密连接被打开的结论相符[10]。
微泡在脑内血液循环时,超声使微泡破裂产生空化效应,但仅限于对脑微血管壁产生影响,打开紧密连接,促进局部BBB开放。超声微泡的作用与单纯低频聚焦超声比较,前者比后者的超声功率降低几个数量级后,仍能开放BBB,操作容易,大大降低了安全性风险,未发生脉管损伤所致的迟发性脑缺血和细胞凋亡[11]。低频聚焦超声联合微泡在低声压水平开放BBB时,仅仅使靶区温度升高0.025 ℃,对周
围组织没有任何影响[12]。低频低声压下超声辐射力并不破碎微泡,而使大量微泡由管腔中央向管壁发生数微米至数百微米的移位,并在管壁表面聚集成微泡团,使靶向黏附率增加20~80倍,有利于BBB靶向性开放,提高基因或药物定点释放的准确性和高效性[13, 14]。本文也证明了超声微泡对BBB开放影响的可逆性。因此该技术在一定参数下是安全的。
低频聚焦超声联合微泡开放BBB的技术参数 包括超声功率、频率、辐照时长和微泡浓度剂量。微泡组分、直径和浓度不同,则相应的超声频率和功率不同,空化效应也有差异。微泡的生物学效应受超声频率影响较大,超声频率越低,开放BBB需要的超声功率值越低[15, 16, 17]。固定超声频率、功率、辐照时长,微泡数量增加时,无创可逆开放BBB的超声功率阈值也降低[18]。微泡越多、超声功率越大,以聚焦超声焦点为中心的BBB开放范围和程度就越大,但同时靶区脑组织出血渗出及损伤也加重[19]。因此想做到高水平、无创可逆、靶向开放BBB,必须在大 量实验基础上针对具体微泡和超声条件探讨超声频率、功率、辐照时长和微泡剂量之间最适宜的参数组合。本文针对脑胶质瘤,获得理想参数: 超声频率为1 MHz,声强为4 W·cm-2,微泡粒径约3.26 μm,浓度约5.8×108~6.7×108/mL,超声辐照30s。在该参数下可以安全有效地局部靶向开放BBB,为实现脑胶质瘤靶向药物递送打下基础。
| [1] | Hong Y, Zhou Y, Wang J, et al. Lead compound optimization strategy (4)-improving blood-brain barrier permeability through structural modification [J]. Acta Pharm Sin (药学学报), 2014, 49: 789-799. |
| [2] | Aryal M, Arvanitis CD, Alexander PM, et al. Ultrasound-mediated blood-brain barrier disruption for targeted drug delivery in the central nervous system [J]. Adv Drug Deliv Rev, 2014, 72: 94-109. |
| [3] | Liu HL, Fan CH, Ting CY, et al. Combining microbubbles and ultrasound for drug delivery to brain tumors: current progress and overview [J]. Theranostics, 2014, 4: 432-444. |
| [4] | Konofagou EE. Optimization of the ultrasound-induced blood-brain barrier opening [J]. Theranostics, 2012, 2: 1223-1237. |
| [5] | Fan CH, Ting CY, Lin HJ, et al. Spio-conjugated, doxorubicin-loaded micro-bubbles for concurrent MRI and focused-ultrasoundenhanced brain-tumor drug delivery [J]. Biomaterials, 2013, 34: 3706-3715. |
| [6] | Treat LH, McDannold N, Zhang Y, et al. Improved anti-tumor effect of liposomal doxorubicin after targeted blood-brain barrier disruption by MRI-guided focused ultrasound in rat glioma [J]. Ultrasound Med Biol, 2012, 38: 1716-1725. |
| [7] | Sheikov N, McDannold N, Sharma S, et al. Effect of focused ultrasound applied with an ultrasound contrast agent on the tight junctional integrity of the brain microvascular endothelium [J]. Ultrasound Med Biol, 2008, 34: 1093-1104. |
| [8] | Zhao YZ, Liang HD, Mei XG, et al. Preparation, characterization and in vivo observation of phospholipid-based gas-filled microbubbles containing hirudin [J]. Ultrasound Med Biol, 2005, 31: 1237-1243. |
| [9] | Do J, Foster D, Renier C, et al. Ex vivo Evans blue assessment of the blood brain barrier in three breast cancer brain metastasis models [J]. Breast Cancer Res Treat, 2014, 144: 93-101. |
| [10] | Marquet F, Teichert T, Wu SY, et al. Real-time, transcranial monitoring of safe blood-brain barrier opening in non-human primates [J]. PLoS One, 2014, 9: e84310. |
| [11] | McDannold N, Zhang Y, Vykhodtseva N. Blood-brain barrier disruption and vascular damage induced by ultrasound bursts combined with microbubbles can be influenced by choice of anesthesia protocol [J]. Ultrasound Med Biol, 2011, 37: 1259-1270. |
| [12] | Unger EC, Porter T, Culp W, et al. Therapeutic applications of lipid-coated microbubbles [J]. Adv Drug Deliv Rev, 2004, 56: 1291-1314. |
| [13] | Aryal M, Vykhodtseva N, Zhang YZ, et al. Multiple treatments with liposomal doxorubicin and ultrasound-induced disruption of blood-tumor and blood-brain barriers improve outcomes in a rat glioma model [J]. J Control Release, 2013, 169: 103-111. |
| [14] | Park EJ, Zhang YZ, Vykhodtseva N, et al. Ultrasound-mediated blood-brain/blood-tumor barrier disruption improves outcomes with trastuzumab in a breast cancer brain metastasis model [J]. J Control Release, 2012, 163: 277-284. |
| [15] | Hynynen K, McDannold N, Vykhodtseva N, et al. Non-invasive opening of BBB by focused ultrasound [J]. Acta Neurochir Suppl, 2003, 86: 555-558. |
| [16] | Mesiwala AH, Farrell L, Wenzel HJ. High-intensity focused ultrasound selectively disrupts the blood-brain barrier in vivo [J]. Ultrasound Med Biol, 2002, 28: 389-400. |
| [17] | O'Reilly MA, Waspe AC, Ganguly M, et al. Focused-ultrasound disruption of the blood-brain barrier using closely-timed short pulses: influence of sonication parameters and injection rate [J]. Ultrasound Med Biol, 2011, 37: 587-594. |
| [18] | O'Reilly MA, Hynynen K. Ultrasound enhanced drug delivery to the brain and central nervous system [J]. Int J Hyperthermia, 2012, 28: 386-396. |
| [19] | O'Reilly MA, Waspe AC, Chopra R, et al. MRI-guided disruption of the blood-brain barrier using transcranial focused ultrasound in a rat model [J]. J Vis Exp, 2012, (61): pii: 3555. |
 2015, Vol. 50
2015, Vol. 50


