2. 南京中医药大学 基础医学院, 江苏 南京 210046;
3. 南京中医药大学 名医验方研究中心、国家中医药管理局名医验方评价与转化重点研究室, 江苏 南京 210046
2. College of Preclinical Medicine, Key Laboratory of Famous Doctors' Proved Recipe Evaluation and Transformation of State Administration of Traditional Chinese Medicine, Nanjing University of Chinese Medicine, Nanjing 210046, China;
3. Doctors Prescription Research Center, Key Laboratory of Famous Doctors' Proved Recipe Evaluation and Transformation of State Administration of Traditional Chinese Medicine, Nanjing University of Chinese Medicine, Nanjing 210046, China
出血性中风 (脑出血) 是国内外临床上常见的疾病,该病发病急骤、进展迅速、病死率高。当前西医学治疗脑出血的方法为手术治疗和内科综合治疗两大类,有一定危险性且疗效不够显著。而中医认为出血性中风源于血分瘀热、搏击不解、闭阻脑窍,而令邪热愈炽,进而化火生风生痰,造成瘀热阻窍,故治疗时以凉血散瘀、通腑泄热为主[1]。
凉血通瘀方是周仲瑛教授治疗出血性中风的临床经验方,主要由大黄、丹皮、赤芍、石菖蒲等八味药组成。方中大黄清热泻火、凉血逐瘀、通腑泄热; 生地滋阴清热、凉血止血,丹皮泻血中伏热、凉血散瘀; 赤芍凉血活血、和营泄热; 三七通脉化瘀; 石菖蒲开窍醒神、引药上行。这些药相互配合具有凉血化瘀、通腑泄热的作用[2]。临床评价表明该方能明显改善急性出血性中风患者凝血、血流变和炎症等作用[3],治疗出血性中风疗效显著,且毒副作用较小,值得推广。
前期采用脑出血大鼠模型评价显示,凉血通瘀方可促进血肿吸收、改善血脑屏障通透性[4],但该方凉血活血药效物质基础尚不清楚。因此本文基于出 血性中风的发病机制建立血热血瘀大鼠模型[5],系统筛选该方凉血活血有效部位,并应用GC-MS、HPLC- MS-ESI技术鉴别有效部位化学成分,为深入研究凉血通瘀方药效物质基础及作用机制奠定基础。
材料与方法 药品与试剂丹皮 (Paeonia suffruticosa Andr,批号130201)、三七 (Panax notoginseng (Burk.) F. H. Chen,批号130301)、水牛角 (Bubalus bubalis Linnaeus,批号121113)、地龙 (Pheretima aspergillum (E. Perrier),批号130301)、石菖蒲 (Acorus tatarinowii Schott,批号130312)、大黄 (Rheum palmatum L,批号121226)、地黄 (Rehmannia glutinosa Libosch,批号130301)、赤芍 (Paeonia lactiflora Pall,批号130120) 购自安徽丰原铜陵中药饮片有限公司,经南京中医药大学中药鉴定教研室吴德康教授鉴定; 阿司匹林 (拜耳医药保健有限公司生产,批号J20130078); 干酵母 (安琪酵母股份有限公司,批号GB/T20886-2014); 芍药内酯苷 (MUST-14031214)、芍药苷 (MUST-13113009)、苯甲酰芍药苷 (MUST-13030401) 购自成都曼斯特生物科技有限公司,大黄酸、大黄素、大黄素甲醚、芦荟大黄素、大黄酚对照品为实验室自制并鉴定结 构,纯度大于98%; 醋酸和甲醇 (色谱纯,美国Tedia公司)。
仪器血液流变仪 (北京中勤世帝科学仪器有限公司); Agilent 19091S-433气相色谱仪 (PaloAlto,CA,USA),Agilent 色谱工作 (Agilent Technologies,Palo Alto,CA); LC-20A型快速液相色谱仪: 配有在线脱气机、二元、高性能自动进样器和二极管阵列 检测器 (日本岛津公司); 高分辨质谱检测系统: AB SCIEX Triple TOFTM 5600,配有电喷雾离子源 (ESI)、Analyst1.6色谱工作站和Peak View等质谱分析软件 (美国AB Science)。
动物雄性Sprague Dawly大鼠,体重 (200 ± 20) g,购自浙江省实验动物中心,许可证号: SCXK (浙) 20140001。
供试品制备阿司匹林混悬液: 称取阿司匹林适量于研钵中加蒸馏水研磨,定容,制得混悬液 (1 g·mL-1)。干酵母混悬液: 称取适量干酵母于研钵中加入蒸馏水研磨至均匀的混浆,定容,制成混悬液,新鲜配制 (0.2 g·mL-1)。凉血通瘀方提取物 (LP): 按处方剂量比称取药材,加适量水提取两次,合并滤液,浓缩即得 (3.66 g·mL-1)。挥发油部位提取液 (VLP): 按处方剂量比称取药材,参照《中华人民共和国药典》(2005版) 挥发油提取法提取,得到的挥发油与吐温80混匀 (3.66 g·mL-1)。凉血通瘀方二氯甲烷部位 (CLP)、正丁醇部位 (BLP)、水层部位 (WLP): 按上述方法所得凉血通瘀提取物,分别用二氯甲烷和正丁醇等倍量萃取多次,将萃取液及萃取后的水层浓缩,制成凉血通瘀方二氯甲烷部位、正丁醇部位、水层部位 (3.66 g·mL-1)。
GC-MS供试品溶液: 按上述方法得到的挥发油,用无水Na2SO4干燥,乙醚溶解,得供试品溶液 (3.66 g·mL-1)。HPLC-MS供试品溶液: 按上述方法制得同等剂量的正丁醇部位浓缩液,蒸干用甲醇超声溶解,微孔滤膜过滤,得供试品溶液 (3.66 g·mL-1)。HPLC供试品溶液同HPLC-MS供试品溶液。
混合对照品溶液的制备精密称取芍药苷、芍 药内酯苷、苯甲酰芍药苷、大黄酸、大黄素、大黄素甲醚、芦荟大黄素、大黄酚适量,甲醇定容,配成浓度分别为0.984、0.994、0.996、1.033、1.000、1.120、0.836和0.963 mg·mL-1的混标溶液。
GC-MS条件色谱柱HP-5 MS Phenyl Methyl Siloxane石英毛细管色谱柱 (0.25 mm × 30 m,0.25 μm); 进样量1 μL,载气为氦气,流速1 μL·mL-1,分流比20∶1,进样口温度250 ℃,检测器温度250 ℃; 程序升温: 初始温度70 ℃,保持2 min,以2 ℃·min-1速率升温至150 ℃,保持10 min,以2 ℃·min-1的速率升温至180 ℃,保持20 min,以2 ℃·min-1的速率升温至230 ℃,保持5 min。质谱分辨率500,电离方式EI,电子能量70 eV,离子源温度200 ℃,加速电压 4 kV,扫描速度1 s·dec-1,扫描范围m/z 20~500。
HPLC-MS条件色谱柱 (Thermo ODS-2 HYPERSIL 250 mm × 4.6 mm); 进样量10 μL; 柱温: 35 ℃; 流速为1.0 mL·min-1; 流动相: 甲醇 (A)-0.5%甲酸(B),洗脱程序为: 0~10 min,22%~30% A; 10~25 min,30%~40% A; 25~30 min,40%~50% A; 30~50 min,50%~62% A; 50~55 min,62%~100% A; 55~70 min,100% A; 70~71 min,100%~22% A; 71~80 min,22% A; 检测波长: 254 nm。离子源: 电喷雾; 质谱扫描方式: 负离子; 雾化气压力: 55 psi (1 psi ≈ 6.9 kPa); 辅助加热气压力: 55 psi; 气幕压力: 40 psi; 离子化温度: 550 ℃; 碰撞能量: 10 V; 毛细管电压: 5.5 kV; 去簇电压: -60 V; 扫描范围: m/z 50~1 000。
造模及给药雄性SD大鼠随机分为8组,每组8只,分别为空白对照组 (生理盐水组)、模型组 (干酵母组)、阳性对照组 (阿司匹林组) 及LP组、VLP组、CLP组、BLP组和WLP 组。将各组按10 mL·kg-1每天灌胃给药1次,连续7天。于第6天给药1 h后造模[5] (空白对照组于皮下注射等量生理盐水,其余各组于皮下注射干酵母混悬液,注射剂量为10 mL·kg-1),记录大鼠10 h内肛温的变化,禁食10 h,第7天灌胃给药1 h后,颈动脉取血5 mL于加有0.038 g·mL-1枸橼酸钠的离心管中,以3 000 r·min-1转速离心10 min,取上层血浆测定血浆黏度,另取全血适量测定全血高、中、低切黏度。
数据处理统计采用SPSS13.0统计软件对数据进行双样本t检验及方差分析,实验数据以x± s表示。
结果 1 有效部位筛选结果分析 1.1 对体温的影响结果表明 (图 1): 模型组大鼠于第4 h体温明显升高,且持续高温6 h,模型组与空白组比较差异具有显著性 (P < 0.01),说明模型复制成功。与模型组比较,阳性对照组在6~9 h能降低发热大鼠的体温 (P < 0.01或P < 0.05); LP和BLP给药组分别在6~7 h、6~ 8 h明显降低发热大鼠体温 (P < 0.01); VLP给药组能在第5 h时降低发热大鼠的体温 (P < 0.01); WLP和CLP无明显差异。
 |
Figure 1 The rats’ rectal temperature of different groups. LP,VLP,BLP,CLP,and WLP are the extracts from Liangxue Tongyu prescription,its volatile oil,n-butanol part,dichloromethane phase and water phase,respectively |
结果表明 (图 2): 模型组的全血高、中、低切黏度较空白组显著升高 (P < 0.01)。与模型组比较,阳性对照组全血高、中切黏度有显著差异 (P < 0.01),低切黏度有差异 (P < 0.05); LP和VLP给药组均能明显降低全血高、中、低切黏度 (P < 0.01); BLP组对全血高切黏度 (P < 0.01)、中切黏度 (P < 0.05) 有不同程度的降低作用; CLP和WLP给药组效果不明显。
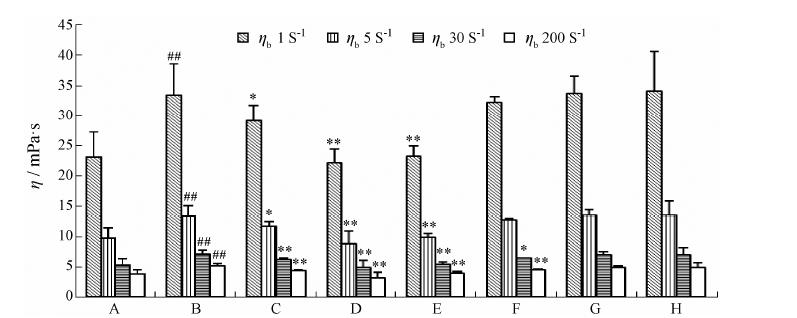 |
Figure 2 The blood viscosity of rats in different groups. A: Blank group; B: Model group; C: Aspirin group; D: LP; E: VLP; F: BLP; G: CLP; H: WLP. P < 0.05,**P < 0.01 vs model group; ##P < 0.01 vs blank group |
结果表明 (图 3): 与空白组比较,模型组血浆粘度具有显著差异 (P < 0.01)。与 模型组比较,阳性对照组、LP、VLP和BLP给药组能降低血浆黏度 (P < 0.05)。CLP和WLP给药组效 果不明显。
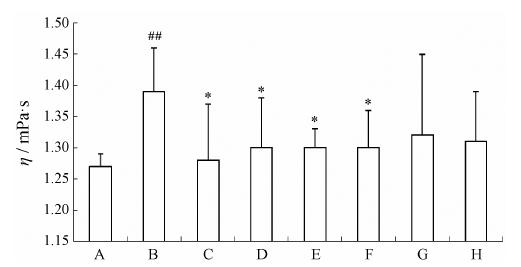 |
Figure 3 The plasma viscosity of rats in different groups. A: Blank group; B: Model group; C: Aspirin group; D: LP; E: VLP; F: BLP; G: CLP; H: WLP. P < 0.05 vs model group; ##P < 0.01 vs blank group |
由此,初步确定正丁醇部位与挥发油部位是凉血通瘀方凉血活血的有效部位。
2 挥发油部位化学成分GC-MS分析采用GC-MS分析凉血通瘀方挥发油部位化学成分,总离子流图见图 4,经数据处理系统对其内存谱库自动检索,人工谱图解析,结合文献[6, 7, 8, 9]资料,鉴定出70个化合物。采用面积归一法测得挥发油中各成分的相对含量,占总量的92.54%,其中β-细辛醚 (36.88%)、丹皮酚 (15.76%)、α-细辛醚 (5.41%)、菖蒲酮 (4.04%)等含量较高。
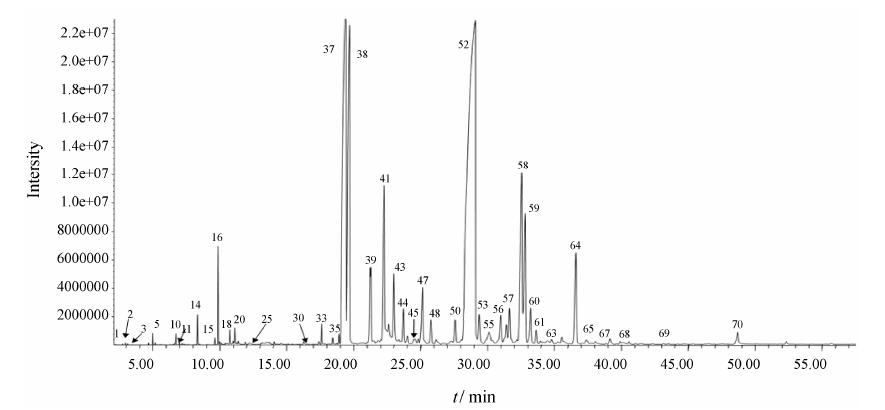 |
Figure 4 The total ion chromatograms (TIC) of volatile oil from Liangxue Tongyu prescription |
β-细辛醚、α-细辛醚、菖蒲酮、莰烯等挥发油成分来源于石菖蒲[6]; 丹皮酚、正十五烷酸、桃金娘烷醇等成分来源于丹皮[7]; 糠醛、己醛、间异丙基甲苯等来源于赤芍[8]; 苯甲醛、α-蒎烯等来源于大黄挥发油[9]。
3 正丁醇部位化学成分HPLC-MS分析采用HPLC-MS-ESI分析凉血通瘀方正丁醇部位化学成分,经正、负离子扫描发现,负离子扫描模式能得到较好的信号。色谱图和总离子流图见图 5,对图谱进行解析,并参照文献[10, 11, 12, 13, 14, 15, 16, 17, 18]和与对照品比对,推断出42个化合物,结果见表 1。鉴定出的化合物结构大体可分为8类:
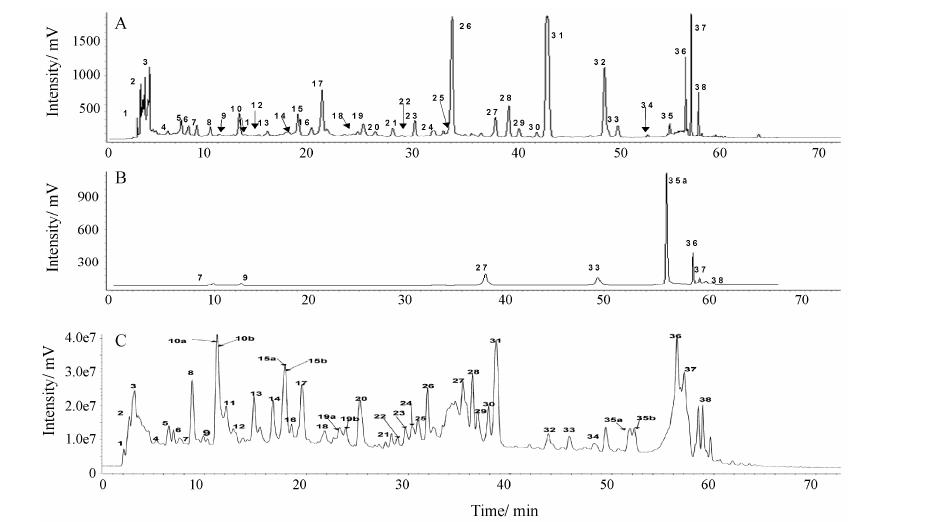 |
Figure 5 HPLC chromatogram of n-butanol extract from Liangxue Tongyu prescription (A) and standards solution (B) and TIC of n-butanol extract from Liangxue Tongyu prescription (C) |
|
|
Table 1 Results of the constituents of MS-ESI |
芍药苷类化合物的特征碎片离子m/z 165为此化合物的蒎烷基本骨架,还有m/z 121、m/z 137、m/z 167和m/z 151分别来源于苯甲酸、对羟基苯甲酸、香草酸和对甲氧基苯甲酸。7和9号峰的准分子离子峰均为 [M+CH3COO]- m/z 539,峰27准分子离子峰为 [M+CH3COO]- m/z 643,根据文献[10]和与对照品比对确定7号峰为芍药内酯苷,9号峰为芍药苷,27号峰为苯甲酰芍药苷。这类化合物多存在于该方的丹皮和赤芍中[10, 11, 12]。
3.2 鞣质类成分的质谱特征没食子酰葡萄糖类化合物的特征碎片离子m/z 169、151,为没食子酸和没食子酰基的碎片离子。在负离子检测方式下,19b,15b,11,10b号峰的准分子离子峰分别是 [M-H]- m/z 1 091、m/z 939、m/z 787、m/z 635,为依次失去一分子没食子酰基而产生。19b号二级碎片峰m/z 939、769、617、447、169、125为失去一系列没食子酸和没食子酰基而产生,m/z 125的碎片离子为没食子酸裂解丢失一分子CO2后产生。依据文献[11] 19b号峰为六没食子酰葡萄糖,15b为1,2,3,4,6-五没食子酰葡萄糖苷,11和10b号峰分别为四没食子酰葡萄糖苷和三没食子酰葡萄糖苷。该类化合物多存在于该方的丹皮及赤芍、大黄中[10, 11, 12, 13]。
23号峰的准分子离子峰为 [M-H]- m/z 461,碎片峰为313、169、147,其中m/z 461→313为脱去一分子桂皮酸,m/z 313→169为脱桂皮酰反应,m/z 169为没食子酸单元结构离子,m/z 147碎片离子为桂皮酸单元结构离子,与文献[14]报道一致,依此可推断色谱峰23为桂皮酰没食子酰葡萄糖类,该类成分存在于该方的大黄中[14]。
3.3 丹皮酚苷类化合物的质谱特征12和13号峰的准分子离子峰为 [M-H]- m/z 611,两者主要裂解碎片相同,m/z 445为脱去一分子的丹皮酚产生,m/z 283为再失去一分子五碳糖和甲醛后得到的碎片峰,与文献[11]中suffruticoside A、B、C和D报道一致,其中13号峰m/z 313特征碎片离子,为失去苷元及一分子五碳糖后得到的没食子酰葡萄糖碎片离子,故推测13号峰为suffruticoside B或D,12号峰为suffruticoside A或C,与丹皮中成分一致[11]。
3.4 蒽醌类化合物的质谱特征峰33、35a、36、37和38经标准品比对,并结合MS/MS裂解规律,参考文献[13],分别被确定为芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚。
峰26和30号准分子离子峰 [M-H]- m/z 431,与峰33和36的裂解规律比对,峰26中碎片离子m/z 269,是由m/z 431脱掉一分子葡萄糖生成,m/z 240是芦荟大黄素的特征离子峰,故推测峰26芦荟大黄素葡萄糖苷,峰30为大黄素葡萄糖苷[13]。
峰28碎片离子为m/z 277、253、225,其中m/z 253离子为准分子离子m/z 415脱掉一分子葡萄糖后生成,为大黄酚的分子离子峰,其碎片峰与峰37一致,故推断峰28为大黄酚葡萄糖苷。该类成分主要存在于大黄中[13]。
3.5 芪类化合物的质谱特征19a号峰碎片峰m/z 313为准分子离子m/z 541失去一分子白藜芦醇后生成,m/z 169、125为没食子酸特征碎片峰,与文献[14]报道一致,故推测为白藜芦醇没食子酰糖苷。该类化合物存在于大黄中[14]。
3.6 苯丁酮类化合物的质谱特征32号峰的准分子离子 [M-H]- m/z 607,其碎片峰m/z 443为m/z 607失去一分子4-对羟基苯基-2-丁酮后产生,m/z 295为在此基础上脱去一分子桂皮酸,m/z 169、125为没食子酸结构单元的特征碎片峰,故推测为大黄中的4-对羟基苯基-2-丁酮肉桂酰没食子酰基糖苷[14]。
3.7 皂苷类化合物的质谱特征在负离子模式下峰29、31、34、35b的准分子离子峰均以[M+CH3COO]- 的形式存在,峰29碎片峰m/z 799、637、475为相继 失去一分子木糖和两分子葡萄糖而产生,由此鉴定为三七皂苷R1。峰31、34、35b与之相似,碎片离子均是通过失去一系列木糖,葡萄糖而产生的。与文 献[15, 16]报道一致,分别被鉴定为人参皂苷Rg1、人参皂苷Rf、人参皂苷Rh1。该类成分存在于三七中[16]。
3.8 环烯醚萜苷类化合物的质谱特征在负离子模式下,环烯醚萜苷类化合物多以 [M+CH3COO]-为基峰,如峰3的准分子离子峰m/z 421 [M+CH3COO]-,碎片离子m/z 343为m/z 361失去一分子水产生,m/z 199为其脱去一分子葡萄糖产生。峰4其MS/MS中m/z 329、185为m/z 347分别失去一分子水和葡萄糖产生的碎片峰,结合文献[17, 18],推测峰3和4分别为梓醇和益母草苷。该类化合物存在于地黄中[18]。
讨论中医认为,出血性中风是由于“热”和“瘀”这两个病理因素相互搏结所形成的具有新特质的疾病,病位主要在血分。血热证显著的特征为体温升高,血瘀证特征性的变化是血液流变性的改变[19],因此建立干酵母所致的血热血瘀大鼠模型,实验结果显示模型组大鼠体温、全血及血浆黏度升高,符合临床病理特征,故以此评价凉血通瘀方的凉血和活血作用。
本实验用血热血瘀大鼠模型评价凉血通瘀方及系统溶剂部位的凉血活血作用。结果表明,凉血通瘀方提取物能明显降低模型大鼠的体温升高和全血、血浆黏度,说明该方具有凉血活血作用; 正丁醇部位和挥发油部位均能明显降低模型大鼠体温升高,不同程度降低模型大鼠的全血黏度和血浆黏度,与凉血通瘀方提取物药效相当,由此推断正丁醇部位与挥发油部位是凉血通瘀方凉血活血的有效部位。
凉血通瘀方挥发油部位具有凉血活血作用,主要成分为β-细辛醚、丹皮酚、α-细辛醚、菖蒲酮。方中石菖蒲具有开窍醒神,引药上行作用,其挥发油成分α-细辛醚具有抗缺氧、脑保护和益智作用; β-细辛醚能明显降低动脉粥样硬化大鼠血脂,改善高黏血症大鼠的血液流变性[20]。丹皮具有泻血中伏热、凉血散瘀的作用,其挥发油成分丹皮酚具有抗脑缺血再灌注性损伤、抗动脉粥样硬化、抗高血压、抗血栓、促进微循环等治疗心脑血管疾病作用[21]。
凉血通瘀方正丁醇部位主要成分有8类,分别来自不同组方药。其中,大黄具有清热泻火、凉血逐瘀、通腑泄热的功效,其主要成分蒽醌类和没食子酸类成分具有抗炎、抗菌、止血和泻下作用从而达到清热泻火、凉血解毒的功效[22],并对脑出血性中风神经功能的损伤具有明显改善作用[23]; 白藜芦醇可以改善心脑血管循环、调节免疫系统、抗氧化[24]。丹皮泻血中伏热、凉血散瘀,赤芍凉血活血、和营泄热,二药均含有芍药苷,具有扩张血管、解热解痉等作用,同时对脑缺血后脑水肿、血脑屏障具有显著的保护作用[25]。三七通脉化瘀,其三七皂苷R1可降低全血黏度,对脑出血和脑缺血细胞有保护作用[26]。
通过筛选凉血通瘀方凉血活血部位以及化学成分分析,初步明确了凉血通瘀方的药效物质基础,为进一步研究物质基础及作用机制奠定基础。
| [1] | Wu MH, Guo WF, Zhou XQ, et al. Study on ideas and methods of ‘stagnated heat' theory of ZHOU Zhong-ying [J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2009, 24: 1319-1321. |
| [2] | Yuan Y, Guo WF. Stagnated heat blocking orifice syndrome in cerebral hemorrhage in acute stage [J]. Chin J Integr Med Cardio-/Cerebro Dis (中西医结合心脑血管病杂志), 2007, 8: 723-725. |
| [3] | Huang Y, Zhao FM, Liang XW, et al. Effect of Liangxuetongyu Fang on NO and NOS production in vascular endothelial cells [J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2010, 26: 55-57. |
| [4] | He CY, Huang JH, Zhou XP, et al. Effect of Liangxue Tongyu Formula on t-PA and MMP-9 expressions in rats with intracerebral hemorrhage [J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2011, 21: 50-53. |
| [5] | Liu J, Zhang L, Ding AW, et al. Establishment of blood-heat and hemorrhage syndrome rat model based on traditional Chinese medicine characteristics [J]. Chin Pharmacol Bull (中国药理学通报), 2012, 28: 1319-1324. |
| [6] | Liu CH, Liu XJ, Yang HS. GC-MS analysis of essential oils from Acorus Tatarinowii Schott [J]. Chin Arch Tradit Chin Med (中医药学刊), 2006, 24: 1280-1281. |
| [7] | Qu JN, Jiang XT, Xiao HH, et al. Analysis of Cortex Moutan extract with GC/MS [J]. Tobacco Chem (烟草化学), 2012, 6: 45-47. |
| [8] | Li XR, Liang YZ, Yang H, et al. Chemical component study of herb pairs in traditional Chinese medicine-analysis of volatile oil in Rhizoma Ligustici Chuanxiong-Radix Paeoniae Rubra by GC-MS and chemometric resolution method [J]. Chem J Chin Univ (高等学校化学学报), 2006, 27: 443- 448. |
| [9] | Yang BB, Rong R, Lyu QT, et al. Analysis of the volatile components in rhubarb with different extraction methods by GC-MS [J]. Chem Anal Meter (化学分析计量), 2013, 22: 14-16. |
| [10] | Xu SJ, Yang L, Zhang M, et al. Rapid identification of compounds in Cortex Moutan by liquid chromatography-tandem mass spectrometry [J]. Acta Pharm Sin (药学学报), 2006, 41: 852-856. |
| [11] | Xu S, Yang L, Zeng X, et al. Characterization of compounds in the Chinese herbal drug Mu-Dan-Pi by liquid chromatography coupled to electrospray ionization mass spectrometry [J]. Rapid Commun Mass Spectrom, 2006, 20: 3275-3288. |
| [12] | Wang YT, Wang LM, Jin XQ. HPLC fingerprint and HPLC-MS analysis for Red Peony Root [J]. Chin Tradit Pat Med (中成药), 2010, 32: 1089-1092. |
| [13] | Ye M, Han J, Chen HB, et al. Analysis of phenolic compounds in Rhubarbs using liquid chromatography coupled with electrospray ionization mass spectrometry [J]. J Am Soc Mass Spectrom, 2007, 18: 82-91. |
| [14] | Jiang HQ, Rong R, Lu QT. Identification of chemical composition in rhubarb by high performance liquid chromatography with mass spectrometry [J]. Lishizhen Med Mater Med Res (时珍国医国药), 2011, 22: 1705-1706. |
| [15] | Liu JH, Wang X, Cai SQ, et al. Analysis of the constituents in the Chinese drug notoginseng by liquid chromatography-electrospray mass spectrometry [J]. J Chin Pharm Sci, 2004, 13: 225-237. |
| [16] | Xiao SY, Luo GA, Wang YM, et al. Identification of Panax notoginseng and its preparations by LC-MS [J]. Acta Pharm Sin (药学学报), 2013, 48: 1464-1470. |
| [17] | Zhao XF, Li P, Sun YQ. HPLC-ESI-MS analysis of the Radix Rehmanniae Preparata [J]. Chin J Pharm Anal (药物分析杂志), 2007, 27: 874-876. |
| [18] | Zhong J, Tan ZD, Wang TM, et al. Absorption and pharmacokinetics of Radix Rehmanniae in rats [J]. Acta Pharm Sin (药学学报), 2013, 48: 1464-1470. |
| [19] | Liu XJ, Su SB, Wang XF, et al. Effects of Bixue capsule on hemorheological changes in rats with acute blood stasis [J]. Chin J Exp Tradit Med Formul (中国实验方剂学杂志), 2011, 17: 174-176. |
| [20] | Han YL, Liu P, He XR, et al. Research progress in essential component and pharmacologic actions of volatile oil in Acorus tatarinowii Schott [J]. Chin J Drug Appl Monit (中国药物应用与监测), 2011, 8: 120-123. |
| [21] | Zhang WG, Zhang ZS. Anti-ischemia reperfusion damage and anti-lipid peroxidation effects of paeonol in rat heart [J]. Acta Pharm Sin (药学学报), 1994, 29: 145-148. |
| [22] | Wang LY, Zhang LZ, Lu GY, et al. Progress in pharmacological effects of rhubarb [J]. Lishizhen Med Mater Med Res (时珍国医国药), 2000, 11: 381-382. |
| [23] | Zhang CB, Teng L, Shi Y, et al. Effect of emodin on proliferation and differentiation of 3T32L1 preadipocyte and FAS activity [J]. Chin Med J, 2002, 115: 1035-1038. |
| [24] | Li YH, Wang WJ, Zhang LW, et al. Current situation and prospect of resveratrol research [J]. China Brewing (中国酿造), 2008, 7: 10-12. |
| [25] | Sun R, Yi YP, Lu LL, et al. Effects of paeoniflorin on pathological changes in global brain ischemia model rats [J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 2518- 2522. |
| [26] | Lin C, Zhang YL, Chen ZG, et al. The effect of Panax notoginseng saponins on intracerebral hemodynamics in acute basal ganglia hemorrhage [J]. Chin J Integr Med Cardio-/ Cerebro Dis (中西医结合心脑血管病杂志), 2007, 5: 1048- 1050. |
 2015, Vol. 50
2015, Vol. 50


