三七为五加科植物三七(Panax notoginseng (Burk.) F. H. Chen) 的干燥根和根茎,主产于云南东南部,广西、四川等地也有分布,有散瘀止血、消肿定痛等功效[1]。随着其在治疗脑动脉血管硬化、缺血性脑损伤、脑梗死、脑出血等疾病功效的开发,三七现已成为预防和治疗心血管疾病的基础药物。三七生长环境主要有气候温暖、潮湿等特点,且其有效部位直接与土壤接触,极易沾染真菌、诱发霉变[2, 3, 4]。目前已知的真菌毒素有200多种,按其主要产毒菌种 可分为曲霉菌毒素 (如黄曲霉毒素、赭曲霉毒素等)、青霉菌毒素和镰刀菌毒素 (如T-2毒素、HT-2毒素、二乙酰藨镰刀菌烯醇、脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮等) 等几大类[5]。《中国药典》2010年版一部收录了中药材黄曲霉毒素B1、B2、G1和G2的高效 液相色谱荧光检测方法,对桃仁、胖大海、陈皮等中药规定了黄曲霉毒素B1最高限量为5 μg·kg-1,黄曲霉毒素 (B1+B2+G1+G2) 最高限量为10 μg·kg-1 [1]。 但是,仅对部分中药且仅限黄曲霉毒素的检测是远远不够的。三七作为名贵中药材,是仅次于人参的中药材大品种。现阶段我国以三七为原料的中成药品 种400多个,涉及的生产厂家1 300家,年需要三七800万公斤,含三七中成药制剂销售额达320亿元[6]。近几年文献中不乏针对三七中真菌毒素的报道,陈娟等[7]在三七药材中检出赭曲霉毒素A含量为1.7 μg·kg-1,谭婧等[8]在三七饮片中检出黄曲霉毒素G2含量为3.95 μg·kg-1。为保证三七药材及其相关产品的安全性,完善质量标准,本文建立了一种三七药材中真菌毒素多残留污染的LC-MS/MS检测方法,对黄曲霉毒素、赭曲霉毒素、脱氧雪腐镰刀菌烯醇、霉酚酸等10种毒素进行了定量检测。
材料与方法 仪器超高效液相色谱-串联质谱仪 (LCMS- 8030,日本岛津公司),配有电喷雾离子源 (ESI); 氮气吹干仪 (N-EVAPTM112型,美国Organomation Associates,Inc公司); 分析天平 (BS2202/TE-612-L/ CP225D型,德国Sartorius公司); Oasis HLB柱 (3 mL,60 mg,美国Waters公司)。
药品与试剂甲醇、乙腈为色谱纯,实验用水为超纯水; 醋酸铵、甲酸为分析纯; 黄曲霉毒素混合对照品溶液 (美国SUPELCO公司,批号LB80734,黄曲霉毒素G2、G1、B2和B1的质量浓度分别为0.3、1.0、0.3和1.0 µg·mL-1)、赭曲霉毒素A (美国ROMER 公司,批号S11263Z,100 µg·mL-1)、T-2毒素(J&K公司,批号LHAOM26,100 µg·mL-1)、霉酚酸 (美国ROMER公司,批号L13331A,100 µg·mL-1)、玉米赤霉烯酮 (美国ROMER公司,批号S10404Z)、玉米赤霉烯醇 (美国ROMER公司,批号S10207Z)、脱氧雪腐镰刀菌烯醇 (Fluka公司,批号SZE8150XV)。三七药材购于亳州药材市场。
对照品溶液的制备将各种毒素溶解后以一定比例混合,于40 ℃下氮气吹干,用15% 乙腈复溶,配制成含有黄曲霉毒素B2、G2为15 ng·mL-1,黄曲霉毒素B1、G1、赭曲霉毒素A、T-2毒素、霉酚酸为50 ng·mL-1,玉米赤霉烯酮、玉米赤霉烯醇为250 ng·mL-1,脱氧雪腐镰刀菌烯醇为1 μg·mL-1的混合储备液。用15% 乙腈稀释,配成系列浓度的对照品溶液。
样品预处理方法 提取取三七药材粉末2.0 g,精密称定,置于50 mL离心管中,精密加入乙腈10 mL,涡旋混匀后,超声波提取30 min,提取后以12 000 r·min-1的速度离心处理,准确吸取上清液5 mL于40 ℃下N2吹干,用乙腈 500 μL复溶后加水稀释至25 mL,涡旋混匀。
净化提取稀释液缓慢通过活化后的HLB柱,流速约1 mL·min-1,以5 mL水淋洗,静置30 min后用含0.2% 甲酸的乙腈5 mL洗脱,收集洗脱液,于40 ℃下N2吹干,加入15% 乙腈溶液1 mL,超声30 s,涡旋1 min,通过0.22 μm微孔滤膜即得。
色谱及质谱条件 色谱条件Phenomenex Kinetex XB-C18色谱柱 (100 mm × 2.1 mm,1.7 μm); 流动相为5 mmol·L-1醋酸铵 (A) - 甲醇(B),梯度洗脱: 0~6 min,25% B; 6~8 min,25%~70% B; 8~8.5 min,70%~95% B; 8.5~9.5 min,95%~100% B; 9.5~12 min,100%~25% B; 流速0.3 mL·min-1; 柱温40 ℃; 进样量10 μL。
质谱条件离子源: 电喷雾离子源; 检测方式: 多反应监测; 毛细管电压: 4.5 kV; 检测电压: 1.64 kV; 雾化气流速: 3.0 L·min-1; 脱溶剂气流速: 15.0 L·min-1; 脱溶剂管温度: 250 ℃; 加热模块温度: 400 ℃; 碰撞气压力230 kPa。采集模式、监测离子对 (m/z) 和其他参数见表 1。
|
|
Table 1 Qualitative and quantitative ion pair,cone voltage,collision energy and ionization mode of 10 mycotoxins |
在上述色谱-质谱条件下,10种真菌毒素MRM定量离子图见图 1。从图可知,10种真菌毒素分离良好,而空白基质加标样品的分析表明基质成分不干扰被测真菌毒素的检测。
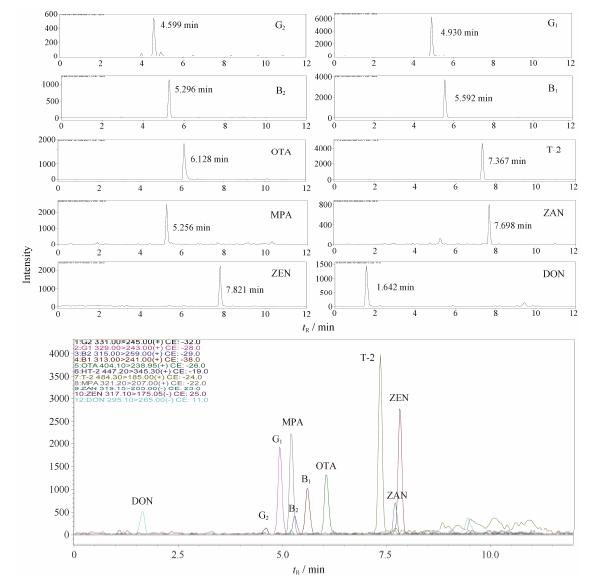 |
Figure 1 MRM chromatograms of 10 mycotoxins |
选取不含真菌毒素的三七作为空白样品,按样品预处理方法制备空白基质溶液,添加不同量的真菌毒素混合对照品制作基质标准曲线,以待测化合物色谱峰峰面积 (Y) 为纵坐标,进样浓度 (X,ng·mL-1) 进行线性回归。线性范围、回归方程及相关系数见表 2。以线性方程中最低添加浓度点的数据,根据3倍信噪比计算10种毒素的检测限、10倍信噪比计算10种毒素的定量限 (表 2)。
|
|
Table 2 Linear equations,linear ranges,correlation coefficients (r),LODs,LOQs,recoveries of 10 mycotoxins |
取三七空白样品2.0 g,共18份,按低、中、高三水平分别添加对照品储备液40、100和200 μL,每个加标水平平行6份,按上述方法制备供试品溶液并测定,计算各真菌毒素的回收率和相对标准偏差,结果见表 2。结果表明,回收率为73.8%~107%,相对标准偏差为0.1%~10.9%。
4实际样品的检测取市售的三七药材样品31份,按上述方法测定,检出真菌毒素3种,分别为T-2毒素、霉酚酸和玉米赤霉烯酮。检出的阳性样品28份,检出的阳性样品中均含有MPA (图 2),含量在0.54~20.4 μg·kg-1之间。1份样品检出T-2毒素,含量为0.258 μg·kg-1,1份样品检出玉米赤霉烯酮,含量为2.45 μg·kg-1。
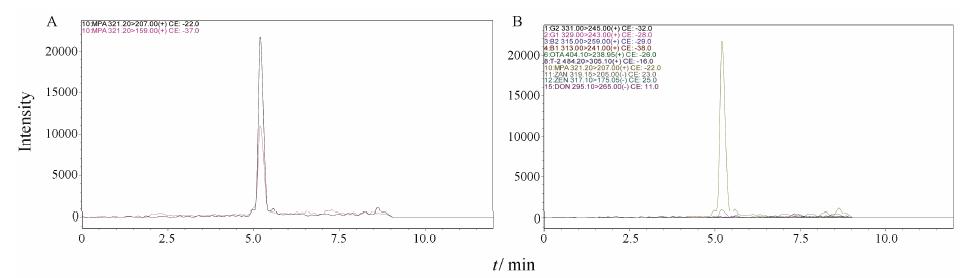 |
Figure 2 MRM chromatograms of Panax notoginseng infected by MPA. A: Quantitative and qualitative ions of MPA; B: Quantitative ions of 10 mycotoxins |
液质联用分析流动相选择需要同时兼顾物质分离和离子化效率。本研究比较了纯水、0.1% 氨水、0.1% 甲酸及5 mmol·L-1醋酸铵作为流动相A相,甲醇和乙腈作为流动相B相,同时启用正负离子两种模式多反应监测10种真菌毒素。实验结果表明,纯水作为流动A相时各种毒素的离子化效率不高,0.1% 氨水会降低正离子模式下检测的离子化效率,0.1% 甲酸会降低负离子模式下检测的离子化效率,而5 mmol·L-1醋酸铵为流动相A相时在正负离子两种模式下均有较好的离子化效率,故选择其为A相[9]。甲醇作为流动相B相时,其灵敏度明显大于乙腈,因此选择甲醇作为流动相B相。
对提取条件进行优化时发现,三七药材基质中大量的皂苷类成分极易溶于水,对于所检测的真菌毒素有着极强的基质减弱效应,因此需要兼顾真菌毒素提取效率及杂质溶解[10, 11]。在样品中添加混标 溶液50 μL,考察70% 甲醇、100% 甲醇、84% 乙腈及100% 乙腈的提取效率。结果表明,使用100% 乙腈提取在满足回收率要求的同时有着更高的检测灵敏度。
为了达到更好的净化效果,本研究对两种多功能净化柱及洗脱液进行了比较。结果表明,使用甲醇作为洗脱液时,Waters 226柱对于OTA、MPA回收率极差,而HLB柱对4种黄曲霉毒素和MPA的回收率较差,但其他毒素回收率均达到60% 以上。由于226柱对某些毒素完全没有保留,HLB柱对黄曲霉毒素保留较差可能与洗脱液性质有关,有提升空间,故本文选择HLB柱作为净化柱[12, 13]。以HLB为净化柱,优化洗脱液时发现,采用含0.2% 甲酸的甲醇洗脱,黄曲霉毒素回收率均达到90% 以上,OTA、MPA等毒素回收率虽有所下降但均大于60%,因而选择含0.2% 甲酸的甲醇溶液作为洗脱液。
为了提高柱效、改善色谱峰型,本研究比较了15% 乙腈、30% 乙腈、50% 乙腈、15% 甲醇、30% 甲醇、50% 甲醇六种供试品定容液,发现15% 乙腈、30% 乙腈和15% 甲醇定容时回收率均较好,但30% 乙腈定容时色谱峰型较差,其余两者均较好,最终选取15% 乙腈作为定容液。
在实际市售样品的检测中发现,多数三七样品中污染霉酚酸 (MPA),MPA主要作为免疫抑制剂被国内外广泛应用于预防、治疗移植器官急性排异反应,而正常人摄入会产生免疫机能弱化、呕吐、腹泻、白细胞减少、尿频等不良反应,体质虚弱的患者摄入更易产生由免疫力弱化而引发的多种并发症[14]。因此,尽快制定和规范三七药材乃至所有常用中药材的真菌毒素的限量标准和检测方法十分必要。
| [1] | Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. 2010 ed. Part I. Beijing: China Medical Science Press, 2010: 11. |
| [2] | Wang WL, Xu H, Chen HZ, et al. Separation and molecular identification of fungal contamination on surface of 15 Chinese herbal medicines [J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 1910-1914. |
| [3] | Jiang N, Qin L, Ye YF. Research advances in diseases of Panax notoginseng [J]. J South Agric (南方农业学报), 2011, 42: 1070-1074. |
| [4] | Song MF, Chen J, Li XL, et al. Primary investigation of contaminating fungi on Panax notoginseng and Amomum tsaoko in Yunnan [J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 1734-1737. |
| [5] | Gong XM, Ren YP, Dong J, et al. Determination of 18 mycotoxin contaminants in peanuts and oils by gel permeation |
| [6] | Cui XM, Huang LQ, Guo LP, et al. Chinese Sanqi industry status and development countermeasures [J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 553-557. |
| [7] | Chen J, Gao WW, Tang D, et al. Investigation of fungal populations in seven ochratoxin A contaminated root herbs [J]. China J Chin Mater Med (中国中药杂志), 2010, 35: 2647- 2651. |
| [8] | Tan J, Zhen RS, Wang WL, et al. Simultaneous determination of aflatoxins and zearalenone in Chinese crude drugs by high performance liquid chromatography-tandem mass spectrometry [J]. Lishizhen Med Mater Med Res (时珍国医国药), 2012, 23: 2469-2472. |
| [9] | Zhao KX, Ge BK, Chen XY, et al. Determination of 10 mycotoxins in Chinese herbs and Chinese medicines by liquid chromatography-tandem mass spectrometry using on-line immunoaffinity purifying [J]. Chin J Anal Chem (分析化学), 2011, 39: 1341-1346. |
| [10] | Chourasia HK. Mycobiota and mycotoxins in herbal drugs of Indian pharmaceutical industries [J]. Mycol Res, 1995, 99: 697-703. |
| [11] | Mateo EM, Medina A, Mateo F, et al. Ochratoxin A removal in synthetic media by living and heat-inactivated cells of Oenococcus oeni isolated from wines [J]. Food Control, 2010, 21: 23-28. |
| [12] | Reif K, Metzger W. Determination of aflatoxins in medicinal herbs and plant extracts [J]. J Chromatogr A, 1995, 692: 131-136. |
| [13] | Kim YH, Kang HS, Oh SW, et al. Monitoring of aflatoxins in medicinal herbs [J]. Korean J Food Sci Technol, 2010, 42: 27-32. |
| [14] | Kitchin JES, Pomeranz MK, Pak G, et al. Rediscovering mycophenolic acid: a review of its mechanism, side effects, and potential uses [J]. J Am Acad Dermatol, 1997, 37: 445- 449. |
 2015, Vol. 50
2015, Vol. 50


