2. 天津艾赛博生物技术有限公司, 天津 300457;
3. 天津市药用植物细胞规模培养企业重点实验室, 天津 300457
2. Tianjin Acelbio Biological Technology Co., LTD, Tianjin 300457, China;
3. Tianjin Key Enterprise Laboratory of Medicinal Plant Cell Culture, Tianjin 300457, China
红豆杉属 (Taxus L.) 植物为常绿乔木或灌木,全世界共有11种,分布在北半球。我国有4个种和1个变种,均含有紫杉醇类化合物[1]。红豆杉属植物生长缓慢,树皮中紫杉醇的含量低 (0.01% 干重)。近年来,由于紫杉醇的价格居高不下,野生的红豆杉资源受到极大的破坏,也使得野生的红豆杉成为濒危物种[2]。因此,寻找紫杉醇的替代资源是当务之急。
目前,世界上获得紫杉醇的替代方法主要有4种: 从前体化合物10-deacetyl-bacatin III进行半合成、全合成、用内生真菌或细菌进行生物合成、离体细胞培养[3]。其中,对离体的红豆杉组织细胞进行培养,从而生产紫杉醇及其衍生物被认为是最具潜力的方法[4]。在理想情况下该方法能够连续均匀生产,受外界条件影响小,无污染,而且可以在生物反应器中大规模培养,易于通过发酵条件的调控来提高产量,是紫杉醇工业化生产的较好方法。自1991年Christen等[5]获得红豆杉细胞培养的第一个专利以来,已经有多种红豆杉植物建立了细胞悬浮培养系统,培养技术也取得很大进展[6]。在南方红豆杉细胞培养物化学成分的研 究中,已经发现几十种紫杉烷二萜类化合物,从红豆杉细胞培养得到的紫杉烷二萜类化合物中发现,红豆杉细胞中含有丰富的酶系统,往往能催化衍生出结构多样的紫杉烷二萜化合物[7]。在南方红豆杉细胞培养物中,这些化合物大部分是以4,20环外双键和4,20环氧型骨架 (如baccatin类) 为基 础经过一系列的氧化作用 (羟基化、乙酰化等) 得到的紫杉烷二萜类化合物以及一些桥环的紫杉烷二萜类化合物[7],并且发生氧化的位置常常在C1、C2、C4、C5、C7、C9、C10、C13、C14[8]。目前,从南方红豆杉细胞培养物中得到的化学成分与南方红豆杉植物中发现的大体一致,包括: 紫杉烷二萜类,如taxol、7-epitaxol、baccatin III、baccatin VI及其他已知紫杉烷类二萜化合物; 非紫杉烷二萜类化合物,如黄酮、甾醇等化合物[9]。同时,从南 方红豆杉细胞培养物中也发现了许多新结构化合物[10],如以Yunnanxane为母核得到的酯化产物[11]。进行红豆杉细胞的离体培养,不仅可以得到具有强大抗肿瘤活性的紫杉醇及其类似物,还可以深入研究紫杉醇类化合物的生物合成途径,并为最终通过基因工程手段来调控紫杉醇的含量打下基础。本文对南方红豆杉悬浮细胞80%乙醇提取物进行化学成分的研究,旨在从中找到更多结构与紫杉醇类似的化合物。
本文从南方红豆杉悬浮细胞80% 乙醇提取物的二氯甲烷萃取部位中分离并鉴定了13个化合物,其中,化合物1为新化合物,化合物2、4、10、11为首次从南方红豆杉细胞培养物中分离得到 (图 1)。
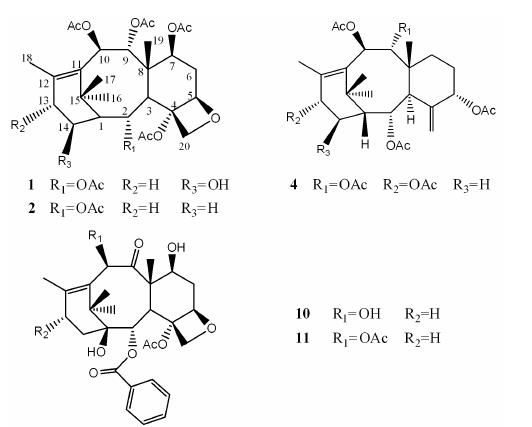 |
Figure 1 Structures of compounds 1,2,4,10 and 11 |
化合物1的13C NMR谱中,显示有30个碳信号,结合DEPT谱信息,可知分子中含有9个甲基、3个亚甲基、8个次甲基和10个季碳。在低场区可以看到5个羰基碳信号 (δ 170.9、171.3、171.8、171.9、172.2)、2个烯键信号 (δ 132.5、139.1),高场区显示有9个甲基信号。一般紫杉烷类化合物的母核上存在4个甲基信号,结合观察到的5个羰基碳信号和紫杉烷类化合物的结构特点,可以确定该化合物的基本母核结构为五乙酰氧基取代的紫杉烷类化合物。化合物1的1H NMR谱中,在低场区可以看到,4个与乙酰氧基取代的碳上相连的氢信号 (δ 5.92、5.71、5.37、5.33) 以及1个与氧相连的次甲基 氢信号(δ 4.92,H-5)、与氧相连亚甲基碳上的两个氢信号[4.46 (d,J = 8.4 Hz,H-20β)、4.15 (d,J = 8.4 Hz,H-20α)]、1个与羟基相连的碳上的氢信号 (δ 3.84,H-14),在高场区可以看到9个甲基的氢信号,这与碳谱上的甲基个数是一致的,并且可以观察到5个乙酰氧基上的甲基氢信号δ 2.02 (C-2位乙酰氧基上甲基氢信号)、δ 2.06 (C-4位乙酰氧基上甲基氢信号)、δ 2.02 (C-7位乙酰氧基上甲基氢信号)、δ 2.16 (C-9位乙酰氧基上甲基氢信号)、δ 1.93 (C-10位乙酰氧基上甲基氢信号),与之对应的甲基碳的化学位移为δ 21.2、20.1、21.4、21.8、20.8,乙酰氧基的羰基碳的化学位移为δ 170.9、171.3、171.8、171.9、172.2,2.59 (1H,d,J = 5.2 Hz) 处的氢信号是紫杉烷类化合物的H-3α特征信号。
通过HSQC谱可以对所有直接相关的碳氢信号进行归属 (表 1)。 通过比较,化合物1的1H和13C NMR数据与化合物2十分相似,不同之处在于1H NMR谱中,化合物1在δ 3.84处显示有一连氧碳上的质子信号,在13C NMR谱中多了一个与之对应的连氧碳信号。在HSQC谱中进一步观测到δ 3.84与δ 63.8的相关信号。结合高分辨率质谱数据推断化合物1为2的羟基化产物。同时在HMBC谱中 (图 2),可以观测到δ 3.84与 δ 37.2 (C-15) 和δ 68.8 (C-2) 的远程相关,进一步证明羟基在C-14位。在NOESY谱中可 以观测到δ 3.84 (H-14) 与δ 2.02 (C-2乙酰氧基甲基),δ 2.59 (H-3α),δ 1.59 (C-16,-CH3) 的相关信号,上述3个位置的质子信号都位于α构型位置,从而确定H-14构型为α构型,14-羟基的构型为β构型。因此,确定化合物1结构为2α,4α,7β,9α,10β-pentaacetoxy-14β- hydroxytax-11-ene,经数据库检索为一新化合物。
|
|
Table 1 NMR spectral data for compound 1 (DMSO-d6,J in Hz) |
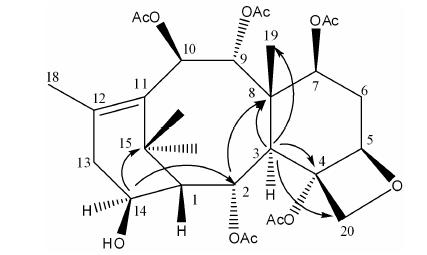 |
Figure 2 Key HMBC correlations in 1 |
采用多种分离技术对南方红豆杉悬浮细胞培养物体积分数为80% 的乙醇提取物进行了分离,共得到13个化合物,从南方红豆杉的叶、枝等部位及细胞培养物已分离得到了多个14位酯化的4 (20) 位环氧型紫杉烷类化合物,与这些已知成分不同的是,新化合物1的14-位为羟基取代。化合物2曾在中国红豆杉 (Taxus chinensis) 的细胞培养物中发现[12],化合物4曾在东北红豆杉 (Taxus cuspidata) 愈伤组织中发现[13],化合物10和11曾在中国红豆杉 (Taxus chinensis) 细胞培养物中发现[14],本文首次从南方红豆杉的细胞培养物中分离得到上述4个化合物。
目前,已经从红豆杉的各组织培养中获得了紫杉醇、baccatin III等至少30种已知的紫杉烷类化合物,一些新的紫杉烷类化合物也被发现,其中已获得专利的新型紫杉烷类成分Sinenxans最具代表性[15]。Sinenxans (A,B和C) 是中国医学科学院药物研究所的研究人员首次从红豆杉愈伤组织培养物中分离得到的一类新的紫杉烷类化合物,这类化合物是具有紫杉烷类6/8/6的基本母核、4 (20) 双键、C-14位含氧取代的一类结构新颖的化合物。本研究中的化合物5~9均为此类化合物。目前此类化合物还未在红豆杉植物中发现,但在细胞培养物中此类化合物种类丰富且含量很高,说明通过红豆杉的细胞培养可产生结构多样的紫杉烷类化合物。
实验部分Agilent 1200分析型高效液相色谱仪; Finnigan LCQ Advangane MAX质谱仪; Bruker AV 300/400型超导核磁共振仪; JAS-CO V-550型紫外/可见光谱仪; 硅胶GF254薄层预制板和柱色谱硅胶 (200~300目和80~100目) 为青岛海洋化工厂产品; Sephadex LH 20为Amersham Biosciences产品; 色谱纯甲醇购自山东禹王有限公司,分析纯化学试剂购自天津富宇精细化工有限公司。
1 细胞培养实验用细胞株为天津艾赛博生物技术有限公司于2011年利用南方红豆杉嫩茎诱导筛选出的紫杉醇高产细胞株。
继代培养基为B5基本培养基,添加1 mg·L-1 2,4-D、0.1 mg·L-1 6-BA、100 mg·L-1 Vc、0.292 8 g·L-1谷氨酰胺与15 g·L-1蔗糖,pH调至5.8。
悬浮细胞在500 mL三角瓶中继代培养,培养基装液量为100 mL,于115 ℃灭菌15 min。在无菌条件下,悬浮培养14天的细胞经120目筛网过滤后,以10 g湿重/100 mL的接种量接种于新鲜培养基中,放置于25 ℃恒温室中暗培养,摇床转速为100 r·min-1,每隔14天继代一次。
细胞在20升规模的反应器规模继代时,在无菌条件下,除去在反应器中生长14天的细胞上清液后将部分湿细胞转入新反应器中,然后通过膜过滤方式向反应器中注入继代培养基,总体积控制在20~25 L,细胞初始浓度保持在40~50 g (鲜重)·L-1,培养温度保持25 ℃,继代周期为14天。
诱导子茉莉酸甲酯用75% 乙醇配制成100 mmol·L-1母液,放置在 -20 ℃冰柜中保存备用。
在无菌条件下,除去在反应器中生长14天的细胞上清液后,通过膜过滤向反应器中注入生产培养基,其为MS基本培养基,添加0.2 mg·L-1 2,4-D、0.5 mg·L-1 NAA、0.5 mg·L-1 6-BA及30 g·L-1蔗糖,pH调至5.8,总体积保持在20~25 L,细胞初始浓度为90~100 g (鲜重)·L-1。在培养的第4与第7天,分别通过膜过滤向反应器中加入茉莉酸甲酯,使其浓度为100 μmol·L-1。温度保持在 (25 ± 1) ℃,直至第28天生产结束并收集细胞。
2 提取分离将反应器的细胞过滤除去培养基后送往中科云健康科技 (天津) 有限公司干燥,得到188 g干细胞,用80% 乙醇超声提取3次,合并提取液,减压浓缩后用二氯甲烷萃取3次,合并二氯甲烷萃取液,减压浓缩,通过柱色谱等纯化方法得到主要成分紫杉醇后,将其余部位合并,减压浓缩后冷冻干燥,得到5.3 g含多种紫杉烷类化合物的混合物。经硅胶色谱柱环己烷-乙酸乙酯梯度洗脱,结晶析出大量白色晶体化合物13(60 mg),合并组分得Fr 1~Fr 5。Fr 1经过环己烷-乙酸乙酯梯度洗脱,在溶剂20∶1比例下得到化合物5 (30 mg),剩下的流分在制备HPLC中得到化合物7 (12 mg)、8 (15 mg)、9 (20 mg); Fr 2使用凝胶柱分离效果不好,重新过硅胶柱,环己烷-乙酸乙酯梯度洗脱,在溶剂8∶1比例下得到化合物2 (15 mg),剩下的流分合并点板有两个极性很相近的点,经过制备HPLC得到化合物4 (20 mg) 和6 (12 mg); Fr 3经过环己烷-乙酸乙酯梯度洗脱,在6∶1比例下得到化合物3 (20 mg),剩下的流分在制备HPLC中得到化合物10 (8 mg) 和11 (10 mg); Fr 4 TLC分析有一个 主斑点,由于量比较少,直接经过制备HPLC得到化合物12 (20 mg); Fr 5经过制备HPLC得到化合物1 (10 mg)。
3 结构鉴定化合物1 白色粉末 (甲醇),[α]= +39 (c 0.5,MeOH); UV (MeOH) λmax 215.6 nm; IR (KBr) υmax 3 460,2 921,1 735 cm-1。香草醛-浓硫酸显紫色; HR- ESI-MS: 617.2723 [M+Na]+。1H NMR (300 MHz,DMSO-d6) 和13C NMR数据 (75 MHz,DMSO-d6) 见表 1。
化合物2 白色粉末 (甲醇),香草醛-浓硫酸显紫色,HR-ESI-MS: 601.262 9 [M+Na]+。1H NMR (300 Mz,CD3OD) δ: 6.12 (1H,d,J = 11.2 Hz,H-10),5.86 (1H,d,J = 11.2 Hz,H-9),5.57 (1H,d,J = 4.4 Hz,H-2),5.53 (1H,d,J = 8.9 Hz,H-7),4.99 (1H,d,J = 8.8 Hz,H-5),4.55 (1H,d,J = 8.1 Hz,H-20α),4.23 (1H,d,J = 8.1 Hz,H-20β),3.38 (1H,m,H-14α),2.89 (1H,d,J = 5.4 Hz,H-3),2.49 (1H,m,H-6α),2.36 (1H,m,H-13β),2.23 (1H,d,H-13α),2.18 (1H,s,-OCOCH3),2.09 (1H,s,-OCOCH3),2.09 (1H,s,-OCOCH3),2.01 (1H,s,-OCOCH3),1.97 (3H,s,H-18),1.96 (1H,s,-OCOCH3),1.83 (1H,m,H-14β),1.68 (1H,d,J = 5.2 Hz,H-6β),1.66 (3H,s,H-16),1.66 (1H,d,J = 7.0 Hz,H-1),1.49 (3 H,s,H-19),1.00 (3H,s,H-17); 13C NMR (75 MHz,CD3OD) δ:51.1 (C-1),71.4 (C-2),44.8 (C-3),82.3 (C- 4),85.1 (C-5),35.5 (C-6),73.3 (C-7),46.8 (C-8),76.7 (C-9),72.4 (C-10),132.8 (C-11),142.6 (C-12),30.2 (C-13),18.1 (C-14),38.3 (C-15),26.4 (C-16),31.9 (C- 17),20.9 (C-18),12.9 (C-19),77.6 (C-20),170.9,171.3,171.8,171.9,172.2 (5×-OCOCH3),21.1,31.4,21.4,21.5,22.1 (5×-OCOCH3)。波谱数据与文献[12]一致,故鉴定化合物2为2α,4α,7β,9α,10β-pentaacetoxytax- 11-ene。
化合物3 白色粉末 (甲醇),香草醛-浓硫酸显浅绿色,HR-ESI-MS: 721.2852 [M+Na]+。波谱数据与文献[16]一致,故鉴定化合物3为1β-deoxybaccatin VI。
化合物4 白色粉末 (甲醇),香草醛-浓硫酸显浅蓝色,HR-ESI-MS: 585.270 8 [M+Na]+。波谱数据与文献[13]一致,故鉴定化合物4为2α-acetoxytaxusin。
化合物5 白色针状结晶 (甲醇),香草醛-浓硫酸显紫红色,HR-ESI-MS: 527.2675 [M+Na]+。波谱数据与文献[11]一致,故鉴定化合物5为taxuyunnanine C。
化合物6 浅黄色粉末 (甲醇),香草醛-浓硫酸显紫红色,HR-ESI-MS: 585.3262 [M+Na]+。波谱数据与文献[11]一致,故鉴定化合物6为yunnanxane。
化合物7 无色粒状结晶 (甲醇),香草醛-浓硫酸显紫红色,HR-ESI-MS: 541.2852 [M+Na]+。波谱数据与文献[11]一致,故鉴定化合物7为2α,5α,10β-triacetoxy- 14β-propionyloxy-4 (20),11-taxadiene。
化合物8 无色粒状结晶 (甲醇),香草醛-浓硫酸显红色,HR-ESI-MS: 555.300 1 [M+Na]+。波谱数据与文献[11]一致,故鉴定化合物8为2α,5α,10β-triacetoxy- 14β-isobutyryloxy-4 (20),11-taxadiene。
化合物9 无色柱状结晶 (甲醇),香草醛-浓硫酸显红色,HR-ESI-MS: 569.3162 [M+Na]+。波谱数据与文献[11]一致,故鉴定化合物9为2α,5α,10β-triacetoxy- 14β-(2'-methyl)butyryloxy-4 (20),11-taxadiene。
化合物10 白色粉末 (甲醇),香草醛-浓硫酸显红色,HR-ESI-MS: 593.2365 [M+Na]+。波谱数据与文献[14]一致,故鉴定化合物10为13-dehydroxylbaccatin III。
化合物11 白色粉末 (甲醇),香草醛-浓硫酸显红色,HR-ESI-MS: 551.2240 [M+Na]+。波谱数据与 文献[14]一致,故鉴定化合物11为13-dehydroxy-10- deacetylbaccatin III。
化合物12 无色针状结晶 (甲醇),香草醛-浓硫酸显蓝色,HR-ESI-MS: 876.319 9 [M+Na]+。波谱 数据与文献[17]一致,故鉴定化合物12为紫杉醇 (paclitaxel)。
化合物13 白色针状结晶 (乙酸乙酯),与β-谷甾醇对照品比对一致,故鉴定化合物13为β-谷甾醇。
| [1] | Gan FY, Zheng GZ. Progress of Taxus chinensis cell engineering [J]. World Notes Plant Med (国外医药植物药 分册), 1994, 9: 256-259. |
| [2] | Ru WM, Zhang JT, Zhang F, et al. Eco-environmental char-acteristics and endangered causes of Taxus mairei, an endemic to China [J]. Bull Bot Res (植物研究), 2006, 26: 624-628. |
| [3] | Kong JQ, Wang W, Zhu P, et al. Study on biosynthesis of taxol [J]. Acta Pharm Sin (药学学报), 2007, 42: 358-365. |
| [4] | Zhong JJ. Plant cell culture for the production of paclitaxel and other taxane [J]. J Biosci Bioeng, 2002, 94: 591-599. |
| [5] | Christen AA, Gibson DM, Bland J. Production of taxol or taxollike compounds in cell cultures: US 5019504 [P]. 1991-05-28. |
| [6] | Sun BX, Zhang GY, Liu D, et al. Cell culture of Taxus and paclitaxel produce [J]. Plant Physiol Commun (植物生理学通讯), 1999, 35: 135-140. |
| [7] | Han PP, Ye TX, Qiao B, et al. Taxoids profiling of suspension Taxus chinensis var. mairei cells in response to shear stress [J]. Biochem Eng J, 2013, 77: 66-73. |
| [8] | Jennewein S, Rithner CD, Williams RM, et al. Taxoid metabolism: taxoid 14 β-hydroxylase is a cytochrome P450-dependent monooxygenase [J]. Arch Biochem Biophys, 2001, 390: 265-278. |
| [9] | Min ZD, Jiang H, Liang JY. Study on the taxane diterpenes of the heart wood from Taxus mairei [J]. Acta Pharm Sin (药学学报), 1989, 24: 673-677. |
| [10] | Xie D, Jia HT, Zhang Y, et al. Four new minor taxanes from cell cultures of Taxus chinensis [J]. J Asian Nat Prod Res, 2009, 11: 490-497. |
| [11] | Ma WW, Stahlhut RW, Adams TL, et al. Yunnanxane and its homologousester from cell cultures of Taxus chinensis var. mairei [J]. J Nat Prod, 1994, 57: 1320-1324. |
| [12] | Birgittia M, Wolfgang E, Peter JH, et al. Taxoids from cell cultures of Taxus chinensis [J]. Phytochemistry, 1998, 49: 113-125. |
| [13] | Zhang L, Bai J, Li ZL, et al. Isolation and identification of the taxanes from a callus of Taxus cuspidate [J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2010, 27: 883-887. |
| [14] | Menhard B, Eisenreich W, Hylands PJ, et al. Taxoids from cell cultures of Taxus chinensis [J]. Phytochemistry, 1998, 49: 113-125. |
| [15] | Cheng KD, Chen WM, Zhu WH. Manufacture of taxane analog by callus culture of Taxus plants: WO 9406740 (CI. C07035/37), JP 249047 [P]. 1992-09-18. |
| [16] | Chen XY, Liang JY. Chemical constituents of cultured Taxus mairei (I) [J]. Chin J Nat Med (中国天然药物), 2006, 4: 52-57. |
| [17] | Zhang ZZ, Jia ZJ. Taxanes from Taxus yunnanensis [J]. Phytochemistry, 1990, 29: 3673-36751. |
 2015, Vol. 50
2015, Vol. 50


