随着全球人口的急剧老龄化,神经退变性疾 病已成为一个严重的问题,其中阿尔茨海默病 (Alzheimer’s disease,AD) 已经成为人类晚年精神衰竭的最普遍的形式。AD是一种神经退变性疾病,临床表现为认知和记忆功能不断恶化,日常生活能力进行性减退,并有各种神经精神症状和行为障碍[1]。尽管其发病机制还没有完全阐明,但研究表明,AD患者脑中低的乙酰胆碱水平、β-淀粉样蛋白 (β-amyloid,Aβ) 的异常增加与沉积以及氧化损伤等在AD的发病机制中起着重要的作用[2]。目前AD主要具有3种特征性的病理表现: 神经传递基质乙酰胆碱水平的降低[3]、患者大脑小半鞘翅中β-淀粉样蛋白增加[4, 5]和Tau蛋白 (含量最高的微管相关蛋白) 的过度磷酸化[6]。人们还在为探索AD的病因做着更多、更新的研究[7, 8, 9, 10, 11]。
目前治疗AD以乙酰胆碱酯酶抑制剂 (AChEI) 为主,如利斯的明 (rivastigmine)、他克林 (tacrine)、多奈哌齐 (donepezil)、加兰他敏 (galanthamine) 和石杉碱甲 (huperzine-A)等[12]。但是已经开发的这些药物无法完全满足临床的需求,需要进一步开发高效低毒的药物来满足社会的需要。
近来报道了1个新化合物Ⅰ及其类似物[13, 14, 15] (图 1),对抑制AChE有非常好的效果,其IC50值达到了0.51 μmol·L-1。有文献报道化合物含有富电子 (如甲氧基) 的芳香基团,能够与AChE的外周阴离子结合部位 (peripheral anionic site,PAS) 结合[16, 17]。化合物Ⅰ的A官能团拥有甲氧基、苯环和噻唑环,都有很丰富的电子,使它能很好地结合PAS位点,因而拥有极好的活性。本文依据生物电子等排原理,用A1官能团代替A官能团,A1官能团由苯环和咪唑酮环组成,电子同样富有,而且A1官能团的电子更为集中,预想它能与PAS部位更易结合且更稳固; 在对先导物化合物进行合理生物电子等排取代时,用苯环代替噻唑环,咪唑酮代替苯环,使其参数 (键角、杂化、电子分布、电荷等) 尽可能的保留,进一步稠合成苯并咪唑酮结构。
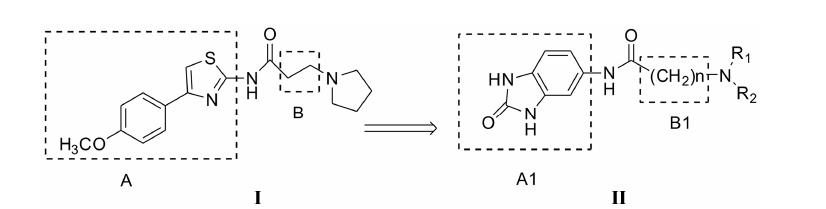 |
Figure 1 The structures of compounds Ⅰ and Ⅱ |
本文研究治疗AD的出发点是从抑制乙酰胆碱酯酶着手。随着乙酰胆碱酯酶晶体结构的研究,发现人的AChE的活性部位是一个由表面向内部伸展的狭长通道,呈哑铃型,通道开口处和底部比较开阔,中间狭窄。开口处富含带负电荷的氨基酸残基如酪氨酸、色氨酸和天冬氨酸等,该位置被称为外周阴离子结合部位,底部是AChE的催化活性中心 (catalysis active site,CAS)。研究发现,AD患者脑中高活性AChE多聚集在神经斑块和神经纤维结处,而且AChE的PAS部位能促进Aβ蛋白的形成并加速其沉淀[18, 19]。这些研究表明,AChE可能在AD发展过程中起着多重作用,因此同时作用于AChE的CAS部位和PAS部位的双位点抑制剂可能对AD治疗有多重作用机制 (图 2)。因此本文对化合物Ⅰ另一部分修饰就是延长或缩短碳链,寻找能同时作用于AChE的CAS部位和PAS部位的双位点抑制剂,也就是B1官能团代替B。最终合成新的化合物Ⅱ (图 1),并考察它们对AChE的抑制作用,为新的AChEI的开发做探索性研究。本文以5-氨基苯并咪唑酮为原料,经过酰胺化反应,生成化合物1~4,化合物1~4与二级胺反应生成目标化合物。具体反应过程见合成路线1。
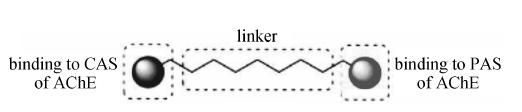 |
Figure 2 Design of Multi-target hybrids |
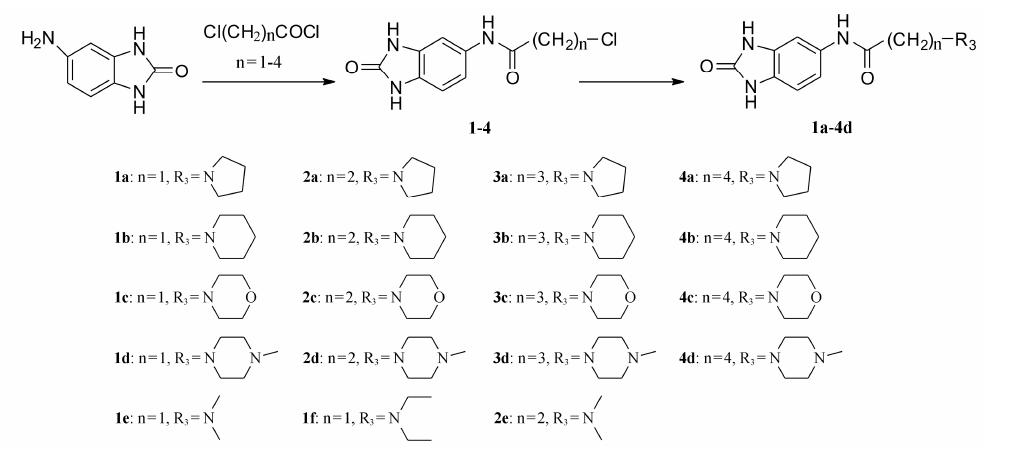 |
Scheme 1 Synthetic route of target compounds |
目标化合物的结构经1H NMR、MS、元素分析及IR得以确证,理化数据见表 1、2。
|
|
Table 1 Spectra data of compounds 1a-1f,2a-2e,3a-3d and 4a-4d |
|
|
Table 2 Physical property of compounds 1a-1f,2a-2e,3a-3d and 4a-4d |
为了进一步研究化合物的生物活性,进行了AChE体外抑制活性实验。测试结果表明,制备的19个化合物中,5个具有生物活性 (表 3)。化合物4d对乙酰胆碱酯酶的抑制活性是最佳的,其IC50平均值达到了7.2 μmol·L-1,优于对照药利斯的明,但没有石杉碱甲的活性好。通过化合物的结构对比发现,5个有活性的化合物有3个酰基上的碳链为4个亚甲基,并且活性最好的4d也含有4个亚甲基,由此推测碳链比较长时,活性较好。
|
|
Table 3 Inhibition of AChE activity by target compounds |
二级胺对化合物的活性也有显著的影响,从化合物1a~4d之间可以得出,不同的含氮基团对化合物的活性有决定性的作用,当R3是CH3N(CH2CH2)2N- 时,化合物才表现出最好活性。
3 丁酰胆碱酯酶体外抑制活性胆碱酯酶是体内迅速水解乙酰胆碱的酶,表面有两个活性中心,既CAS部位和PAS部位。该酶有两种: 真性胆碱酯酶 (乙酰胆碱酯酶),存在于胆碱能神经元内、胆碱能突触及红细胞内,是水解内源性乙酰胆碱的必需酶; 假性胆碱酯酶 (丁酰胆碱酯酶),主要存在于血浆、肝脏及胶质细胞,在终止内源性乙酰胆碱的作用上不起主要作用,并且抑制BuChE,会引起干细胞损伤。因此有必要对BuChE的活性进行测定。
选择对乙酰胆碱酯酶抑制活性的化合物做了相应的丁酰胆碱酯酶体外抑制活性实验,并与对照药进行了比对,5个化合物中只有4d对丁酰胆碱酯酶 有抑制活性 (表 4),但对于丁酰胆碱酯酶抑制效果不佳,因此选择性相对较好。
|
|
Table 4 Inhibition of BuChE activity by target compounds |
合成的19个化合物中化合物4d对乙酰胆碱酯 酶的生物活性最好,其IC50均值达到了7.2 μmol·L-1,活性优于对照药物利斯的明但不如石杉碱甲。其对 丁酰胆碱酯酶的抑制活性均值为1 200 μmol·L-1,说明4d对乙酰胆碱酯酶抑制有很好的选择性。因此5-氨基苯并咪唑酮类衍生物对乙酰胆碱酯酶的活性值得进一步的研究。
实验部分所有实验材料除另作说明外,均为市售。乙酰胆碱 (电鳗) 购自Sigma公司。用SGW X-4显微熔点仪测定熔点 (上海精密科学仪器有限公司,中国),温度未校正。1H NMR由Bruker AVANCE 600核磁共振仪 (DMSO-d6为溶剂,TMS做内标) 测定。质谱由Bruker apex ultra 7.0 T傅里叶变换型质谱仪测定; 元素分析由Carlo Erba-1160型元素分析仪测定; 红外光谱采用FTIR-8400S傅里叶变换红外分光光度计。96孔板读取用1420 Victor 酶标仪。
1 化合物合成 1.1 化合物1~4的合成 (以化合物1为例)取0.1 mol (14.9 g) 的5-氨基苯并咪唑酮、0.05 mol K2CO3 (6.9 g) 和200 mL的N,N-二甲基甲酰胺 (DMF) 置于500 mL的反应瓶中,室温搅拌,然后滴加氯乙酰氯和DMF的混合溶液,混合溶液用等体积的氯乙酰氯 (0.11 mol) 和DMF混合,然后摇匀,滴加完后反应10 min。反应结束后加入600 mL水,出现沉淀,静置半小时抽滤,每次用50 mL的水冲洗3遍,晾 干称重得到9.5 g浅灰色化合物1,收率69%,熔点303~305 ℃。1H NMR δ 10.57 (s,1H,imidazole-H),10.52 (s,1H,imidazole-H),10.16 (s,1H,-CONH-),7.44 (d,J = 1.7 Hz,1H,ArH)),7.01 (d,J = 1.9 Hz,1H,ArH)),6.86 (d,J = 8.3 Hz,1H,ArH)),4.21 (s,2H,-CH2-); ESI-MS m/z 226.0 [M+H]+; C9H8N3O2(EA) Calcd. (%): C 48.00; H 3.56; N 18.67; Found (%): C 47.91; H 3.57; N 18.62。
同法制的化合物2~4。化合物2: 收率: 70%,熔点299~301 ℃。1H NMR δ 10.56 (s,1H,imidazole-H),10.49 (s,1H,imidazole-H),9.92 (s,1H,-CONH-),7.47 (s,1H,ArH),7.01 (d,J = 8.1 Hz,1H,ArH),6.84 (d,J = 8.2 Hz,1H,ArH),3.87 (t,J = 6.0 Hz,2H,-CH2-),2.79 (t,J = 6.0 Hz,2H,-CH2-); ESI-MS m/z 240.1 [M+H]+; C10H10N3O2(EA) Calcd. (%): C 50.21; H 4.18; N 17.57; Found (%): C 50.12; H 4.21; N 17.53。
化合物3 收率65%,熔点290~292 ℃。1H NMR δ 10.53 (s,1H,imidazole-H),10.46 (s,1H,imidazole- H),9.85 (s,1H,-CONH-),7.46 (s,1H,ArH),7.05~7.00 (m,1H,ArH),6.82 (d,J = 8.3 Hz,1H,ArH),3.68 (t,J = 6.5 Hz,2H,-CH2-),2.45 (t,J = 7.3 Hz,2H,-CH2-),2.06~1.99 (m,2H,-CH2-); ESI-MS m/z 254.1 [M+H]+; C11H12N3O2(EA) Calcd. (%): C 52.17; H 4.74; N 16.60; Found (%): C 52.08; H 4.77; N 16.56。
化合物4 收率64%,熔点298~299 ℃。 1H NMR δ 10.52 (s,1H,imidazole-H),10.45 (s,1H,imidazole- H),9.74 (s,1H,-CONH-),7.46 (s,1H,ArH),7.00 (d,J = 8.1 Hz,1H,ArH),6.82 (d,J = 8.3 Hz,1H,ArH),3.66 (t,J = 6.2 Hz,2H,-CH2-),2.31 (t,J = 7.0 Hz,2H,-CH2-),1.76 (dd,J = 13.5,6.8 Hz,2H,-CH2-),1.71 (dd,J = 14.3,7.1 Hz,2H,-CH2-); ESI-MS m/z 268.1 [M+H]+; C12H14N3O2(EA) Calcd. (%): C 53.93; H 5.24; N 15.73; Found (%): C 53.84; H 5.27; N 15.70。
1.2 化合物1a~2e的合成 (以化合物1a为例)取0.5 g化合物1 (2.2 mmol)、0.9 g三乙胺 (8.8 mmol)、0.2 g四氢吡咯 (2.5 mmol) 和3 mL DMF置于反应 试管中,80 ℃反应8 h。反应结束后加入9 mL水,出沉淀,静置12 h后抽滤,用5 mL的水冲洗,冲洗3遍,确保DMF除净,晾干称重得到0.1 g化合物1a,同法制的化合物1b~1f、2a~2e。
1.3 化合物3a~4d的合成 (以化合物3a为例)取0.5 g化合物3 (2 mmol)、0.8 g三乙胺 (8 mmol)、0.16 g四氢吡咯 (2.2 mmol) 和3 mL DMF置于反应试管中,120 ℃反应8 h。反应结束后加入20 mL二氯甲烷,出沉淀,静止1 h后抽滤,每次用5 mL的二氯甲烷冲洗,冲洗3遍,除掉DMF,然后用300 mL甲醇溶解所得固体。减压蒸出溶剂,剩余物经硅胶色谱柱 (洗脱剂为二氯甲烷与甲醇,体积比6∶1) 分离纯化得到0.15 g 3a,同法制的化合物3b~3d、4a~4d。
2 体外AChE抑制实验采用Ellman分光光度法[20]在体外考察化合物对电鳗乙酰胆碱酶的抑制作用,设置空白组,利斯的明、石杉碱甲为阳性对照组进行实验。配制Tris缓冲液pH为7.2,底物ACTI (碘化硫代乙酰胆碱) 的浓度为0.6 mmol·L-1,显色剂DTNB的浓度为3 mmol·L-1,电鳗AChE总量为0.035 U,抑制剂的配置浓度分别为1×10-4、1×10-5、1×10-6、1×10-7、1×10-8 mol·L-1。
分别取20 μL Tris缓冲液、10 μL电鳗AChE、10 μL各浓度的抑制剂于96孔板中,37 ℃下保温12 min,然后加入10 μL底物ACTI 和50 μL的显色剂DTNB,5 min后使用1420 Victor多标计数仪在405 nm处 读取每孔吸光度。空白组用10 μL Tris缓冲液分别 代替底物和抑制剂,标准组用10 μL Tris缓冲液代 替抑制剂,每个化合物在不同浓度均实验2次。然后以抑制率I [I = 100 × (A测-A空) / (A标-A空)%] 对抑制剂浓度C作图,进行S型曲线线性拟合,得到半数抑 制率IC50对应的浓度Cx,为了得到准确的IC50,然 后从1×10-5~1×10-9 mol·L-1中选择最接近Cx的浓 度1×10-x mol ·L-1,且1×10-x mol·L-1小于Cx。配制1×10-x、3×10-x、5×10-x、7×10-x、9×10-x mol·L-1,同法操作酶抑制实验,然后以抑制率I对抑制剂浓度C作图,进行直线线性拟合,求出IC50。
3 体外BuChE抑制实验取5 mL静脉人血,室温静置1 h,4 ℃放置2 h。用离心机2 000 r·min-1离心10 min,取上清液,即得丁酰胆碱酯酶酶液。其实验具体操作方法与乙酰胆 碱酯酶酶活力测定方法相同,将乙酰胆碱酯酶酶活力测定中的底物碘化硫代乙酰胆碱换成碘化硫代丁酰胆碱即可。
| [1] | DeKosky ST, Scheff SW. Synapse loss in frontal biopsies in Alzheimer's disease: correlation with cognitive severity [J]. Ann Neurol, 1990, 27: 457-464. |
| [2] | Guo ZR. Strategy of molecular drug design: dual-target drug design [J]. Acta Pharm Sin (药学学报), 2009, 44: 209-218. |
| [3] | Bartus RT, Dean LD 3rd, Beer B, et al. The cholinergic hypothesis of geriatric memory dysfunction [J]. Science, 1982, 217: 408-414. |
| [4] | Glenner GG, Wong CW. Alzheimer's disease and Down's syndrome: sharing of a unique cerebrovascular amyloid fibril protein [J]. Biochem Biophys Res Commun, 1984, 122: 1131- 1135. |
| [5] | Glenner GG, Wong CW. Alzheimer's disease: initial report of the purification and characterization of a novel cerebrovascular amyloid protein [J]. Biochem Biophys Res Commun, 1984, 120: 885-890. |
| [6] | Zhang JT. Pathogenesis and therapeutic strategies of senior dementia [J]. Acta Pharm Sin (药学学报), 2000, 35: 635-640. |
| [7] | Schreurs BG, Smith-Bell CA, Lemieux SK. Dietary cholesterol increases ventricular volume and narrows cerebrovascular diameter in a rabbit model of Alzheimer's disease [J]. Neuroscience, 2013, 254: 61-69. |
| [8] | More SS, Vartak AP, Vince R. The butter flavorant, diacetyl, exacerbates β-amyloid cytotoxicity [J]. Chem Res Toxicol, 2012, 25: 2083-2091. |
| [9] | Trzepacz PT, Yu P, Sun J, et al. Comparison of neuroimaging modalities for the prediction of conversion from mild cognitive impairment to Alzheimer's dementia [J]. Neurobiol Aging, 2014, 35: 143-151. |
| [10] | Lok K, Zhao H, Zhang C, et al. Effects of accelerated senescence on learning and memory, locomotion and anxiety-like behavior in APP/PS1 mouse model of Alzheimer's disease [J]. J Neurol Sci, 2013, 335: 145-154. |
| [11] | Dukart J, Mueller K, Villringer A, et al. Relationship between imaging biomarkers, age, progression and symptom severity in Alzheimer's disease [J]. Neuroimage Clin, 2013, 3: 84-94. |
| [12] | Taylor P. Development of acetylcholinesterase inhibitors in the therapy of Alzheimer's disease [J]. Neurology, 1998, 51 (Suppl 1): 30-35. |
| [13] | Ma ZY, Zhang YG, Yang Q, et al. Design, synthesis and evaluation of acetylcholinesterase inhibitors [J]. Acta Pharm Sin (药学学报), 2014, 49: 346-351. |
| [14] | Ma ZY, Yang Q, Zhang YG, et al. Design, synthesis and evaluation of N-acyl-4-phenylthiazole-2-amines as acetylcholinesterase inhibitors [J]. Acta Pharm Sin (药学学报), 2014, 49: 813-818. |
| [15] | Ma ZY, Zhang YG, Yang Q, et al. Design, synthesis and evaluation of N-acyl-thiochromenothiazol-2-amine as acetylcholinesterase inhibitors [J]. Acta Pharm Sin (药学学报), 2014, 49: 1289-1295. |
| [16] | Cavalli A, Bolognesi ML, Capsoni S, et al. A small molecule targeting the multifactorial nature of Alzheimer's disease [J]. Angew Chem Int Ed Engl, 2007, 46: 3689-3692. |
| [17] | Nadri H, Pirali-Hamedani M, Shekarchi M, et al. Design, synthesis and anticholinesterase activity of a novel series of 1-benzyl-4-((6-alkoxy-3-oxobenzofuran-2(3 H)-ylidene) methyl) pyridinium derivatives [J]. Bioorg Med Chem, 2010, 18: 6360-6366. |
| [18] | Pang YP, Quiram P, Jelacic T. Highly potent, selective, and low cost bis-terahydroaminacrine inhibitors of acetylcholinesterase. Steps toward novel drugs for treating Alzheimer's disease [J]. J Biol Chem, 1996, 271: 23646-23649. |
| [19] | Bolognesi ML, Cavalli A, Valgimigli L. Multi-target-directed drug design strategy: from a dual binding site acetylcholinesterase inhibitor to a trifunctional compound against Alzheimer's disease [J]. J Med Chem, 2007, 50: 6446-6449. |
| [20] | Ellman GL, Courtney KD, Valentino A Jr, et a1. A new and rapid colorimetric determination of acetylcholinesterase activity [J]. Biochem Pharmacol, 1961, 7: 88-95. |
 2015, Vol. 50
2015, Vol. 50


