2. 黑龙江中医药大学, 黑龙江 哈尔滨 150040
2. Heilongjiang University of Chinese Medicine, Harbin 150040, China
狼毒大戟 (Euphorbia fischeriana Steud) 为大戟科狼毒属植物,俗称“猫眼草”,研究表明对多种肿瘤细胞生长具有抑制作用[1],因此受到人们的广泛关注。近年来,国内外学者对狼毒大戟做了大量的研究工作,并从中分离出一系列药理活性成分,阐明了许多重要化合物的结构,为其深层次开发提供了可靠依据。本实验室从狼毒大戟干燥根中提取了8种单体成分,其中没食子酸乙酯 (ethyl gallate,EG) 为提取的主要成分之一。前期研究采用MTT法对3株不同转移能力的乳腺癌细胞进行了筛选,其中高转移能力的乳腺癌MDA-MB-231细胞的生长抑制作用最明显。
乳腺癌是当今世界各大城市女性发病率最高的癌症,且常早期出现转移。10%~15% 乳腺癌患者,由于肿瘤细胞缺乏雌激素受体 (ER-)、孕激素受体 (PR-),其侵袭性强,总体生存期短,与其他类型的乳腺癌患者相比,显示了高转移性[2]。乳腺癌的治疗除了寻找特异性的标志物使其能够尽早诊断之外,有效的药物治疗在根治或者延长患者生存期方面起着重要的作用。本研究探讨了EG对乳腺癌细胞侵袭、迁移、黏附能力的影响及其作用机制。
材料与方法 试剂和药品EG由本课题组天然植物分离提取研究室提供,相对分子质量为198.172 7,分子结构式为C9H10O5,纯度大于99%,淡棕色粉末,溶于PBS中,配制为800 μg·mL-1母液,-20 ℃保存。实验时用完全培养基稀释到所需浓度。Akt、p-Akt、NF-κB p-65抗体均为美国Cell Signal Technology公司产品,Matrigel为BD公司产品。其他试剂均为国产分析纯。MMP-9、MMP-2引物序列,由上海生工生物技术有限公司合成。
细胞培养人乳腺癌MDA-MB-231,购于中国科学院上海细胞库。细胞于37 ℃孵箱中培养并传代,培养基为含10% 胎牛血清的L15培养液,0.25% 胰酶消化传代。所用细胞均为对数生长期细胞。
细胞与Matrigel黏附实验Matrigel包被96孔板,置37 ℃成胶60 min,吸弃上清液,加入2% BSA封板处理30 min以阻断非特异性黏附,PBS洗板2次待用。消化细胞呈单细胞悬液,PBS洗涤后,计数,按每孔加入1×105细胞,重悬于1 mL完全培养基中,并分别加入EG (终质量浓度分别为0、2.5、5和10 μg·mL-1) 和DiI染色液 (3 μg·mL-1) 孵育,PBS洗 3次,将细胞按照不同剂量组加入已包被Matrigel的96孔板中,每个剂量组设5个复孔,置37 ℃、5% CO2饱和湿度孵箱内黏附30 min,预热的PBS轻轻洗去未黏附细胞,黏附细胞在荧光显微镜下拍片,计数上、中、下、左、右5个不同视野内细胞数,计算平均值。
细胞重组基质膜侵袭实验将Transwell置于24孔板内,用Matrigel稀释液均匀地铺在Transwell侵袭小室底部聚碳酯膜上,每孔100 μL,每组设3个复孔,于37 ℃孵箱内成胶60 min,取出,FN均匀涂抹在小室的下面作为细胞侵袭趋化剂,干燥后备用。细胞消化制备单细胞悬液,用PBS洗2次,计数,按每孔加入1×105细胞,重悬于1 mL完全培养基中,并分别加EG (终质量浓度分别为0、2.5、5和10 μg·mL-1) 孵育,PBS洗3次,将各剂量组细胞重悬于200 μL无血清培养基,加入到上室,下室加入含10% FBS的完全培养基600 µL,37 ℃、5% CO2培养24 h。取出小室,棉签小心擦去上室面未穿过膜的细胞,穿膜细胞浸泡甲醇溶液中固定30 min,风干后用0.1% 的结晶紫染色20 min,PBS洗3次,200倍荧光显微镜下拍照,染色细胞用10% 醋酸溶解,酶标仪读OD570 nm,记录结果。以穿膜细胞的相对数目表示肿瘤细胞的侵袭能力。以上实验重复3次。
细胞重组基质膜迁移运动实验方法同侵袭实验,但Transwell细胞培养小室上室不铺Matrigel。直接向Transwell小室上室加入200 μL无血清培养基 含2.5×105细胞,下室加含10% FBS的完全培养基600 μL,37 ℃、5% CO2培养24 h,擦去膜上面未穿膜的肿瘤细胞,结晶紫染色,200倍荧光显微镜下拍照,染色细胞10% 醋酸溶解,酶标仪读OD570 nm,记录结果。以上实验重复3次。
总蛋白提取和Western blot分析收集不同条件EG处理的细胞,用细胞裂解液 [50 mmol·L-1 Tris-HCl (pH 7.4)、5 mmol·L-1 EDTA、1% Triton X-100、150 mmol·L-1 NaCl、5 mmol·L-1 MgCl2、2 mmol·L-1 Na3VO4、1×CompleteTM protease inhibitor] 冰上裂解30 min,收集上清液,采用BSA法测定蛋白含量。取蛋白40 μg与上样缓冲液混合,于75 V进行SDS- PAGE电泳,待指示剂进入分离胶1.5 cm时将电压改成100 V,分离胶的浓度为10%。 5% 脱脂奶粉于37 ℃封闭2 h。加入一抗 (1∶1 000) 4 ℃过夜,1×TBST洗膜3次,每次10 min。加入相应的二抗 (1∶2 000),室温2 h,1×TBST洗膜3次,每次10 min。NC膜与Western显色底物室温下反应10 min,用ECL显色系统显示,拍照并记录。
RT-PCR分析MMP-2 mRNA、MMP-9 mRNA表达不同剂量EG处理细胞24 h后,Trizol试剂提取细胞总RNA,严格按照RT-PCR试剂盒说明操作。MMP-2: 上游引物5'-GGATGATGCCTTTGCTCG-3',下游引物5'-CAGTGGACATGGCGGTCT-3'; MMP-9: 上游引物5'-TCCCTGGAGACCTGAGAACC-3',下游引物5'-GGCAAGTCTTCCGAGTAGTTT-3'; β-actin: 上游引物5'-ATCATGTTTGAGACCTTCAACACC-3',下游引物5'-TAGCTCTTCTCCAGGGAGG-3'。PCR扩增产物每个样本取5 μL,各加6×Loading Buffer 1 μL,1.5% 琼脂糖凝胶120 V电泳20 min,凝胶成像仪成像并保存结果,凝胶分析软件进行灰度值分析。
统计学分析实验数据以x± s表示,采用SPSS 13.0统计软件进行分析。多组间比较采用One-Way ANOVA,两组间比较采用Q检验。
结果 1 EG对MDA-MB-231与Matrigel黏附能力的影响经不同剂量EG孵育细胞2 h后,PBS洗涤3次,与Matrigel黏附30 min,用荧光探针DiI染色的黏 附细胞,在荧光显微镜下呈红色,实验结果如图 1,MDA-MB-231与Matrigel黏附受到不同程度的抑制。与Control组相比,EG在2.5、5、10 μg·mL-1剂量时MDA-MB-231细胞与Matrigel的黏附能力明显降低(P < 0.01)。
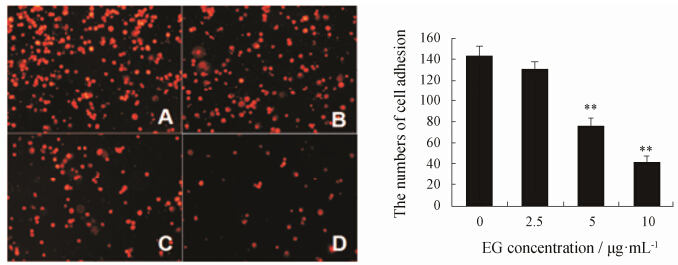
|
Figure 1 Ethyl gallate (EG) suppressed cell adhesion to Matrigel in MDA-MB-231 cells. The photos show the Dil-stained MDA-MB-231 cells adhesion to Matrigel treated with EG at indicated concentration. A: Control; B: 2.5 μg·mL-1; C: 5 μg·mL-1; D: 10 μg·mL-1. The numbers of cell adhesion were shown as mean ± SD. **P < 0.01 vs EG 0 μg·mL-1 group |
细胞迁移和侵袭是肿瘤转移发生的前奏和基本步骤,常采用Transwell小室检测肿瘤细胞对细胞外基质的侵袭和迁移能力。MDA-MB-231细胞恶性程度高,侵袭能力强,1×105个细胞15 h后穿膜细胞OD570 nm为0.623 ± 0.053,而不同剂量EG处理细胞2 h后,其迁移和侵袭MDA-MB-231细胞数量明显减少。EG剂量为10 μg·mL-1时可明显抑制MDA-MB-231细胞迁移和侵袭能力 (P < 0.01),抑制率可高达91%,见图 2。
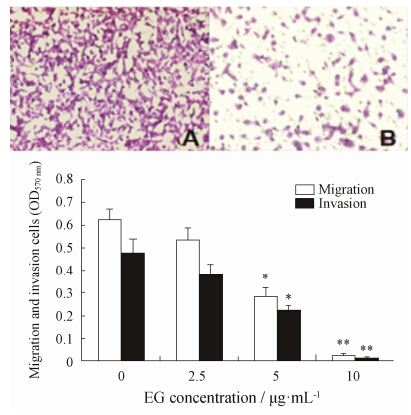
|
Figure 2 EG suppressed migration and invasion of MDA-MB- 231 cells. The photos show the crystal violet-stained migrated cells. A: Control; B: 10 μg·mL-1. The optical densities at 570 nm of migration and invasion cells were shown as mean ± SD. P < 0.05,**P < 0.01 vs EG 0 μg·mL-1 group |
肿瘤细胞分泌MMP-2和MMP-9降解细胞外基质在肿瘤细胞侵袭步骤中发挥重要作用,而MMPs的活性受到基因转录水平的调节。RT-PCR结果显示,EG孵育后,人乳腺癌MDA-MB-231细胞MMP-2、MMP-9相对mRNA表达量均降低,尤其EG在5、10 μg·mL-1时,可明显减少MMP-2 mRNA和MMP-9 mRNA表达 (P < 0.05),见图 3。
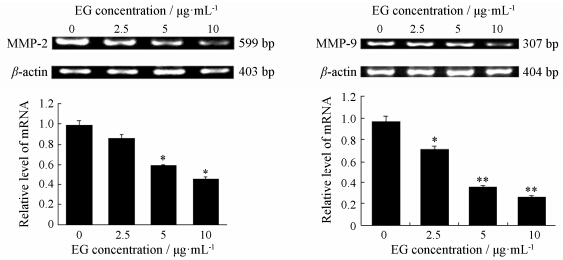
|
Figure 3 EG suppressed mRNA expressions of MMP-2 and MMP-9. The density of the band (normalized to β-actin) was shown as mean ± SD is relative to that of 0 (as the control,designated as 1.0). P < 0.05,**P < 0.01 vs EG 0 μg·mL-1 group |
由于PI3K/Akt和NF-κB信号通路对肿瘤细胞侵袭的重要性,分析了EG对Akt-NF-κB通路的影响。Western blot检测不同剂量的EG对细胞内转导通路分子及磷酸化形式蛋白表达情况,结果如图 4所示。
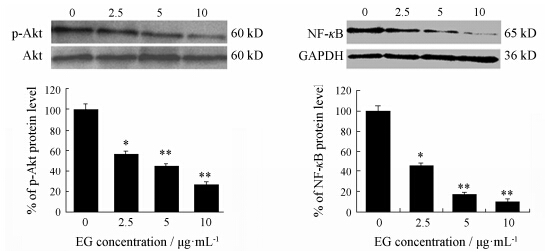
|
Figure 4 EG inhibited Akt and NF-κB activation. The density of the p-Akt band (normalized to Akt) and the density of the NF-κB band (normalized to GAPDH) were shown as mean ± SD is relative to that of 0 (as the control,designated as 100%). EG inhibited expression of p-Akt and NF-κB. P < 0.05,**P < 0.01 vs EG 0 μg·mL-1 group |
乳腺癌转移仍是严重影响预后的主要因素[3]。在肿瘤转移复杂的过程中,肿瘤细胞与细胞外基质 (extracellular matrixs,ECM) 的黏附、侵袭和迁移运动是转移到远处器官的关键步骤[4]。本实验选用人工重组基底胶Matrigel作为黏附基质,其成分与组织 基底膜相似,可模拟组织基底膜,常被用于研究肿瘤细胞与细胞外基质的相互作用分子模型。Matrigel铺在Transwell Chamber内的聚碳酸酯膜上层,穿越的细胞数可反应肿瘤细胞的侵袭迁移能力。采用了高转移能力的人乳腺癌MDA-MB-231细胞作为体外生物学研究的细胞模型,研究了狼毒大戟中的有效成分EG,对其恶性行为相关的侵袭、运动、黏附能力的影响。本实验使用的EG是从狼毒大戟中提取的有效成分,然而上市的EG可用于油脂的抗氧化剂、食品添加剂及某些药品的中间体。两者抗肿瘤活性是否存在差异,待后续实验深入研究。实验中EG的最大剂量设为10 μg·mL-1,此剂量孵育细胞2 h对细胞生长无影响 (结果未示出),因此实验结果可以排除由于抑制细胞增殖而引发的后续反应。EG在体外可明显抑制MDA-MB-231细胞的侵袭、运动和黏附能力,可从多个环节抑制乳腺癌细胞的体外侵袭能力。
ECM降解是肿瘤侵袭的关键步骤,研究表明基质金属蛋白酶 (matrix metalloproteinases,MMP)-2、-9的表达对降解ECM起重要作用[5],有利于肿瘤细胞扩散到远处器官。MMPs的活性受到基因转录水平的调节,其基因转录水平与肿瘤侵袭转移直接相关[6]。本实验RT-PCR结果显示,EG可明显降低MDA-MB- 231细胞MMP-2 mRNA、MMP-9 mRNA水平,因此抑制细胞外基质的降解,阻止肿瘤细胞的侵袭,这可能是EG降低MDA-MB-231细胞侵袭能力的重要环节。
此外,乳腺癌的侵袭转移也受信号网络调节,诸多信号通路中磷脂肽肌醇3激酶/蛋白激酶B (PI3K/ Akt) 信号通路与参与乳腺癌细胞生长、侵袭、迁移等生物学行为[7],PI3K/Akt激活可使细胞骨架重排,调节细胞运动和细胞迁移,还可通过多种途径上调MMP-9活性[8],促进细胞侵袭。核转录因子 (NF-κB) 作为信号传导通路的中枢,是Akt重要的下游分子之一,其异常活化可促进肿瘤细胞的浸润和转移。p-Akt和NF-κB已成为抗肿瘤药物研究的主要靶分子[9, 10, 11]。本实验中探讨了EG对Akt-NF-κB信号通路中Akt、p-Akt和NF-κB蛋白表达的影响。结果显示,EG抑制p-Akt和NF-κB蛋白表达,而对总Akt表达无影响,认为EG抗乳腺癌的侵袭转移作用可能与抑制Akt- NF-κB通路密切相关。狼毒大戟活性成分EG可明显抑制乳腺癌体外侵袭能力,推测其可能降低乳腺癌患者的病死率和延长患者的生存期,其机制有待于进一步研究。
| [1] | Wang YB, Huang R, Wang HB, et al. Diterpenoids from the roots of Euphorbia fischeriana [J]. J Nat Prod, 2006, 69: 967-970. |
| [2] | Reis-Filho JS, Tutt AN. Triple negative tumours: a critical review [J]. Histopathology, 2008, 52: 108-118. |
| [3] | Chaffer CL, Weinberg RA. A perspective on cancer cell metastasis [J]. Science, 2011, 331: 1559-1564. |
| [4] | Adams LS, Phung S, Yee N, et al. Blueberry phytochemicals inhibit growth and metastatic potential of MDA-MB-231 breast cancer cells through modulation of the phosphatidy-linositol 3-kinase pathway [J]. Cancer Res, 2010, 70: 3594- 3605. |
| [5] | Park SY, Kim JH, Lee YJ, et al. Surfactin suppresses TPA-induced breast cancer cell invasion through the inhibition of MMP-9 expression [J]. Int J Oncol, 2013, 42: 287-296. |
| [6] | Kessenbrock K, Plaks V, Werb Z. Matrix metalloproteinases: regulators of the tumor microenvironment [J]. Cell, 2010, 141: 52-67. |
| [7] | Yamaguchi N, Ito T, Azuma S, et al. Constitutive activation of nuclear factor-κB is preferentially involved in the proliferation of basal-like subtype breast cancer cell lines [J]. Cancer Sci, 2009, 100: 1668-1674. |
| [8] | Kang H, Lee M, Choi KC, et al. N-(4-hydroxyphenyl)retinamide inhibits breast cancer cell invasion through suppressing NF-κB activation and inhibiting matrix metalloproteinase-9 expression [J]. J Cell Biochem, 2012, 113: 2845-2855. |
| [9] | Patel JB, Mehta J, Belosay A, et al. Novel retinoic acid metabolism blocking agents have potent inhibitory activities on human breast cancer cells and tumour growth [J]. Br J Cancer, 2007, 96: 1204-1215. |
| [10] | Zhao Y, Zhang D, Wang S, et al. Holothurian glycosami-noglycan inhibits metastasis and thrombosis via targeting of nuclear factor-κB/tissue factor/factor Xa pathway in melanoma B16F10 cells [J]. PLoS One, 2013, 8: e56557. |
| [11] | Mao YJ, Li HH, Li JF, et al. Singal transduction by protein tyrosine kinases and antitumor or agents [J]. Acta Pham Sin (药学学报), 2008, 43: 323-334. |
 2015, Vol. 50
2015, Vol. 50


