心室肥厚作为心源性猝死的一个独立危险因素,是原发性高血压常见的并发症之一。高血压患者中 约有1/3可发生左心室重构,主要表现为心肌细胞肥大、心肌间质细胞增生[1]。另一方面,使得心肌发生电重构,从而诱发恶性心律失常,导致猝死的发生率升高[2]。Huang等[3]研究提示,肥厚心肌瞬时外向钾电流 (transient outward potassium current,Ito) 降低,进而引起细胞内钙浓度明显升高,有助于恶性心律失常的发生。作者前期研究也发现,在兔心肌细胞肥大后Ito减少,可能是心肌肥大及诱发心律失常的潜在因素之一[4]。
大蒜素 (allitridum,All) 是大蒜中的主要生物活性物质,其在对心血管保护作用方面已有诸多研究,其可通过释放一氧化氮和刺激内皮细胞释放舒血管物质等发挥舒张血管效应[5, 6],大蒜素也抑制左室肥厚的发生发展[7]。但大蒜素是否在缓解高血压大鼠心室重构的同时,也减少电重构,降低心律失常的发生,尚未见报道。故本研究应用大蒜素干预自发性高血压大鼠 (spontaneously hypertensive rats,SHR),观察其对大鼠左室Ito重构的作用及可能的通道门控机制,以期探讨高血压心室电重构的防治新方法,降低高血压的靶器官损害及心源性猝死的发生。
材料与方法 实验动物与分组12周龄雄性SHR 30只及12周龄雄性Wistar Kyoto (WKY) 大鼠10只 (北京维通利华实验动物技术有限公司)。SHR大鼠又随机分3组,低剂量大蒜素组: All 7.5 mg·kg-1; 高剂量大蒜素组: All 15.0 mg·kg-1; 生理盐水组: 注射同等体积的0.9% 生理盐水。每组10只。腹腔注射,每天1次,连续8周。
溶液与试剂大蒜素注射液 (15 mg·mL-1,徐州莱恩药业有限公司,批号20130316); 胶原酶II、牛血清白蛋白、天门冬氨酸钾、丙酮酸钠、MgATP、HEPEs、CaCl2、CdCl2、BaCl2、4-氨基吡啶 (4-aminopyridine,4-AP)、dofeilite、tetrodotoxin (TTX) 均为Sigma公司产品; 乙二醇四乙酸 (EGTA) 购自Fluka Biochemika公司; 其他试剂均为分析纯。
Tyrode液 (mmol·L-1): NaCl 135、KCl 5.4、CaCl2 1.8、MgCl2 1.0、NaH2PO4 0.33、HEPES 10和glucose 10,pH值用NaOH调至7.3; 无钙Tyrode液和0.2 mmol·L-1 Ca2+ Tyrode液,分别为Tyrode液中不加CaCl2和加0.2 mmol·L-1 CaCl2。细胞保护液 (KB液,mmol·L-1): KOH 110、taurine 10、oxalic acid 10、glutamic acid 70、KCl 25、KH2PO4 10、EGTA 5、Hepe 5和glucose 10,用KOH调pH 7.4。细胞外液 (mmol·L-1): NaCl 140、MgCl2 5、CaCl2 0.5、HEPES 5和CdCl2 0.1,用NaOH调pH值至7.2。细胞内液 (mmol·L-1): KCl 45、K-aspartate 85、Na-pytuvate 5、MgATP 5.0、EGTA 10、HEPES 10和glucose 11,用KOH调pH值至7.4。于细胞外液加入BaCl2 200 μmol·L-1阻断IK1,加入dofeilite 5 nmol·L-1阻断IKr,CdCl2 100 μmol·L-1阻断ICa,L,TTX 100 μmol·L-1阻断INa。
心脏超声检查4组大鼠分别称体重,10% 水合氯醛 (3 mL·kg-1) 腹腔注射麻醉,前胸脱毛后用心脏超声仪 (SONO S5500,American Philips Co.) 11-3L探头经胸壁作心前区探查,测定左室舒张末期内径 (left ventricular end-diastolic dimension,LVEDd),于心脏短轴切面测量室间隔舒张期厚度 (inter-ventricular septal thickness,IVSDT) 和左心室后壁舒张期厚度 (left ventricular posterior wall thickness,LVPWT)。
心室肌细胞分离各组大鼠经腹腔注射20% 水合氯醛 (2 mL·kg-1) 麻醉,迅速取心脏,在37 ℃和通氧条件下进行Langendorff灌流。用无Ca2+ Tyrode’s液灌流3~5 min,含II型胶原酶30 mg、胰蛋白酶 5 mg的无Ca2+ Tyrode’s液灌流15~18 min以消化,剪碎入KB液中并吹打使细胞脱落,-4 ℃保存。取保存液加于1 mL灌流槽中,待细胞贴壁后,选边缘整齐、表面无颗粒、横纹清晰和无收缩的细胞,于37 ℃下进行实验。
膜片钳记录采用全细胞膜片钳记录方法,将Axon-700B膜片钳放大器同计算机连接。刺激信号 及电压输入信号的采集应用Digidata 1440A数模转换器,均由软件 (pCLAMP10.2) 控制。GG-17玻璃毛坯经pp-83微电极拉制仪 (Narishige Co. Japan) 拉 制成电阻为2.0~5.5 MΩ的电极。调节三维操纵器 使封接电阻达1 GΩ以上,吸破细胞膜形成全细胞记录模式。测定电容时,施以0.4 V·s-1的斜坡刺激,测电流并按方程Cm = I·[dV·dt-1]-1计算(Cm为膜电容,I为电流值,dV·dt-1即电压斜率)。为消除细胞间的误差,I值以电流密度 (pA·pF-1) 表示。信号经截止频率为1 kHz的四阶贝塞尔低通滤波器滤波,采样率为5 kHz。串联电阻补偿90%~95% 以消除电压偏差,液接电位补偿校正至小于2 mV,慢电容补偿约为85%~90%,以消除膜电容的充放电影响。
参数设置Ito电流-电压曲线 (I-V): 给予 -40 mV、20 ms的预刺激失活钠电流,施予300 ms,阶跃10 mV,-40 mV~+50 mV的去极化脉冲记录Ito,以各电压下的电流密度与电压作图。
Ito稳态激活曲线: 施予500 ms,阶跃为10 mV,-70 mV~+50 mV的去极化脉冲记录Ito。标准化各 电流并对电位作图,用Boltzmann方程I/Imax = 1/{1 + exp[(Vm-V1/2)/k]} 拟合求出半激活电压 (V1/2) 和曲线斜率 (k)。
Ito稳态失活曲线: 施予1 000 ms,阶跃为10 mV,-90 mV~+20 mV的去极化脉冲,在每一条件脉冲后紧跟固定的+50 mV,300 ms测试脉冲记录Ito,标准化各电流并对各膜电位作图,用Boltzmann方程进行曲线拟合求参数。
Ito失活后恢复曲线: 给予 +50 mV,300 ms的去极化脉冲,分别间隔40、80、160、320、640、1 280、2 560和5 120 ms后,施予 +50 mV,300 ms脉冲,将第2次脉冲引出的电流与条件电流相比,按单项指数式I = A·Exp(-t/τ) 求出恢复时间常数。
Ito关闭态失活时间常数: 给予 +50 mV,300 ms去极化脉冲,恢复至 -110 mV,再给予 -65 mV,5、10、25、50、100、200、400和800 ms不同时间使通道失活,在每个间隔给 +50 mV,300 ms的测试脉冲,单项指数式拟合。
蛋白表达检测取SHR和WKY各组大鼠心室肌组织标本250 mg,剪碎放入匀浆器中,加入预冷的蛋白裂解液1 mL,在冰上匀浆30 min,使通道蛋白充分裂解。将匀浆后的组织液倒入1.5 mL EP管中,煮沸5 min,10 000 r·min-1离心1 min,放于 -70 ℃冰箱。BCA法进行蛋白定量,SDS-PAGE电泳分离样品后电转移至聚偏二氟乙烯 (PVDF) 膜,4 ℃封闭过夜。加入1∶400兔抗鼠Kv4.2、Kv4.3抗体,4 ℃孵育过夜后加入二抗 (1∶1 000),37 ℃孵育1 h显色,采用凝胶成像分析系统测定各条带的吸光度值,以代表蛋白表达量。
数据处理数据以x± s表示,采用pCLAMP10.2处理,用spss13.0软件进行统计学分析,多组间数据比较用ANOVA方差分析,组间两两比较用SNK-q检验。以P < 0.05为显著差异。
结果 1 All对反映SHR左心室及心室肌细胞重构的各项指标的作用与WKY组比较,SHR组的LVEDd、IVSDT、LVPWT均明显增加 (P < 0.05),应用All后,上述指标有所恢复,且以高剂量组效果明显 (P < 0.05),但均未达到对照水平。对单个心室肌细胞电容测试,发现SHR组较WKY组显著,而All高、低剂量组可逆转这种改变,提示药物可以通过对单个细胞的影响减少心肌肥厚的产生,见表 1。
|
|
Table 1 Effect of allitridum (All) on heart indices. n = 10,x± s. WKY: Wistar-kyoto rats; SHR: Spontaneously hypertensive rats; LVEDd: Left ventricular end-diastolic dimension; IVSDT: Inter-ventricular septal thickness; LVPWT: Left ventricular posterior wall thickness; LVFS: Left ventricular fraction shortening; Cm: The membrane capacitance. P < 0.05,**P < 0.01 vs WKY group; #P < 0.05,##P < 0.01 vs SHR group |
与WKY组相比,SHR心室肌细胞的Ito明显降低 (n = 15)。应用All后Ito电流密度增加,且在高剂量组增加更明显 (n = 16),见图 1。
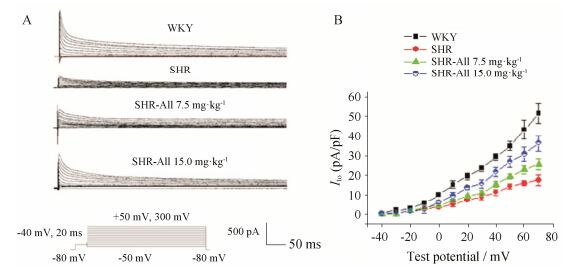
|
Figure 1 Effect of All on Ito in SHR ventricular myocytes. A: The effects of 7.5 mg·kg-1 (n = 15) and 15.0 mg·kg-1 (n = 16) of All on Ito are shown. B: I-V relationships of Ito demonstrate that current densities increased in a test potential dependent manner after exposure to All 7.0 and 15.0 mg·kg-1 over the test potential of +10 mV |
从图 1可见,WKY大鼠的Ito约在 -10 mV被激 活,并随着刺激脉冲向去极化移动,呈现出明显的外向整流特征。SHR的Ito与WKY组比较均有降低,尤其在 +10 mV以上,随着刺激电压的增加电流密度降低更加明显。应用All后,SHR的Ito在各电压下电流密度均增加,随电压增加该效应更大。
4 All对SHR心室肌细胞Ito稳态激活的作用无论是WKY组,还是SHR组及All给药组,Ito激活曲线变化不大,各组之间的半激活电压 (V1/2,act) 和激活曲线斜率 (kact) 均无显著差异,见图 2。
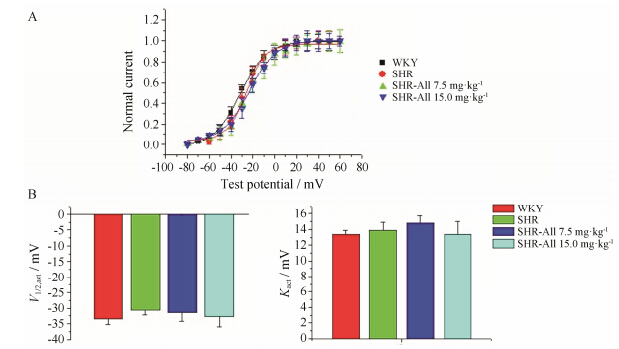
|
Figure 2 Effects of All on steady-state activity of Ito. A: Steady-state activity curve of Ito is markedly different before and after the application of All. B: Voltage-dependent variables for Ito activation are fitted to the Boltzmann equation and V1/2,act and kact are slightly different among four groups |
与WKY组相比,SHR心室肌细胞Ito的半失活电压 (V1/2,inact) 显著左移,提示在相同电压下刺激SHR的Ito更易失活,这可能是电流密度降低的主要原因。All使V1/2,inact向右移,且以15.0 mg·kg-1剂量使其移动明显,见图 3A。
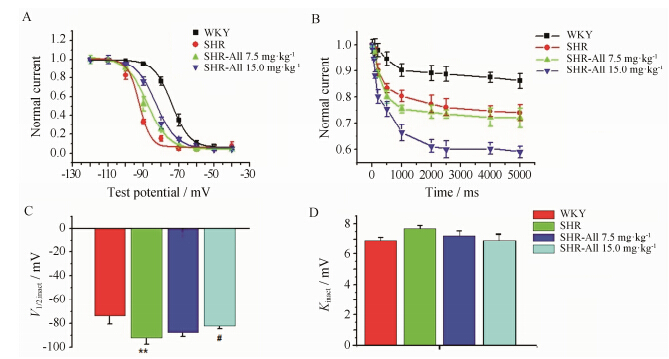
|
Figure 3 Effects of All on steady-state and closed-state inactivity of Ito. A: Steady-state inactivity curve of Ito in SHR group is shifted to more positive potentials by All. B: Closed-state time constants of Ito are prolonged by All. C: V1/2,inact of Ito from SHR is shifted to more negative potential from WKY. After exposure to All,V1/2,inact change of SHR is relieved. D: Kinact is slightly different among four groups. **P < 0.01 vs WKY group; #P < 0.05 vs SHR group |
WKY组细胞电流的关闭态失活较小,至5 000 ms时,还有约90.0% 通道开放,而SHR通道关闭态失活速率增加,关闭态时间常数明显缩短,至5 000 ms时仅有60.0% 通道开放 (n = 12),提示电流密度降低与此关系较密切,应用高、低剂量的All后,关闭态失活得到缓解,分别为75.1% 和72.3%,见图 3B。
6 All对SHR心室肌细胞Ito失活后恢复曲线的作用与WKY比较,SHR心室肌细胞Ito的失活后恢复显著减慢 (图 4),这与上述由于SHR大鼠Ito关闭态失活较大、待开放的通道储备降低一致。用All后这种改变得到缓解,提示药物可以通过改变通道失活后的恢复过程,增加电流。
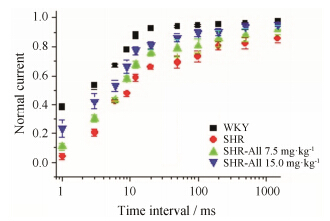
|
Figure 4 Effects of All on recovery from inactivation of Ito. Time constant of recovery from inactivation in SHR is shortened by All |
将SHR和WKY各组大鼠心室肌测得的Kv4.2和Kv4.3条带光密度值与内参β-Actin条带光密度值比较,所得的比值代表该标本中通道蛋白表达水平。图 5显示,无论是SHR还是WKY大鼠的Kv4.2和Kv4.3的蛋白表达均无变化,在应用All后,两种通道的蛋白表达也无明显改变。
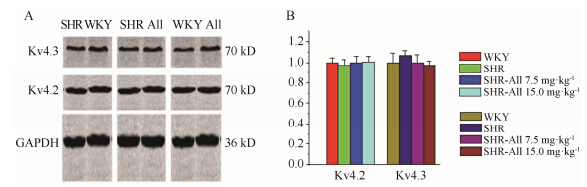
|
Figure 5 Effects of All on protein expression of Kv4.2 and Kv4.3. A: Western blotting results; B: Summary of statistical analysis of groups (n = 3) |
高血压造成的靶器官损伤越来越受到重视,而心肌肥厚是高血压致心肌损伤的重要标志,它包括心肌细胞肥大增生,心肌成纤维细胞合成胶原增多以及胶原堆积等[8, 9]。同时,随着心肌细胞结构的改变,也引起心脏电重构,如左室肥厚时由于心肌离子流的改变,使动作电位时程明显延长,引起恶性心律失常和心源性猝死[10, 11]。
本研究的主要发现是,SHR的Ito电流密度较WKY显著降低,而应用All治疗后,SHR大鼠的Ito重构得到很好的恢复,可能的机制来自两方面: 一方面由于长期应用药物可以使SHR大鼠心室肌肥厚得到逆转。研究显示,在长期高血压患者中有大部分患者存在心肌肥厚的现象,这是一种代偿过程,心肌肥厚导致心脏结构改变,并在此基础上引起细胞膜离子通道的电重构。作者研究发现,SHR组的LVEDd、IVSDT、LVPWT较WKY组均明显增加,说明高血压导致心室发生了重构,All可使上述指标变化减小,表明All可逆转SHR心室重构。进一步研究发现,All对单个心室肌细胞电容的改变有明显的逆转效应,提示药物可能通过对单个细胞的影响减少心肌肥厚的产生,使心室重构得到缓解,从而减少Ito的重构。另一方面,给予All后可以使重构的Ito稳态失活曲线右移,即在相同电压刺激下通道失活减慢。同时也可以使通道的关闭态失活减弱,在静息态电压下,有更多的通道储备,进而导致在失活后恢复的研究中显示,其恢复速率明显快于SHR大鼠,与WKY相近。正是由于这些原因,可以认为All减少SHR的Ito重构,减小心室肌细胞电容,从而逆转心室重构。在体研究发现,大蒜素可以抑制左室肥厚的发生发展,减弱心脏的病理性重构,并且抑制心肌肥厚标志物的表达[7]。
Ito是一种电压依赖性的外向性钾电流,它是心肌细胞复极早期的重要离子流之一。Lebeche等[12]报道Ito降低将引起动作电位时程延长,使肥厚的心肌细胞更易发生LVPWT,导致触发性室性心律失常。进一步过度表达编码心肌细胞瞬时外向钾通道的主要基因Kv4.3,能够逆转主动脉缩窄引起的大鼠左心室肥厚。本实验发现,Ito的两个主要组成蛋白Kv4.2和Kv4.3在SHR和WKY组心室肌上的表达没有显著性差异,这与上述报道不同,可能的原因是动物模型的种类不同,所形成离子通道重构的机制差异所致。当然,应用All对二者也无影响,说明药物对离子流的逆转与影响通道蛋白无关。
Huang等[3]研究发现,肥厚心肌Ito降低,引起肥厚心肌细胞内钙超载,也有助于恶性心律失常的发生。本研究的局限性在于未能对细胞内的钙离子进 行分析,故All是否经此途径发挥作用尚未知。然而,本结果可以提示,All从逆转心室重构及直接减少Ito电重构两个方面,改善心肌功能,减少心律失常的发生。这对防治高血压心室肥厚和筛选药物等方面的研究具有重要意义。
| [1] | Bajpai JK, Sahay AP, Agarwal AK, et al. Impact of prehypertension on left ventricular structure, function and geometry [J]. J Clin Diagn Res, 2014, 8: BC7-10. |
| [2] | Courand PY, Jenck S, Bricca G, et al. R wave in aVL lead: an outstanding ECG index in hypertension [J]. J Hypertens, 2014, 32: 1317-1325. |
| [3] | Huang ZB, Fang C, Lin MH, et al. Effect of fosinopril on the transient outward potassium current of hypertrophied left ventricular myocardium in the spontaneously hypertensive rat [J]. Naunyn Schmiedebergs Arch Pharmacol, 2014, 387: 419-425. |
| [4] | Xu XH, Sun HY, Zhang YH, et al. Allitridi inhibits multiple cardiac potassium channels expressed in HEK 293 cells [J]. PLoS One, 2012, 7: e51550. |
| [5] | Lin L, Nasjletti A. Role of endothelium derived prostanoid inangiotensin induced vasoconstriction [J]. Hypertension, 1991, 18: 158-164. |
| [6] | Sharifi AM, Darabi R, Akbarloo N. Investigation of antihypertensive mechanism of garlic in 2K1 chypertensive rat [J]. J Ethnopharm, 2003, 86: 219-224. |
| [7] | Sun XW, Ku DD. Allicinin garlic protects against coronary endothelial dysfunction and right heart hypertrophy inpulmonary hypertensive rats [J]. Am J Physiol Heart Circ Physiol, 2006, 291: H2431-H2438. |
| [8] | Radulescu D, Stoicescu L, Buzdugan E, et al. Patterns of left ventricular remodeling among patients with essential and secondary hypertension [J]. Rev Med Chil, 2013, 141: 1520- 1527. |
| [9] | Cerbai E, De Paoli P, Sartiani L, et al. Treatment with irbesartan counteracts the functional remodeling of ventricular myocytes from hypertensive rats [J]. J Cardiovasc Pharmacol, 2003, 41: 804-812. |
| [10] | Chouabe C, Ricci E, Kurdi M, et al. Evaluation of remodeling in left and right ventricular myocytes from heterozygous (mRen2) 27 transgenic rats [J]. Gen Physiol Biophys, 2009, 28: 24-38. |
| [11] | Okin PM, Bang CN, Wachtell K, et al. Relationship of sudden cardiac death to new-onset atrial fibrillation in hypertensive patients with left ventricular hypertrophy [J]. Circ Arrhythm Electrophysiol, 2013, 6: 243-251. |
| [12] | Lebeche D1, Kaprielian R, del Monte F, et al. In vivo cardiac gene transfer of Kv4.3 abrogates the hypertrophic response in rats after aortic stenosis [J]. Circulation, 2004, 110: 3435-3443. |
 2015, Vol. 50
2015, Vol. 50


