过氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptor γ,PPARγ) 是糖尿病口服药物噻唑烷二酮类 (thiazolidinediones,TZDs) 的功能受体,该类药物具有PPARγ反应原件 (PPARγ response element,PPRE) 介导的转录激活活性,称为PPARγ激动剂。其代表药罗格列酮 (rosiglitazone) 被认为是完全激动剂 (full agonists),而部分激动剂 (partial PPARγ agonist),如曲格列酮 (troglitazone),表现为PPRE转录激活活性弱于完全激动剂,且可浓度依赖性拮抗完全激动剂的转录激活活性,对PPARγ的结合构象和辅因子的募集与全激动剂不同[1]。相反,PPARγ受体拮抗剂,如GW9662,则无转录激活活性,且可浓度依赖性拮抗以罗格列酮为代表的PPARγ激动剂的活性[2]。近年发现完全激动剂,如罗格列酮,在临床应用中的副作用明显,如引起体重增加、钠水潴留[3]、可能导致心血管事件风险增加[4]以及骨质疏松[5, 6]的发生。目前对PPARγ靶点的药 物研发主要集中在寻找PPARγ部分激动剂或PPAR多激动剂,如PPARα/γ双激动剂、γ/δ双激动剂和PPARα/γ/δ泛激动剂。
以PPRE介导的转录激活活性的药物筛选方法,一直以来被广泛应用于筛选以TZDs药物为代表的PPARγ完全激动剂,但随着研究深入,一些转录激活活性远弱于罗格列酮的PPARγ激动剂被发现也可以达到TZDs药物的抗糖尿病作用,且不具有或减少TZDs药物的副作用,被认为是选择性PPARγ激动剂 (selective PPARγ agonist) 或PPARγ部分激动剂 (partial agonist),统称为PPARγ调节剂 (modulator)[7, 8]。目前对PPARγ调节剂的活性筛选,国内外报道主要采用转录激活活性及PPARγ配体结合活性的检测方法[9]。
近期研究发现,细胞周期蛋白依赖性激酶 (cyclin- dependent Kinase 5,cdk5) 可以使PPARγ蛋白273位丝氨酸位点磷酸化,与PPARγ调节糖脂代谢的功能失活有关。而通过抑制cdk5介导的PPARγ磷酸化 水平,可以激活PPARγ调节糖脂代谢的相关功能,且不会引起与PPARγ全激动剂的副作用[10],目前已有报道称发现某些化合物,如MRL24[11]、SR1664[12]和GQ-16[13]等,通过影响cdk5对PPARγ的磷酸化发挥降糖作用,同时未发现体重增加等副作用。以SR1664为代表的一类化合物,报道的PPARγ亲和 力与罗格列酮接近,而几乎无转录激活活性,被认为是一类非激动剂PPARγ配体 (non-agonist PPARγ ligand)。
本实验室一直致力于研发新型PPARγ调节剂,先后在细胞水平建立了PPRE转录激活活性筛选方法以及PPARγ配体结合区结合活性的筛选方法。虽然两种方法都基于转录激活的调控,但在细胞内分子作用原理上有区别,而且在具体的化合物筛选过程中,作者发现不同的化合物在两种活性评价方法中表现不同的作用特点。因此,本文拟从方法学角度,将细胞水平的PPRE转录激活和PPARγ结合活性评价方法,与分子水平的PPARγ配体结合评价方法综合运用,目的是发现一类无PPRE转录激活活性,但具有PPARγ结合活性以及亲和力的化合物,初步确认其体外降糖活性,可作为PPARγ调节剂先导物进一步研究。 材料与方法
药品及试剂
质粒载体pcDNA3.1、转染试剂lipofectamine 2000 (REF11668-019) (Invitrogen公司); 荧光素酶报告基因质粒Peak12 SxSyn-luci (中国医学科学院基础所蒋澄宇教授实验室赠送)。GAL4的DNA结合区 (Gal4DB) 表达质粒pGBKT7 (中国医学科学院药物所王伟教授实验室赠送)。克隆所需的胰化蛋白胨、酵母提取物和琼脂糖 (Oxoid公司); 高保真Taq酶、限制性内切酶、T4 DNA连接酶 (Takara公司,DR005A,D1162A,D1060A,D2011A等); 反转录试剂盒、质粒提取试剂盒,荧光素酶报告基因检测试剂盒 (北京威格拉斯生物技术公司,Cat#K011、Cat#N001、Cat#T003); 293E细胞和L02细胞购自美国模式培养物集存库 (American type culture collection,ATCC),由本实验室传代保存。分别用于培养293E细胞和L02细胞的DMEM高糖培养基和1640培养基 (Gibco); 2-NBDG和LanthaScreen TR-FRET PPAR gammar竞争性结合检测试剂盒 (Life Technologies公司,N13195和PV4894); 胎牛血清 (AusGeneX公司,CatNo FBS500-S); 细胞培养板及酶标板 (Corning公司); 测试药物或工具药罗格列酮、吡格列酮为江苏恒瑞医药股份有限公司生产的原料药; GW9662 (70785,Cayman公司); 筛选的苯磺酰胺衍生物由本所化学合成实验室提供。门冬胰岛素注射液 (诺和锐,600 μmol•L-1) 为诺和诺德公司生产。其他试剂均为国产或进口分析纯试剂。采用多功能酶标仪 (BioTek,Synergy 2) 检测荧光素酶学反应及2-NBDG荧光强度。 质粒构建
人PPARγ (Gene bank,NM_015869)、维甲酸X受体 (retinoid X receptor α,RXRα) (Gene bank,NM_002957) 全长片段以及PPARγ配体结合区 (ligand binding domain,LBD) 片段 (Ser204-Tyr505) 均通过反转录−多聚酶链式反应 (reverse transcriptase- polymerase chain reaction,RT-PCR) 分别从人肝细胞HepG2中获得,并克隆插入pcDNA3.1质粒载体,分别构建成pcDNA3.1-hPPARγ、pcDNA3.1-hRXRα。PPARγ的顺式反应原件 (PPARγ response element,PPRE),即序列5'-AAACTAGGTCA-3'以4拷贝插入Peak12 Sx Syn luci构建成为Peak12-4×PPRE-luci报告基因质粒。Gal4DB片段通过PCR反应从表达质粒pGBKT7上获得,并将其与PPARγ配体结合区 (hPPARγLBD) 片段串联插入pcDNA3.1质粒载体,构建出PPARγLBD-Gal4DB融合蛋白的表达质粒pcDNA3.1-hPPARγLBD-Gal4DB。Gal4的顺式反应原件(upstream activator sequence,UAS),即序列5'-CGG AAGACTCTCCTCCG-3'以6拷贝插入Peak12 Sx Syn luci构建成为Peak12-6×Gal4UAS-luci报告基因质粒。以上所有质粒经过测序验证成功后,进行质粒大量提取和纯化,可用于细胞转染实验。 293E细胞转染及报告基因表达水平的检测
293E细胞以3×105的细胞密度分至6孔板,培养24 h后,采用脂质体lipofectamine 2000按说明书推荐的方法处理待转染的质粒,在PPRE介导的转录激活的报告基因检测体系,将pcDNA3.1-hPPARγ、pcDNA3.1-hRXRα和Peak12-4×PPRE-luci按1∶1∶2的质量比,总质量为2 μg的DNA加入6孔板细胞培养基中,继续培养24 h。在PPARγ结合活性的报告基因检测体系,将pcDNA3.1-hPPARγLBD-Gal4DB与Peak12-6×Gal4UAS-luci按1∶1的质量比,总质量为2 μg的DNA加入6孔板细胞培养基中,继续培 养24 h。药物处理时,将转染24 h的细胞消化收集,按细胞数3×104分至96孔板,各待测药物或样品用DMSO配制,按所需浓度稀释到培养基中,阴性对照则加入相同体积比的DMSO,各待测药物每个浓度或阴性对照设3孔平行实验。药物作用24 h后,弃去培养基,裂解细胞,加入荧光素酶底物后,酶标仪化学发光法迅速检测细胞裂解液中的荧光素酶活性,获得酶反应的发光值 (Value)。该酶活性反映药物作用后细胞荧光素酶报告基因表达水平,即PPRE转录激活活性 (hPPARγ、hRXRα和PPRE-Luci体系) 和PPARγ结合活性体系 (hPPARγLBD-Gal4DB和Gal4- Luci体系)。计算测试化合物不同浓度下相比阴性对照的荧光素酶活性倍数 (fold of luciferase activity) = Value化合物/Value阴性对照。以完全激动剂罗格列酮的最大荧光素酶活性值为100%,计算其他测试化合物在不同浓度下的标准化荧光素酶活性百分比 (% normalized luciferase activity)。 PPARγ配体亲和力检测
检测方法根据试剂盒推荐的方法进行。5 nmol•L-1 GST-PPARG-LBD、5 nmol•L-1铽-GST抗体、5 nmol•L-1 Fluormone Pan- PPAR Green与不同浓度的检测化合物 (待测配体) 充分混合后,加入384孔荧光酶标板,总反应体系为18 μL。设无配体对照,即相同体积的溶媒DMSO。每个检测化合物在相同浓度下设置2个平行对照孔。当检测体系在384孔板中室温孵育2 h后,在PerKin Elmer ViewLux微孔板检测仪上检测TR-FRET信号,即检测340 nm激发波长和520 nm发射波长的荧光读数,在490 nm检测铽信号,通过计算测试化合物与无配体对照的520 nm/490 nm比值,获得待测化合物各浓度下的荧光强度。当化合物作为PPARγ的配体,将与Fluormone Pan-PPAR Green竞争性结合PPARγ,表现为荧光强度的降低。为显示待测化合物浓度依赖的PPARγ竞争性结合能力,将无配体对照的荧光强度设为100%,计算待测化合物在不同浓度下的标准化荧光强度百分比 (% normalized intensity)。 NBDG检测肝细胞葡萄糖摄取实验
2-NBDG为荧光标记的葡萄糖类似物,常规用于体外的葡萄糖摄取活性检测[14]。本实验采用正常人肝细胞系L02细胞,在96孔培养板中培养至细胞融合时,更换新鲜培养基,并分别加入待测化合物10 μmol•L-1继续培养24 h,阴性对照为DMSO。进行2-NBDG摄取检测前,细胞采用胆碱缓冲液 (含140 mmol•L-1氯化胆碱,5 mmol•L-1 KCl,2.5 mmol•L-1 CaCl2,1 mmol•L-1 MgSO4,1 mmol•L-1 KH2PO4,10 mmol•L-1 HEPES,调pH值至7.4) 饥饿3 h,然后将阴性对照和化合物孵育的细胞孔更换为含50 μmol•L-1 2-NBDG的胆碱缓冲液,同时设不含2-NBDG的胆碱缓冲液孵育的细胞孔为空白对照。为考察细胞在胰岛素刺激下的2-NBDG摄取能力,将阴性对照和化合物孵育的细胞分为胰岛素处理组和无胰岛素处理组,胰岛素处理组的所有细胞孔内分别加入100 nmol•L-1胰岛素。继续培养1 h后,弃去培养基,胆碱缓冲液洗3次后,采用裂解液 (含1% Nonidet P-40,1% sodium deoxychcholate,40 mmol•L-1 KCl,20 mmol•L-1 Tris,调pH值至7.4) 100 μL裂解细胞,酶标仪特定波长 (Ex = 485 nm,Em = 528 nm) 检测细胞裂解液内的2-NBDG荧光强度值 (Value),计算细胞在1 h内的2-NBDG摄取量 (ΔValue化合物/阴性对照 = Value化合物/阴性对照 − Value空白对照),评价化合物促进细胞摄取2-NBDG的能力 (Fold = ΔValue化合物/ ΔValue /阴性对照)。 数据分析及统计
所有实验数据均由GraphPad Prism6统计软件分析,计算均值及标准误 (Mean ± SEM),采用t检验统计显著性差异,浓度−活性曲线用四参数非线性拟合,得出药物的半数有效浓度EC50,半数抑制浓度IC50以及抑制常数Ki值 (根据试剂盒提供的计算公式Ki= [IC50] / (1 + [tracer] / KD),[tracer]在本反应体系中为20 nmol•L-1,KD为14 ± 4 nmol•L-1)。 结果 1 细胞水平的PPRE转录激活活性检测
以罗格列酮 (rosiglitazone) 为代表的PPARγ全激动剂,在293E细胞表达的PPRE转录激活报告基因模型上,可显示浓度依赖的激活作用,其EC50为22.79 nmol•L-1 (图 1A)。与罗格列酮相比,吡格列酮 (pioglitazone) 在该模型上可达到罗格列酮约70% 的激活效能,其EC50为1.012 μmol•L-1 (图 1B)。GW9662和ZLJ01未显示明显的浓度依赖性PPRE转录激活作用。目前认为该模型基于PPARγ转录复合物对PPRE的作用调控,可反映全激动剂、部分激动剂或非激动剂的差别,即达到或接近以罗格列酮为代表的全激动剂的最大效能,可认为是全激动剂; 部分激动剂的最大效能,一般为全激动剂的20%~60%[7, 11]; 非激动剂在该模型上不显示明显的激动活性[12]。从实验结果分析,初步判断ZLJ01不具有PPRE转录激活作用,其作用特征与PPARγ拮抗剂GW9662类似。
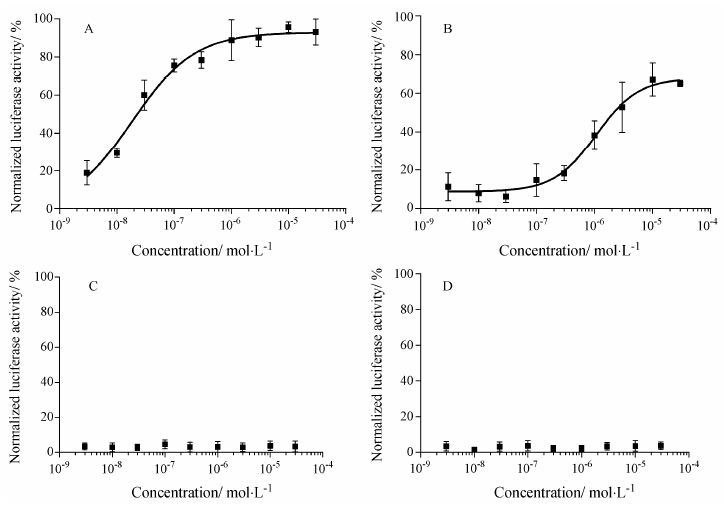
|
Figure 1 The cell-based transactivation assays by cotransfecting PPAR γ,RXRα and PPRE triggered luciferase reporter gene into 293E cells. A: Rosiglitazone; B: Pioglitazone; C: GW9662; D: ZLJ01. The concentrations of each drugs were from 10 nmol ·L-1 to 50 μmol·L-1,and luciferase activities at the indicated concentrations were normalized to the percentage of the maximum activity of rosiglitazone at the concentration of 10 μmol·L-1. Graphs were plotted from triplicate parallel experiments and shown as mean ± SEM |
由于293E细胞本身不存在Gal4调控的靶基因转录系统,该检测体系受内源性因素激活的影响较小。转染入细胞的外源性PPARγ受体基因仅表达了其配体结合区 (LBD),可反映化合物或药物对PPARγ与其转录辅因子之间结合程度和相互作用的影响。在 该模型上,罗格列酮显示很强的激活活性,其对荧光素酶报告基因的激活倍数可达到数十倍,EC50为1.6 μmol•L-1 (图 2A)。而吡格列酮,虽然PPRE转录激活活性可接近罗格列酮,但在结合活性检测模型上,效能仅为罗格列酮的5%,EC50为6.7 μmol•L-1 (图 2B)。GW9662则未显示明显的激活活性,在1 μmol•L-1时的激活活性为相同浓度下罗格列酮的8%,其最大效能仅为罗格列酮的0.6% (图 2C)。当GW9662不同浓度与1 μmol•L-1罗格列酮共同作用于细胞时,GW9662可浓度依赖地降低罗格列酮的激活作用,其IC50约为0.022 μmol•L-1 (图 2E),为较强的PPARγ拮抗剂。化合物ZLJ01可浓度依赖地结合并激活PPARγ,在10 μmol•L-1浓度时的激活活性可达到吡格列酮的最大活性,且EC50更小,为1.64 μmol•L-1 (图 2D)。当不同浓度的ZLJ01与1 μmol•L-1罗格列酮共同作用于细胞时,ZLJ01仅在高浓度时显示拮抗罗格列酮的激活作用,其IC50约为12.8 μmol•L-1,显示部分激动剂的特征 (图 2F)。
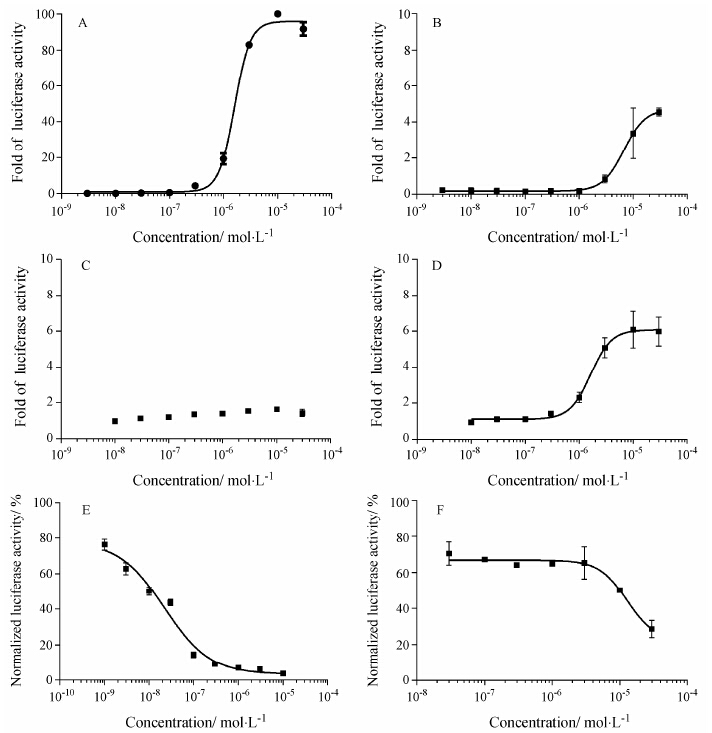
|
Figure 2 The cell-based transactivation assays by cotransfecting PPAR γ LBD-Gal4DB and Gal4UAS triggered luciferase reporter gene into 293E cells: A to D. The luciferase activity fold of rosiglitazone (A),pioglitazone (B),GW9662 (C) and ZLJ01 (D),the concentrations of each drugs were from 10 nmol·L-1 to 50 μmol·L-1. E and F: GW9662 (E) and ZLJ01 (D) in the presence of 1 μmol·L-1 rosiglitazone, the concentrations of each drugs were from 10 nmol·L-1 to 50 μmol·L-1,and luciferase activities at the indicated concentrations were normalized to the percentage of the maximum activity of rosiglitazone at the concentration of 1 μmol·L-1. Graphs were plotted from triplicate parallel experiments and shown as mean ± SEM |
在细胞水平的PPARγ结合活性检测模型上,不能反映化合物或药物对PPARγ的直接结合作用,即配体与蛋白分子的亲和力水平。通过基于TR-FRET技术的PPARγ受体竞争性结合实验,可考察化合物或药物是否是直接结合PPARγ的配体。罗格列酮在该模型上显示浓度依赖的竞争性结合能力,其IC50为106.0 nmol•L-1,Ki值为38.1 nmol•L-1 (图 3A)。吡格列酮与PPARγ的亲和力弱于罗格列酮,也呈浓度依赖的竞争性结合能力,但起效浓度较高,其IC50为 2 396.0 nmol•L-1,Ki值为860.1 nmol•L-1 (图 3B)。GW9662的IC50为9.9 nmol•L-1,Ki值为3.5 nmol•L-1 (图 3C)。化合物ZLJ01的IC50为2.3 nmol•L-1,Ki值为0.8 nmol•L-1 (图 3D)。
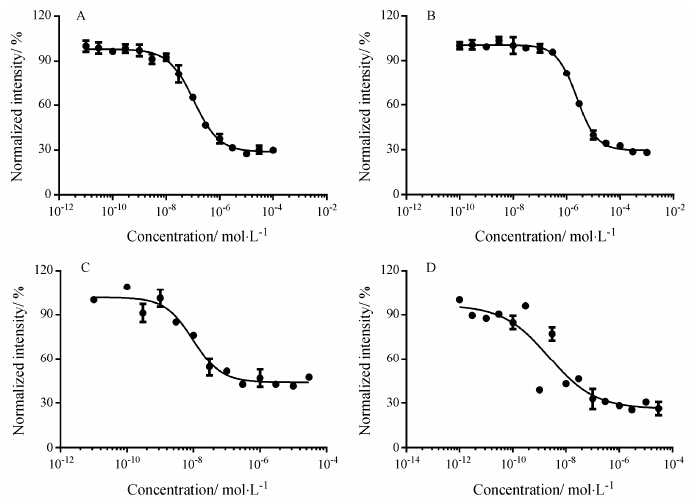
|
Figure 3 Lanthascreen PPARγ competitive binding assay to evaluate the affinity of compounds to PPARγ. A: Rosiglitazone; B: Pioglitazone; C: GW9662; D: ZLJ01. The concentrations of compounds were ranged from 1 pmol·L-1 to 1 mmol·L-1,and intensity at the indicated concentrations was normalized to the percentage of intensity of negative control (DMSO only). Graphs were plotted from duplicate parallel experiments and shown as mean ± SEM |
L02细胞在100 nmol•L-1胰岛素刺激下,1 h内2-NBDG增加至1.38倍,反映了肝细胞胰岛素依赖的促葡萄糖摄取作用。罗格列酮作用24 h后,使L02细胞2-NBDG摄取能力增加了0.44倍,而胰岛素刺激的2-NBDG摄取增加了0.75倍,表明罗格列酮具有胰岛素增敏作用,可增加胰岛素刺激的葡萄糖摄取量。ZLJ01对L02细胞无胰岛素刺激的2-NBDG摄取无明显影响,但可明显增加胰岛素刺激的2-NBDG摄取,表明ZLJ01具有类似罗格列酮的胰岛素增敏作用。在本实验条件下,无论细胞有无胰岛素刺激,PPARγ拮抗剂GW9662未显示明显的促2-NBDG摄取作用 (图 4)。
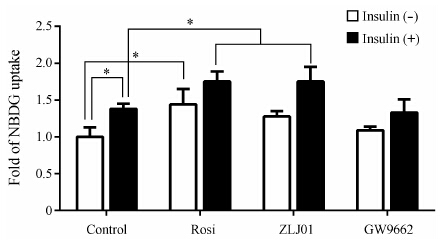
|
Figure 4 Fluorescent glucose analogue 2-NBDG uptake in L02 cells. After 24 hour-incubation with rosiglitaone (Rosi),ZLJ01 and GW9662,separately,NBDG uptake by L02 cells treated with or without 100 nmol·L-1 insulin was measured. Graphs were plotted in three parallel experiments and were shown as mean ± SEM,*P < 0.05 |
通过以上方法对化合物进行细胞水平的转录活性、结合活性及体外亲和力检测,发现一个无明显PPRE介导的转录激活活性而与PPARγ竞争性结合水平接近罗格列酮的PPARγ高亲和力配体ZLJ01。将进一步考察该类化合物的PPARγ激活活性及相关机制,评价该类化合物是否具有抗糖尿病药效学作用。 讨论
作者建立的细胞水平PPRE转录激活活性和PPARγ结合活性的检测方法,其分子生物学基础均是PPARγ受体形成转录复合物介导的靶基因调控转录,但在实际运用中应该有所区分。前者采用PPARγ全长序列以及二聚体蛋白RXRα共同调控的PPRE转录激活体系,除PPARγ配体诱导的构象改变激活该转录体系外,细胞的内源性核受体对PPRE的转录调控影响、细胞内辅助作用蛋白对PPARγ的DNA结合区的影响等可能影响该体系的活性表现。而后者采用PPARγ配体结合区与Gal4转录激活体系,293E细胞内本身不存在Gal4的转录调控模式,理论上受其他内源性核受体的影响较小,可考察PPARγ配体结合区的作用模式。但两种方法均不能鉴定化合物分子是否具有与PPARγ分子的直接结合作用,在化合物活性筛选的实践中,两种方法应互相补充和验证。
在本研究中,两个公认的PPARγ完全激动剂罗格列酮和吡格列酮,PPRE转录激活活性相当,但结合活性相差较大。化合物ZLJ01被发现几乎无PPRE转录激活活性,但在PPARγ结合活性的检测中,其 活性虽明显弱于罗格列酮,但与吡格列酮接近,并可在较大浓度时拮抗罗格列酮的部分活性。而公认的PPARγ拮抗剂GW9662几乎无PPRE转录激活活性和PPARγ结合活性,可浓度依赖地抑制罗格列酮的大部分活性。因此,在细胞水平的两种PPARγ活性筛选方法可区分不同的PPARγ配体的效能和作用特征。
基于TR-FRET技术的PPARγ配体亲和力检测,是目前公认和广泛采用的分子水平PPARγ配体结合活性评价方法。在本研究中,无论是完全激动剂罗格列酮和吡格列酮,还是拮抗剂GW9662,在PPARγ亲和力检测中均表现为浓度依赖性竞争结合PPARγ,均是PPARγ配体。而化合物ZLJ01,也证实是一个高亲和力的PPARγ配体。
以上3种方法,以罗格列酮为阳性对照计算Z因子均大于0.5,均可作为PPARγ活性筛选的高通量方法,可用于PPARγ活性化合物的筛选。但需要说明的是,不同结构的PPARγ调节剂在不同方法中显示差别和特征。在对化合物的PPARγ活性评价时,需考虑不同检测方法的实验原理或检测灵敏度、特异性存在差别,因而采用不同方法取得的结果在对化合物作用特点的描述也不同。
通过3种检测方法的综合评价,发现了一个PPRE转录激活作用较弱、甚至可认为不具有PPRE转录激活活性的化合物ZLJ01,但却具有细胞水平的PPARγ结合活性。该化合物为计算机辅助分子设计定向于PPARγ的新结构分子,目前认为其对PPARγ的作用类似SR1664,为非激动剂PPARγ配体。在初步的体外活性检测中,发现其能发挥类似罗格列酮的胰岛素增敏作用,增加肝细胞的葡萄糖摄取。在下一步的研究中,将探索该类化合物激活PPARγ的作用机制,如对PPARγ Ser273位点是否具有相互作用,是否选择性影响PPARγ调节的糖脂代谢途径,以期发现新型抗糖尿病候选药物。
| [1] | Camp HS, Li O, Wise SC, et al. Differential activation of peroxisome proliferator-activated receptor-γ by troglitazone and rosiglitazone [J]. Diabetes, 2000, 49: 539-547. |
| [2] | Leesnitzer LM, Parks DJ, Bledsoe RK, et al. Functional consequences of cysteine modification in the ligand binding sites of peroxisome proliferator activated receptors by GW9662 [J]. Biochemistry, 2002, 41: 6640-6650. |
| [3] | Guan YF, Hao CM, Cha DR, et al. Thiazolidinediones expand body fluid volume through PPARγ stimulation of ENaC-mediated renal salt absorption [J]. Nat Med, 2005, 11: 861-866. |
| [4] | Home PD, Pocock SJ, Beck-Nielsen H, et al. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open-label trial [J]. Lancet, 2009, 373: 2125- 2135. |
| [5] | Shockley KR, Lazarenko OP, Czernik PJ, et al. PPARγ 2 nuclear receptor controls multiple regulatory pathways of osteoblast differentiation from marrow mesenchymal stem cells [J]. J Cell Biochem, 2009, 106: 232-246. |
| [6] | Wei W, Wang XQ, Yang M, et al. PGC1β mediates PPARγ activation of osteoclastogenesis and rosiglitazone-induced bone loss [J]. Cell Metab, 2010, 11: 503-516. |
| [7] | Higgins LS, Mantzoros CS. The development of INT131 as a selective PPARγ modulator: approach to a safer insulin sensitizer [J]. PPAR Res, 2008, doi: 10.1155/2008/936906. |
| [8] | Fujimura T, Sakuma H, Konishi S, et al. FK614, a novel peroxisome proliferator-activated receptor γ modulator, induces differential transactivation through a unique ligand-specific interaction with transcriptional coactivators [J]. J Pharmacol Sci, 2005, 99: 342-352. |
| [9] | Yue LD, Ye F, Du Y, et al. Four screening methods of PPARγ agonists [J]. Chem Life (生命的化学), 2004, 24: 243-244. |
| [10] | Choi JH, Banks AS, Estall JL, et al. Obesity-linked phosphorylation of PPARγ by cdk5 is a direct target of the anti-diabetic PPARγ ligands [J]. Nature, 2010, 466: 451-456. |
| [11] | Acton JJ, 3rd, Black RM, Jones AB, et al. Benzoyl 2-methyl indoles as selective PPARγ modulators [J]. Bioorg Med Chem Lett, 2005, 15: 357-362. |
| [12] | Choi JH, Banks AS, Kamenecka TM, et al. Antidiabetic actions of a non-agonist PPARγ ligand blocking Cdk5-mediated phosphorylation [J]. Nature, 2011, 477: 477-481. |
| [13] | Amato AA, Rajagopalan S, Lin JZ, et al. GQ-16, a novel peroxisome proliferator-activated receptor γ (PPARγ) ligand, promotes insulin sensitization without weight gain [J]. J Biol Chem, 2012, 287: 28169-28179. |
| [14] | Huan Y, Li LY, Liu Q, et al. A cell-based fluorescent glucose transporter assay for SGLT2 inhibitor discovery [J]. Acta Pharm Sin B, 2013, 3: 97-101. |
 2014, Vol. 49
2014, Vol. 49


