2. 道地药材国家重点实验室培育基地, 中国中医科学院中药资源中心, 北京 100700
2. State Key Laboratory Breeding Base of Dao-di Herbs, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
萜类化合物是自然界中最大的家族之一,是由细胞质中的甲羟戊酸途径 (MVA) 和质体中甲基赤藓醇-4-磷酸途径 (MEP) 合成的[1,2,3]。羟甲基丁烯 基-4-磷酸合成酶 (HDS,又名1-hydroxy-2-methyl-2- (E)-butenyl-4-diphosphate synthase或GCPE或IspG,EC 1.17.4.3) 催化2-C-甲基赤藓醇-2,4-环焦磷酸 (2- C-methylerythritol 2,4-cyclodiphosphate,ME-cPP) 转化生成羟甲基丁烯基-4-磷酸 (hydroxymethylbutenyl 4-diphosphate,HMBPP),属于GCPE蛋白家族,定位在质体中。目前已经从番茄[1]、拟南芥[4]、长春花[5]、银杏[6]等植物中克隆出HDS基因并对其功能进行了研究,Altincicek等[7]、Campos等[8]在对大肠杆菌的HDS的功能研究中&l t;/ span>,发现HDS是大肠杆菌生长所必需的基因; Ginis等[9]对长春花HDS的功能研究发现,HDS主要在叶脉的维管束处表达,HDS的启动子可以与具有cis-元件的转录因子特异性的结合,进而调控萜类物质前体的合成; 同时对拟南芥突变体CSB3的研究也得出,在MEP代谢途径中HDS起控制代谢流的作用,而且还参与植物的防御机制[10]。丹参酮类化合物属于二萜醌类化合物,主要通过MEP途径合成,所以HDS在调控丹参酮类化合物合成中起着非常重要的作用。
白花丹参 (Salvia miltiorrhiza Bge.f.alba C.Y.Wu et H.W.Li) 为唇形科鼠尾草属植物,是紫花丹参的白花变型,研究证明,白花丹参与紫花丹参的化学成分基本相同,含有水溶性成分酚酸类和脂溶性成分丹参酮类,但白花丹参水溶性成分明显高于紫花丹参,约为紫花丹参的2倍。另外白花丹参中铁、锰、镁等5种微量元素也高于紫花丹参[11]。因此,白花丹参具有重要的医药和经济价值。
本研究以白花丹参为材料,通过RT-PCR的方 法从白花丹参根中获得SmHDS全长cDNA序列,并构建pET32a(+)-SmHDS重组质粒,转化到大肠杆菌BL21(DE3) 中进行诱导表达,对影响蛋白表达的4个关键因素: 即诱导温度、诱导时间、IPTG浓度和诱导时宿主菌的密度 (A600) 进行了优化,这为进一步研究1-羟基-2-甲基-2-(E)-丁烯基-4-二磷酸合酶在丹参酮类化合物生物合成途径中的作用提供了理论依据。 材料与方法
材料 白花丹参组培苗、原核表达载体pET32a(+) 为本实验室保存; Trizol试剂购自Invitrogen生物技 术有限公司; 分子质量标准DL10000购自TaKaRa公司; pEASY-Blunt Simple Cloning Kit、预染蛋白Marker购于北京全式金生物技术有限公司; 反转录试剂盒购自Fermentas公司; T4 DNA连接酶、Phusion超保真DNA聚合酶、限制性核酸内切酶购于NEB公司; 氨苄霉素、β-巯基乙醇、IPTG等化学试剂购于Sigma公司; 其他生化试剂均为国产分析纯; 引物合成由上海生工生物工程股份有限公司完成。
总RNA的提取、检测及cDNA的合成 称取 100 mg白花丹参组培苗的根,在液氮中研磨,利用Trizol试剂进行总RNA的提取,通过1% 琼脂糖电 泳检测RNA的质量。以白花丹参的总RNA为模板,oligo (dT) 为引物,反转录合成cDNA。
SmHDS基因的全长克隆 根据丹参转录组数 据库,用Primer Premier 5.0软件设计基因特异性引物。上游引物: 5'-CCTCTGAGTTGGCTTCACTATCT- 3',下游引物: 5'-CAAAATGATGATAAGGTAGCTGC TC-3',以反转录的cDNA为模板进行扩增。将回收的特异性扩增片段克隆到pEASY-Blunt Simple载体中,转化到大肠杆菌DH5α上,挑取阳性克隆进行测序分析。
将获得的序列在NCBI (http://www.ncbi.nlm.nih.gov/) 数据库中,通过Blast搜索蛋白质和核苷酸数据库进行序列比对和分析,使用ORF Finder (http:// www.ncbi.nlm.nih.gov/gorf/gorf.html) 查找开放阅读框 (ORF)。采用Interpro (http://www.ebi.ac.uk/Tools/ InterProScan/) 进行结构域比对,ExPASy在线服务器的Compute PI/Mw (http://web.expasy.org/compute pi/) 预测相对分子质量与理论等电点,TargetP 1.1 server (http://www.cbs.dtu.dk/services/TargetP/) 进行信号肽分析,Psort (http://psort.hgc.jp/) 和Wolfpsort (http:// wolfpsort.org/) 分析亚细胞定位,TRMHMMserver v2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0/) 进行跨膜域分析,predictprotein (http://www.predictprotein.org/) 进行二级结构预测,SWISS-MODEL (http://swissmodel.expasy.org/) 进行三维同源建模。用BioEdit软件进 行氨基酸序列多重比对,并参照NCBI数据库中已公布的不同物种 (表 1) 来源的HDS的氨基酸序列通过MEGA5.10软件构建系统进化树,Bootsrap重复次数为1 000次,进行聚类分析。
|
|
Table 1 The source of different species of HDS amino acid sequence |
原核表达载体的构建 对获得的序列进行分析,设计上游引物: 5'-ttttttgtcgacaaATGGCGACTGGAG CTGTTCCG-3' (小写字母划线处为SalⅠ酶切位点); 下游引物: 5'-ttttttttgcggccgcCTCCTCCACTGGTGG ATCCA-3' (小写字母划线处为NotⅠ酶切位点)。以pEASY-Blunt-SmHDS质粒为模板进行扩增,回收PCR产物,用SalⅠ和NotⅠ对带有酶切位点的PCR产物和表达载体pET32a(+) 分别进行双酶切,切胶回收目的片段与线性化pET32a(+) 载体片段,用T4DNA连接酶16 ℃连接过夜。将连接产物转化到DH5α感受态细胞上,在含氨苄霉素的LB培养板上 (终浓度为100 mg·L-1) 37 ℃培养过夜。挑取单克隆 进行菌液PCR检测,双酶切鉴定,测序。
重组质粒的原核表达及条件优化 将鉴定正确的重组质粒和表达载体pET32a(+) 分别转化到大肠杆菌BL21(DE3) 中,挑取重组菌的单菌落接种至含有氨苄霉素的LB液体培养基中,37 ℃培养过夜。然后按照1∶100比例稀释到含有氨苄霉素的LB液体培养基中,保持诱导时间6 h、IPTG浓度为0.4 mmol·L-1及A600为0.6不变,选择4个不同的温度 (20、25、30、37 ℃) 对诱导温度进行优化; 保持诱导温度30 ℃、IPTG浓度0.4 mmol·L-1及A600为0.6不变,选择4个时间点 (3、6、8、20 h) 对诱导时间进行优化; 保持诱导温度30 ℃、诱导时间6 h及A600为0.6不变,选择4个不同浓度的IPTG (0.2、0.4、0.8、1.0 mmol·L-1) 对IPTG浓度进行优化; 保持诱导温度30 ℃、诱导时间6 h及IPTG浓度0.4 mmol·L-1不变,选择诱导时宿主菌的密度 (A600) 值(0.2、0.4、0.6、0.8 、1.0) 对A600进行优化,分别考察4个因素对蛋白表达的影响。表达后将菌液5 000 r·min-1离心10 min,收集菌体,弃上清液后,加500 µL双蒸水,5 000 r·min-1离心10 min,收集菌体,弃上清液后,每管加入80 µL双蒸水、 20 µL 5×SDS加样缓冲液悬浮菌体,95 ℃水浴5 min,冰浴2~3 min,10 000 r·min-1离心5 min取上清液,用10% 的SDS-PAGE进行分析。电泳完毕后用考马斯亮蓝R250染色2 h,然后脱色至条带清 晰,扫描图片并保存。 结果与分析 1 目的基因的克隆与生物信息学分析
通过已知的丹参转录组数据库中HDS基因核 心序列设计特异性引物,扩增出大约2 500 bp左右的条带 (图 1),与期望大小一致。切胶回收该片段,将其与pEASY-Blunt载体连接,挑取单克隆,进行菌液PCR后,阳性克隆送至华大基因公司测序。
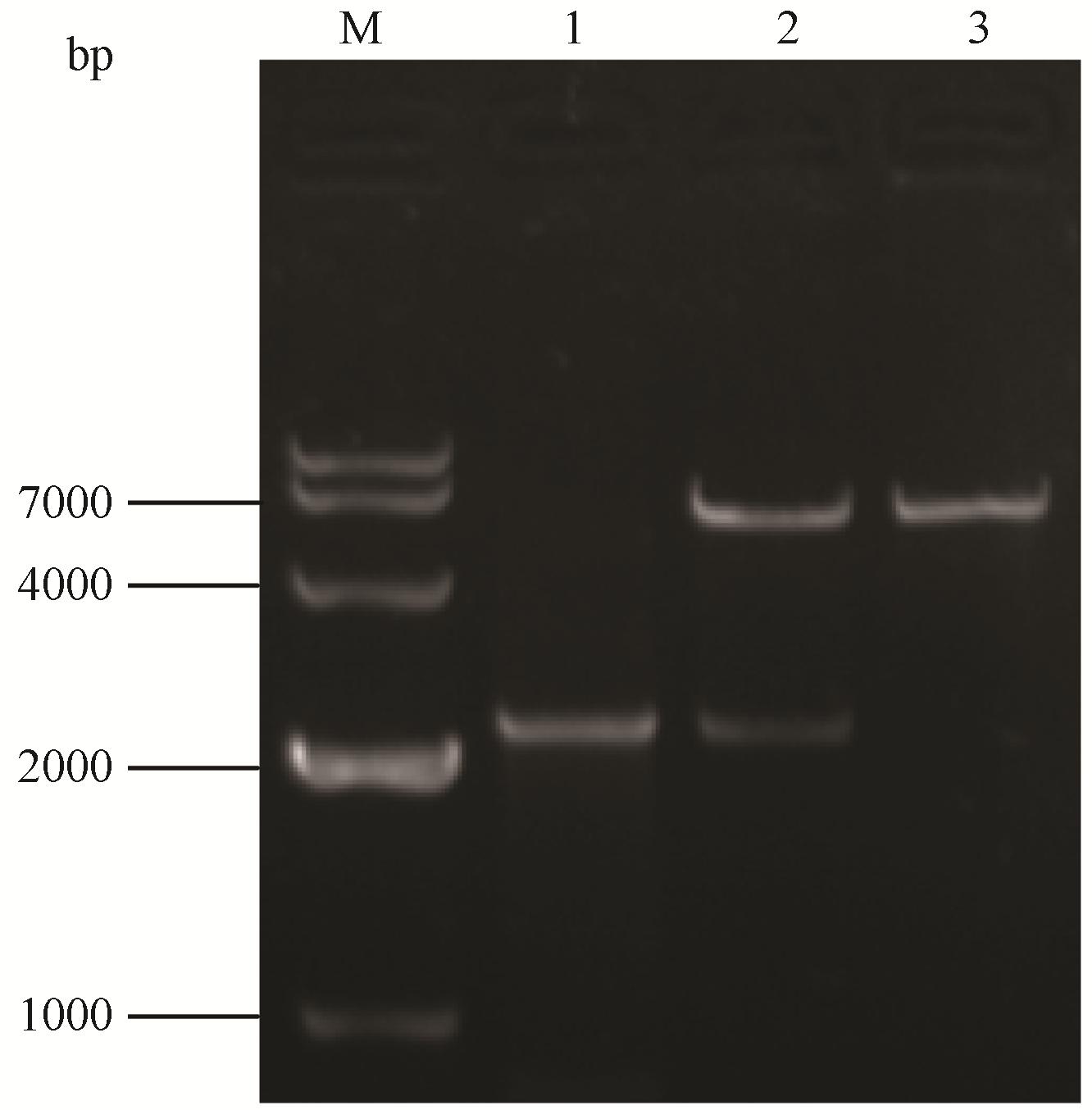 |
Figure 1 Agarose gel electrophoresis of pET32a(+)-SmHDS and pET32a(+) by SalⅠ and NotⅠ digestion. M: DL10000 DNA marker; 1: SmHDS; 2: pET32a(+)-SmHDS by SalⅠ and NotⅠ digestion; 3: pET32a(+) by SalⅠ and NotⅠ digestion |
利用SeqMan软件对获得的序列进行拼接,得到全长为2 529 bp的cDNA序列,通过ORF finder寻找该基因的开放阅读框,结果显示在171~2 399 bp处包含一个2 229 bp的ORF框,包含170 bp的5' 非翻译区和130 bp的3' 非翻译区,推断其编码742个 氨基酸。将此基因的ORF序列通过Blast在线比较,结果显示该序列与紫花丹参、库洛胡黄连的HDS核酸序列相似性分别为99.73% 和84.78%,氨基酸序列相似性分别为99.87% 和90.78%。因此可推断获得的cDNA序列编码的应为一个HDS蛋白,将该基因命名为SmHDS,Genbank注册号为KJ746807。 2 理化性质与3D结构预测
利用DNAMAN软件对SmHDS氨基酸序列的分析表明,其蛋白质分子质量为82.4 kDa,等电点 (pI)为6.24,表明该蛋白为酸性蛋白。包括104个酸性氨基酸 (D,E)、93个碱性氨基酸 (K,R)、251个疏水氨基酸 (A,I,L,F,W,V) 及156个极性氨基酸 (N,C,Q,S,T,Y)。亚细胞定位结果表明定位于叶绿体。信号肽分析表明为非分泌蛋白,无信号肽,跨膜域分析为非膜蛋白。
SmHDS二级结构分析结果表明,该蛋白的二级结构中37.32% 为α-螺旋结构 (helix)、20% 为β-折叠结构 (sheet)、42.68% 为反转结构 (loop),说明反转结构是SmHDS蛋白质二级结构的骨架。利用SWISS- MODEL进行三维结果预测发现,SmHDS预测编码蛋白质二级结构与三级结构预测结果相符合(图 2),该模型以炭疽杆菌 (Bacillus anthracis) 4mwa.2.D蛋白为模板,序列同源性为45.53%,用于建立该模型的氨基酸残基范围为84~362位。
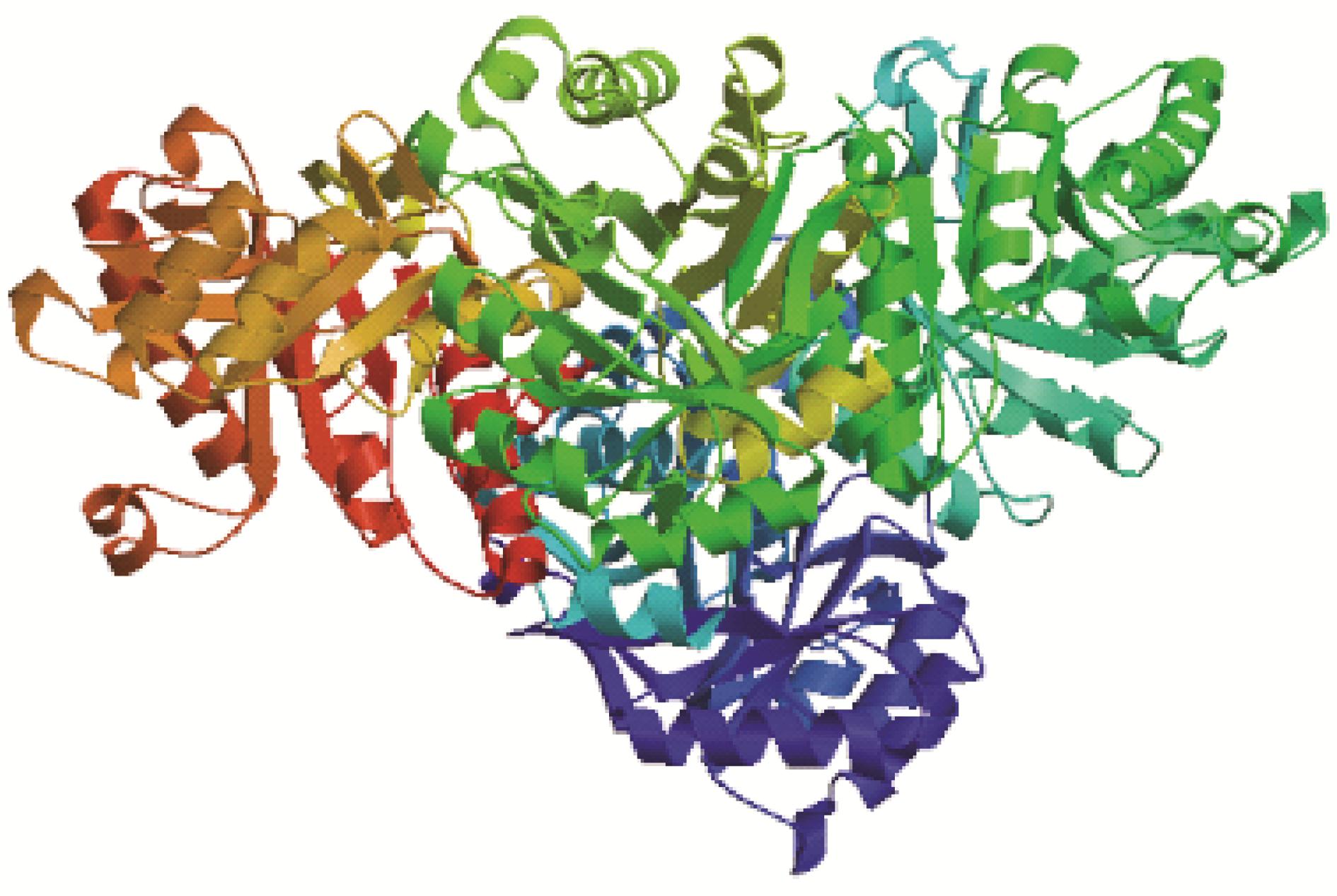 |
Figure 2 The predicted protein tertiary structure of SmHDS |
白花丹参HDS与GenBank中的19种植物的19种蛋白进行比对分析,在软件MEGA5.1平台上采用相邻连接法构建进化树,进行聚类分析。如图 3所示,白花丹参HDS与紫花丹参HDS聚为一支,其次与库洛胡黄连的关系较近,与植物类聚为一大支,与苔藓和绿藻关系最远。
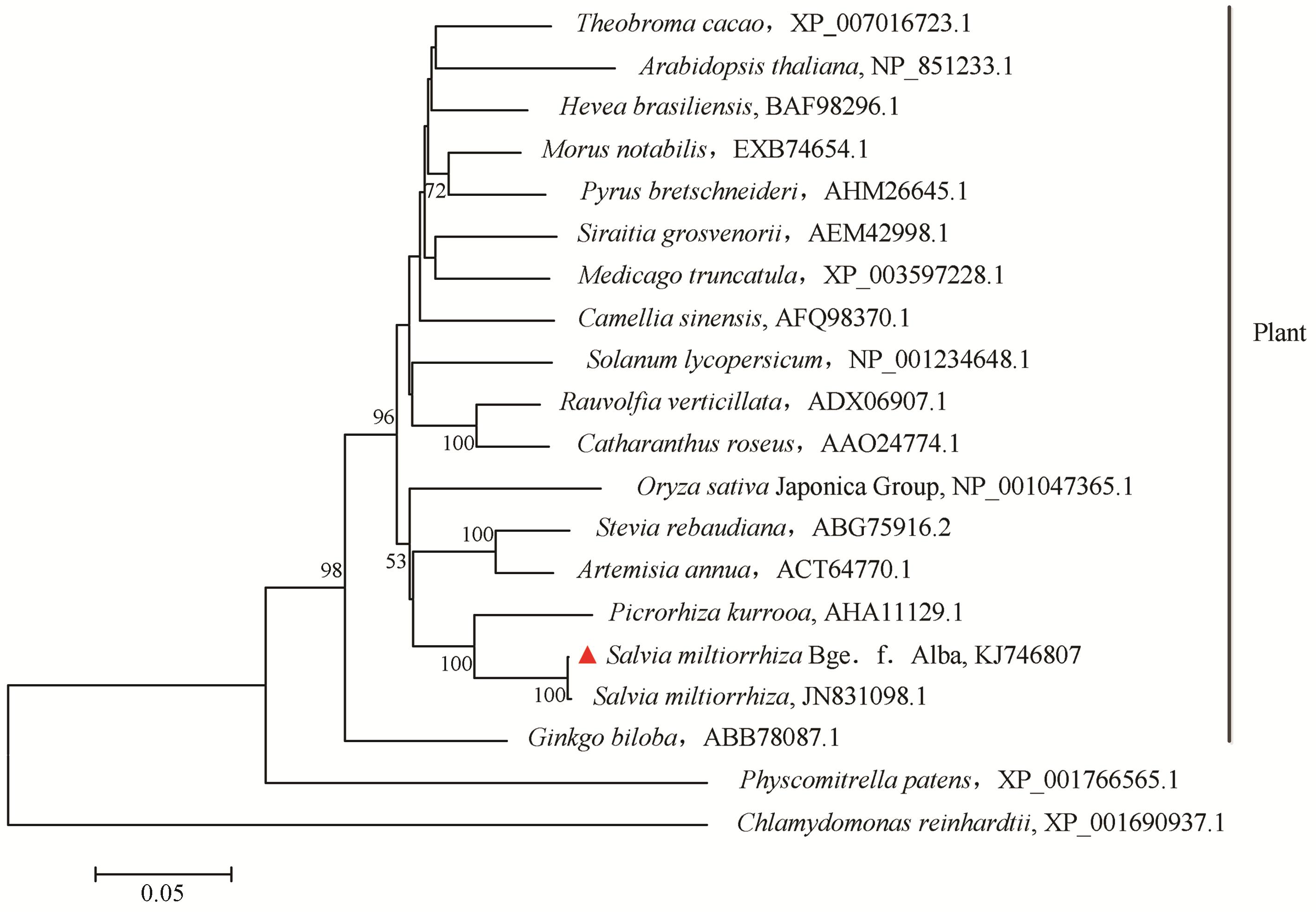 |
Figure 3 Phylogenetic tree of SmHDS and their related sequences (value for condensed tree ≥50 %) |
用SalⅠ和NotⅠ双酶切SmHDS基因片段,将该片段插入到经SalⅠ和NotⅠ酶切处理的pET32a(+) 载体上,命名为pET32a(+)-SmHDS; 将其转化至大肠杆菌BL21 (DE3) 中,挑取单克隆若干进行菌液PCR检测,双酶切鉴定有2 229 bp的目标基因片段 (图 1); 重组质粒经再次测序表明,与所克隆的HDS基因ORF序列完全一致,未发生移码突变。 5 pET32a(+)-SmHDS原核表达条件的优化
5.1 诱导温度对pET32a(+)-SmHDS
表达条件的影响 保持诱导时间6 h、IPTG浓度为0.4 mmol·L-1及A600为0.6不变,选择4个不同的温度 (20、25、30、37 ℃),得出温度对pET32a(+)-SmHDS的表达影响较明显,在20~37 ℃均能够进行重组蛋白的表达,但在20 ℃时蛋白的表达量比较少,而37 ℃时蛋白表达量虽然有所增加,但和30 ℃表达量相比却有所降低 (图 4)。表明该蛋白表达的最合适的温度为30 ℃。
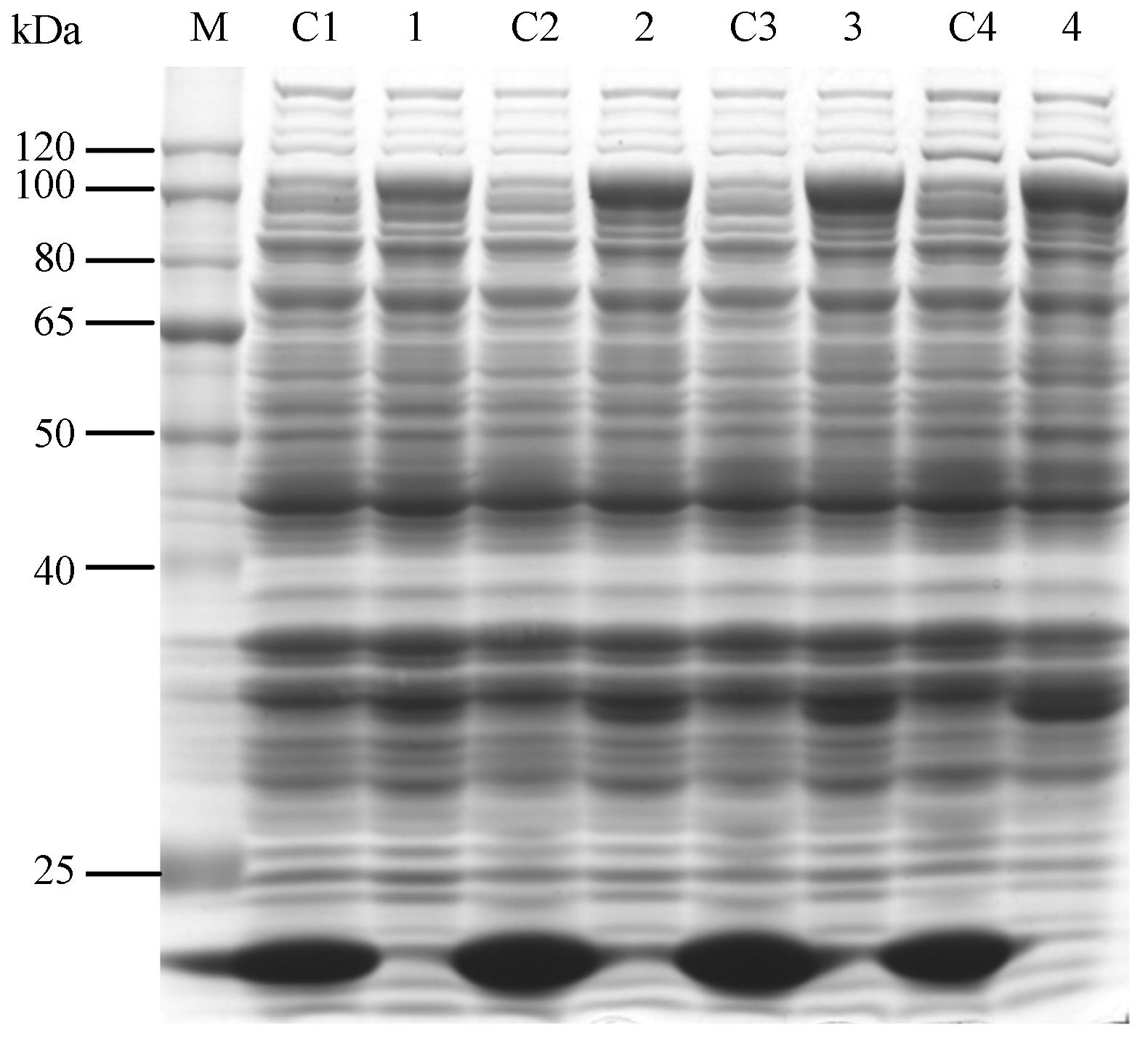 |
Figure 4 SDS-PAGE of analysis for pET32a(+)-SmHDS in different temperatures. M: Protein marker; C1-C4: pET32a(+) at 20 ℃,25 ℃,30 ℃ and 37 ℃,respectively; 1-4: pET32a(+)- SmHDS at 20 ℃,25 ℃,30 ℃ and 37 ℃,respectively |
表达条件的影响 保持诱导温度30 ℃、IPTG浓度0.4 mmol·L-1及A600为0.6不变,研究诱导时间对pET32a(+)-SmHDS表达的影响,选择4个时间点 (3、6、8、20 h) 进行诱导表达,得出随着诱导时间的延长,蛋白表达量也不断增加,在诱导20 h时蛋白表达量最高 (图 5),说明诱导时间的延长有利于目的蛋白的表达。
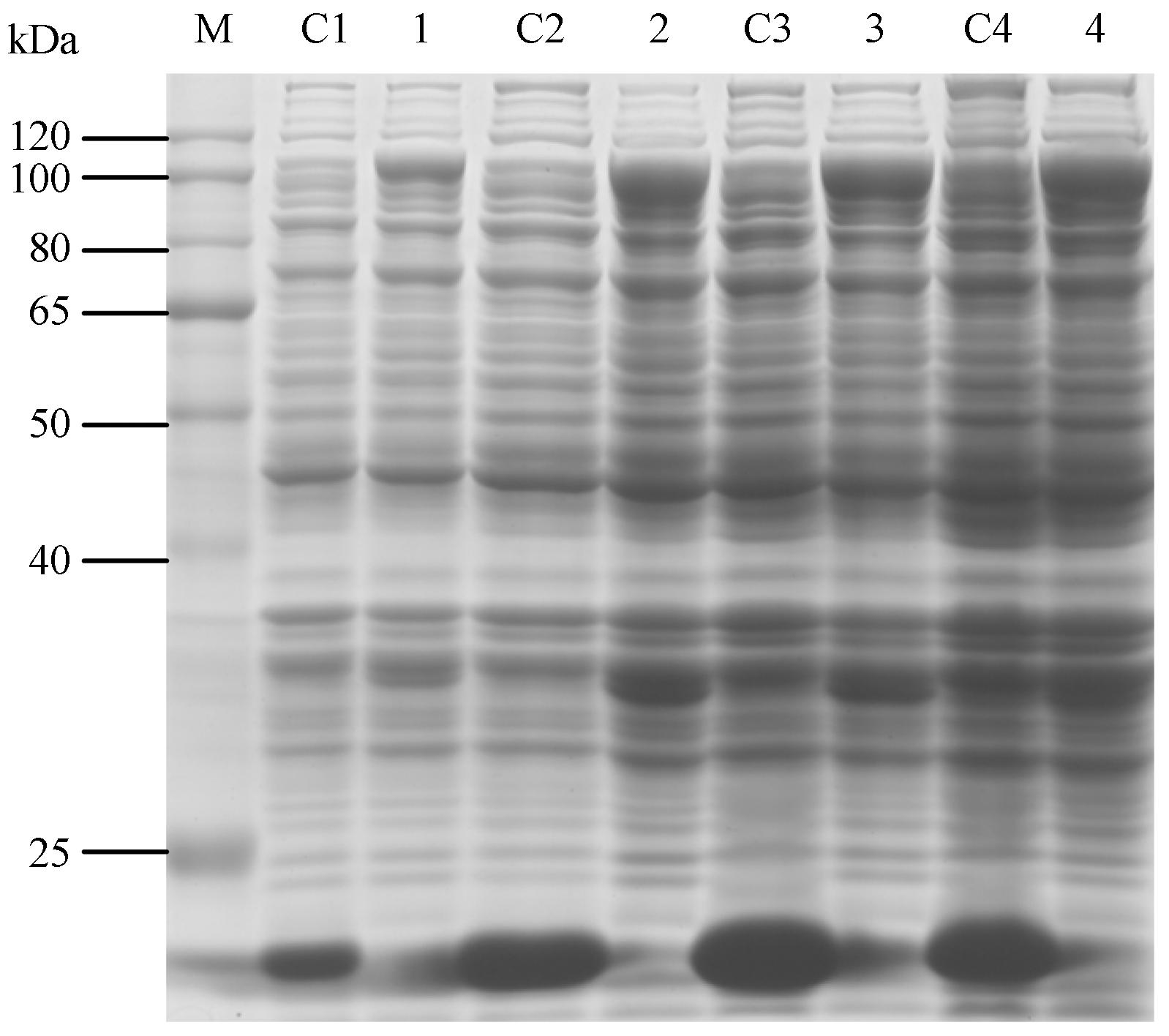 |
Figure 5 SDS-PAGE of analysis for pET32a(+)-SmHDS in different induction time. M: Protein marker; C1-C4: pET32a(+) with induction 3,6,8,20 h,respectively; 1-4: pET32a(+)- SmHDS with induction 3,6,8,20 h,respectively |
保持诱导温度30 ℃、诱导时间6 h及A600 为0.6不变,选择4个不同浓度的IPTG (0.2、0.4、 0.8、1.0 mmol·L-1) 进行诱导表达,得出随着IPTG 浓度的增加,蛋白表达量却降低,当IPTG浓度在 0.2 mmol·L-1时蛋白表达量最高,说明高浓度的 IPTG不能增加蛋白的表达,低浓度的IPTG浓度反 而有利于SmHDS表达 (图 6)。
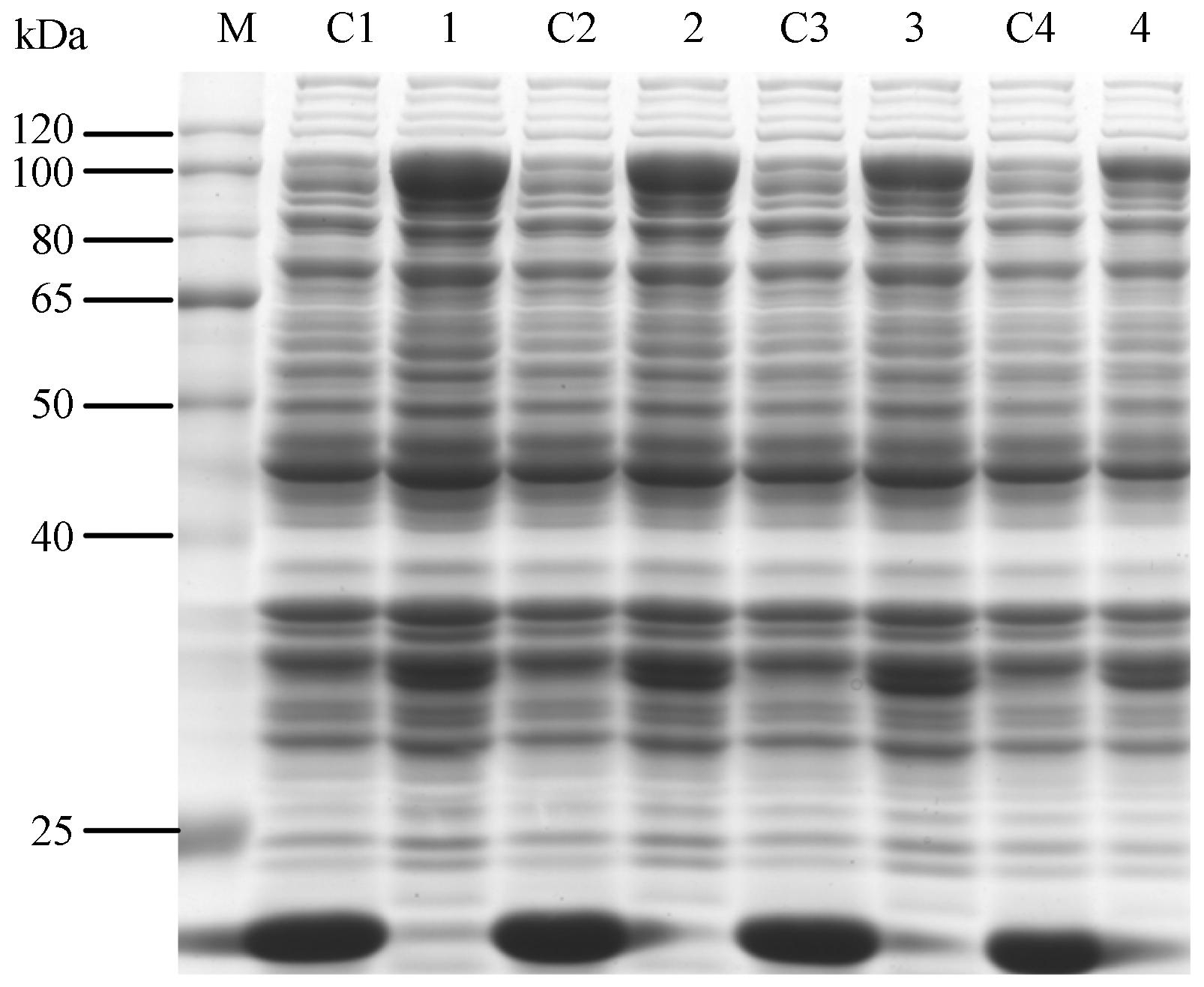 |
Figure 6 SDS-PAGE of analysis for pET32a(+)-SmHDS in different IPTG induction concentrations. M: Protein marker; C1-C4: pET32a(+) induced in 0.2,0.4,0.8 and 1.0 mmol·L-1 IPTG,respectively; 1-4: pET32a(+)-SmHDS induced in 0.2,0.4,0.8 and 1.0 mmol·L-1 IPTG,respectively |
保持诱导温度30 ℃、诱导时间6 h及IPTG浓度0.4 mmol·L-1不变,选择诱导时宿主菌的密度 (A600) 值(0.2、0.4、0.6、0.8、1.0) 进行诱导表达,得出宿主菌的密度对蛋白表达量影响不明显,A600为0.6时效果较好 (图 7)。
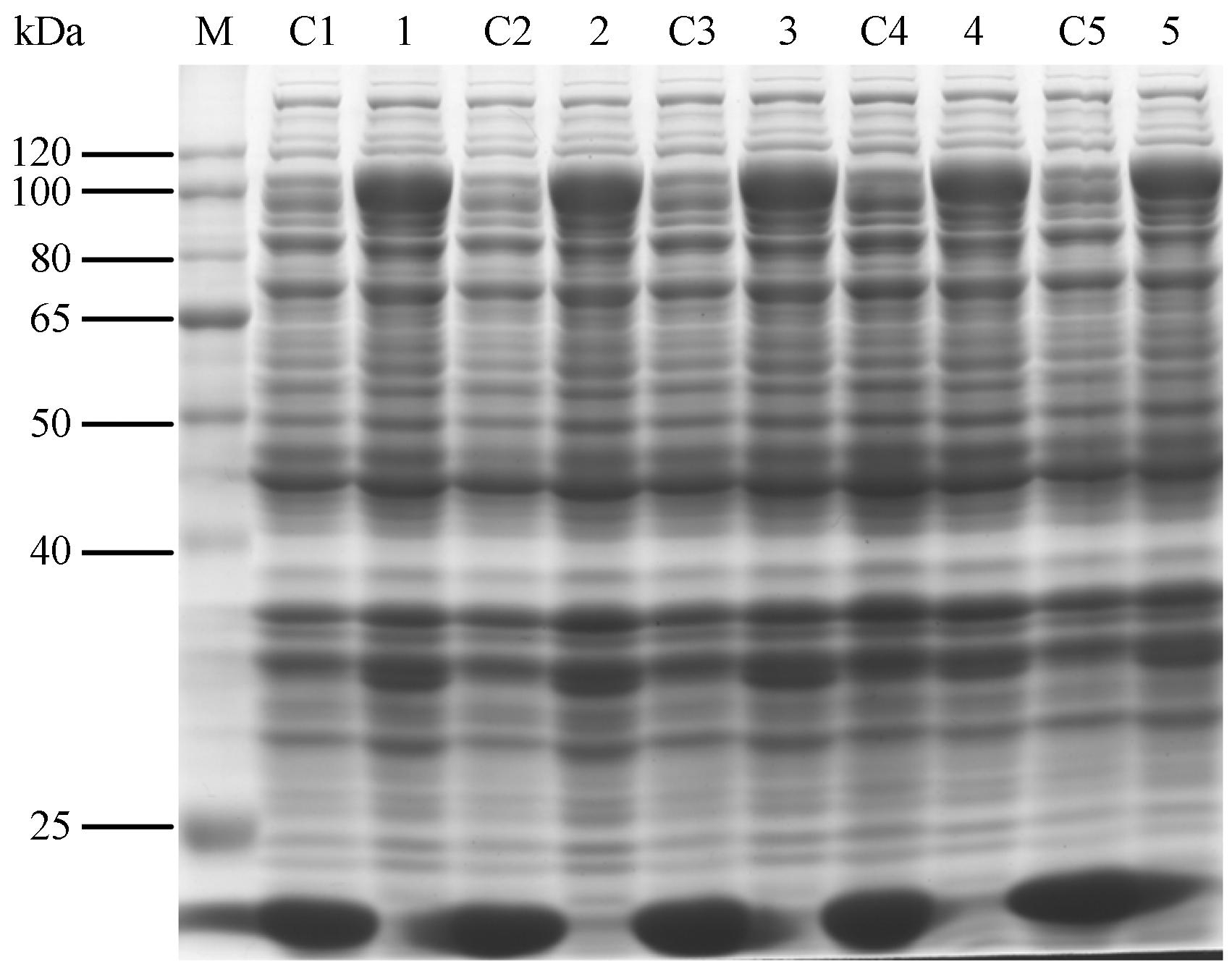 |
Figure 7 SDS-PAGE of analysis for pET32a(+)-SmHDS in different culture densities before IPTG induction. M: Protein marker; C1-C5: pET32a(+) induced in 0.2,0.4,0.6,0.8 and 1.0 A600,respectively; 1-5: pET32a(+)-SmHDS induced in 0.2,0.4,0.6,0.8 and 1.0 A600,respectively |
综上所述,本研究通过RT-PCR从白花丹参根中获得SmHDS全长cDNA序列,长度为2 529 bp,包 含一个2 229 bp的ORF框,包含170 bp的5' 非翻 译区和130 bp的3' 非翻译区 ,推断其编码742个氨 基酸,与紫花丹参HDS的序列相似性最高。同时构建pET32a(+)-SmHDS重组质粒,转化到大肠杆菌BL21(DE3) 中进行诱导表达,对影响蛋白表达的4个关键因素: 即诱导温度、诱导时间、IPTG浓度和诱导时宿主菌的密度 (A600) 进行了优化,最佳表达体系为: 诱导温度30 ℃; 诱导时宿主菌的密度 (A600) 为0.6; IPTG终浓度0.2 mmol·L-1; 诱导时间20 h。这为进一步研究HDS的催化功能提供了理论依据。 讨论
丹参对治疗心脑血管疾病、抗氧化和肝损伤保 护[12]都有显著疗效,其药理活性成分基本清楚,作为最常用的中药之一。此外由于丹参基因组小、染色体数目少、组织培养和转基因技术成熟、时代周期短、生命力强的特点,已成为中药研究的理想药用模式植物,为国际传统药物学研究提供模式平台[13,14]。
本实验分别构建了pET32a(+)-SmHDS和pET28a (+)-SmHDS重组质粒,但是在后期的诱导表达中,发现pET32a(+)-SmHDS表达出的蛋白量较高,而pET32a(+) 属于带有N-端硫氧还蛋白 (trxA·Tag) 编码序列融合表达载体,在E.coli中以不溶形式存在 的蛋白,当和trxA·Tag序列融合后,可增加表达蛋白的溶解性[15]; 此外,表达宿主菌BL21(DE3) 可以增加存在于细胞质中蛋白质的二硫键的形成,使得蛋白的可溶性更好[16]。大肠杆菌是常用的融合蛋白质表达系统之一,影响融合蛋白表达的因素是多方面的,除了合理的选择酶切位点、表达载体、宿主菌、试剂外,还可以通过改变培养条件来提高蛋白表达量,如改变诱导温度[17]、诱导时间[18]、IPTG浓度[19]和诱导时宿主菌的密度[20] (A600) 等。诱导温度对白花丹参SmHDS重组蛋白表达量有明显影响,在20 ℃ 时蛋白的表达量最少,不利于蛋白表达,37 ℃时蛋白表达量虽然有所增加,但和30 ℃表达量相比却有所降低,37 ℃培养可能会使一些蛋白积累形成包涵体,30 ℃培养会形成可溶的、有活性的蛋白[21]。随着诱
导时间的延长,白花丹参SmHDS的表达量也随之增加,3 h时蛋白表达量过低,6 h与8 h时蛋白表达量 没有明显区别,为了加快实验的周期性,可以选择6 h作为诱导时间。IPTG浓度在0.2~1.0 mmol·L-1对表达量影响明显,随着IPTG浓度的增加,蛋白表达量却随着减少,IPTG浓度在0.2 mmol·L-1时蛋白表达量最高,原核生物的转录和翻译是同时进行的,由于较低的IPTG浓度使局部的表达蛋白浓度不会太高,缓慢转录使得翻译的蛋白有条件正确的折叠,因而能得到较多的可溶性蛋白。
本研究通过RT-PCR技术扩增了白花丹参的HDS,并在大肠杆菌中得到了成功的表达,进行了表达体系的优化,在诱导温度30 ℃、诱导时宿主菌的密度 (A600) 为0.6、IPTG终浓度0.2 mmol·L-1、诱 导20 h中SmHDS能够得到很好地表达。然而,对于SmHDS催化功能以及对丹参酮类成分生物合成调控机制,还有待于下一步的深入研究。
| [1] | Rodríguez-Concepción M, Querol J, Lois LM, et al. Bioinformatic and molecular analysis of hydroxymethylbutenyl diphosphate synthase(GCPE)gene expression during carotenoid accumulation in ripening tomato fruit [J]. Planta, 2003, 217: 476-482. |
| [2] | Liao ZH, Chen M, Gong YF, et al. A new geranylgeranyl diphosphate synthase gene form Ginkgo biloba, which intermediates the biosynthesis of the key precursor for ginkgolides [J]. DNA Seq, 2004, 15: 153-158. |
| [3] | Chappell J. Biochemistry and molecular biology of the isoprenoid biosynthetic pathway in plants [J]. Ann Rev Plant Physiol Plant Mol Biol, 1995, 46: 521-547. |
| [4] | Querol J, Campos N, Imperial S, et al. Functional analysis of the Arabidopsis thaliana GCPE protein involved in plastid isoprenoid biosynthesis [J]. FEBS Lett, 2002, 514: 343- 346. |
| [5] | Oudin A, Mahroug S, Courdavault V, et al. Spatial distribution and hormonal regulation of gene products from methyl erythritol phosphate and monoterpene-secoiridoid pathways in Catharanthus roseus [J]. Plant Mol Biol, 2007, 65: 13-30. |
| [6] | Kim SM, Kim SU. Characterization of 1-hydroxy-2-methyl- 2-(E)-butenyl-4-diphosphate synthase(HDS)gene from Ginkgo biloba [J]. Mol Biol Reports, 2010, 37: 973-979. |
| [7] | Altincicek B, Kollas AK, Sanderbrand S, et al. GcpE is involved in the 2-C-methyl-D-erythritol 4-phosphate pathway of isoprenoid biosynthesis in Escherichia coli [J]. J Bacteriol, 2001, 183: 2411-2416. |
| [8] | Campos N, Rodriguez-Concepcion M, Seemann M, et al. Identification of gcpE as a novel gene of the 2-C-methyl-D- erythritol 4-phosphate pathway for isoprenoid biosynthesis in Escherichia coli [J]. FEBS Lett, 2001, 488: 170-173. |
| [9] | Ginis O, Courdavault V, Melin C, et al. Molecular cloning and functional characterization of Catharanthus roseus hydroxymethylbutenyl 4-diphospate synthase gene promoter from the methyl erythritol phosphate pathway [J]. Mol Biol Reports, 2012, 39: 5433-5447. |
| [10] | Gil MJ, Coego A, Mauch-Mani B, et al. The Arabidopsis csb3 mutant reveals a regulatory link between salicylic acid- mediated disease resistance and the methyl-erythritol 4- phosphate pathway [J]. Plant J, 2005, 44: 155-166. |
| [11] | Hao GP, Wang JM, Shi RJ, et al. Cloning molecular characterization and expression of acireductone dioxygenase(ARD)gene from Salvia miltiorrhiza [J]. China J Chin Mater Med(中国中药杂志), 2011, 36: 346-350. |
| [12] | Xu JK, Hiroshi K, Zheng JJ, et al. Protective effect of tanshinones against liver injury in mice loaded with restraint stress [J]. Acta Pharm Sin(药学学报), 2006, 41: 631-635. |
| [13] | Wang QH, Chen AH, Zhang BL. Salvia miltiorrhiza: a traditional Chinese medicine research model organism [J]. Acta Chin Med Pharm(中医药学报), 2009, 37: 1-3. |
| [14] | Song JY, Luo HM, Chen SL, et al. Salvia miltiorrhiza as medicinal model plant [J]. Acta Pharm Sin(药学学报), 2013, 48: 1099-1106. |
| [15] | Yasukawa T, Kanei IC, Maekawa T, et al. Increase of solubility of foreign proteins in Escheichia coli by coproduction of the bacterial thioredoxin [J]. J Biol Chem, 1995, 270: 25328-25331. |
| [16] | Aslund F, Beckwith J. The thioredoxin superfamily: redundancy, specificity, and gray-area genomics [J]. J Bacteriol, 1999, 181: 1375-1379. |
| [17] | Weickert MJ, Pagratis M, Curry SR, et al. Stabilization of apoglobin by low temperature increases yield of soluble recombinant hemoglobin in Escherichia coli [J]. Appl Environ Microbiol, 1997, 63: 4313-4320. |
| [18] | Zhang H, Liu ZG, Qu S. Research on optimal expression and purification of human receptor associated protein in Escherichia coli [J]. Acta Med Univ Sci Technol Huazhong(华中科技大学学报医学版), 2004, 33: 265-272. |
| [19] | Baneyx F. Recombinant protein expression in Escherichia coli [J]. Curr Opin Biotechnol, 1999, 10: 411-421. |
| [20] | Yu GQ, Jiang SQ, Li YL. Optimizing expression of recombinant 26-kilodalton glutathione S-transferases of Schistosoma japonicum in Escherichia coli [J]. Chin J Zoon(中国人兽共患病学报), 2006, 22: 770-773. |
| [21] | Schein CH, Noteborn MHM. Formation of soluble recombinant proteins in Escherichia coli is favoured by lower growth temperature [J]. Nat Biotechnol, 1988, 6: 291-294. |
 2014, Vol. 49
2014, Vol. 49


