2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
γ-氨基丁酸 (γ-aminobutyric acid,GABA) 是一种天然存在的非蛋白组成氨基酸,广泛分布于动植物体内。它是中枢神经系统主要的抑制性神经递质,占所有突触神经递质的30%~40%[1],主要由谷氨酸经谷氨酸脱羧酶转化而来[2]。研究表明,体内GABA含量异常易引起神经障碍类疾病,如阿尔茨海默症、帕金森症、自闭症以及急性创伤后应激障碍症[3,4,5,6]等。
缺乏GABA时,人们容易产生焦虑、不安等情绪,因此,GABA被添加到许多保健品、功能性饮料、果酒等帮助人体补充GABA,这也提示其可能存在被开发成新药的潜力,但是目前国内外尚无关于口服GABA的人体药动学报道。因此,有必要建立快速、灵敏、易操作的LC-MS/MS法测定人血浆中的GABA,并将经过验证的方法应用于GABA的人体药动学研究。
GABA的特殊结构使其测定存在以下困难: ① 分子量小,极性大,在常规反相柱上较难获得保留; ② GABA是人体内源性物质,空白基质中存在一定基线值,如何采用合适的空白基质建立标准曲线是难点; ③ 本实验需测定健康志愿者口服γ-氨基丁酸片后血浆中GABA的含量从而反映其药动学特征,故如何排除受试者血浆中的基线值对药动学结果产生的影响也非常重要。
目前有许多文献报道关于测定多种基质中的GABA。文献[7,8]采用LC-MS/MS法分别测定了人和大鼠脑脊液、大鼠微透析样品中的GABA,然而,两篇文献均未提及其是否适用于测定血浆中GABA。文献[6,9,10,11]报道的测定血浆中GABA预处理多采用衍生化或固相萃取,在无自动化设备的情况下相对繁琐。目前文献报道的测定人血浆中GABA均为测定血浆中GABA基线值,不完全适用于人体药动学研究。因此,本实验旨在建立快速、灵敏、易操作的LC-MS/ MS法测定人血浆中GABA,并将验证后的方法应用于γ-氨基丁酸片的人体药动学初步研究。 材料与方法
药品和试剂 γ-氨基丁酸对照品 (含量99%) 购自Sigma-Aldrich公司,d2-γ-氨基丁酸由本实验室合成纯化得到 (纯度99.5%),γ-氨基丁酸片 (规格: 250 mg/片) 购自上海信谊药厂,牛血清白蛋白 (上海生工生物)。
仪器 API 4000型三重四极杆串联质谱仪,配备电喷雾电离源 (ESI源),美国Applied Biosystems公司; 岛津液相色谱系统,包括LC-20AD型二元液相泵,SIL-HTA型自动进样器,日本岛津公司。
色谱条件 分析柱: Luna HILIC色谱柱 (100 mm × 3.0 mm,3 μm,美国Phenomenex公司); 预柱: C18保护柱(4.0 mm × 3.0 mm, 5 μm,美国Phenomenex公司); 流动相: A相 (含0.2% 甲酸水)-B相(含0.1% 甲酸乙腈),20∶80; 流速: 0.5 mL·min-1; 进样量: 5.0 μL。
质谱条件 离子源: ESI源; 源喷射电压: 5.5 kV; 离子源温度: 400 ℃; 离子源气体1 (N2) 压力: 50 psi (1 psi ≈ 6.9 kPa); 离子源气体2 (N2) 压力: 15 psi; 气帘气体 (N2) 压力: 10 psi; 碰撞气压力 (CAD): 10 psi; 去簇电压 (DP) 均为30 V; 碰撞能量 (CE) 均为22 V; 正离子方式检测; 扫描方式为多反应监测 (MRM)。待测物的离子反应分别为: m/z 104→m/z 69 (GABA)、m/z 106→m/z 71 (d2-GABA)。
人造空白血浆的配制 称取牛血清白蛋白5.00 mg,溶于生理盐水50.0 mL中,涡流混匀,即得人造空白血浆[12]。
标准系列样品和质控样品的制备 精密称取GABA对照品适量,用甲醇溶解并定容至10 mL,得1.00 mg·mL-1 GABA储备液,再以甲醇-水 (50∶50) 稀释该储备液,获得一定浓度的标准系列溶液。GABA的线性范围为5.00~1 000 ng·mL-1。采用人空白血 浆配制QC样品 [GABA加入浓度为: 5.00 ng·mL-1 (LLOQ)、15.0 ng·mL-1 (LQC)、100 ng·mL-1 (MQC) 和800 ng·mL-1 (HQC)] 均储存于 -70 ℃条件下备用。
血浆样品预处理 血浆样品预处理采用沉淀蛋白法。取血浆100 μL,分别加入甲醇-水 (50∶50) 100 μL、内标溶液 (500 ng·mL-1 d2-GABA) 25.0 μL和乙腈300 μL,涡流1 min,离心5 min (14 000 r·min-1),取上清液5.0 μL进行LC-MS/MS分析。
方法验证 对建立的方法进行方法验证,参照美国FDA生物分析方法验证指南[13]和欧盟生物分析方法验证相关指导原则[14],从方法的选择性、标准曲线和定量下限、精密度和准确度、稳定性、回收率、基质效应、残留效应和同位素效应等各方面进行方法验证。
选择性 分别取6份不同来源的人空白血浆样品以及相应人空白血浆配制的LLOQ样品进行LC-MS/MS分析测定,考察空白血浆中的内源性物质是否干扰待测物及其内标的测定。接受标准为: 测得的人空白血浆配制的LLOQ样品值应为测得的空白血浆基线值加上GABA的加入浓度,偏差在 ± 20% 之内,空白样品中内标通道的响应不超过LLOQ样品的5%。
标准曲线 标准曲线设计7个浓度点,GABA血浆浓度分别为5.00、10.0、20.0、50.0、200、500和1 000 ng·mL-1,按“血浆样品预处理”项下操作,以每个待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,用加权 (W = 1/x2) 最小二乘法进行回归运算,求得的直线回归方程即为标准曲线。
残留效应 在标准曲线最高浓度点后连续进样2个空白样品,考察样品与内标的残留效应。
精密度与准确度 取低、中、高3个浓度 (GABA加入质量浓度分别为15.0、100和800 ng·mL-1) 的QC样品,按“血浆样品预处理”项下操作,每浓度进行6样本分析,分别在3日内测试,根据当日标准曲线计算QC样品的测得浓度,根据QC样品结果计算本法的日内、日间精密度与准确度。
同位素效应 取人造空白血浆100 μL,按“血浆样品预处理”项下操作,平行制备6样本,作为零点样品; 取人造空白血浆100 μL,加入标准曲线定量下限溶液,按“血浆样品预处理”项下操作,平行制备6样本,作为LLOQ样品; 取人造空白血浆100 μL,加入标准曲线定量上限溶液,除不加内标外,按“血浆样品预处理”项下操作,平行制备6样本,作为ULOQ (无内标) 样品; 以此考察同位素效应。
基质效应 分别取6份不同来源的人空白血浆和1份溶血的人空白血浆,按“血浆样品预处理”项下操作,获得不同空白血浆基线值 (3样本测定,取平均值)。以甲醇-水 (50∶50) 稀释GABA储备液,使其浓度分别对应6份不同来源人空白血浆和1份 溶血人空白血浆中GABA基线值。取这7份溶液各100 μL,加入低、高浓度对照溶液 (GABA质量浓度分别为15.0和800 ng·mL-1) 和内标溶液,按“血浆样品预处理”项下操作,每一浓度进行3样本分析,获得相应的平均峰面积 (A)。同时另取这7份空白基质,除不加内标外,按“血浆样品预处理”项下操作,取全部上清液,加入低、高浓度对照溶液 (GABA浓度分别为15.0和800 ng·mL-1) 和内标溶液,按“血浆样品预处理”项下操作,每一浓度进行3样本分 析,获得相应的平均峰面积 (B),以两种处理方法的平均峰面积比值计算待测物的基质效应,计算公式为B/A×100%。每一浓度基质效应的RSD≤15%,可忽略基质效应影响。内标的基质效应采用相似的评价方法。
回收率 采用人空白血浆配制低、中、高三浓度 (GABA加入浓度分别为15.0、100和800 ng·mL-1) 的样品,按“血浆样品预处理”项下操作,每一浓度进行6样本分析。同时另取人空白血浆100 µL,除不加内标溶液外,按“血浆样品预处理”项下操作,取全部上清液,加入相应浓度对照溶液 (GABA低、中、高浓度分别为15.0、100和800 ng·mL-1) 和内标溶液,涡流1 min后进样分析。以每一浓度两种处理方法的峰面积比值计算处理回收率。
稳定性 本实验考察了GABA人血浆样品室温放置、经处理后自动进样器放置、经历3次冷冻-解冻循环和 -70 ℃长期放置的稳定性。考察时,取人空白血浆配制低、高浓度 (GABA加入浓度分别为15.0和800 ng·mL-1) 样品,每一浓度水平3样本分析。此外,本实验还考察GABA及内标d2-GABA储备液室温及4 ℃放置稳定性,GABA工作液4 ℃放置稳定 性。考察时,比较新旧溶液的峰面积,若峰面积差异≤10%,则认为溶液稳定。
稀释实验 考察了血浆浓度超出定量上限的样品,经空白人造血浆稀释后的准确度。取GABA的稀释质控样品 (GABA加入浓度为8 000 ng·mL-1),用空白人造血浆稀释10倍后,按“血浆样品预处理”项下操作,进行6样本分析,根据当日标准曲线计 算每一样本测得浓度。与稀释前浓度比较,精密度应≤15%,准确度应在 ± 15% 之间。
药动学初步应用 临床试验经复旦大学附属华山医院伦理委员会批准,选取6名健康成年受试者,签署知情同意书后进行试验。受试者先服用安慰剂,采集血样获得其基线值; 清洗期7天后单剂量口服 γ-氨基丁酸片2 g。每阶段均在服药前及服药后0.25、0.5、0.75、1、1.5、2、3、4、6、8、10、12和24 h由前臂静脉留取血样。血样在采集后置于含肝素的 抗凝管中,立即于4 ℃中以3 500 r·min-1转速下离心10 min,获得的血浆样品于 -70 ℃冷冻保存。 结果 1 质谱分析
由于GABA的结构中既含有碱性氮原子,也含有羧基,所以本实验比较了正、负两种离子检测。结果发现,GABA的甲醇-水 (50∶50) 溶液 (浓度为500 ng·mL-1) 在正离子模式下响应约为负离子的10倍,故优先选择ESI源下正离子检测方式。在正离子检测模式下,GABA及内标d2-GABA分别主要生成m/z 104和m/z 106的 [M+H]+ 峰,选择性对 [M+H]+ 峰进行产物离子扫描分析,GABA生成的主要碎片离子分别为m/z 69和m/z 87,d2-GABA生成的主要碎片离子有m/z 71和m/z 89,但实验过程中发现,m/z 87的碎片离子在待测物出峰时间处有干扰,且噪音高,故最终选择m/z 69和m/z 71分别作为GABA及内标d2-GABA定量分析时的产物离子。待测物及内标的[M+H]+产物离子全扫描质谱图见图 1。 2 色谱优化
本实验对色谱柱的选择进行了考察。分别考察了Eclipse Plus C18柱、Agela Venusil ASB C18柱以及适用于分离极性化合物的Phenomenex Hydro柱和Luna HILIC柱。由于GABA的极性较大,在普通的反相柱上保留较差,如在Eclipse Plus C18柱和Agela Venusil ASB C18柱上均死时间出峰; 在Phenomenex Hydro柱上表现为峰较宽,而在Luna HILIC柱上保留较好,且峰形对称,因而最终选择Phenomenex Luna HILIC色谱柱作为本次实验的分析柱。
 |
Figure 1 Product ion mass spectra of protonated molecules obtained from GABA (A) and its IS d2-GABA (B) |
流动相的有机相考察了甲醇和乙腈,发现在HILIC柱上乙腈的洗脱能力弱于甲醇,因此为增加GABA的保留,采用乙腈作为有机相; 水相最初采用纯水,加入甲酸后GABA响应提高,故最终采用含0.2% 甲酸水溶液作为水相。HILIC柱为亲水作用色谱,不同于反相柱,其流动相体系需要高比例有机相 (至少60%) 和低比例水相。考察有机相比例时发现,有机相比例为80% 时的保留时间恰当,但峰形有些拖尾,向有机相乙腈中加入0.1% 甲酸后,峰形有了明显改善,故最终采用水相为水 (含0.2% 甲酸),有机相为乙腈 (含0.1% 甲酸),有机相比例为80%,流速为0.5 mL·min-1。 3 方法学验证 3.1 选择性
结果表明,空白人血浆中的内源性物质不干扰GABA和内标d2-GABA的测定,且同位素内标d2-GABA不干扰GABA的测定。典型色谱图见图 2。
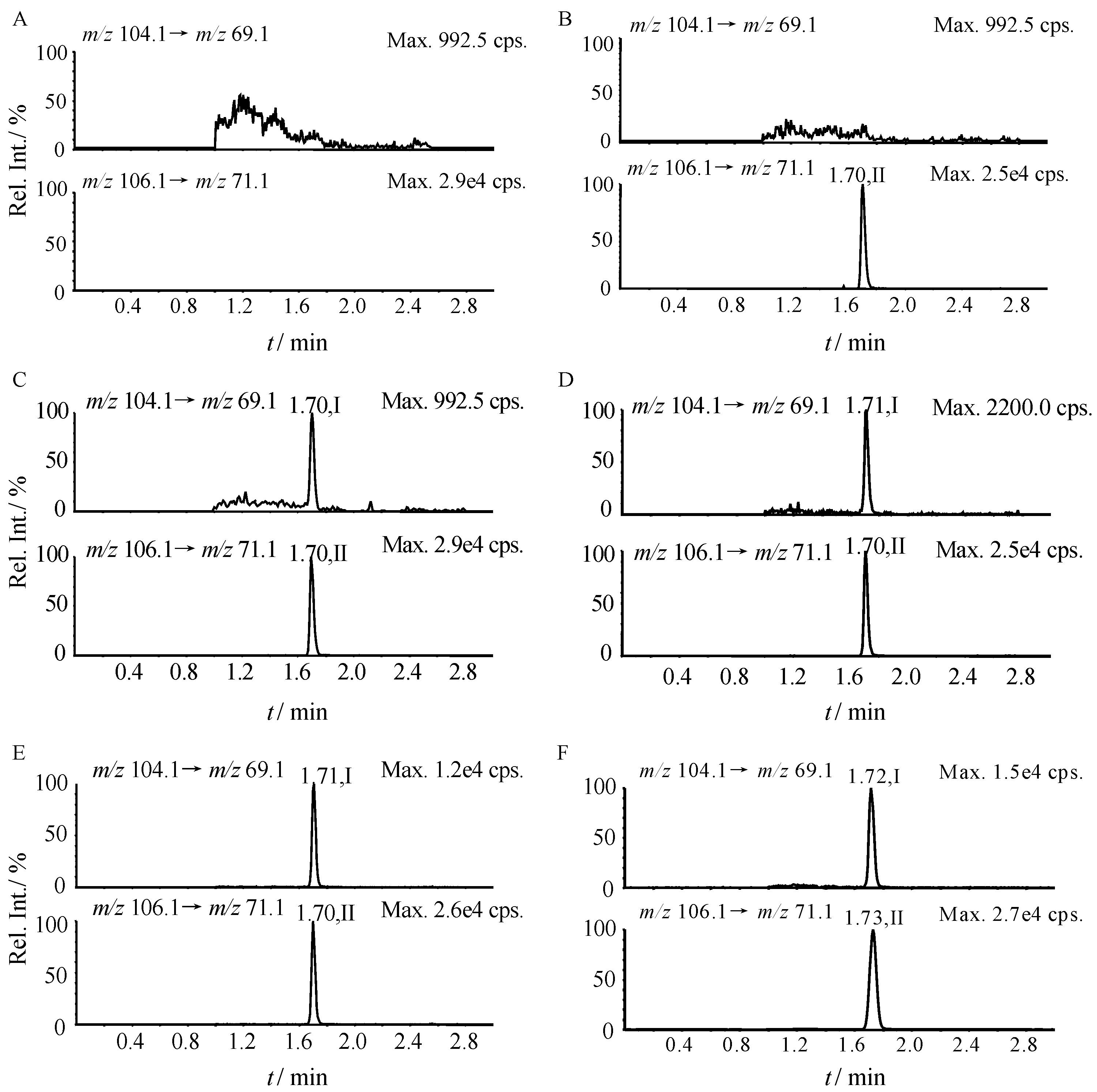 |
Figure 2 Typical LC-MS/MS chromatograms of GABA,d2-GABA (IS). A: BSA; B: BSA spiked with IS (500 ng·mL-1); C: BSA spiked with IS (500 ng·mL-1) and GABA (5.00 ng·mL-1); D: LLOQ sample spiked with IS (500 ng·mL-1); E: MOQ sample spiked with IS (500 ng·mL-1); F: human plasma sample spiked with IS (500 ng·mL-1) after an oral administration at dose of 2 000 mg GABA; Peaks I and II refer to GABA and d2-GABA,respectively |
用加权 (W = 1/x2) 最小二乘法进行回归运算,求得的标准曲线的相关系数 (r2) 均大于0.99。根据标准曲线,GABA的线性范围为5.00~1 000 ng·mL-1。典型标准曲线如下所示: y = 0.004 01 x + 0.015 (r2 = 0.999 2)。 3.3 定量下限
取LLOQ血浆样品 (GABA加入浓度为5.00 ng·mL-1),进行6样本分析,连续测定3天,并根据当日标准曲线计算每一样本测得浓度。求得 该浓度GABA的日内精密度为5.7%,日间精密度为9.9%,准确度为 (RE) 2.9%。该结果表明LC-MS/MS法测定人血浆中GABA定量下限可达5.00 ng·mL-1。相关数据见表 1。
|
|
Table 1 The intra- and inter-day precision and accuracy values of the QC samples of GABA (n = 6). LLOQ is expressed as baseline (13.3) + added Conc. (5.00); LQC is expressed as baseline (13.3) + added Conc. (15.0); MQC is expressed as baseline (13.3) + added Conc. (100); HQC is expressed as baseline (13.3) + added Conc. (800) |
3.4 残留效应
结果显示,样品与内标保留时间处均未出现干扰杂质峰,在本实验选择的色谱和质谱条件下,待测物及内标无残留。 3.5 精密度与准确度
GABA每一浓度水平的QC样品的日内精密度小于5.0%,日间精密度小于5.5%,准确度 (RE) 在-0.9%~4.3% 之间。待测物QC样品测试结果均符合生物样品测定有关要求。相关数据见表 1。 3.6 回收率
采用沉淀蛋白法处理血浆样品可获得较高的回收率。GABA在低、中、高三浓度的回收率分别为92.7%、91.5% 和98.2%。 3.7 基质效应
GABA在低、高两浓度的基质效应分别为100% 和105%,相对标准差分别为3.1% 和1.9%。内标d2-GABA的基质效应为91.7%, 相对标准差为6.0%。结果表明,待测物及其内标在本实验选择的色谱和质谱条件下,可忽略基质效应的影响。 3.8 稳定性
GABA低、高两浓度血浆样品经预处理后室温放置24 h稳定,血浆样品室温放置6 h、经历3次冷冻-解冻循环和 -70 ℃放置62天条件下均稳定。相关数据见表 2。GABA储备液及内标d2-GABA储备液室温放置6 h稳定,4 ℃放置57天稳定,GABA工作液4 ℃放置32天稳定。数据均符合相关接受标准。
|
|
Table 2 Stability data of GABA in human plasma under various storage conditions (n = 3) |
GABA测得的精密度和准确度 (RE) 分别为1.7% 和10%。结果表明,人血浆样品经空白人造血浆稀释10倍后测定不影响结果的准确度。 4 药动学初步应用
将所建立并经过验证的方法初步应用于γ-氨基丁酸片的人体药动学研究。6名健康受试者血浆中GABA的背景基线值曲线见图 3。6名健康受试者单剂量口服γ-氨基丁酸片后的药时曲线见图 4。
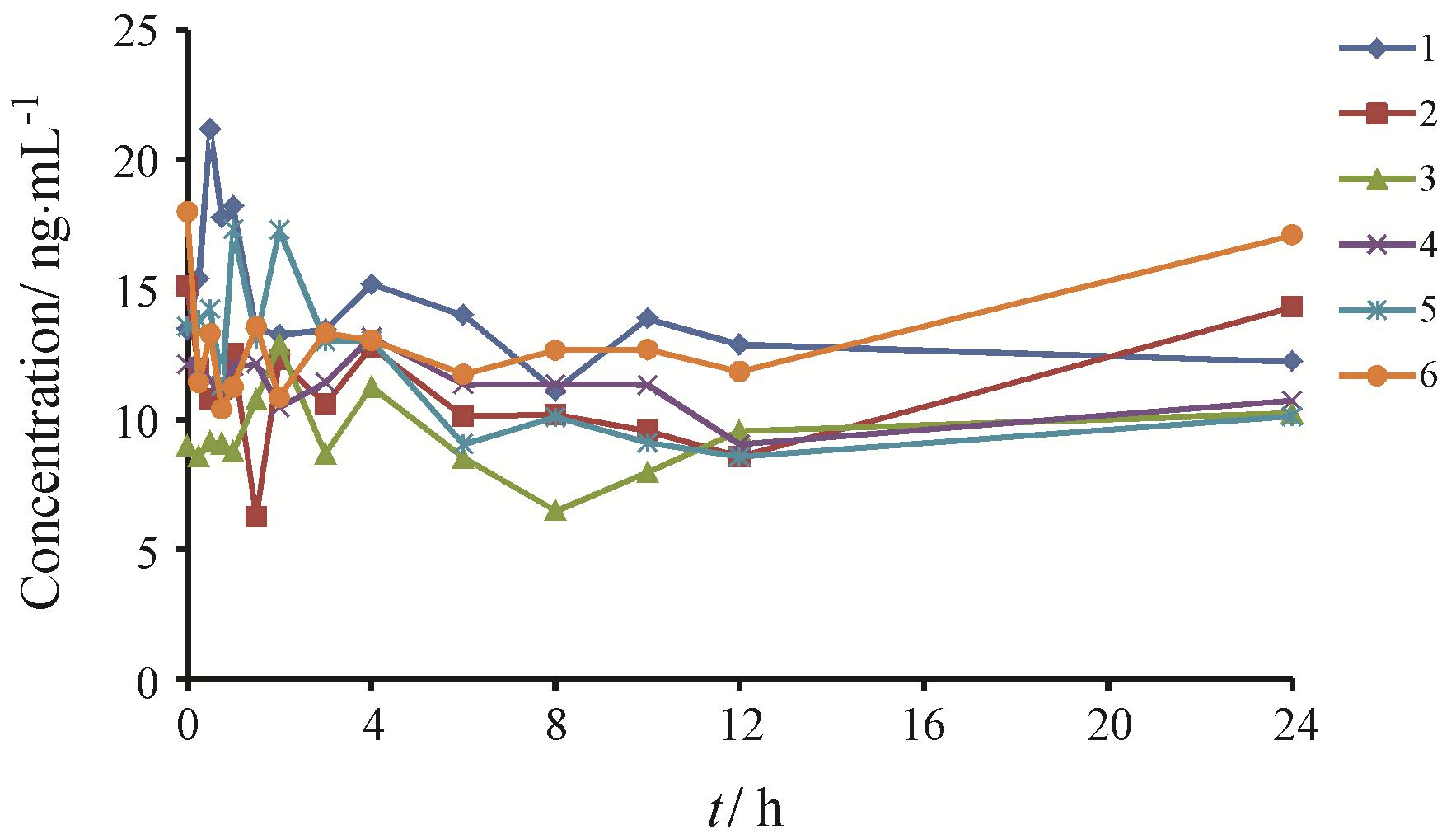 |
Figure 3 Plasma baseline concentration-time curves of GABA in Chinese healthy volunteers (n = 6) |
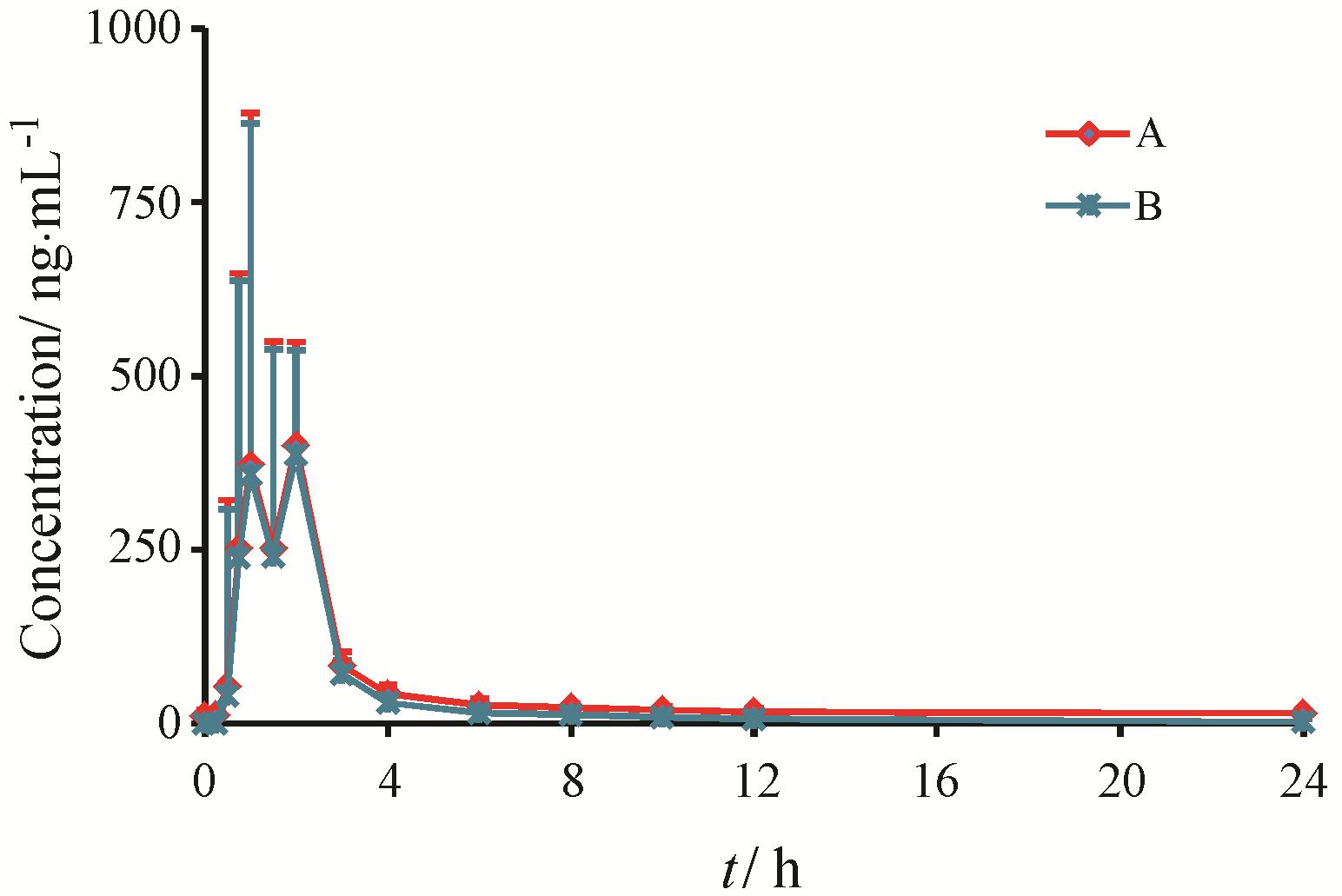 |
Figure 4 Plasma concentration-time curves of GABA after single oral administration at dose of 2000 mg in Chinese healthy volunteers (n = 6). A: Measured concentration; B: After baseline subtraction |
GABA的分子量较小,极性大,故采用适用于小分子大极性化合物检测的ESI源作为电离源,正离 子检测。因GABA是内源性物质,在人空白血浆中 含有一定基线值,因此本实验采用人造空白血浆 (适当浓度的BSA) 作为替代基质建立标准曲线[12],并用人空白血浆配制的QC样品来评价标准曲线的可行性。考虑到GABA 分子量较小,在定量分析时易受 到基质干扰,故对不同浓度的人造空白血浆进行了考察,最终选择浓度为0.100 mg·mL-1的BSA作为替代基质。本实验最终的QC结果证明采用替代基质建立标准曲线可行。
本实验采用人造空白血浆建立的标准曲线测定第一阶段给予安慰剂后的血浆样品,获得每位受试者各个时间点的背景基线值,平均约为12.2 ng·mL-1。每位受试者第二阶段采集的血浆样品测得的浓度值应扣除其第一阶段相应时间点的背景基线值,得到各时间点的最终浓度值。
本实验选择d2-GABA作为内标,同时考察了同位素效应。在开始实验前,首先通过计算得出GABA天然存在的同位素相对丰度为0.51% (m/z 105.07),表明GABA并不会干扰d2-GABA。而同位素效应考察结果也表明,在该实验条件下,标准曲线最高浓度点对内标不会产生干扰,且内标d2-GABA不干扰待测物GABA的测定。与文献[7,8]报道的d6-GABA相比,本文所用内标d2-GABA与待测物的色谱和质谱行为更接近。
与之前文献报道的采用LC-MS/MS法测定人血浆GABA的方法进行对比,本文方法预处理简单、分析时间短、血浆用量少、定量下限满足测定要求、线性范围较合理。文献[10]采用柱前衍生化及在线预处理的方法,缩短了样品预处理所需的时间,但其选择的色谱柱的填料粒径较细使得上样过程变慢,若减少上样体积则达不到需要的灵敏度,且该方法血浆用量大需200 μL,设定的线性范围也不适用于本次药动学实验; 文献[11]测定了人血浆中单胺类和氨基酸类神经递质 (包含GABA) 及其代谢物,该文献采用L-天冬氨酸作为GABA的内标,采用丹酰氯进行衍生化,同时测定了10多种物质,分析时间为23 min,不适于单独测定GABA,且其测定GABA定量下限仅为20 ng·mL-1,无法满足药动学实验的定量下限要求。
本文建立了LC-MS/MS法测定人血浆样品中的GABA,并进行了完整的方法验证。通过优化预处理条件、色谱条件、分析时间等显著提高了分析方法的效率。本方法具有简单、灵敏、易操作、选择性好的特点,并成功应用于γ-氨基丁酸片的人体药动学研究。
致谢: 复旦大学附属华山医院在临床实验上给予支持。雷鹏、上海药物研究所博士生余京华在氘代内标合成上提供帮助。
| [1] | Vander Zeyden M, Oldenziel WH, Rea K, et al. Microdialysis of GABA and glutamate: analysis, interpretation and comparison with microsensors [J]. Pharmacol Biochem Behav, 2008, 90: 135-147. |
| [2] | Ting Wong CG, Bottiglieri T, Snead OC. GABA, γ-hydroxybutyric acid, and neurological disease [J]. Ann Neurol, 2003, 54: S3-S12. |
| [3] | Advokat C, Pellegrin AI. Excitatory amino acids and memory: evidence from research on Alzheimer's disease and behavioral pharmacology [J]. Neurosci Biobehav Rev, 1992, 16: 13-24. |
| [4] | Raiteri L, Raiteri M, Bonanno G. Coexistence and function of different neurotransmitter transporters in the plasma membrane of CNS neurons [J]. Prog Neurobiol, 2002, 68: 287-309. |
| [5] | Dhossche D, Applegate H, Abraham A, et al. Elevated plasma gamma-aminobutyric acid(GABA)levels in autistic youngsters: stimulus for a GABA hypothesis of autism [J]. Med Sci Monit, 2002, 8: PR1-6. |
| [6] | Vaiva G, Thomas P, Ducrocq F, et al. Low posttrauma GABA plasma levels as a predictive factor in the development of acute posttraumatic stress disorder [J]. Biol Psychiatry, 2004, 55: 250-254. |
| [7] | Eckstein JA, Ammerman GM, Reveles JM, et al. Analysis of glutamine, glutamate, pyroglutamate, and GABA in cerebrospinal fluid using ion pairing HPLC with positive electrospray LC/MS/MS [J]. J Neurosci Methods, 2008, 171: 190-196. |
| [8] | Buck K, Voehringer P, Ferger B. Rapid analysis of GABA and glutamate in microdialysis samples using high performance liquid chromatography and tandem mass spectrometry [J]. J Neurosci Methods, 2009, 182: 78-84. |
| [9] | Bjork JM, Moeller FG, Kramer GL, et al. Plasma GABA levels correlate with aggressiveness in relatives of patients with unipolar depressive disorder [J]. Psychiatry Res, 2001, 101: 131-136. |
| [10] | Song Y, Shenwu M, Dhossche D, et al. A capillary liquid chromatographic/tandem mass spectrometric method for the quantification of γ-aminobutyric acid in human plasma and cerebrospinal fluid [J]. J Chromatogr B, 2005, 814: 295-302. |
| [11] | Cai HL, Zhu RH, Li HD. Determination of dansylated monoamine and amino acid neurotransmitters and their metabolites in human plasma by liquid chromatography - electrospray ionization tandem mass spectrometry [J]. Anal Biochem, 2010, 396: 103-111. |
| [12] | Hirche F, Fischer M, Keller Janine, et al. Determination of carnitine, its short chain acyl esters and metabolic precursors trimethyllysine and γ-butyrobetaine by quasi-solid phase extraction and MS/MS detection [J]. J Chromatogr B, 2009, 877: 2158-2162. |
| [13] | FDA. Guidance for Industry: Bioanalytical Method Validation(draft). 2013. http://www.fda.gov/downloads/Drugs/GuidanceCompliance RegulatoryInformation/Guidances/UCM368107.pdf. |
| [14] | European Medicines Agency. Guideline on Bioanalytical Method Validation. 2011. http://www.ema.europa.eu/docs/en_GB/document_library/ Scientific_guideline/2011/08/WC500109686.pdf. |
 2014, Vol. 49
2014, Vol. 49


