二甲双胍 (metformin,Met) 是目前治疗2型糖尿病 (type 2 diabetes,T2DM) 的一线药物。以往研究认为,Met的降糖作用机制主要是抑制肝脏葡萄糖输出、促进骨骼肌摄取葡萄糖等[1]。近年研究显示,Met还具有调节血脂、抗氧化、治疗非酒精性脂肪肝及延缓2型糖尿病心血管病变发生等作用[2]。随着Met在临床应用范围的日益扩大,其作用机制仍有待挖掘和探讨。
β细胞数量的减少和分泌功能减退对2型糖尿 病的发生发展至关重要。人们逐步认识到糖脂毒性 等机体内环境的变化可引发胰岛β细胞内代谢压 力、氧化应激、内质网应激和炎症通路活化,这些因素均对β细胞的功能产生重要影响[3]。细胞水平研究显示,Met可以保护棕榈酸诱导的胰岛β细胞株MIN-6的凋亡,推测作用机制可能与适度调节β细胞自噬通路某些关键因子有关[4]。虽然如此,Met是否直接有益于β细胞功能,或对2型糖尿病发生发展 过程中的β细胞数量减少存在直接保护作用,尚不 完全清楚。
本研究选用自发性2型糖尿病KKAy小鼠模型,长期给予Met,围绕胰腺病理生理变化及胰岛β细胞功能展开研究,采用金标准——高葡萄糖钳夹技术评价Met对β细胞胰岛素分泌的直接影响,并分析Met作用后对与β细胞功能相关的常见因素及新靶点沉默信息调节因子5 (SIRT5) 的分子水平表达变化的影响,初步探讨Met保护胰岛功能的可能作用机制。
材料与方法 药品、试剂及实验仪器盐酸二甲双胍片 (0.5 g,批号A114L),澳大利亚艾华大药厂; 胰岛素 (优泌林),礼来制药公司; 诱导型一氧化氮合酶活性测定试剂盒 (iNOS),南京建成生物工程研究所; 小鼠超敏胰岛素ELISA试剂盒,ALPCO公司; Insulin、Glucagon、SIRT5、NF-κB p65及磷酸化NF-κB抗体,Cell Signaling Technology (CST) 公司; 葡萄糖、L-谷氨酸钠、戊巴比妥钠等其他试剂均为国产分析纯; μ-Quant酶标仪 (美国BIO-TEK公司); Master Flex-L/S蠕动泵 (美国Cole-Parmer公司); GLUCOTREND 2血糖仪 (德国Roche公司); JY-92Ⅱ型超声破碎仪 (宁波新芝科技股份有限公司); 3-18K型低温高速离心机 (德国Sigma公司); HZQ-C空气浴震荡器 (哈尔滨东明医疗仪器厂); ABI7000 PCR仪 (美国ABI公司)。
实验动物分组及给药自发性2型糖尿病KKAy小鼠40只,8周龄,雌性,体重32~35 g,购自中国医学科学院实验动物研究所。许可证编号为SCXK (京) 2002-0003。所有动物均饲养于SPF级动物房。该模型具有糖脂代谢紊乱和胰岛素抵抗特征,随着饲养时间增加、鼠龄增大,则会出现明显的糖尿病症状,伴有高血糖、高血脂和高血压,是一种较理想的2型糖尿病动物模型。待KKAy小鼠体重至40 g以上、接近16周龄时,进行多指标预测,依据胰岛素耐量试验 (ITT) 40 min血糖下降百分数 (BG decrease at 40 min in ITT)、空腹血糖 (FBG)、血甘油三酯 (TG)、血总胆固醇 (CHO) 及体重 (BW) 等,选取24只具有胰岛素抵抗特征的动物均分2组 (n = 12),分别为模型对照组 (Con组) 和二甲双胍组 (Met组)。Met组给予盐酸二甲双胍 (0.2 g·kg-1体重) 水溶液,Con组给予等体积蒸馏水,每日灌胃1次,连续12周。分组指标详见表 1。
|
|
Table 1 Data for animal grouping. Animals were grouped primarily according to the percent of blood glucose (BG) decrease at 40 min in insulin tolerance test (ITT),fasting blood glucose (FBG),TG,CHO levels and body weight (BW). n = 12, . Con: Control; Met: Metformin . Con: Control; Met: Metformin
|
给药5周后,实验当天动物禁食3 h,灌胃给予葡萄糖 (2.0 g·kg-1) 负荷。于负荷前 (0 min) 及负荷后30、60和120 min取血,用葡萄糖氧化酶法测定血糖值,计算30 min血糖上升百分数及血糖曲线下面积 (AUC)。
胰岛素耐量试验 (ITT)给药第7周,实验当天动物禁食3 h,皮下注射常规胰岛素溶液 (0.4 U·kg-1),于注射前 (0 min) 和注射后40及90 min采血样,测定各时间点的血糖值,并计算40 min血糖下降百分数及血糖曲线下面积 (AUC)。
高葡萄糖钳夹实验依照本实验室已建立的相关方案进行钳夹实验[5]。给药10周后,动物在实验前禁食16 h,戊巴比妥钠麻醉 (80 mg·kg-1体重,腹腔注射),固定、行颈静脉插管手术。尾尖采血50 μL,用于测定空腹血糖和血清胰岛素水平 (FINS),其后开始高糖钳夹实验。经颈静脉插管注射初始剂量葡萄糖 (100 mg·kg-1体重),于第1、5、10和15 min分别尾尖采集血样约15 μL,用于观察第一时相胰岛素分泌,其后开启蠕动泵持续输入葡萄糖 (10%,w/v),每5分钟检测血糖,并调整葡萄糖输注速率,使血糖水平维持在 (16.0 ± 0.5) mmol·L-1 [即(288± 9) mg·dL-1]。稳态后取5个时间点的葡萄糖输注速率 (GIR) 平均值作为稳态时GIR。另外,钳夹开始后第60、90、120及180 min时分别采集血样15 μL,用ELISA法测定各时间点的胰岛素分泌量,用于绘制胰岛素分泌曲线。根据GIR值判断胰岛β细胞的功能,即β细胞对葡萄糖的反应性及β细胞胰岛素的分泌能力; 其中GIR计算公式为: GIR (mg·kg-1·min-1) = 葡萄糖输注速率 (mL·min-1) × 100 (mg·mL-1) ÷ 体重(g)。
胰腺病理形态及免疫荧光标记胰岛素和胰高血糖素给药第12周后,处死血糖钳夹实验后剩余的动物,分离胰腺,生理盐水冲洗,拭干后,称重并计算胰腺指数; 一部分胰腺组织于液氮中迅速冻存,用于生化指标测定。取胰尾部分用Bouin’s液固定,常规石蜡包埋,5 μm切片,进行HE染色; 用免疫荧光染色标记KKAy小鼠胰岛中的胰岛素 (insulin) 和胰高血糖素 (glucagon) 的变化。采用多媒体彩色病理图像分析系统在分辨率、对比度、亮度等相同条件下观察胰腺组织的形态学变化。
胰腺匀浆生化指标测定取冻存的部分胰腺组织,用冷生理盐水制成10% 的匀浆,以2 000 r·min-1低温离心10 min,取上清液按各试剂盒说明书操作步骤,分别测定胰腺匀浆中TG含量、iNOS和ATPase的活性; 蛋白定量采用考马斯亮蓝法。
检测胰腺组织中炎症及离子通道相关因子的mRNA表达水平RNA提取及反转录: 取胰腺组织约100 mg,加入1 mL Trizol,充分裂解,离心后加 入氯仿,振荡混匀,室温放置15 min,在4 ℃离心 (12 000 r·min-1) 15 min。吸取上层水相,加入0.5 mL异丙醇混匀,-20 ℃放置10 min,离心弃上清,RNA沉于管底,75% 乙醇洗沉淀2次,加40 μL DEPC水溶解RNA样品。逆转录为cDNA,用RNase free水稀释至20 ng·μL-1用于RT-PCR。目的基因扩增: 采用两步法进行,预变性,95 ℃ 30 s,PCR反应,95 ℃ 5 s → 60 ℃ 31 s,解离阶段,共40个循环。测定各基因的 溶解温度Ct值,并将各个样本的Ct值与其内参基因β-actin的Ct值通过数据处理计算出2-ΔΔCt,使数据统一化,比较目的基因的组间差异。引物序列见表 2。
|
|
Table 2 Sequences of real-time PCR primers. TLR4: Toll-like receptors 4; JNK: c-jun N-terminal kinase; iNOS: Inducible nitric oxide synthase; NF-κB: Nuclear factor kappa B; IL-6: Interleukin-6; TNFα: Tumor necrosis factor α; Ryr2: Ryanodine receptor; SERCA2: Sarco/endoplasmic reticulum Ca2+-ATPase; SNAP25: Synaptosomal-associated protein 25; NCX1: Sodium-calcium exchange |
选取给药结束后取材保存的胰腺组织,考察其NF-κB p65亚基及其磷酸化形式蛋白 的表达差异; 另外,选取正常给药和钳夹实验结束后取材保存的胰腺组织,考察其SIRT5蛋白的表达差异。从 -80 ℃冰箱中取出胰腺组织标本约100 mg,加入400 μL含磷酸化酶抑制剂、蛋白酶抑制剂的蛋白裂解液,超声匀浆,充分裂解,冰浴放置35 min,期间适时混匀。12 000 r·min-1离心5 min。取上清液与上样缓冲液混匀煮沸制备成蛋白电泳样品,用Western blotting检测胰腺中蛋白表达水平变化。
统计学方法 采用SPSS 17.0统计软件进行分 析,数据以 表示,组间比较采用t检验。P < 0.05为差异有统计学意义。
表示,组间比较采用t检验。P < 0.05为差异有统计学意义。
葡萄糖耐量试验结果如表 3所示,与Con比较,Met给药组KKAy小鼠的空腹血糖 (P < 0.05)、口服葡萄糖后30及120 min的血糖显著降低 (P < 0.05),血糖时间曲线下面积 (AUC) 显著低于Con组 (P < 0.05)。
|
|
Table 3 Effects of metformin on plasma glucose and area under the plasma glucose concentration time curve (AUC) during glucose tolerance tests (OGTT) in KKAy diabetic mice. After 5 weeks treatment,plasma glucose concentrations were tested after 3 h fasting in OGTT. n = 12, . P < 0.05 vs Con group . P < 0.05 vs Con group
|
胰岛素耐量试验结果如表 4所示,与Con比较,Met给药组KKAy小鼠的空腹血糖 (P < 0.01)、注射胰岛素后40及90 min的血糖显著减低 (P < 0.01,P < 0.05),ITT血糖曲线下面积 (AUC) 显著降低 (P < 0.01)。KKAy小鼠(Con组) ITT试验中40 min血糖下降百分数约为19.9%,而给予Met后显著升高 (27.6%,P < 0.01)。
|
|
Table 4 Effects of metformin on plasma glucose and area under the plasma glucose concentration time curve (AUC) during ITT in KKAy diabetic mice. After 7 weeks of treatment,plasma glucose concentrations were tested after 3 h fasting in ITT. n = 12, . P < 0.05,**P < 0.01 vs Con group . P < 0.05,**P < 0.01 vs Con group
|
高葡萄糖钳夹实验结果如表 5和图 1所示,与Con组相比,给予Met组的空腹血糖、血清胰岛素均显著降低 (P < 0.01),钳夹稳态葡萄糖输注速率GIR值显著升高 (P < 0.05); Con组小鼠的静脉葡萄糖刺激的第一时相胰岛素分泌明显缺失 (1st phase,0~10 min,图 1A),给予Met后,KKAy小鼠的第一时相胰岛素分泌明显增强,在葡萄糖刺激后1、5和15 min均显著升高 (P < 0.01,P < 0.05,P < 0.01,图 1A); 高糖钳夹过程中 (60~180 min) 最大胰岛素分泌量显著高于Con组(P < 0.001,180 min,图 1B)。
|
|
Table 5 Effects of metformin on glucose infusion rate (GIR),fasting plasma glucose (FBG) and insulin (FINS) levels during hyperglycemic clamp in KKAy diabetic mice. After 10 weeks of treatment,fasting plasma glucose and insulin levels were tested after 16 h fasting. GIR during clamp were calculated. n = 5, . P < 0.05,**P < 0.01 vs Con group . P < 0.05,**P < 0.01 vs Con group
|
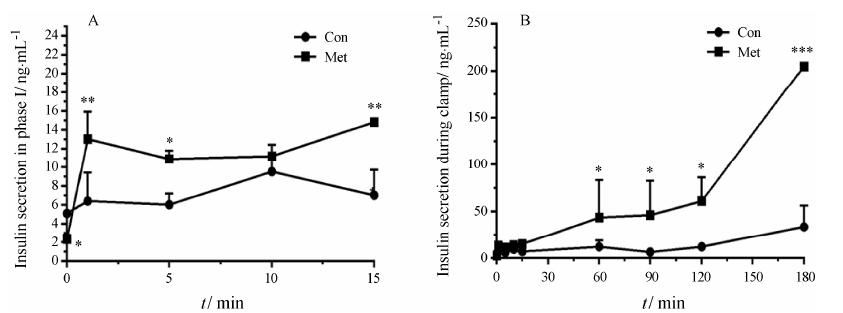 |
Figure 1 Effects of metformin on glucose stimulated insulin secretion in hyperglycemic clamp after 10 weeks treatment. A: Plasma insulin level in 1st phase (0-15 min); B: Plasma insulin levels during the whole clamp. The response to the intravenous glucose challenge shows a biphasic profile,with distinct 1st phase (0-15 min,Figure 1A) and 2nd phase (60-180 min) insulin-secretory responses. Values are means ± SD of 5 mice in each group. P < 0.05,**P < 0.01,***P < 0.001 vs Con group |
胰腺组织中脂质、硝化应激及ATP酶活性结果如表 6所示,与Con组比较,Met组可降低KKAy小鼠胰腺中的甘油三酯 (TG) 含量及一氧化氮合酶 (iNOS) 的活性分别达43.6% 和31.1% (P < 0.01,P < 0.05); Met亦显著增加KKAy小鼠胰腺中钙镁ATP酶活性 (Ca2+-Mg2+-ATPase,P < 0.05)。提示Met可一定程度降低KKAy小鼠胰腺脂质堆积及炎症相关酶活性,且胰腺中离子稳态及能量代谢功能均有一定程度的恢复。
|
|
Table 6 Effects of metformin on pancreatic biochemical indices including TG content,activities of iNOS and ATPase of KKAy diabetic mice. n = 7, . P < 0.05,**P < 0.01 vs Con group . P < 0.05,**P < 0.01 vs Con group
|
胰腺组织病理形态如图 2所示,Con组小鼠胰腺具内分泌功能的胰岛成纤维细胞增加,脂肪细胞明显增多,部分胰岛中出现炎性浸润、空泡状且外周不规则 (图 2A箭头),给予Met后,一些胰岛外周接近规则、边界也较清晰,炎性浸润情况有所减轻 (图 2B); Con组胰岛中insulin表达阳性区域即为β细胞 (图 2C),给予Met后,胰岛中insulin表达阳性区域及亮度显著增加 (图 2D); Con组胰岛中glucagon表达阳性区域即为α细胞,在胰岛中分布无序,亮度较大 (图 2E),给予Met治疗后,glucagon表达阳性区域显著减少及亮度降低,且α细胞一定程度恢复向胰岛边缘的分布 (图 2F)。
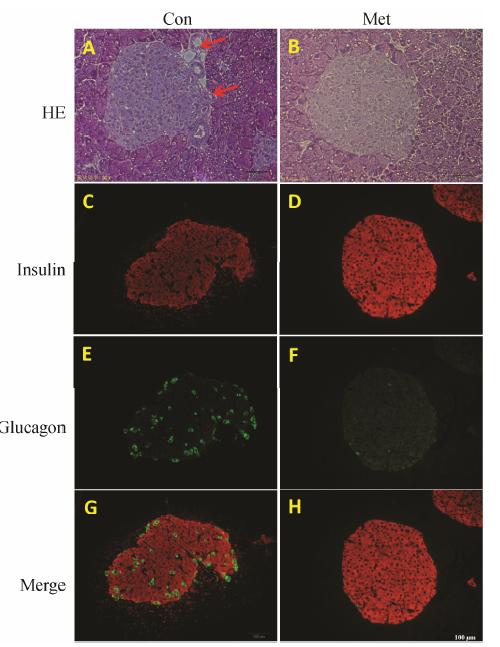 |
Figure 2 The effects of Met on histopathological morphology of the pancreas of KKAy diabetic mice. HE,hematoxylin and eosin staining (A and B),arrow,fat drop and fibroblast. Islets in paraffin-embedded pancreas sections were double immunostained for insulin (red) and glucagon (green) and analyzed by fluorescence microscopy; insulin immunoreactivity (C and D); glucagon immunoreactivity (E and F); merge of insulin and glucagon were shown in G and H |
炎症及离子通道相关因子的mRNA表达水平如图 3所示,与Con组相比,给予Met后,KKAy小鼠胰腺中炎症通路相关因子TLR4 (P < 0.001)、iNOS (P < 0.001)、NF-κB (P < 0.001)、JNK (P < 0.05)、IL-6 (P < 0.001) 和TNF-α (P < 0.001) 的mRNA表达水 平显著下调; 胰岛素颗粒胞吐相关蛋白Syntaxin (P < 0.01) 和Snap25 (P < 0.001) 的mRNA表达水平显著上调; 细胞内钙稳态平衡相关因子SERCA2的mRNA表达水平显著上调 (P < 0.001),而NCX1的mRNA表达水平显著下调 (P < 0.001); ATP敏感性钾离子通 道的组成亚基Kir6.2的mRNA表达水平显著上调 (P < 0.001)。
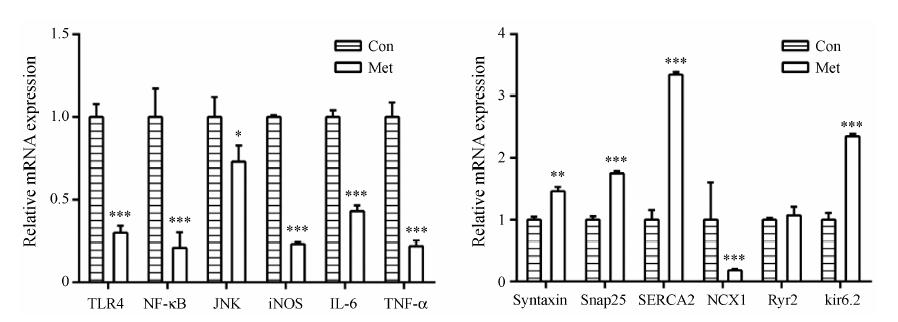 |
Figure 3 Effects of metformin on genes expression involved in inflammation,insulin granules exocytosis and ion channel in pancreas of KKAy diabetic mice. Quantitative Real-time PCR analysis of pancreatic mRNA expression,a comparative threshold cycle (Ct) method 2-ΔΔCt was used for relative quantification of gene expression. β-actin served as internal reference. n = 3-4. The values are expressed as means ± SD; P < 0.05,**P < 0.01,***P < 0.001 vs Con group |
去乙酰化蛋白SIRT5蛋白表达水平如图 4A所 示,长期给予Met后,KKAy小鼠胰腺中SIRT5蛋白表达水平显著下调 (P < 0.05); 但如图 4B所示,在高糖钳夹实验中取材获得的胰腺组织处于长时间高 糖刺激下,Met可显著上调胰腺组织中SIRT5的表达 (P < 0.05)。提示Met可能通过调节高糖应激下SIRT5的表达,而影响KKAy小鼠的胰岛细胞功能。
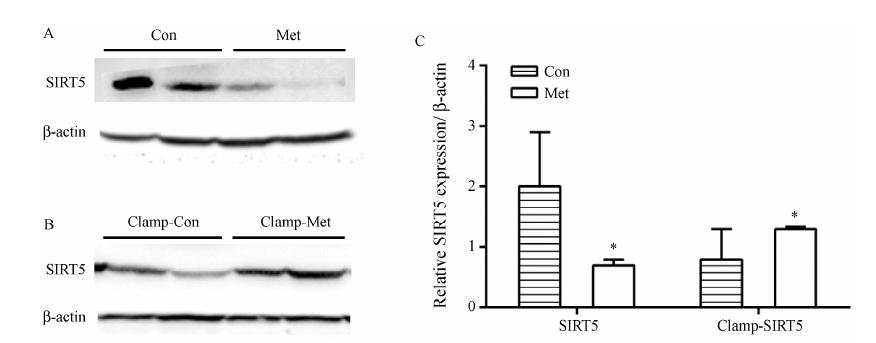 |
Figure 4 Effects of metformin on SIRT5 expression in pancreas of KKAy diabetic mice. A: Pancreas from KKAy mice treated with Met for 12 weeks. B: Pancreas from KKAy mice treated with Met for 10 weeks and performed hyperglycemic clamp test. C: The density of the bands was analyzed. Protein expression levels were detected by Western blotting. P < 0.05 vs Con group |
NF-κB蛋白及其磷酸化蛋白表达水平如图 5A所示,长期给予Met后,KKAy小鼠胰腺中NF-κB p65亚基的蛋白表达水平有下调趋势,而其活性形式——磷酸化的NF-κB p65 (P-NF-κB p65) 蛋白表达水平显著下调 (P < 0.05)。提示Met可一定程度下调KKAy小鼠胰腺中NF-κB炎症信号通路。
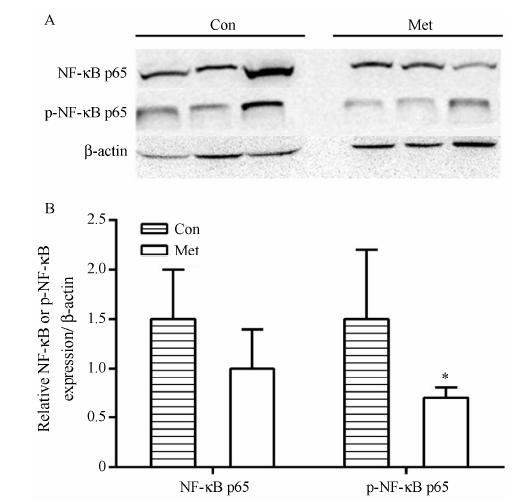 |
Figure 5 Effects of metformin on NF-κB p65 and phosphorylation- NF-κB p65 expression in pancreas of KKAy diabetic mice. A: Pancreas from KKAy mice treated with Met for 12 weeks. B: The density of the bands was analyzed. Protein expression levels were detected by Western blotting. P < 0.05 vs Con group |
随着更多的临床应用数据的获得,发现Met具有更广泛的药理作用,如调血脂、治疗多囊卵巢综合征和非酒精性脂肪肝等[6]。因此,对Met作用机制的探讨也更加深入和广泛,提示Met还可能针对其他靶点、靶组织具有更宽泛的作用和调控机制。
本研究采用自发性2型糖尿病KKAy小鼠模型,着眼于胰腺组织,考察Met治疗后对胰岛β细胞功能的影响及作用机制探讨。结果提示,在2型糖尿病KKAy小鼠中,Met通过降低糖脂紊乱状态下胰腺中的脂质堆积、缓解炎症状态,且一定程度恢复胰腺中钙离子稳态等方面,改善β细胞对葡萄糖刺激反应性,初步推断Met对β细胞功能存在保护作用,可以从下述几个方面的结果得到该推论:
首先,在本研究中采用的高葡萄糖钳夹技术,是评价胰岛β细胞的胰岛素分泌功能的金标准[7]。在该实验中能够获得胰岛素分泌曲线及GIR值,可反映葡
萄糖刺激的双相胰岛素分泌及最大胰岛素分泌能力。本实验中Met可显著增加KKAy小鼠高葡萄糖钳夹中的GIR值,并且可增加静脉葡萄糖刺激后1 min的胰岛素分泌量 (P < 0.01) 和钳夹稳态时的β细胞的最大分泌能力 (P < 0.001)。这些结果表明,Met可能通过直接或间接作用增加了KKAy小鼠β细胞对葡萄糖的敏感性,促进了葡萄糖刺激的胰岛素分泌。
本研究发现,给予Met后可一定程度恢复糖尿病状态下的胰岛α、β细胞重新排布,调节胰岛中两种维持血糖稳态激素——胰岛素和胰高血糖素的胞内表达量。免疫组化标记检测可见,KKAy小鼠的α细胞分布杂乱,胰高血糖素阳性表达颗粒较多且荧光强度较大,而β细胞中的胰岛素阳性颗粒表达不均匀,荧光染色较低; 给予Met后,切片中多数胰岛中α细胞趋向分布于胰岛边缘,且胰高血糖素阳性表达荧光适中,β细胞中的胰岛素阳性颗粒表达均匀,荧光强度增强。该结果提示,Met也可一定程度促进β细胞内胰岛素的表达,恢复KKAy小鼠胰岛素的基础生物合成量。
其次,本研究中还观察到Met可调节KKAy小鼠胰腺中多个钙离子稳态调节相关离子通道的基因表达水平。在生理状态下,Ca2+作为细胞内第二信使,在维持细胞增殖、分裂、能量代谢和氧代谢发挥着重要作用[8]。胰岛β细胞胞质中Ca2+浓度平衡和信号刺激后迅速升高是维持胰岛素正常分泌的重要因素之一。内质网钙库在胰岛素分泌中发挥着重要作用。内质网钙ATP酶 (SERCA2) 的作用主要是将胞浆钙泵回胞内的钙库[9]。本研究结果显示: Met可上调KKAy小鼠胰腺组织中SERCA2的mRNA表达水平,下调NCX1的mRNA表达水平,其中,SERCA2的活性增加可能利于细胞内“钙超载”时胞内钙浓度的恢复,钠钙交换体 (NCX1) 是一种双向离子转运体,负责将钠和钙离子的双向转运,NCX1的表达减少可能一定程度减少胰岛细胞的钙超载,利于胰岛β细胞的胰岛素分泌功能。另外,胰腺生化测定结果显示,Met可显著增加2型糖尿病KKAy小鼠胰腺中Ca2+-Mg2+- ATPase的活性,其活性增加表明,胰腺中离子稳态及能量代谢功能均有一定程度的恢复。
体外研究报道证实,二甲双胍在某些离体细胞实验中可以表现出一定的抗炎作用[10,11]。本研究中也发现Met可能参与调节KKAy小鼠胰腺中炎症相关因子的基因和蛋白表达水平变化。Met可降低KKAy小鼠胰腺中硝化应激因子iNOS的活性,并且下调胰腺中NF-κB信号通路上下游因子,包括TLR4、iNOS、IL-6和TNF-α等的mRNA表达水平。另外,Met可显著下调胰腺中磷酸化NF-κB的表达。TLR4激活后,可引起下游转录因子NF-κB、IRF3和MAP激酶的激活[12],而NF-κB活化[13]后调控下游相关靶基因的转录,包括iNOS、肿瘤坏死因子α、白细胞介素1等[14,15]。这些促炎症因子又可进一步引起中间介质的释放,如一氧化氮 (NO)、脂质介质及活性氧物质以及一些利于炎性细胞进入组织的细胞黏附分子的上调,诱导组织慢性炎症和细胞损伤[16]。虽然,Met改善KKAy小鼠胰岛β细胞功能紊乱很可能与其改善胰腺组织中炎症状态有关,但具体二甲双胍的抗炎机制是依靠改善机体胰岛素敏感性降低血糖间接作用,还是自身的抗炎作用仍不是十分清楚,需在进一步的研究中加以证实。
最后,作者还考察了Met对新兴的蛋白靶点——线粒体蛋白SIRT5的影响。SIRT5属于Sirtuin家族的一员,又称沉默信息调节因子 (silent information regulator)。SIRT5的作用底物之一是参与线粒体诱导细胞凋亡过程中的重要因子——细胞色素C[17]。本研究发现,长期给予Met可显著下调KKAy小鼠胰腺 中SIRT5的表达水平,这与Buler等[18]近期研究证实“SIRT5可能受AMPK与PGC-1α的调控,小鼠肝 细胞中过表达AMPK可显著下调SIRT5的表达”的现象不谋而合。研究认为,Met的主要作用靶点即为AMPK,AMPK激活后可调控其下游PGC-1α,通过转录激活作用调控SIRT5的表达,因此,Met显著下调KKAy胰腺中SIRT5的表达可能与此机制相关; 但 在高糖钳夹实验血糖达稳态的过程中,动物长时间处于高血糖状态下,Met可显著上调此状态下胰腺中SIRT5的蛋白水平,该结果提示,基础状态下,Met下调胰腺中的SIRT5,但在高糖调解下,Met上调SIRT5蛋白的表达,可能一定程度保护胰岛细胞在高糖应激状态下受到的损伤。由此,初步推测Met可能通过调节胰腺中的SIRT5感受外界环境变化,参与保护并恢复β细胞的功能。
综上,本研究表明,Met长期给药可改善KKAy小鼠胰岛β细胞功能紊乱状态,其机制可能主要与其下调胰腺中炎症通路活化因子,缓解其胰腺中的低度炎症状态及调节胰腺钙离子稳态平衡有关。本研 究中首次报道了糖尿病KKAy小鼠的二甲双胍治疗与胰腺SIRT5蛋白表达变化的关系。后续工作将集中寻找Met在β细胞中的关键作用靶点或通路,进一步阐明Met对胰腺功能的直接影响,至于Met究竟是通过哪一条信息传递通路发挥改善β细胞功能的作用,仍需深入的研究和探讨。
| [1] | Viollet B, Guigas B, Garcia NS, et al. Cellular and molecular mechanisms of metformin: an overview [J]. Clin Sci, 2012, 122: 253-270. |
| [2] | Woo SL, Xu H, Li HG, et al. Metformin ameliorates hepatic steatosis and inflammation without altering adipose phenotype in diet-induced obesity [J]. PLoS One, 2014, 9: e91111. |
| [3] | Lightfoot YL, Chen J, Mathews CE. Oxidative stress and beta cell dysfunction [J]. Methods Mol Biol, 2012, 900: 347-362. |
| [4] | Jiang Y, Huang W, Wang J, et al. Metformin plays a dual role in MIN6 pancreatic β cell function through AMPK-dependent autophagy [J]. Int J Biol Sci, 2014, 10: 268-277. |
| [5] | Liu SN, Liu Q, Shen ZF. A preliminary study on the mechanism of impaired beta cell function in monosodium glutamate obese rat with insulin resistance [J]. Acta Pharm Sin(药学学报), 2008, 43: 1106-1111. |
| [6] | Pernicova I, Korbonits M. Metformin--mode of action and clinical implications for diabetes and cancer [J]. Nat Rev Endocrinol, 2014, 10: 143-156. |
| [7] | DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quantifying insulin secretion and resistance [J]. Am J Physiol, 1979, 237: E214-223. |
| [8] | Hara T, Mahadevan J, Kanekura K, et al. Calcium efflux from the endoplasmic reticulum leads to β-cell death [J]. Endocrinology, 2014, 155: 758-768. |
| [9] | Kono T, Ahn G, Moss DR, et al. PPAR-γ activation restores pancreatic islet SERCA2 levels and prevents β-cell dysfunction under conditions of hyperglycemic and cytokine stress [J]. Mol Endocrinol, 2012, 26: 257-271. |
| [10] | Kato Y, Koide N, Komatsu T, et al. Metformin attenuates production of nitric oxide in response to lipopolysaccharide by inhibiting MyD88-independent pathway [J]. Horm Metab Res, 2010, 42: 632-636. |
| [11] | Moiseeva O, Deschênes-Simard X, St-Germain E, et al. Metformin inhibits the senescence-associated secretory phenotype by interfering with IKK/NF-κB activation [J]. Aging Cell, 2013, 12: 489-498. |
| [12] | Garay-Malpartida HM, Mourão RF, Mantovani M, et al. Toll-like receptor 4(TLR4)expression in human and murine pancreatic beta-cells affects cell viability and insulin homeostasis [J]. BMC Immunol, 2011, 12: 18. |
| [13] | Salem HH, Trojanowski B, Fiedler K, et al. Long-term IKK2/NF-κB signaling in pancreatic β-cells induces immune- mediated diabetes [J]. Diabetes, 2014, 63: 960-975. |
| [14] | Cao ZH, Yin WD, Zheng QY, et al. Caspase-3 is involved in IFN-γ- and TNF-α-mediated MIN6 cells apoptosis via NF-κB/ Bcl-2 pathway [J]. Cell Biochem Biophys, 2013, 67: 1239- 1248. |
| [15] | Liu XH, Wang YP, Wang LX, et al. Exendin-4 protects murine MIN6 pancreatic β-cells from interleukin-1β-induced apoptosis via the NF-κB pathway [J]. J Endocrinol Invest, 2013, 36: 803-811. |
| [16] | Wang Y, Zhu Y, Gao L, et al. Formononetin attenuates IL-1β-induced apoptosis and NF-κB activation in INS-1 cells [J]. Molecules, 2012, 17: 10052-10064. |
| [17] | Schlicker C, Gertz M, Papatheodorou P, et al. Substrates and regulation mechanisms for the human mitochondrial sirtuins Sirt3 and Sirt5 [J]. J Mol Biol, 2008, 382: 790-801. |
| [18] | Buler M, Aatsinki SM, Izzi V, et al. SIRT5 is under the control of PGC-1α and AMPK and is involved in regulation of mitochondrial energy metabolism [J]. FASEB J, 2014, 28: 3225-3237. |
 2014, Vol. 49
2014, Vol. 49


