2. 哈药集团生物工程有限公司, 黑龙江 哈尔滨 150025
2. Harbin Pharmaceutical Group Bio-Engineering Co., Ltd., Harbin 150025, China
呼吸道病毒感染是人类最常见的疾病之一,其在临床上,初期可表现为亚临床感染,症状较轻,且多可自愈。一旦病情恶化,可引发多种并发症,严重威胁人们的生命健康。上呼吸道感染约90% 是由病毒引起的,主要为流感病毒、副流感病毒、呼吸道合胞病毒、冠状病毒等[1],而博卡病毒、麻疹病毒、水痘-疱疹病毒和巨细胞病毒等引发的感染相对少 见[2]。近年来,不断出现一些新型的以感染呼吸道为主的高致病性病毒,如严重急性呼吸综合征冠状病毒、甲型H5N1人禽流感病毒、2009年新甲型H1N1流感病毒和2013年新甲型H7N9流感病毒等[3, 4]。加之社会人口老龄化、器官移植、免疫抑制剂在免疫相关疾病中的应用、人类获得性免疫缺陷综合征发病率增加和患病人数的累积等因素,使新发或再发呼吸道病毒感染的发病率不断增加,而且有些病毒感染所致的病死率极高,因此这一类型疾病已经成为不容忽视的公共卫生问题。针对呼吸道病毒感染的预防及治疗措施一般相对滞后,且由于病毒容易发生变异,给疫苗研究带来了极大的困难。现有流感疫苗需每年监测抗原变化,只有针对当年流感病毒流行株抗原的疫苗才具有保护作用,保护率仅为60%~80%,远远不能满足市场需求[5],目前其他呼吸道感染病毒也尚无可供应用的疫苗。现有治疗药物数量有限,发展较慢,且仍有很多病毒没有可供使用的特效药物。因此,积极开发广谱高效安全的抗呼吸道病毒新药是对科研人员的严峻挑战[6]。
干扰素 (IFN) 是一种广谱抗病毒剂,大致可分为3类: I型干扰素 (IFN-α、IFN-β、IFN-ω),II型干扰素 (IFN-γ) 以及III干扰素 (IFN-λ1、IFN-λ2、IFN-λ3)。IFN是人体非特异性病毒免疫的重要因子之一,就其本质来说,它是机体对病毒感染最早的免疫反应因子,具有广谱抗病毒活性,几乎对所有病毒都有一定程度的抑制作用。一般来说,RNA病毒比DNA病毒对IFN敏感; 在RNA病毒中,正链RNA病毒对IFN的敏感性又强于负链RNA病毒,即使在同一DNA 或RNA病毒中,不同病毒科、病毒属或病毒株对IFN的敏感性又有很大差别[7]。干扰素并不直接杀伤或抑制病毒,而主要是通过与细胞表面受体作用产生抗病毒蛋白,从而抑制病毒的复制; 同时还可增强自然杀伤细胞 (NK细胞)、巨噬细胞和T淋巴细胞的活力,通过发挥免疫调节作用从而增强其抗病毒能力[8]。近年来,干扰素在抗病毒治疗中,尤其是对慢性乙型肝炎和慢性丙型肝炎的治疗,取得了长足的进展。在抗病毒效应中,由于不同病毒的生物特性不同,干扰素体现出不同的抗病毒效应能力。干扰素α1与受体的结合能力较低,只有与α2相伴随时才能有较高的结合能力,因此临床上干扰素α1的抗病毒效果常不如干扰素α2。由于干扰素诱导的抗病毒蛋白对病毒复制的抑制多发生在胞浆,而对在细胞核内复制的病毒难以发挥直接的抗病毒效应,因此,干扰素对丙型肝炎病毒的抗病毒作用高于乙型肝炎病毒[9]。但是,目前应用干扰素进行呼吸道病毒感染的预防和治疗的报道较少[1,7],所以作者采用CPE法、MTT法和qRT-PCR法研究临床用药重组人干扰素α2b在体外细胞水平是否具有广谱抗呼吸道病毒的作用,希望为临床治疗呼吸道病毒感染提供一定的理论基础和依据。
材料与方法 细胞和病毒人喉癌细胞 (Hep2)、人二倍体细胞 (HEL)、人肺癌细胞 (A549) 及狗肾细胞 (MDCK) 均为本室自行传代保存。冠状病毒 (coronavirus)、副流感病毒 (HPIV-3)、呼吸道合胞病毒 (RSV) 及流感病毒A/FM/1/47 (H1N1) 购自美国典型菌种保藏中心 (ATCC),本室常规传代,-80 ℃冰箱保存。流感病毒: 磷酸奥司他韦耐药株A/辽宁振兴/1109/2010 (H1N1) (LNZX)、金刚烷 胺耐药株A/福建同安/196/2009 (H3N2) (FJTA)、A/江西东湖/312/2006 (H3N2) (JXDH) 和B/济防/13/97由中国疾病预防控制中心病毒病预防控制所提供,本室常规传代,-80 ℃冰箱保存。
实验试剂和仪器细胞培养所用F-12KNutrient Mixture (1X) 培养基、胎牛血清、Non-Essential Amino Acids (NEAA) 和青链霉素混合液 (100X) (GIBCO公司),细胞培养所用Minimum Essential Medium (MEM) 培养基、pH为7.2~7.4的磷酸盐缓冲液 (PBS) (北京迈晨科技有限公司)。
注射用重组人干扰素α2b,3×106 U/支,批号: 20101102 (哈药集团生物工程有限公司); 阳性对照药磷酸奥司他韦 (oseltamivir phosphate,中国药品生物制品检定所); 利巴韦林 (ribavirin,RBV),批号为22081227 (新乡药业); 金刚烷胺 (amantadine,批号为211-560-2)、噻唑蓝 (MTT)、牛血清白蛋白 (BSA) 和甲苯磺酰苯丙氨酰氯甲酮(TPCK) 处理的胰蛋白酶 (Sigma公司); 二甲基亚砜 (DMSO,北京化工厂)。
细胞培养瓶和96孔培养板 (美国Corning公司); 二氧化碳孵箱 (Model 3111) 和低速离心机 (美国Thermo公司); 酶标仪 (ELX808,美国BioTeK公司); 7500-fast real time PCR system (Applied Biosystems公司); 生物安全柜 (美国NUAIRE公司); 倒置显微镜 (奥林巴斯公司)。
维持液配制流感病毒维持液: 将40 mL 1% BSA,5 mL青链霉素混合液 (100X),5 mL NEAA和 1 mg TPCK处理的胰蛋白酶加入至500 mL MEM 或F-12K Nutrient Mixture (1X) 培养基中得到含0.08% BSA和2 μg·mL-1 TPCK处理的胰蛋白酶的 维持液,于4 ℃保存,用前预热至37 ℃。副流感病毒、呼吸道合胞病毒和冠状病毒的维持液: 将10 mL血清,5 mL青链霉素混合液 (100X) 加入至500 mLF-12K Nutrient Mixture (1X) 培养基中得到含2% 血清的维持液,于4 ℃保存,用前预热至37 ℃。
CPE判断标准利用倒置显微镜观察各孔细胞的生长状态,不同浓度给药的细胞与正常细胞 (未加药细胞) 比较,以细胞状态改变或死亡比例分别标记为4+ (细胞死亡比例75%~100%)、3+ (细胞死亡比例50%~75%)、2+ (细胞死亡比例25%~50%)、1+ (细胞死亡比例0~25%)、0+ (细胞形态未发生变化或全部存活),标记为0+表示无毒。
qRT-PCR引物及试剂盒内参对照3-磷酸甘油醛脱氢酶 (glyceraldehyde phosphate dehydrogenase,GAPDH) 引物: 5'-CTCTGGAAAGCTGTGGCGTGA TG-3' 和5'-ATGCCAGTGAGCTTCCCGTTCAG-3'; 甲型流感病毒离子通道蛋白M2通用引物: 5'-GACCRA TCCTGTCACCTCTGAC-3' 和5'-GGGCATTYTGGAC AAAKCGTCTACG-3' 均由北京Invitrogen公司合成。RNA提取试剂盒 (RNeasy Mini kit) 为QIAGEN公司产品,荧光定量qRT-PCR试剂盒 (TransScriptTM Green One-Step qRT-PCR SuperMix) 为TransGen Biotech公司产品。
细胞毒测定(MTT染色法)Hep2细胞: 以细胞数1×104或5×103个/孔加入96孔板。在37 ℃孵箱培养16 h后,用2% FBS的F-12K Nutrient Mixture (1X) 培养基按浓度梯度稀释药物平行3孔,加入到培养板中 (原培养基吸弃),继续培养。给药72 h (1×104个/孔) 或96 h (5×103个/孔) 后,进行MTT检测,每孔加入5 mg·mL-1 MTT 10 μL后于37 ℃放置 4 h,终止时加入DMSO 150 μL,最后测定490 nm的吸收值 (OD)。
HEL细胞: 以细胞数5×104个/孔加入96孔板 中。在37 ℃孵箱培养16 h后,用2% FBS的F-12K Nutrient Mixture (1X) 培养基按浓度梯度稀释药物平行3孔,加入到培养板中 (原培养基吸弃),继续培养。给药72 h后,进行MTT检测 (同上)。
A549细胞: 以细胞数2×104个/孔加入96孔板中。在37 ℃孵箱培养16 h后,用含1% NEAA和0.08% BSA的F-12K Nutrient Mixture (1X) 培养基按浓度梯度稀释药物平行3孔,加入到培养板中 (原培养基吸弃),继续培养。给药72 h后,进行MTT检测 (同上)。
MDCK细胞: 以细胞数3×104个/孔加入96孔板中。在37 ℃孵箱培养16 h后,用含1% NEAA和0.08% BSA的MEM培养基按浓度梯度稀释药物平行3孔,加入到培养板中 (原培养基吸弃),继续培养。给药72 h后,进行MTT检测 (同上)。
实验均设细胞对照孔,结果用Reed-Muench法计算半数有毒浓度TC50,计算公式如下:
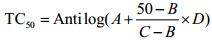
Hep2细胞以1×104个/孔接种到96孔板中,培养16 h后病毒用病毒稀释液稀释,药物用维持液稀释,感染时将100 μL滴度为100TCID50的病毒液与100 μL含有不同浓度药物的维持液混合后加到细胞中,待病毒对照组病变达4+ 时观察结果,并用Reed-Muench法计算半数抑制浓度IC50 (方法同TC50) 及选择指数 (SI = IC50 / TC50)。
抗呼吸道合胞病毒活性 (CPE法)Hep2细胞以5×103个/孔接种到96孔板中,培养16 h后病毒用病毒稀释液稀释,药物用维持液稀释,感染时将100 μL滴度为100TCID50的病毒液与100 μL含有不同浓度药物的维持液混合后加到细胞中,待病毒对照组病变达4+ 时观察结果,并用Reed-Muench法计算半数抑制浓度IC50 (方法同TC50) 及选择指数 (SI = IC50 / TC50)。
抗冠状病毒活性 (CPE法)HEL细胞以5×104 个/孔接种到96孔板中培养16 h,100 μL滴度为100TCID50的病毒液感染细胞2 h,2 h后改用维持液稀释的药物,继续培养至病毒对照组病变达4+ 时观察结果,并用Reed-Muench法计算半数抑制浓度IC50 (方法同TC50) 及选择指数 (SI = IC50 / TC50)。
抗流感病毒B活性测定(CPE法)MDCK细胞以3×105个/孔接种到96孔板中培养16 h,弃培养液后PBS洗1次(吸弃),加入100 μL滴度为100TCID50的病毒液,吸附2 h后,弃病毒液,加入不同浓度待测药液或阳性对照药处理,每浓度2孔,继续培养至病毒对照组病变达4+ 时观察结果,并用Reed-Muench法计算半数抑制浓度IC50 (方法同TC50) 及选择指数 (SI = IC50 / TC50)。
抗流感病毒A活性测定 (qRT-PCR法)A549细胞以6×105个/孔接种到6孔板中,培养16 h后,用PBS洗1次板(原液弃掉),再用600 μL滴度为100TCID50的病毒液感染细胞,2 h后加入不同浓度 待测药液或阳性对照药处理。培养48 h后,吸弃培 养基,用RNeasy Mini Kit提取细胞内总RNA,流感病毒RNA表达水平用TransScriptTM Green One-Step Qrt-PCR SuperMix在7500-fast real time PCR system (Applied Biosystems) 上定量检测,即20 μL反应体系按照50 ℃ 5 min,94 ℃ 30 s,40个循环 (94 ℃ 5 s,60 ℃ 15 s,72 ℃ 10 s) 进行荧光定量反应。计算各浓度药物对流感病毒的抑制率 (%) (抑制率计算公式如下所示),并用Reed-Muench法计算半数抑制浓度IC50 (方法同TC50) 及选择指数 (SI = IC50 / TC50)。
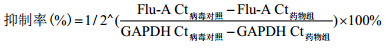
采用SPSS13.0统计程序的t检验比较药物对流感病毒RNA的抑制作用。
结果 1 MTT法测定细胞毒性结果在进行重组人干扰素α2b的体外药效评价之前,先采用MTT法对其在不同细胞中的毒性进行测定。如表 1所示: Hep2细胞在5×103个/孔时,重组人干 扰素α2b毒性的TC50为31 337.27 U·mL-1; 在1×104个/孔时,重组人干扰素α2b毒性TC50为125 263.49 U·mL-1; HEL细胞在5×104个/孔时,重组人干扰素α2b毒性的TC50 >3×105 U·mL-1; A549细胞在2×105个/孔时,重组人干扰素α2b的TC50 >3×105 U·mL-1; MDCK细胞在3×105个/孔时,重组人干扰素α2b的TC50为212 924.29 U·mL-1。以上结果说明重组人干扰素α2b对各细胞株的毒性较低,与其在临床上用药的安全性相一致。
|
|
Table 1 TC50 of drugs on cells (MTT). -: Not tested |
在药物的无毒浓度下,采用CPE法对重组人干扰素α2b在细胞水平对副流感病毒、呼吸道合胞病毒和冠状病毒的药效进行评价。每个毒株的评价工作都进行了3次实验。如表 2所示,重组人干扰素α2b对副流感病毒的半数抑制浓度 (IC50) 为39.79 U·mL-1,选择指数SI为1 476.63; 对呼吸道合胞病毒的IC50为104.64 U·mL-1,选择指数SI为141.37; 对冠状病毒的IC50为122.75 U·mL-1,选择指数SI >2 820.76。重组人干扰素α2b对3种病毒的药效均强于对照药物 利巴韦林,说明其具有很好的抗呼吸道病毒活性,有很好的应用前景。
|
|
Table 2 IC50 of drugs on virus (CPE) |
由于B型流感病毒缺乏离子通道蛋白M2,无法利用针对M2的通用引物进行qRT-PCR的测定,所以仍利用CPE法,在流感病毒易感的MDCK细胞中进行药效评价。药物在细胞内对流感病毒B的抑制作用见表 3。在MDCK细胞中,重组人干扰素α2b对流感病毒B/济防/13/97的IC50为88 332.47 U·mL-1,选择指数SI为2.74; 阳性对照药利巴韦林在10 μg·mL-1时对流感病毒B/济防/13/97的IC50为0.11 μg·mL-1,选择指数SI为5 934.83; 磷酸奥司他韦在40 μg·mL-1时,金刚烷胺在10 μg·mL-1时对流感病毒B/济防/13/ 97均没有抑制作用。结果说明重组人干扰素α2b对 B型流感病毒的抑制作用不是很好,具体原因还需进一步深入机制研究。
|
|
Table 3 IC50 of drugs on influenza virus B (CPE) |
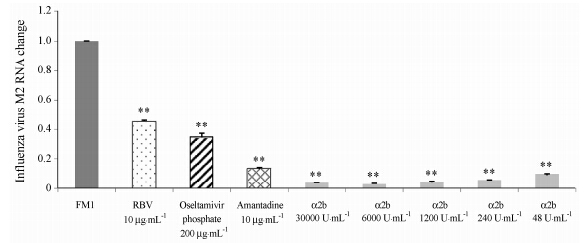
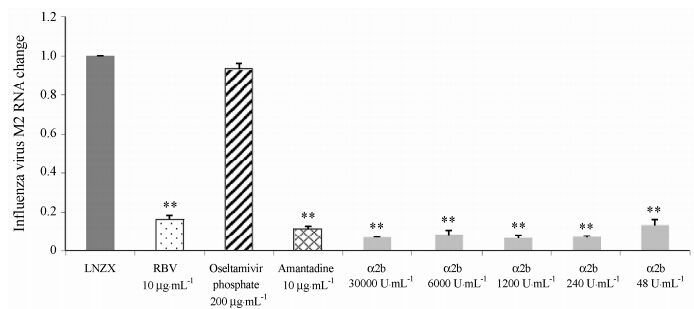
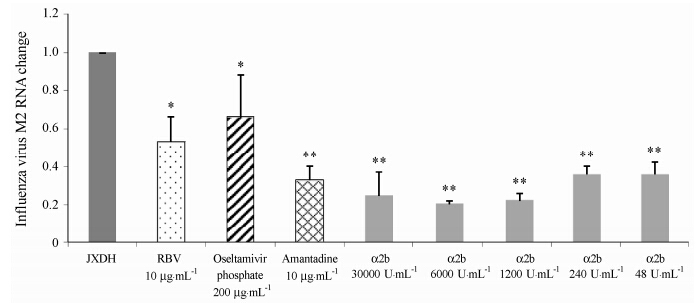
采用CPE法评价药物的抗病毒药效有一定的主观性。随着实验技术的发展,采用新的实验手段进行药物抗病毒筛选已经广泛应用。根据文献资料的查 询,本实验室建立了qRT-PCR的方法来评价药物对A型流感病毒的作用。如图 1~4和表 4所示,对于流感病毒A/FM/1/47 (/H1N1) 株: 重组人干扰素α2b的IC50 < 48 U·mL-1,选择指数SI >6 250; 磷酸奥司 他韦在200 μg·mL-1时抑制效率为65.59%; 利巴韦 林在10 μg·mL-1时抑制效率为54.28%; 金刚烷胺在10 μg·mL-1时抑制效率为86.34%。
|
Figure 1 The inhibitory activity of drugs on influenza virus A (FM1) RNA (qRT-PCR). **P < 0.01 vs FM1 |
|
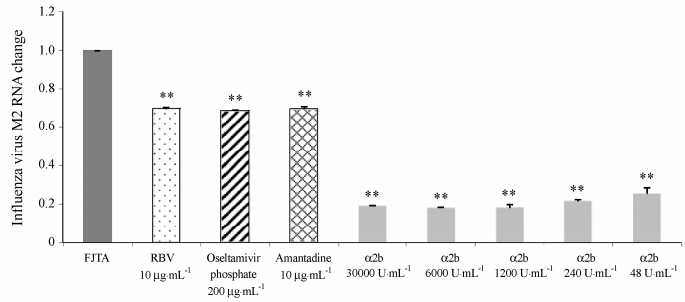
Figure 2 The inhibition of drugs on influenza virus A (FJTA) RNA (qRT-PCR). **P < 0.01 vs FJTA |
|
Figure 3 The inhibition of drugs on influenza virus A (LNZX) RNA (qRT-PCR). **P < 0.01 vs LNZX |
|
Figure 4 The inhibition of drugs on influenza virus A (JXDH) RNA (qRT-PCR). P < 0.05,**P < 0.01 vs JXDH |
|
|
Table 4 The inhibition of recombinant human interferon alpha 2b on influenza virus A RNA (IC50,U·mL-1) (qRT-PCR) |
对流感病毒A/福建同安/196/2009 (H3N2) 株: 重组人干扰素α2b的IC50为82.84 U·mL-1,选择指数 SI > 3 621.44; 磷酸奥司他韦在200 μg·mL-1时抑制效率为31.32%; 利巴韦林在10 μg·mL-1时抑制效率为30.15%; 金刚烷胺在10 μg·mL-1时抑制效率为30.48%。
对流感病毒A/辽宁振兴/1109/2010 (H1N1) 株: 重组人干扰素α2b的IC50 < 48 U·mL-1,选择指数SI > 6 250; 磷酸奥司他韦在200 μg·mL-1时抑制效率为6.47%; 利巴韦林在10 μg·mL-1时抑制效率为83.48%; 金刚烷胺在10 μg·mL-1时抑制效率为88.27%。
对流感病毒A/江西东湖/312/2006 (H3N2) 株: 重组人干扰素α2b的IC50为177.92 U·mL-1,选择指数SI >1 686.20; 磷酸奥司他韦在200 μg·mL-1时抑制效率为33.81%; 利巴韦林在10 μg·mL-1时抑制效率为46.53%; 金刚烷胺在10 μg·mL-1时抑制效率为67.03%。
以上结果说明,重组人干扰素α2b对多种A型流感病毒的RNA均有很强的抑制作用,从而抑制流感病毒的增殖,其药效优于所选浓度下的对照药物。
讨论呼吸道病毒感染性疾病是临床最常见的疾病之一,其病原学复杂、病毒变异性大,易在人群中造成暴发流行。可引起呼吸道感染的病毒多达100~200余种,包括RNA病毒和DNA病毒两种类型,其中最常见的致病病毒包括流感病毒、副流感病毒、呼吸道合胞病毒、腺病毒、鼻病毒及冠状病毒等。近年来,不断出现一些不同种类的以感染呼吸道为主的新型高致病性病毒,有些病毒感染所致的病死率极高,因此这一类型疾病已经成为不容忽视的公共卫生问题。但是针对呼吸道病毒感染得到的预防及治疗措施相对滞后,由于病毒容易发生变异,给疫苗研究带来了很大困难。另外现有治疗药物数量有限[10, 11],有的病毒缺乏特效药物,成千上万的患者急需药物预防及治疗。
干扰素 (IFN) 作为一种广谱抗病毒剂,是目前用于临床治疗最重要的细胞因子之一。干扰素在宿主细胞受到刺激,如病毒、细菌等各种病原体侵染时产生,并最终启动机体免疫系统的保护机制[12]。干扰素作用于同一或邻近细胞的IFN受体,激活一系列的抗病毒级联反应,从而诱导上百种含干扰素刺激反应元件的基因转录[13]。这些干扰素激活大量抗病毒相关基因的表达,如2',5'-寡腺苷酸合成酶 (OAS)、蛋白激酶 (PKR)、IFITM3、Mx蛋白等[14]。干扰素在对慢性乙型肝炎和慢性丙型肝炎抗病毒治疗方面,近些年取得了长足的进展。但是,应用干扰素进行呼吸道病毒感染的预防和治疗仅有少量的文献报道[1,7],主要是在临床上的抗病毒药效评价。目前临床上对呼吸道疾病的病原诊断多采用血常规检测的方法,检测疾病是由细菌还是病毒引起,然后对症治疗,但是仍缺乏广谱抗呼吸道病毒的特效药物,因此,具有广谱抗呼吸道病毒活性的干扰素为临床上的病毒性呼吸道疾病的防治提供了希望,如近期研究发现新型天然Ⅰ型干扰素Alferon N可以抑制野生型流感病毒,同时还可以阻止H7N9药物抗性病毒的复制[15]。
重组人干扰素α2b是目前抗病毒药物中临床疗效显著者之一,对多种病毒感染性疾病如乙肝、丙肝、带状疱疹和子宫颈糜烂等均有良好的疗效,重组人干扰素α2b由于其低免疫原性、符合人体自然状态、高比活性等特点成为临床首选的干扰素α亚型。目前对于重组人干扰素α2b对呼吸道病毒是否具有抑制效果还未有较为全面和具体的报道。本研究应 用CPE法、MTT法和qRT-PCR法等多种方法,发现临床用重组人干扰素α2b在体外细胞水平上具有广谱抗呼吸道病毒的作用。实验结果显示重组人干扰素α2b在体外对多种野生型流感病毒、耐药流感病毒、副流感病毒、冠状病毒和呼吸道合胞病毒均有很好的抑制活性,而且重组人干扰素α2b毒性低,治疗指数高,治疗效果优于阳性对照药物。因此,重组人干扰素α2b在体外药效实验中呈现出很好的广谱抗呼吸道病毒的效果。关于重组人干扰素α2b在体内是否具有同样的抑制效果,还需进一步确认和研究。在后续研究中作者将开展重组人干扰素α2b体内抗呼吸道病毒感染的药效评价。鉴于本研究发现的其对多种呼吸道病毒较好的抑制作用,重组人干扰素α2b有希望成为临床治疗呼吸道病毒感染的特效药。
| [1] | Gao LL, Yu SY, Chen Q, et al. A randomized controlled trial of low-dose recombinant human interferons α-2b nasal spray to prevent acute viral respiratory infections in military recruits [J]. Vaccine, 2010, 28: 4445-4451. |
| [2] | Paranhos-Baccala G, Komurian-Pradel F, Richard N, et al. Mixed respiratory virus infections [J]. J Clin Virol, 2008, 43: 407-410. |
| [3] | Nguyen-Van-Tam JS, Sellwood C. Intervention strategies for emerging respiratory virus infections: policy and public health considerations [J]. Curr Opin Virol, 2013, 3: 192-198. |
| [4] | Shen Z, Chen Z, Li X, et al. Host immunological response and factors associated with clinical outcome in patients with the novel influenza A H7N9 infection [J]. Clin Microbiol Infect, 2013, 20: O493-O500. |
| [5] | Pica N, Palese P. Toward a universal influenza virus vaccine: prospects and challenges [J]. Annu Rev Med, 2013, 64: 189- 202. |
| [6] | Chen HS, Zhang XQ. Antivirus Drug: Methods and Applications: Vol 20(抗病毒药物及其研究方法: 第20卷)[M]. Beijing: Chemical Industry Press, 2006: 328. |
| [7] | Yu DX, Chen Q, Zhang LL, et al. A field trial of recombinant human interferon α-2b for nasal spray to prevent SARS and other respiratory viral infections [J]. Chin J Exp Clin Viro(中华实验和临床病毒学杂志), 2005, 19: 216-219. |
| [8] | Fensterl V, Sen GC. Interferons and viral infections [J]. Biofactors, 2009, 35: 14-20. |
| [9] | Chevaliez S, Pawlotsky JM. Interferons and their use in persistent viral infections [J]. Handb Exp Pharmacol, 2009: 203-241. |
| [10] | Zu M, Zhou D, Gao L, et al. Evaluation of Chinese traditional patent medicines against influenza virus in vitro [J]. Acta Pharm Sin(药学学报), 2010, 45: 408-412. |
| [11] | Zhang Q, Zhao QJ, Xiong RS, et al. Research progress of anti-influenza virus agents [J]. Acta Pharm Sin(药学学报), 2010, 45: 289-299. |
| [12] | de Weerd NA, Samarajiwa SA, Hertzog PJ. Type I interferon receptors: biochemistry and biological functions [J]. J Biol Chem, 2007, 282: 20053-20057. |
| [13] | van de Sandt CE, Kreijtz JH, Rimmelzwaan GF. Evasion of influenza A viruses from innate and adaptive immune responses [J]. Viruses, 2012, 4: 1438-1476. |
| [14] | Wang X, Hinson ER, Cresswell P. The interferon-inducible protein viperin inhibits influenza virus release by perturbing lipid rafts [J]. Cell Host Microbe, 2007, 2: 96-105. |
| [15] | Liu Q, Ma J, Strayer DR, et al. Emergence of a novel drug resistant H7N9 influenza virus: evidence based clinical potential of a natural IFN-α for infection control and treatment [J]. Expert Rev Anti Infect Ther, 2014, 12: 165-169. |
 2014, Vol. 49
2014, Vol. 49


