2. 新疆埃乐欣药业有限公司, 新疆 乌鲁木齐 830013
2. Xingjiang Ailexin Pharm. Co., Ltd., Urumqi 830013, China
固有溶出率 (intrinsic dissolution rate,IDR) 可用于表示固体药物特性[1, 2]、推断溶出速率与晶型的关系或研究表面活性剂和pH值对难溶药物增溶作用的影响[3, 4]。在新药研发过程中,固有溶出率是成药性研究的重要内容,若大于1 mg·cm-2·min-1,说明该药物在制备成口服固体制剂时,其溶出过程一般不会成为吸收的限速过程[5]; 原料药的固有溶出率不仅能够描述药物的溶出速率,是药物处方前研究的一项重要物理参数; 还可以用于评价原料药批次间、不同来源、不同结晶条件或不同晶型的一致性[6],为药物原料药质量评价和生产工艺的筛选提供重要数据。固有溶出率可以作为原料药一致性评价的指标,可用于鉴别区分同一物质的不同晶型。以利福昔明为 例,其α、β、γ三种晶型物采用USP固有溶出率测定装置的转盘法,测定出三者之间的固有溶出率有明显差异[7],因此可以对不同晶型药物原料的制备工艺进行考察。
近几年,国内外关于药物固有溶出的研究均有文献报道[2, 8],Lawrence[2]等对BCS分类中的6种 难溶性和9种易溶性药物的IDR进行测定,以0.1 mg·cm-2·min-1为界限来评价溶解性与BCS分类中以溶解度来评价溶解性具有良好的相关性,并建议用IDR来替换溶解度评价药物的溶解性,进而对BCS进行分类。
药物固有溶出率的测定方法和装置见美国药 典USP (34版) 中<1087>章节。USP中收载了转盘 法 (rotating disk system) 和定盘法 (stationary disk system),并规定了原料药的制片压力、直径和搅拌速度范围[9]。欧洲药典和英国药典中也收载了固有溶出度的测定方法,但只规定了转盘法测定装置[10, 11]。中国药典尚未收录固有溶出率测定方法来对原料药质量进行评价。
光纤传感技术已成功用于固体制剂药物溶出度的实时原位测定,无需过滤,无需取样分析[12, 13],节省了大量时间和人力,通过溶出度的过程分析曲线,获取更多的信息,反映更多制剂工艺的差异[17]。
光纤传感药物溶出度分析系统 (fiber-optic drug dissolution test system,FODT) 分为溶出系统和分析系统两部分组成。光纤探头由入射光纤、反射镜和检测光纤组成[18]。当氘灯光源辐射 (200~600 nm) 经聚焦系统经石英光缆到达浸入开放式样品池固定位置的探头,辐射经试液吸收,由探头反射,经光纤到达检测器电感耦合器件 (charged couple device,CCD),分析系统以紫外-可见分光光度法定量分析原理Lambert-Beer定律 (A = ECl) 为依据,对数据进行处理分析,通过更换探头,可调节光程l。
光纤传感药物固有溶出度分析系统将光纤传感药物溶出度分析系统与USP中固有溶出度装置[19] ——转盘法或定盘法结合,仪器系统包括3个部分: 数字压片装置、光纤药物固有溶出度测定仪和固有溶出度检测分析软件; 能够实现固有溶出率的全部实验操作,获得实时原位的化合物固有溶出曲线。
本研究以蒜氨酸原料药为研究对象,分别采用转盘法和定盘法,光纤传感固有溶出度分析仪测定蒜氨酸在不同介质中的固有溶出曲线及固有溶出率,并采用非模型依赖法中的相似因子 (similarity factor,f2) 法对两种装置测定的结果进行比较。f2计算公式如下:
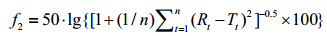
Rt和Tt分别为两种装置药物在t时刻的平均溶 出量; n为取样时间点的个数。
当两条溶出曲线f2值大于50,可认为具有相似性[6]。
材料与方法 仪器与试药光纤传感药物固有溶出度过程分析仪 (FODT-101G),FODT-101 V1.0药物溶出度分析系统 (FODT-101Y),智能数字压片机 (上海富科思生物技术有限公司); 盐酸,冰乙酸 (含量 > 99.8%,天津福晨化学试剂厂); 无水乙酸钠 (含量 > 99.5%,天津永晟精细化工有限公司); 磷酸二氢钾 (分析纯,天津市天新精细化工开发中心); 氢氧化钠 (分析纯,上海试四赫维化工有限公司); 蒜氨酸对照品 (99.5%),蒜氨酸 (93.9%) (新疆埃乐欣药业有限公司)。
溶出介质的配制水: 蒸馏水超声脱气20 min; pH 1.2盐酸溶液: 取盐酸7.65 mL,加水稀释至1 L; pH 4.5醋酸盐缓冲液: 取醋酸钠2.99 g,2 mol·L-1醋酸溶液 (114 → 1 000) 14 mL,加水溶解并稀释至1 L; pH 6.8磷酸盐缓冲液: 取0.2 mol·L-1磷酸二氢钾溶液 (27.22 → 1 000) 250 mL与0.2 mol·L-1氢氧化钠溶液 (8.00 → 1 000) 112 mL混合后,再加水稀释至1 L。
对照品溶液的配制称取蒜氨酸100.32 mg至100 mL量瓶中,用蒸馏水溶解并定容至刻度,得到质量浓度为997.88 μg·mL-1的蒜氨酸储备液。分别用4种溶出介质稀释储备液得到质量浓度分别为15.97、27.94、39.92、55.88、71.85和79.83 μg·mL-1的蒜氨酸系列对照品溶液。
测定波长及光纤探头的选择精密吸取蒜氨酸储备液1.4 mL,于25 mL量瓶,分别加水、pH 1.2 HCl、pH 4.5和pH 6.8缓冲液溶出介质定容至刻度。固有溶出仪在200~600 nm波长范围扫描吸收光谱,根据吸收峰位置分别选择214 nm (水)、214 nm (pH 1.2 HCl)、221 nm (pH 4.5缓冲液) 和221 nm (pH 6.8缓冲液) 为测定波长,550 nm为参比波长; 根据吸光度值确定以5 mm光纤探头进行实验。
方法学考察分别选取不同介质的质量浓度为15.97、27.94、39.92、55.88、71.85、79.83 μg·mL-1的蒜氨酸系列对照品溶液,以吸光度 (A) 值与浓度作标准曲线; 分别取不同介质的同一蒜氨酸对照品溶液测定A值,进行精密度考察; 分别平行配制不同介质线性范围内的高、中、低浓度蒜氨酸对照品溶液各3份,进行方法的重复性考察和相对回收率实验。
固有溶出率测定精密称取蒜氨酸原料药粉末适量,分别置于孔径为4 mm的转盘和定盘模具中,于压片机中,按压力75 kg、5 min制片,将固有溶出装置安装于光纤溶出仪,选择规格为5 mm探头,转速100 r·min-1,于37 ℃溶出介质700 mL,214 nm (水和pH 1.2 HCl) 和220 nm (pH 4.5缓冲液和pH 6.8 缓冲液) 为测定波长,550 nm为参比波长,测定蒜氨酸实时溶出曲线和固有溶出率。
结果 1 方法学考察 1.1 线性关系以A值为横坐标,蒜氨酸浓度 (C) 为纵坐标,求得不同溶出介质的线性方程 (表 1),结果表明蒜氨酸溶液在质量浓度15.97~79.83 μg·mL-1内与吸光度线性良好。
|
|
Table 1 Linear equations of alliin solution with different dissolution media (n = 3) |
在水、pH 1.2 HCl、pH 4.5和pH 6.8缓冲液溶出介质中,同一对照品溶液测定的吸光度相对标准偏差 (relative standard deviation,RSD) (n = 9) 分别为0.09%、0.25%、0.25% 和0.27%,表明仪器精密度良好。
1.3 重复性不同介质的高、中、低蒜氨酸对照品溶液A值的RSD值均小于2% (表 2),表明该方法重复性良好。
1.4 相对回收率不同介质的高、中、低蒜氨酸对照品溶液平均相对回收率均在95%~105%,RSD值均小于2% (表 2),表明本方法回收率良好。
|
|
Table 2 The results of repeatability and relative recovery test. CH: High concentration; CM: Medium concentration; CL: Low concentration |
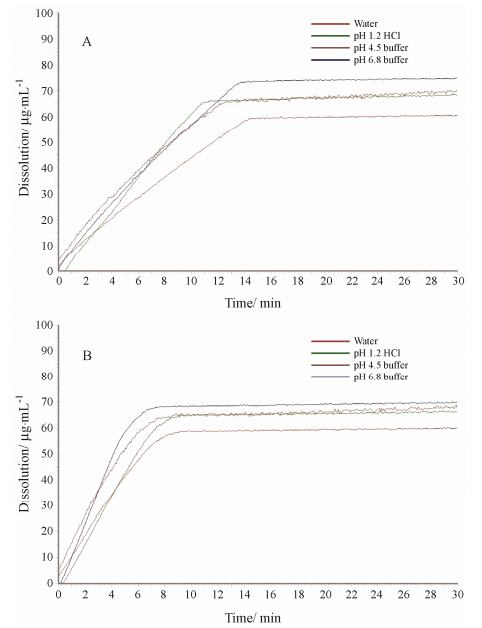
蒜氨酸原料药在上述实验条件下得到30 min内不同溶出介质中的固有溶出曲线 (图 1),结果表明,采用两种方法得到的蒜氨酸溶出过程有差异,定盘法中药物在10 min内几乎全部溶出,而转盘法中药物在15 min几乎全部溶出。在溶出0时刻至全部溶出时,曲线的斜率除以压片的表面积,即为固有溶出率。两种装置测定4种溶媒中的固有溶出曲线,进行f2因子相似度比较 (表 3),以水和pH 1.2盐酸溶液作为介质时,f2 > 50,可认为两种方法具有相似性; 以pH 4.5和pH 6.8缓冲盐作为介质时,f2 < 50,认为两种方法测定结果不具有相似性。
|
Figure 1 Intrinsic dissolution profiles of alliin in four dissolution media: water,pH 1.2 HCl,pH 4.5 buffer and pH 6.8 buffer with rotating disk system (A) and stationary disk system (B) |
|
|
Table 3 Intrinsic alliin dissolution rates and similarity factor. IDR: Intrinsic dissolution rates; f2: Similarity factor (n = 3) |
本研究参考药物溶出度测定实验溶媒,选择水、pH 1.2 HCl、pH 4.5和pH 6.8缓冲液。蒜氨酸在4种溶出介质的平均固有溶出速率为30.25 mg·cm-2·min-1 (转盘法) 和46.92 mg·cm-2·min-1 (定盘法),远大于 1 mg·cm-2·min-1,说明该药物在制备成口服固体制剂时,其溶出过程不会成为吸收的限速因素。
固有溶出率反映了药物的溶解程度和速度,是由化合物固有的结构决定,而溶解度只能反映化合物的溶解程度,因此在成药性研究中,固有溶出速率参数比溶解度更能反映其成药性特点。
光纤传感药物固有溶出度过程分析仪可对药物的固有溶出度进行原位实时监测,数据采集的时间间隔和采集时间均可以自行设置。高溶解性药物一般在短时间内完全溶解,以蒜氨酸为研究对象,蒜氨酸是水溶性很好的化学物质,如果采用传统的取样分析,不可能在短时间内获得大量数据信息,本实验设定5 s为一个数据采集点,在10 min内获得了120个数据,软件系统实时绘制溶出曲线。
实验过程中以介质水为例,参考文献[1]选择转 速75 r·min-1和100 r·min-1对定盘法的转速进行了 研究。当转速为75 r·min-1时,固有溶出率为12.55 mg·cm-2·min-1; 转速为100 r·min-1时,固有溶出率 为43.86 mg·cm-2·min-1,说明转速是药物固有溶出率测定的影响因素。《美国药典》中,转盘法建议使用转速为300 r·min-1,通常其转速调节范围为60~500 r·min-1; 定盘法并未给出要求。而《英国药典》和《欧洲药典》只有转盘法,且未对转速提出建议和要求,因此在制订某一药物固有溶出率测定方法时,与固体制剂药物溶出度测定方法一样,需要规定装置和转速,还有制片参数,如药物用量、压片直径、制片压力和压制时间等。
| [1] | Amidon GE, Higuchi WI, Ho NF. Theoretical and experimental studies of transport of micelle-solubilized solutes [J]. J Pharm Sci, 1982, 71: 77-84. |
| [2] | Yu LX, Carlin AS, Amidon GL, et al. Feasibility studies of utilizing disk intrinsic dissolution rate to classify drugs [J]. Int J Pharm, 2004, 270: 221-227. |
| [3] | Jinno J, Oh DM, Crison JR, et al. Dissolution of ionizable water-insoluble drugs: the combined effect of pH and surfactant [J]. J Pharm Sci, 2000, 89: 268-274. |
| [4] | Dahlan R, McDonald C, Sunderland VB. Solubilities and intrinsic dissolution rates of sulphamethoxazole and trimethoprim [J]. J Pharm Pharmacol, 1987, 39: 246-251. |
| [5] | Hanson R, Gray V. Handbook of Dissolution Testing [M]. 3rd ed. Beijing: Chinese Medical Science and Technology Press, 2007: 19. |
| [6] | Viegas TX, Curatella RU, Winkle LL, et al. Measurement [7] Viscomi GC, Campana M, Braga D, et al. Polymorphous forms of rifaximin, preparation and application thereof used in pharmaceutical preparation: CN, 101260114B [P]. 2012-11-28. |
| [7] | Chen JX, Guo Z, Li HY, et al. Real-time UV imaging of chloramphenicol intrinsic dissolution characteristics from ophthalmic in situ gel [J]. Acta Pharm Sin (药学学报), 2013, 48: 1156-1163. |
| [8] | The United States Pharmacopeia Convention. United States Pharmacopeia/National Formulary [S]. 2011 ed. Vol. 2. Baltimore: United Book Press, 2011. |
| [9] | The European Pharmacopoeia Commission. European Pharmacopoeia [S]. 7th ed. Strasbourg: European Directorate for the Quality of Medicines, Council of Europe, 2010. |
| [10] | The British Pharmacopoeia Commission. British Pharmacopoeia [S]. 2010 ed. London: The Stationary Office, 2010. |
| [11] | Zhang QM, Ge JH, Chen J. Continuous in situ monitoring of the dissolution rate of solid pharmaceutical preparations using a multiple channel fiber-optic chemical sensor [J]. Acta Pharm Sin (药学学报), 2003, 38: 294-297. |
| [12] | Li XX, Wang Y, Xu PP, et al. Effects of temperature and wavelength choice on in-situ dissolution test of cimetidine tablets [J]. J Pharm Anal, 2013, 3:71-74. |
| [13] | Li XX, Wang YW, Wang Y, et al. A fiber optic chemical sensor system for on-line monitoring the drug dissolution of Rifampicin [J]. Acta Pharm Sin (药学学报), 2002, 37: 721-723. |
| [14] | Zhu B, Xing JF, Chen J, et al. Continuous in situ monitor-ing of the dissolution rate of metronidazole tablets using a fiber-optic chemical sensor [J]. Acta Pharm Sin (药学学报), 1994, 29: 369-374. |
| [15] | Jin L, Li L, Li XX, et al. Rapid analysis of metronidazole tablets by optic-fiber sensing technologies and the similarity of ultraviolet spectra [J]. Acta Pharm Sin (药学学报), 2011, 46: 203-206. |
| [16] | Nie K, Li L, Li XX, et al. Monitoring ambroxol hydrochloride sustained-release tablets release by fiber-optic drug dissolution in situ test system [J]. Dissolut Technol, 2009, 16: 14-17. |
| [17] | Issa MG, Ferraz HG. Intrinsic dissolution as a tool for evaluating drug solubility in accordance with the biopharmaceutics classification system [J]. Dissolut Technol, 2011, 18: 6-13. |
| [18] | Shah VP, Tsong Y, Sathe P, et al. In vitro dissolution pro-file comparison-statistics and analysis of the similarity factor, f2 [J]. Pharm Res, 1998, 15: 889-896. |
 2014, Vol. 49
2014, Vol. 49


