熊果苷(arbutin),又名熊果素、熊果叶苷、熊果酚苷,其化学名称为对羟基苯-D-吡喃葡萄糖苷,最初是从杜鹃花科熊果属植物叶子中提取的一种天然活性物质,具有抗炎、抑菌、镇咳、祛痰、平喘及美白作用[1-4]。因熊果苷能有效地抑制黑素细胞酪氨酸酶活性[5-7],阻断黑色素的形成,并可通过自身与酪氨酸酶直接结合,加速黑色素的分解与排泄,从而减少皮肤色素沉积,达到美容美白的效果,在美白类化妆品行业中常被作为美白添加剂[8],因此,熊果苷在化妆品中的含量限定可作为评价其质量优劣的重要指标。而我国目前对化妆品含量限定评价的欠缺导致部分商家以假乱真,以次充好,严重侵害了消费者的权益,对其有效检测方法的深入研究势在必行,建立快速有效的分析方法,对于保证化妆品的质量和维护消费者的权益具有重要意义。近年来,对于熊果苷的研究主要集中于其合成方法及含量测定方法,在对照品的定值[9-11]研究方面尚属空白。
本文分别采用质量平衡法、差示扫描量热法(DSC法)及定量核磁共振法(qNMR法)3种方法对熊果苷对照品的含量进行定值研究[12-15]。其中,质量平衡法以高效液相色谱法结合其他杂质定量方法进行定值(定值公式:含量=(100.0-水分量-灰分量-溶剂残留量)×色谱纯度×100%);差示扫描量热法基于热动力学原理通过度量熊果苷对照品中的总杂质绝对含量来对其进行定值;而qNMR法选择已标定纯度的肌酐为内标物,以氘代水为溶剂,由内标物特征峰面积与熊果苷对照品的特征峰面积计算熊果苷对照品的纯度值。3种方法的测定能够更好地保证熊果苷对照品赋值的准确性。因此,该方法的建立有利于为我国化妆品的市场监督与企业管理提供技术保障,同时可规范企业的化妆品生产,从而保证其使用安全性[16],保护消费者的权益不受侵害,具有一定的应用价值。α-熊果苷结构见图 1。
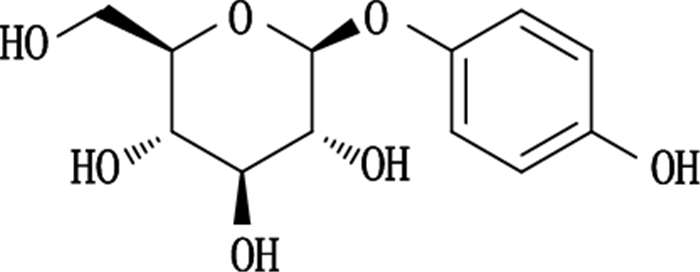
|
图 1 α-熊果苷结构式 Figure 1 Structure of α-arbutin |
Agilent 1100高效液相色谱仪(Agilent公司),Diamond DSC仪(Perkin-Elmer公司),Agilent 7890A-G1888顶空气相色谱仪(Agilent公司),KF库伦法卡式水分测定仪(Metrohm公司),7500CE型电感耦合等离子体质谱仪(Agilent公司),Bruker AVANCE IIITM 800核磁共振仪配置Quadruple inverse 5 mm CPQCI cryo-probehead(H-P/C/N)四共振超低温探头(Bruker公司),UMX2型十万分之一电子分析天平(Mettler Toledo公司)。
1.2 试药熊果苷对照品原料(TRC公司,纯度为88.7%),乙腈(色谱纯,Merck公司),甲酸(色谱纯,Merk公司)、D2O(Sigma公司),内标肌酐标准物质(NIST公司),二水酒石酸钠(Sigma公司),超纯水(Millipore纯化水系统制备)。
2 方法与结果 2.1 熊果苷对照品制备取熊果苷对照品原料800 mg,采用葡聚糖凝胶色谱法对熊果苷样品进行纯化,由薄层色谱和高效液相色谱检识,合并纯度大于98%的流分,减压回收溶剂,真空干燥,制备得熊果苷对照品约620 mg。将熊果苷对照品分装成30份(每份约20 mg),密闭干燥保存。
2.2 质量平衡法定量 2.2.1 纯度分析 2.2.1.1 供试溶液制备随机抽取“2.1项下”熊果苷对照品1份,称取适量,加甲醇溶解制成1 mg·mL-1的熊果苷供试溶液。
2.2.1.2 高效液相色谱条件色谱柱:Xqua C18(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-水(B),梯度洗脱(0~15 min,100%B;15~50 min,100%B→100%A;50~60 min,100%A);流速:1 mL·min-1;柱温:30 ℃;检测波长:226 nm;进样量:5 μL。在上述色谱条件下,质量浓度为1 mg·mL-1的熊果苷溶液色谱图见图 2。
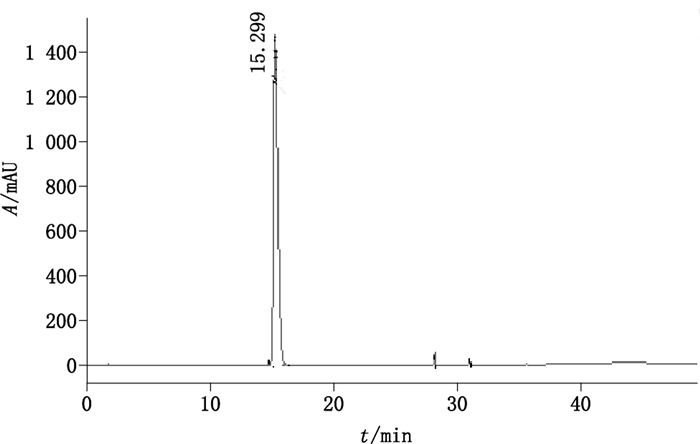
|
图 2 熊果苷HPLC色谱图 Figure 2 HPLC chromatogram of arbutin |
色谱柱:Agilent DB-XLB(15 m×0.25 mm×0.25 μm),分流比5:1,载气为氮气,流速1.5 mL·min-1,进样口温度250 ℃,检测器温度250 ℃,柱温为程序升温(0 min时70 ℃,以10 ℃·min-1升至300 ℃,保持12 min)。在上述色谱条件下,质量浓度为1 mg·mL-1的熊果苷溶液色谱图见图 3。
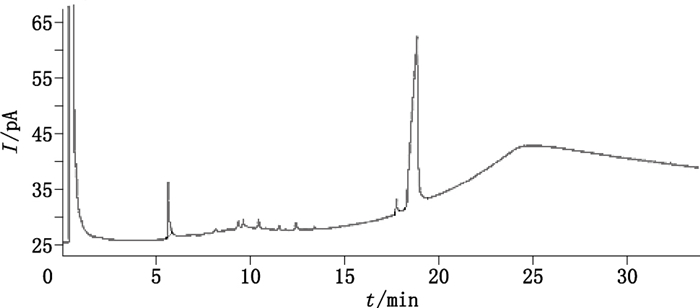
|
图 3 熊果苷GC色谱图 Figure 3 GC chromatogram of arbutin |
从“2.1”项下熊果苷对照品样本中随机抽取13个独立样本,制备供试溶液,在上述高效液相色谱条件下测量纯度,按峰面积归一化法计算得13个测量数据,各个独立样本中熊果苷的色谱纯度分别为99.10%、99.12%、99.11%、99.12%、99.11%、99.10%、99.12%、99.11%、99.11%、99.10%、99.11%、99.10%、99.12%,均值(n=13)为99.11%,RSD为0.008%。
2.2.1.5 气相色谱测定结果从“2.1项下”熊果苷对照品样本中随机抽取13个独立样本,制备供试溶液,在上述气相色谱条件下测量纯度,按峰面积归一化法计算得13个测量数据,各个独立样本中熊果苷的色谱纯度分别为99.11%、99.10%、99.10%、99.10%、99.11%、99.10%、99.09%、99.09%、99.11%、99.10%、99.10%、99.10%、99.11%,均值(n=13)为99.10%,RSD为0.007%。
2.2.2 水分参照《中华人民共和国药典》2015年版四部通则限量检查法(水分测定法),采用卡尔费休库伦法测定熊果苷标准物质中的水分。精密称取熊果苷对照品样本10 mg,迅速打开滴定池上塑胶盖将其置于反应瓶中,仪器触控面板处输入样品称量质量,滴定结束系统自动显示计算出的含水量,每个样本重复测定5次。温度25 ℃,湿度<5%,初始漂移≤10 μg·min-1,样本溶解时间120 s,转速50 r·s-1,。水分测定结果均值为0.013%,RSD为0.12%。
2.2.3 灰分参照《中华人民共和国药典》2015年版四部通则光谱法(电感耦合等离子体质谱法)测定对照品样本的灰分含量。供试溶液为10 mg·ml-1熊果苷甲醇溶液。测定条件:RF功率1.3~1.5 kW,采样深度6~10 mm,载气流速0.4~1.2 L·min-1,反应气为H2模式(2~4 mL·min-1),蠕动泵转速0.1~0.3 r·min-1;离子透镜参数:提取电位(-5±5)V,聚焦电位1、3为-195~50 V,聚焦电位2为(-30±10)V;检测器参数:Discriminator为8 mV,Analog HV为1.6~2.0 kV,Pulse HV为1.1~1.6 kV。选取全部ICP-MS可测元素同位素,选择全元素半定量特有的核质比点积分方式,每个核质比点积分时间为0.1 s,重复测定3次,检测器选择Auto档。灰分测定结果均值为0.000 05%。
2.2.4 残留溶剂参照《中华人民共和国药典》2015年版四部通则限量检查法(残留溶剂测定法),采用顶空气相色谱法。称取熊果苷对照品样本6份,每份10 mg。气相色谱条件同“2.2.1.3”项;顶空进样器参数:加热箱70 ℃,环路温度80 ℃,传输线温度100 ℃,样品平衡时间20 min,循环时间40 min,加压时间0.4 min,环路充装时间0.4 min,环路平衡时间0.05 min,注射时间1 min。结果显示熊果苷对照品样本中无明显的残留溶剂(检测下限通常约为0.1 mg·L-1)。
2.2.5 质量平衡法计算结果定值的纯度以
高效液相色谱法计算得熊果苷纯度均值(n=13)为99.10%,RSD为0.008%;气相色谱法计算得熊果苷纯度均值(n=13)为99.09%,RSD为0.007%。
2.3 差示扫描量热法定量 2.3.1 差示扫描量热法条件测量采用动态法,连续加热使样品熔融,获得数据。样品纯度测试:样品取样量约为2 mg,从150 ℃开始加热,升温速率为10 ℃·min-1,样品全部熔融时间为6 min。坩埚热阻采用纯金属In测量,取13次测量平均值。数据处理:积分区间6%~60%。差示扫描量热曲线见图 4。
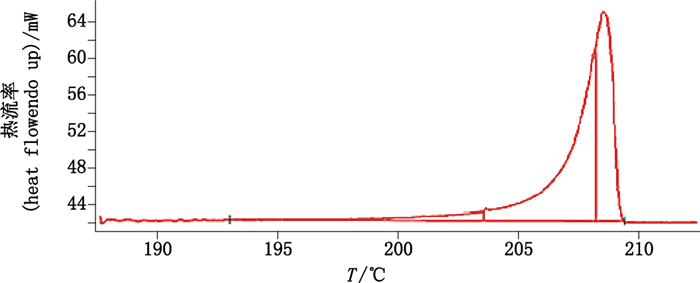
|
图 4 熊果苷差示扫描量热曲线图 Figure 4 DSC curve of arbutin |
从“2.1”项下熊果苷对照品样本中随机抽取13个独立样本,在上述差示扫描量热条件下测量纯度,各独立样本的纯度分别为99.18%、99.19%、99.21%、99.20%、99.19%、99.17%、99.21%、99.19%、99.18%、99.17%、99.18%、99.21%、99.19%,均值(n=13)为99.18%,RSD为0.012%。
2.3.3 差示扫描量热法计算结果定值的纯度以
差示扫描量热法测量熊果苷纯度均值(n=13)为99.18%,RSD为0.012%。
2.4 3种方法纯度定值结果等精度检验采用科克伦法对3种方法定值结果进行等精度判定。科克伦计算公式:
| $C = \frac{{S_{\max }^2}}{{\sum\nolimits_i^m {S_i^2} }} $ |
Si为每种方法单次测量的标准偏差;Smax为Si中最大值。
判断准则:当C≤C(α,m,n)时,表明组数据平均值间为等精度,反之判为不等精度。其中m为实验测量组数,n为每组实验检测次数,α取0.05。
查科克伦检验临界值表,得C(0.05,2,13)=0.770 0,C(0.05,3,13)=0.583 9。等精度判定结果见表 1。
|
|
表 1 熊果苷等精度判定 Table 1 Equal precision determination of arbutin |
3种方法互为等精度,因此取算术平均值作为最终定值结果,即熊果苷纯度定值结果为99.12%。
2.5 qNMR法定量 2.5.1 供试溶液的制备取熊果苷对照品样本约20 mg及内标物质(肌酐)10 mg,精密称定,一式5份,分别置2 mL离心管中,用约1.5 mL D2O溶解,振荡摇匀,即得。
2.5.2 qNMR法测定条件和结果1H NMR测定参数:激发脉冲角度90,时间域数据点32 k,扫描宽度9 615.385 Hz,弛豫延迟60 s,累计采样8次,探头温度296 K。测定结果见表 2[表中P为纯度(%),m为称样量(mg),n为被指定基团氢的个数,I为共振峰的面积,下标x表示被测组分,std表示内标]。
|
|
表 2 熊果苷qNMR测定结果 Table 2 Results of quantitative NMR determination of arbutin |
以熊果苷1H谱中的δ7.0信号峰与内标物1H谱中的δ2.89信号峰(见图 5)计算样本的含量。
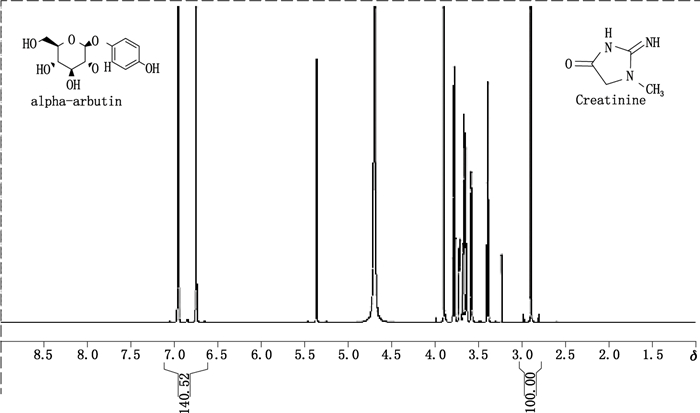
|
图 5 熊果苷qNMR谱图 Figure 5 Quantitative NMR spectrum of arbutin |
含量计算公式:含量=(W1×C1×A2×MW2×2)/(MW1×A1×W2)×100%[其中:W1和W2分别为内标物和对照品样本的称样量;C1为内标物的纯度(99.7%);A1和A2分别为内标物和对照品样本目标峰的积分面积;MW1和MW2分别为内标物和对照品的摩尔分子量(内标物为113.12 g·mol-1,对照品样本为272.25 g·mol-1);2为内标物和对照品样本目标峰所对应的氢质子摩尔数量比]。计算得熊果苷平均含量(n=5)为99.12%,RSD为0.036%。
2.6 不确定度评定 2.6.1 质量平衡法定值不确定度 2.6.1.1 高效液相色谱法定值不确定度① 高效液相色谱法定值测量重复性引入的不确定度u1由13次测量结果的相对标准偏差计算,u1=0.008%。②各组分在不同检测波长下响应差异引入的不确定度u2=0.204%。③做进样量-峰面积线性回归,得到相关系数γ > 0.99,表明分析过程中线性关系好,所以分析过程均在仪器检测线性范围内进行,故非线性响应引入的不确定度u3可以忽略不计。
所以高效液相色谱定值合成标准不确定度:
| ${u_{{\rm{LC}}}} = \sqrt {u_1^2 + u_2^2} = \sqrt {{{0.008}^2} + {{0.00}^2}} = 0.008\% $ |
① 气相色谱法定值测量重复性引入的不确定度u1由13次测量结果的相对标准偏差计算,u1=0.007%。②在纯度测量时,由于熊果苷和杂质在选择的GC法测量条件下灵敏度不同,对杂质测量带来的误差估计为25%,对主体纯度测量带来的误差即0.225%。采用面积归一法时,溶液的配制,溶液浓度的变化,进样体积的改变等因素对测量结果造成的误差大部分可以相互抵消。另外,在选定的色谱条件下,低于检测下限(0.01%)以下的杂质可以忽略不计,因此,可以计算得气相色谱测量时校正因子产生的不确定u2=0.225%。③由于在熊果苷的纯度定值方法研究过程中所确定的进样量均在FID检测器的检测线性范围内,故该部分不确定度忽略不计。
所以气相色谱法定值合成标准不确定度:
| ${u_{{\rm{GC}}}} = \sqrt {u_1^2 + u_2^2} = \sqrt {{{0.007}^2} + {{0.225}^2}} = 0.225\% $ |
① 差示扫描量热法定值测量重复性引入的不确定度uA由13次测量结果的相对标准偏差计算,uA=0.008%。②由仪器测量熔化热引入的不确定度(计为ΔQ/Q)、仪器测量被测物差示扫描量热曲线下熔化峰面积分数引入的不确定度(计为ΔF/F)、被测物称量引入的不确定度(计为Δm/m)、仪器测量温度引入的不确定度[计为ΔT/(T0-Ts)]及标准物质引入的不确定度(计为urel)合成的不确定度uB=0.091%。
所以差示扫描量热法定值合成标准不确定度:
| ${u_{{\rm{DSC}}}} = \sqrt {u_{\rm{A}}^2 + u_{\rm{B}}^2} = \sqrt {{{0.012}^2} + {{0.291}^2}} = 0.092\% $ |
① qNMR法定值测量重复性引入的不确定度uA由5次测量结果的相对标准偏差计算,uA=0.036%。②由天平称量不确定度、核磁测量内标不确定度、摩尔质量不确定度合成的不确定度uB=0.15%。
因此,qNMR法定值合成标准不确定度:
| $ {u_{{\rm{NMR}}}} = \sqrt {u_{\rm{A}}^2 + u_{\rm{B}}^2} = \sqrt {{{0.036}^2} + {{0.15}^2}} = 0.15\% $ |
由于不同方法所测得的数据的差异性,因此考虑方法的差异引入的不确定度,采用方差分析(F检验法)计算。
| ${u_{\rm{R}}} = {S_{\rm{R}}} = \sqrt {\frac{\mathit{1}}{n}\left( {\frac{Q}{{{\gamma _1}}} - \frac{Q}{{{\gamma _2}}}} \right)} = \sqrt {\frac{1}{5}\left( {{{0.42}^2} - {{0.007}^2}} \right)} = 0.18\% $ |
由于研制的标准物质的水分及挥发性物质的含量大于1/1 000,因此在不确定评定中将其计入最终定值不确定度中。即:
| ${u_{{\rm{water}}}} = {\rm{RSD}} \times {\mathit{P}_{{\rm{water}}}} = 0.12 \times 0.013\% = 0.002\% $ |
取上述高效液相色谱法定值不确定度、气相色谱法定值不确定度、差示扫描量热法定值不确定度和qNMR法定值不确定度所得结果的平和方根作为定值结果的不确定度,并考虑方法的差异所引起的不确定度,即:
| $\begin{array}{l} u = \sqrt {u_{{\rm{LC}}}^2 + u_{{\rm{GC}}}^2 + u_{{\rm{NMR}}}^2 + u_{{\rm{DSC}}}^2 + U_{\rm{R}}^2} \\ {\rm{A = }}\sqrt {0.008 + {{0.225}^2} + {{0.091}^2} + {{0.15}^2} + {{0.18}^2}} = 0.38\% \end{array} $ |
熊果苷合成标准不确定度:
扩展不确定度:U=k×uC≈0.38%×2≈0.76%(k为包含因子,取值2)
3 小结与讨论本文采用质量平衡法、差示扫描量热法及qNMR法联合对α-熊果苷对照品进行定值,3种方法测定熊果苷含量的结果基本一致。经上述3种定值方法的测定,熊果苷对照品最终定值结果为99.12%,标准不确定度为0.38%,扩展不确定度为0.76%。
其中,质量平衡法,即测得成分的含量加上水分、溶剂残留和灰分的总量应为100%,但该方法具有一定的局限性,如不同杂质响应值的差异及色谱分离能力的限制,这些因素都将导致质量平衡法测定结果与实际值偏离较大。相比于质量平衡法,差示扫描量热法具有试样用量少,测定时间短,不需要对照品,供试品制备简单,不需分离杂质等优点,但其在测定纯度时,操作条件,如取样量、升温速度等因素均会对测定结果的准确度造成影响。qNMR法是基于核磁共振原理的一种定量分析方法。由于qNMR法测定对照品纯度时不受杂质的影响,也无需已知纯度的标准物质,而仅以已知纯度的普通化学物质(内标物)为参比,就可测得被测物的绝对纯度,且具有灵敏度高,精密度好,分析速度快等优点,所以比较适用于对照品的标定。由于qNMR法在选择合适的内标物时,条件要求比较苛刻,例如内标物信号与待测物中目标峰的信号不发生重叠,化学稳定性好,具有良好的纯度,在不同氘代溶剂中具有良好的溶解性,且其为惰性化合物,不易与其他化合物发生反应等,所以,该方法在测定对照品的纯度时也有一定的局限性。
因此,本实验在采用国际通用的质量平衡法对熊果苷对照品含量进行定值研究的同时,进一步采用差示扫描量热法及qNMR法加以佐证,3种定值方法测定含量结果基本一致,能够更好地保证熊果苷对照品赋值的准确性。此外,本文首次对熊果苷标准物质进行定值,对其含量测定建立了快速有效的检测方法,这不仅填补了熊果苷在定值研究方面的空白,而且该方法的建立也为药品、化妆品等的市场监督提供技术依据,具有一定的应用价值和意义。
| [1] |
刘有停, 张鹏. 化妆品基质原料对α-熊果苷美白功效及稳定性的影响[J]. 日用化学工业, 2012, 42(1): 51. LIU YT, ZHANG P. Effect of cosmetic matrix material on whitening efficiency and stability of α-arbutin[J]. Daily Chem Ind, 2012, 42(1): 51. |
| [2] |
王亚芳, 周宇娜, 张建军. 熊果苷镇咳、祛痰及平喘的药效学研究[J]. 中草药, 2003, 34(8): 739. WANG YF, ZHOU YN, ZHANG JJ. Pharmacodynamics study on antitussive, expectorant and antiasthmatic effects of arbutin[J]. Chin Tradit Herb Drugs, 2003, 34(8): 739. DOI:10.3321/j.issn:0253-2670.2003.08.033 |
| [3] |
王佩, 赖瑛, 吴锡铭. 熊果苷抗炎作用的研究[J]. 中华中医药学刊, 2008, 6(9): 1933. WANG P, LAI Y, WU XM. Study on anti-inflammatory effect of arbutin[J]. Chin Arch Tradit Chin Med, 2008, 6(9): 1933. |
| [4] |
王佩, 赖瑛, 吴锡铭. 熊果苷与甘草酸合用对免疫性炎症的治疗作用[J]. 中国中医药信息杂志, 2009, 16(1): 31. WANG P, LAI Y, WU XM. Therapeutic effect of combination of arbutin and glycyrrhizin on immune inflammation[J]. Chin J Inf Tradit Chin Med, 2009, 16(1): 31. DOI:10.3969/j.issn.1005-5304.2009.01.012 |
| [5] |
LIM YJ, LEE EH, KANG TH, et al. Inhibitory effects of arbutinon melanin biosynthesis of alpha-melanocyte stimulating hormone-induced hyperpigmentation in cultured brownish guinea pig skin tissues[J]. Arch Pharm Res, 2009, 32(3): 367. DOI:10.1007/s12272-009-1309-8 |
| [6] |
孙竞阳, 冯中华, 侯熙彦, 等. 熊果苷类似物的合成、表征及美白活性[J]. 中国药物化学杂志, 2017, 27(4): 267. SUN JY, FENG ZH, HOU XY, et al. Synthesis, characterization and whitening activity of arbutin analogues[J]. Chin J Med Chem, 2017, 27(4): 267. |
| [7] |
刘彩云, 吴培诚, 梁高卫, 等. 3种熊果苷的研究进展[J]. 日用化学工业, 2015, 45(9): 529. LIU CY, WU PC, LIANG GW, et al. Progress in development of three kinds of arbutin product[J]. China Surfact Deterg Cosmet, 2015, 45(9): 529. |
| [8] |
房军, 杜顺晶, 金银龙. 熊果苷在化妆品中应用的研究进展[J]. 卫生研究, 2009, 38(1): 111. FANG J, DU SJ, JIN YL. Research progress of arbutin in cosmetics[J]. J Hyg Res, 2009, 38(1): 111. |
| [9] |
马玲云, 常艳, 戴忠, 等. 基于多元数据分析研究葛根素化学对照品定值准确性与其影响因素的相关性[J]. 药物分析杂志, 2013, 33(12): 2156. MA LY, CHANG Y, DAI Z, et al. Correlation between the calibration accuracy of puerarin and its influential factors based on multivariate analysis[J]. Chin J Pharm Anal, 2013, 33(12): 2156. |
| [10] |
吴昊, 刘斌, 王伟, 等. 荷叶的化学对照品2-羟基-1-甲氧基阿朴啡研究[J]. 药物分析杂志, 2010, 30(9): 1650. WU H, LIU B, WANG W, et al. Lotus leaf chemical reference substance 2-hydroxy-1-methoxy apomorphine study[J]. Chin J Pharm Anal, 2010, 30(9): 1650. |
| [11] |
郑新元, 张茉, 王杰, 等. 黄芩苷对照品2种定值方法比较研究[J]. 药物分析杂志, 2014, 34(6): 1130. ZHENG XY, ZHANG M, WANG J, et al. A comparison study on two measuring methods of baicalin reference substance[J]. Chin J Pharm Anal, 2014, 34(6): 1130. |
| [12] |
徐敏, 陈智群, 王民昌, 等. NTO纯度标准物质定值研究[J]. 化学分析计量, 2011, 20(3): 4. XU M, CHEN ZQ, WANG MC, et al. NTO purity reference material study[J]. Chem Anal Meter, 2011, 20(3): 4. DOI:10.3969/j.issn.1008-6145.2011.03.001 |
| [13] |
张海波, 李新霞, 孟磊, 等. 蒜氨酸标准物质的定值研究[J]. 食品科学, 2014, 35(12): 80. ZHANG HB, LI XX, MENG L, et al. Study on the value of alliin reference materials[J]. Food Sci, 2014, 35(12): 80. DOI:10.7506/spkx1002-6630-201412015 |
| [14] |
马康, 苏福海, 王海峰, 等. 有机纯度标准物质定值技术研究进展[J]. 分析测试学报, 2013, 32(7): 901. MA K, SU FH, WANG HF, et al. Progress on certified technique for chemical purity of organic reference material[J]. J Instrum Anal, 2013, 32(7): 901. DOI:10.3969/j.issn.1004-4957.2013.07.023 |
| [15] |
黄亮, 张伟, 黄挺, 等. 肌酐纯度标准物质的定值方法及其不确定度评定研究[J]. 分析测试学报, 2014, 33(7): 840. HUANG L, ZHANG W, HUANG T, et al. Research on a certified reference material for purity of creatinine and its uncertainty evaluation[J]. J Instrum Anal, 2014, 33(7): 840. DOI:10.3969/j.issn.1004-4957.2014.07.018 |
| [16] |
张凤兰, 苏哲, 吴景, 等. β-熊果苷和氢醌安全性评价及化妆品法规管理现状[J]. 环境与健康杂志, 2017, 34(11): 1017. ZHANG FL, SU Z, WU J, et al. Safety assessment of β-arbutin and hydroquinone and current situation of cosmetics regulation management[J]. J Environ Health, 2017, 34(11): 1017. |
 2019, Vol. 39
2019, Vol. 39 
