2. 中央民族大学, 北京 100081;
3. 青岛市食品药品检验研究院, 青岛 266071;
4. 广东东阳光药业有限公司, 东莞 523808
2. Minzu University of China, Beijing 100081, China;
3. Qingdao Institute for Food and Drug Control, Qingdao 266071, China;
4. Sunshine Lake Pharma Co., Ltd., Guangdong, Dongguan 523808, China
冬虫夏草为麦角菌科真菌冬虫夏草菌Cordyceps sinensis(BerK.)Sacc.寄生在蝙蝠蛾科昆虫幼虫上的子座和幼虫尸体的干燥复合体,主要分布在我国青海、西藏和四川等高海拔地区,是传统的名贵中药材,在中国有着悠久的药用历史,具有补肾益肺及止血化痰的功效[1-2]。由于冬虫夏草特殊的药用价值和来源的紧缺性,伴随着人民生活水平的逐步提高,市场对冬虫夏草的需求也越来越高,造成冬虫夏草的价格非常昂贵。人工繁育冬虫夏草存在许多技术瓶颈,困难重重。经过多年研究,冬虫夏草人工繁育品试验终于取得成功,对于缓解野生冬虫夏草的供不应求,以及缓解生态压力,减少自然资源的流失,均具有重要意义。
DNA条形码(DNA barcoding)是选用标准短的DNA片段对物种进行快速、准确的自动化的鉴定和识别[3]。由Paul Hebert首先提倡将条形码技术引进生物的鉴定中[4]。中药鉴定是研究中药品种、质量,制定中药标准,寻找和扩大药源的前提和基础,DNA分子标记可以弥补和克服传统鉴定方法的一些缺陷和难题[5]。DNA条形码技术是近年来生物分类和鉴定的研究热点,在物种鉴定方面显示了广阔的应用前景[5-8]。
本试验从分子生物学水平,依据《中华人民共和国药典》(简称《中国药典》)2015年版中对冬虫夏草的虫和菌来源的描述,采用DNA条形码技术比较野生冬虫夏草与冬虫夏草人工繁育品的虫和菌的科属是否符合中国药典的规定,从分子生物学的角度检验冬虫夏草人工繁育品是否符合中国药典规定,为其可利用性提供指导性意义。
1 材料和方法 1.1 材料Veriti PCR仪(ABI),EPS-301电泳仪(Amer-sham),全自动凝胶成像系统(BIORAD),AB135-S分析天平(Mettler),Milli-Q纯水仪(Millipore),MM400球磨仪(Retsch),DFD-700水浴锅(东方电器)。
DNeasy Plant Mini Kit(50)(69104,QIAGEN);2×Taq Master Mix缓冲液(GK8006,GENEray);GelRed(41003,Biotium);琼脂糖(BIOWEST);Tris-base(Sigma);冰醋酸(分析纯,国药集团化学试剂有限公司);乙二胺四乙酸二钠(EDTANa2·2H2O,国药集团化学试剂有限公司)。引物ITS4:5′-TCCTCCGCTTATTGATATGC-3′,ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′(ITS);LCO1490:5′-GGTCAACAAATCATAAAGATATTGG-3′,HCO2198:5′-TAAACTTCAGGGTGACCAAAAAAT CA-3′(COⅠ)(上海捷瑞生物工程有限公司)。
冬虫夏草人工繁育品20批,由广东东阳光药业有限公司提供;野生冬虫夏草26批,样品采自于西藏自治区、青海省、四川省、甘肃省、云南省。样品信息见表 1。
|
|
表 1 样品信息 Table 1 Sample information |
取供试样品虫体部分20~30 mg,用MM400球磨仪粉碎,利用DNeasy Plant Mini Kit基因组提取试剂盒进行DNA提取。
1.3 聚合酶链式反应及测序PCR反应体系20 μL:2×Taq Master Mix缓冲液10 μL,上下游引物各0.4 μL,DNA模板1 μL,灭菌的双蒸水8.2 μL。ITS通用引物序列的PCR反应条件:95 ℃预变性4 min;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸7 min。COⅠ通用引物序列的PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,循环40次;72 ℃延伸5 min。
1.4 琼脂糖凝胶电泳检测50×TAE电泳缓冲液的配制:取Tris-base 242 g,冰醋酸57.1 mL,EDTA-Na2·2H2O 37.2 g,加入适量去离子水,充分搅拌溶解,定容至1 000 mL,作为储备液。进行凝胶电泳时稀释50倍成工作液。1.5%琼脂糖凝胶的制备:称取0.6 g琼脂糖,加入1×TAE电泳缓冲液40 mL,微波炉中加热煮沸3次至琼脂糖全部融化,摇匀,冷却至65 ℃左右加入显色剂GelRed(1:10 000),充分混匀,小心地倒入内槽板上,使胶液缓慢展开,直到整个玻璃板表面形成均匀胶层,室温下静置直至凝胶完全凝固,垂直轻拔梳子,将凝胶及内槽放入电泳槽中,添加1×TAE电泳缓冲液至刚没过胶板为止。在Parafilm上将3 μL扩增产物用移液器分别将样品加入胶板的样品槽内。电泳:加样后的凝胶板立即进行电泳,电压5 V·cm-1。当溴酚蓝移动到距离胶板下沿约2 cm处时,停止电泳。凝胶成像:用凝胶成像系统拍照并保存结果。
1.5 扩增产物测序将电泳结果显示为单一明亮条带的扩增产物送测序公司进行测序。
1.6 数据处理测序峰图使用CodonCode Aligner 3.7.1(CodonCode Co.,USA)校对拼接,去除引物区段。将所有序列利用MEGA 5.0(molecular evolutionary genetics analysis)分析比对。基于K2P模型进行遗传距离分析,用邻接法(neighbor-joining method)构建系统树,通过bootstrap(1 000次重复)对各分支进行支持率检验,并将拼接好的序列于Genbank上进行比对分析。
2 结果 2.1 电泳检测结果冬虫夏草人工繁育品与野生冬虫夏草ITS和COⅠ序列的电泳结果均显示为明亮单一条带,且条带大小介于500 bp和750 bp之间。如图 1、2所示。
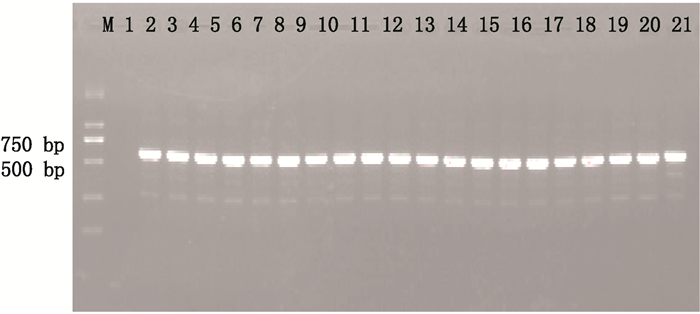
|
M. Marker 1.空白对照(blank control)2~11.冬虫夏草人工繁育品(cultivated Cordyceps sinensis)12~21.野生冬虫夏草(natural Cordyceps sinensis) 图 1 ITS序列的琼脂糖凝胶电泳图 Figure 1 Map of agarose electrophoresis for ITS barcoding |
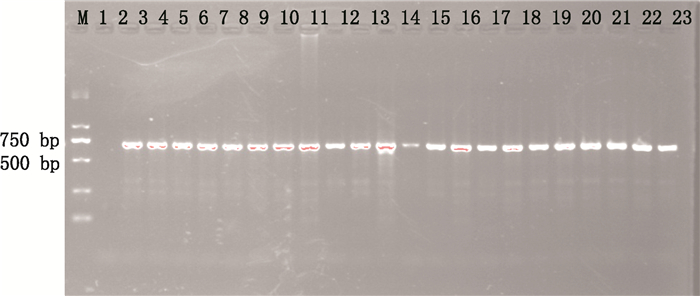
|
M. Marker 1.空白对照(blank control)2~12.冬虫夏草人工繁育品(cultivated Cordyceps sinensis)13~23.野生冬虫夏草(natural Cordyceps sinensis) 图 2 COⅠ序列的琼脂糖凝胶电泳图 Figure 2 Map of agarose electrophoresis for COⅠ barcoding |
基于COⅠ序列和ITS序列采用邻接法构建冬虫夏草人工繁育品与野生冬虫夏草的系统树图(图 3-A、B),COⅠ序列的结果中冬虫夏草人工繁育品和野生冬虫夏草除野生冬虫夏草-18、野生冬虫夏草-20 2个样品均各自聚为1支,且支持率为99%,呈现良好的单系性;ITS序列的结果中冬虫夏草人工繁育品和野生冬虫夏草混聚在一起,没有明确的分支,这可能与冬虫夏草人工繁育品和野生冬虫夏草的ITS序列的高度同源性有关。

|
Bootstap 1 000次重复,支上数值仅显示自展支持率≥60% [The bootstrap scores(1 000 replicates)are shown(≥60%)for each branch] 图 3 基于COⅠ序列(A)和基于ITS序列(B)建立的邻接系统树 Figure 3 Phylogenetic trees of the COⅠsequences(A)and the ITS sequences(B)using neighbor-joining method |
冬虫夏草人工繁育品和野生冬虫夏草的COⅠ序列和ITS序列与Genbank的比对结果如表 2所示。
|
|
表 2 与Genbank比对的结果 Table 2 The results compared with Genbank |
冬虫夏草人工繁育品的COⅠ序列经GenBank数据库比对,结果显示20批冬虫夏草人工繁育品的寄主昆虫均为小金蝠蛾Hepialus xiaojinensis,为蝙蝠蛾科Hepialidae sp.昆虫;野生冬虫夏草的COⅠ序列经GenBank数据库比对,结果显示26批野生冬虫夏草的寄主昆虫均为蝙蝠蛾科Hepialidae sp.昆虫,其中野生冬虫夏草-8为人支蝠蛾Thitarodes renzhiensis,野生冬虫夏草-12为贡嘎蝠蛾Thitarodes gong-gaensis。因此,20批冬虫夏草人工繁育品与26批野生冬虫夏草的虫体来源均符合《中国药典》2015年版中的描述,为蝙蝠蛾科昆虫。
冬虫夏草人工繁育品及野生冬虫夏草的ITS序列与GenBank数据库比对后,相似度达99%以上,比对结果显示20批冬虫夏草人工繁育品和26批野生冬虫夏草的虫菌均为冬虫夏草菌Ophiocordyceps sinensis。通过考证[9-14],Ophiocordyceps sinensis与Cordyceps sinensis为同物异名,因此20批冬虫夏草人工繁育品与26批野生冬虫夏草的虫菌来源均符合《中国药典》2015年版中的描述,为麦角菌科真菌冬虫夏草菌Cordyceps sinensis(Berk.)Sacc.。
3 讨论与分析由于Genbank上冬虫夏草菌的拉丁名称比较混乱,20批冬虫夏草人工繁育品与26批野生冬虫夏草的虫菌比对结果为Ophiocordyceps sinensis,存在与《中国药典》和《中国真菌志》中冬虫夏草菌拉丁名Cordyceps sinensis不一致的现象,因此对冬虫夏草拉丁学名的变更情况进行考证。
《中国药典》2015年版一部[2]中对冬虫夏草的描述为麦角菌科真菌冬虫夏草菌Cordyceps sinensis(Berk.)Sacc.寄生在蝙蝠蛾科昆虫幼虫上的子座和幼虫尸体的干燥复合体。冬虫夏草的定名几经变化,由于真菌存在有性型和无性型,冬虫夏草菌的命名也一度十分混乱。目前冬虫夏草被广泛接受的拉丁学名为Ophiocordyceps sinensis(Berk.)。
《中国真菌志》[9]第三十二卷《虫草属》中记载的冬虫夏草的拉丁学名为Cordyceps sinensis(Berk.)Sacc.,冬虫夏草的无性型为中华被毛孢,其拉丁学名为Hirsutella sinensis。
《中国药典》2015年版四部中[10]《成方制剂中本版药典未收载的药材和饮片》项下记载的冬虫夏草菌粉为发酵冬虫夏草菌粉[Cs-C-Q80中华被毛孢Hirsntella sinensis Lin,Gao,Yuer Zeng(1989)经液体深层发酵所得菌丝体的干燥粉末]。中华被毛孢拉丁学名与《中国真菌志》一致。
《我国虫草产业发展现状、问题及展望——虫草产业发展金湖宣言》[11]对天然冬虫夏草定名的变更过程进行了概述:冬虫夏草于1843年由英国真菌学家Berkeley将其正式定名为Sphaeria sinensis Berk.;1878年,意大利学者Saccardo又将其转到Cordyceps(Fr.)Link属下,将其定名为Cordyceps sinensis(Berk.)Sacc.。直到2007年,Sung[12]在《Studies in Mycology》杂志上,基于多基因系统学分析的结果对广义虫草属Cordyceps s.l.进行了重新划分,采用5至7个基因座对麦角菌科162个类群的发育关系进行分析,包括核糖体小亚基和大亚基(nrSSU and nrLSU),延长因子1α(tef1),RNA聚合酶Ⅱ的最大和第二大亚基(rpb1 and rpb2),β-微管蛋白(tub),线粒体ATP6(atp6)。分析结果支持将冬虫夏草归到线虫草科Ophiocordycepitaceae G. H. Sung,J. M. Sung,Hywel-Jones & Spatafora,因此将冬虫夏草更名为Ophiocordyceps sinensis(Berk.),原文中有如下描述:
Ophiocordyceps sinensis(Berk.)G.H. Sung,J.M. Sung,Hywel-Jones & Spatafora,comb.nov.MycoB ank MB504340.
≡Sphaeria sinensis Berk.,J.Bot(Hooker)2:207.1843.
≡Cordyceps sinensis(Berk.)Sacc.,Michelia 1:320.1879.
Anamorph:Hirsntella sinensis X.J. Liu,Y.L. Guo,Y.X. Yu & W. Zeng
即确认Ophiocordyceps sinensis(Berk.)与Cordyceps sinensis(Berk.)为冬虫夏草不同时期的定名,Hirsntella sinensis为无性型中华被毛孢的定名。
《中药冬虫夏草和所含多种冬虫夏草菌拉丁名混用的历史和现状》[13]中提到2011年世界菌物学会IMA颁布的《阿姆斯特丹宣言》中实施“One Fungus =One Name”,冬虫夏草菌的定名为Ophiocordyceps sinensis(≡Cordyceps sinensis)。《冬虫夏草菌和蛹虫草菌的研究现状、问题及展望》[14]中也提到根据“一种真菌一个名称”(One Fungus=One Name)的发展趋势,今后一种真菌将不再同时拥有有性型和无性型2个合法名称。综上,冬虫夏草菌的拉丁名可以使用目前广泛被接受的Ophiocordyceps sinensis,与Cordyceps sinensis,Hirsntella sinensis一致。
因此,20批冬虫夏草人工繁育品与26批野生冬虫夏草的虫菌比对结果Ophiocordyceps sinensis与《中国药典》中冬虫夏草菌Cordyceps sinensis为同物异名。且20批冬虫夏草人工繁育品与26批野生冬虫夏草的虫体均来自蝙蝠蛾科,其中20批冬虫夏草人工繁育品的寄主昆虫均为小金蝠蛾Hepialus xiaojinensis,26批野生冬虫夏草中野生冬虫夏草-8为人支蝠蛾Thitarodes renzhiensis,野生冬虫夏草-12为贡嘎蝠蛾Thitarodes gonggaensis。
综上所述,20批冬虫夏草人工繁育品的虫体及虫菌来源与26批野生冬虫夏草的虫体及虫菌来源均符合《中国药典》2015年版中的描述:冬虫夏草为麦角菌科真菌冬虫夏草菌Cordyceps sinensis(Berk.)Sacc.寄生在蝙蝠蛾科昆虫幼虫上的子座和幼虫尸体的干燥复合体。
野生冬虫夏草的资源有限,且生境环境比较脆弱,过度采挖往往容易对环境造成不可恢复的破坏。野生冬虫夏草也多存在重金属砷、铜含量超标的现象。本研究从分子生物学的角度验证了冬虫夏草人工繁育品的虫和菌的来源符合《中国药典》的规定,冬虫夏草人工繁育品可以填补市场空缺,缓解由于采集野生冬虫夏草而造成的生态压力,减少自然资源的流失,但是否能够替代野生冬虫夏草或与野生冬虫夏草发挥相同的药用价值,还需进一步临床验证。
| [1] |
郭海平, 杨智敏. 冬虫夏草药理作用研究进展[J]. 中草药, 1999, 30(3): 231. GUO HP, YANG ZM. Advances in pharmacological studies on Dongchongxiacao(Cordyceps sinensis)[J]. Chin Tradit Herb Drugs, 1999, 30(3): 231. DOI:10.3321/j.issn:0253-2670.1999.03.033 |
| [2] |
中华人民共和国药典2015年版.一部[S].2015: 115 ChP 2015.Vol Ⅰ[S].2015: 115 |
| [3] |
郭慧, 王谦博, 贾力维, 等. 中药材DNA条形码技术研究进展[J]. 中国药师, 2016, 19(3): 566. GUO H, WANG QB, JIA LW, et al. Study progress in DNA barcode of traditional Chinese medicine[J]. China Pharm, 2016, 19(3): 566. DOI:10.3969/j.issn.1008-049X.2016.03.046 |
| [4] |
HEBERT PD, CYWINSKA A, BALL SL. Biological identifications through DNA barcodes[J]. Proc R Soc Biol Sci Ser B, 2003, 270(1512): 313. DOI:10.1098/rspb.2002.2218 |
| [5] |
陈士林, 庞晓慧, 姚辉, 等. 中药DNA条形码鉴定体系及研究方向[J]. 世界科学技术-中医药现代化, 2011, 13(5): 747. CHEN SL, PANG XH, YAO H, et al. Identification system and perspective for DNA barcoding traditional Chinese materia medica[J]. World Sci Technol- Mod Tradit Chin Med Mater Med, 2011, 13(5): 747. DOI:10.3969/j.issn.1674-3849.2011.05.001 |
| [6] |
陈士林, 姚辉, 宋经元, 等. 基于DNA barcoding(条形码)技术的中药材鉴定[J]. 世界科学技术-中医药现代化, 2007, 9(3): 7. CHEN SL, YAO H, SONG JY, et al. Use of DNA barcoding to identify Chinese medicinal materials[J]. World Sci Technol Mod Tradit Chin Med Mater Med, 2007, 9(3): 7. DOI:10.3969/j.issn.1674-3849.2007.03.002 |
| [7] |
LI DZ, LIU JQ, CHEN ZD, et al. Plant DNA barcoding in China[J]. J Syst Evol, 2011, 49(3): 165. DOI:10.1111/jse.2011.49.issue-3 |
| [8] |
LI M, CAO H, BUT PPH, et al. Identification of herbal medicinal materials using DNA barcodes[J]. J Syst Evol, 2011, 49(3): 271. DOI:10.1111/jse.2011.49.issue-3 |
| [9] |
梁宗琦. 中国真菌志[M]. 北京: 科学出版社, 2007: 125. LIANG ZQ. Fungi of China[M]. Beijing: Science Press, 2007: 125. |
| [10] |
中华人民共和国药典2015年版.四部[S].2015: 419. ChP 2015.Vol Ⅳ[S].2015: 419 |
| [11] |
董彩虹, 李文佳, 李增智, 等. 我国虫草产业发展现状、问题及展望-虫草产业发展金湖宣言[J]. 菌物学报, 2016, 35(1): 1. DONG CH, LI WJ, LI ZZ, et al. Cordyceps industry in China:current status, challenges and perspectives-Jinhu declaration for Cordyceps industry development[J]. Mycosystema, 2016, 35(1): 1. |
| [12] |
SUNG GH, HYEEL-JONES NL, SUNG JM, et al. Phylogenetic classification of Cordyceps and the clavicipitaceous fungi[J]. Stud Mycol, 2008, 57: 5. |
| [13] |
姚艺桑, 朱佳石. 中药冬虫夏草和所含多种冬虫夏草菌拉丁名混用的历史和现状[J]. 中国中药杂志, 2016, 41(7): 1361. YAO YS, ZHU JS. Indiscriminate use of Latin name for natural Cordyceps sinensis insect-fungi complex and multiple Ophiocordyceps sinensis fungi[J]. China J Chin Mater Med, 2016, 41(7): 1361. |
| [14] |
张姝, 张永杰, SHRESTHABhushan, 等. 冬虫夏草菌和蛹虫草菌的研究现状、问题及展望[J]. 菌物学报, 2013, 32(4): 577. ZHANG S, ZHANG YJ, SHRESTHA Bhushan, et al. Ophiocordyceps sinensis and Cordyceps militaris:research advances, issues and perspectives[J]. Mycosystema, 2013, 32(4): 577. |
 2019, Vol. 39
2019, Vol. 39 
