| 改性花生壳吸附分离湿法炼锌溶液中的镓和锗 |
镓、锗具有优良的物理和化学性能,是当代高新技术产业发展的支撑材料[1-3]。然而,镓、锗属于稀散金属,在自然界中极少存在单独矿床,绝大部分伴生在其他矿物中[4]。目前,镓、锗主要从其伴生矿和二次资源中回收[5]。
凡口锌精矿中富含Ga、Ge,为有效回收锌精矿中的Ga、Ge,丹霞冶炼厂采用二段逆流氧压酸浸工艺使Ga、Ge进入氧压浸出液,再采用富集分离方法实现Ga、Ge的回收[6-10]。目前,从溶液中富集回收镓、锗的方法有中和沉淀法、离子交换法、溶剂萃取法[11]、微生物法及液膜法[12-13]。中和沉淀法较难实现镓、锗的高效选择性分离,镓、锗的回收工艺流程长;离子交换法具有工艺流程复杂,生产周期长等缺点;溶剂萃取法选择性强,萃取体系选择灵活,但萃取剂价格高且大多易挥发、易燃和有毒性,对环境污染大;微生物法、液膜法等方法仍处在研究阶段。与以上方法相比,吸附法具有操作方便、成本低、效果好等优点,因此,国内外研究者针对吸附法从溶液中富集回收微量镓、锗进行了广泛研究。研发的镓、锗吸附材料主要包括活性炭[14-17]、海泡石[18]、膨润土[19]、聚氨酯泡沫塑料[20]、纳米γ-Al2O3[21]及TiO2[22-23]等,但这些吸附剂大多存在吸附效率低、选择性差、成本高等问题。
花生壳作为一种常见的农作物废弃物,其主要成分为纤维素类物质和矿物质,同时还含有大量的酚类物质,如间苯三酚、儿茶酚等[24-25],现阶段仅有少量花生壳被作为粗饲料使用,其余大量的花生壳通过焙烧或丢弃的方式处理,这不仅造成资源的极大浪费,还给环境带来较大污染。为此,以花生壳作为吸附剂除去废液中重金属离子被广泛研究[26-28],但采用花生壳为吸附剂,吸附锌精矿氧压浸出液中的微量镓、锗的研究,目前尚未见报道。为此,本文以花生壳为基体,经有机试剂改性活化处理后,得到改性花生壳吸附剂,并将其用于对湿法炼锌溶液中的微量镓、锗的吸附,研究改性花生壳吸附时间、改性花生壳的用量、溶液初始pH值、吸附温度以及溶液中镓、锗初始浓度对改性花生壳吸附镓、锗的影响,并分析改性花生壳吸附镓、锗的动力学,以确定改性花生壳吸附镓、锗的较优条件及关键影响因素。
1 实验 1.1 实验原料实验所用的花生壳购于赣州某市场,经洗净、干燥、磨细、混合、改性后用作试验原料。对改性后花生壳进行SEM分析,结果如图 1所示,改性后的花生壳呈现蜂窝状,微孔发达,具有较大的比表面积,因此具有较强的吸附性能。实验所用的模拟液根据国内某锌精矿氧压浸出厂实际生产数据配制,含有Zn、Fe、Ga、Ge、Cu等元素。所配溶液成分如表 1所列。
 |
| 图 1 改性花生壳的SEM像 Fig. 1 SEM images of the modified peanut shells |
| 表 1 湿法炼锌浸出液模拟液成分 Table 1 Components of the synthetic leaching solution in zinc hydrometallurgy |
 |
| 点击放大 |
实验所用的七水硫酸锌(ZnSO4·7H2O)、五水硫酸铜(CuSO4·5H2O)、氢氧化钠(NaOH)、硫酸铁(FeSO4·7H2O)、98%浓硫酸(H2SO4)、浓盐酸(HCl)均为分析纯,水为实验室自制去离子水。
1.2 实验方法 1.2.1 花生壳改性实验前期研究工作表明酒石酸与硫酸锌溶液中的锗离子具有较强的配位能力[11],为此,选择酒石酸为活化剂对花生壳进行改性。改性步骤为:首先取一定量的花生壳用16 g/L的酒石酸溶液浸泡,控制液固比(mL/g,下同)为6∶1,置于水浴恒温振荡器中,在30 ℃下振荡24 h。过滤后,用去离子水清洗浸泡的花生壳,将清洗后的花生壳放入60 ℃的烘箱内干燥24 h,即得改性花生壳,花生壳的比表面积较小,活化前仅为2.76 cm2/g,活化后变为4.19 cm2/g。
1.2.2 镓、锗吸附实验取20 mL模拟液于100 mL锥形瓶中,用HCl或NaOH溶液调节溶液pH值,加入一定量改性花生壳,将瓶口密闭,以防止在反应过程中溶液体积发生变化。然后将锥形瓶置于已预设好水浴温度和时间的恒温振荡器中进行振荡,振荡结束后进行过滤分离,测定滤液中镓、锗的浓度,考察改性花生壳对镓、锗的吸附效果。分别用式(1)、式(2)计算吸附率及吸附量。
镓、锗的吸附率(η):
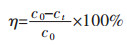
|
(1) |
生物吸附量(qt):
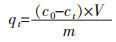
|
(2) |
式(1)、式(2)中:c0表示镓、锗的初始浓度,mg/L;ct则表示镓、锗的在t时刻的浓度,mg/L;qt表示镓、锗的在t时刻的吸附量,mg/g;V表示初始溶液体积或滤液体积,L;m代表改性花生壳的质量,g。
1.2.3 镓、锗解吸再生实验将已吸附镓、锗的改性花生壳吸附剂与溶液分离,并全部倒入锥形瓶中,向其中加入2.0 mol/L H2SO4,控制液固比为5∶1,置于水浴恒温振荡器中,在50 ℃下振荡1 h,过滤,并用去离子水将改性花生壳清洗至中性,烘干。再生后的花生壳再经吸附、解吸,循环吸附镓、锗。
1.3 分析方法采用萃取分离苯芴酮分光光度法测定溶液中Ge的含量(GB/T 8151.13—2000),采用罗丹明分光光度法测定溶液中Ga的含量(GB/T 20975.20—2008),采用Zeta电位分析仪测定改性前后的花生壳吸附剂的Zeta电位。
2 实验结果与讨论 2.1 镓、锗在溶液中的分布根据Ga、Ge在溶液中的离子分布图(图 2、图 3)可知,在pH 0~3范围内,Ga主要以Ga3+的形式存在;在pH 3~8范围内,Ga主要以H2GaO2+的形式存在;而在pH 8~11和pH 11~14的范围内,Ga分别以H5GaO52- 和H6GaO3-的形式存在。而对于Ge;在pH 0~8范围内,Ge主要以H2GeO3的形式存在;在pH 8~12范围内,Ge主要以HGeO3-的形式存在;pH 12~14范围内,Ge主要以GeO32-的形式存在。根据Ga3+、Ge4+离子在不同pH值溶液中的离子分布情况,可为后续硫酸锌溶液中镓、锗的吸附分离提供理论依据。
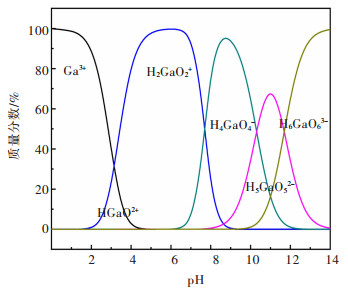 |
| 图 2 Ga2O3-H2O系中各组元的分布(298.15 K) Fig. 2 Distribution diagram of each component in the Ga2O3-H2O system (298.15 K) |
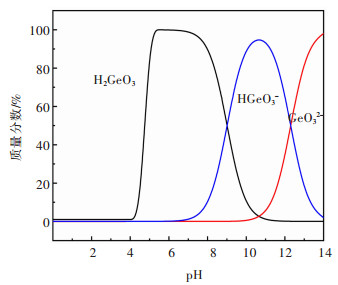 |
| 图 3 GeO2-H2O系中各组元的分布(298.15 K) Fig. 3 Distribution diagram of each component in the GeO2-H2O system (298.15 K) |
2.2 镓、锗的吸附分离 2.2.1 吸附时间的影响
取模拟液20 mL,加入1 g改性花生壳,在pH值为1.5、温度为30 ℃的条件下,考察改性花生壳吸附时间对镓、锗吸附的影响。结果如图 4所示。
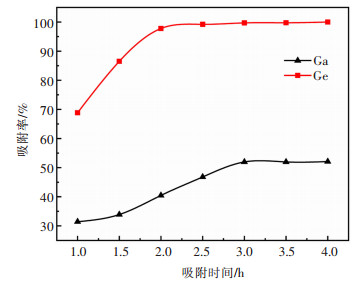 |
| 图 4 吸附时间对镓、锗吸附率的影响 Fig. 4 The influence of contact time on Ga and Ge adsorption |
由图 4可以看出,改性花生壳对镓和锗的吸附率均随时间的增加而增大,镓和锗的吸附在3 h后达到吸附平衡。当吸附时间由1 h增加到3 h时,镓、锗的吸附率分别由31.44%、68.84%增加到51.98%、99.70%。这是由于在吸附反应的初期,吸附剂表面存在大量的可吸附点位,而镓、锗的吸附主要是在花生壳的表面进行,因此吸附更容易进行。此外,在吸附剂开始与溶液中的离子发生吸附时,溶液中镓、锗离子的浓度较高,溶液与吸附剂表面具有较大的浓度梯度,因此可以产生较大的驱动力去进行吸附,使得反应初期的吸附速度更快。但随着吸附时间不断增加,吸附剂表面的吸附点位逐渐饱和,溶液中镓、锗的质量浓度降低,浓度梯度逐渐减小,产生的驱动力不足,同时进入吸附剂的阻力增强,使得镓、锗进入吸附剂的微孔内部更加困难,导致吸附速度减慢。与Ga、Ge吸附行为不同,在整个考察的吸附时间范围内,Zn、Fe的吸附率均小于1%,主要原因是,与Ga、Ge相比,Zn、Fe与酒石酸或花生皮所含的酚类物质的络合能力较弱,不易形成易于吸附分离的络合离子或化合物。
通常采用准一级动力学方程(式(3))和准二级动力学方程(式(4))对生物吸附动力学中的试验数据进行模拟,以此分析金属离子质量浓度随吸附时间的变化关系。准一级动力学方程的线性表达式为:
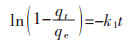
|
(3) |
式(3)中:k1为准一级吸附速率常数,min-1;利用式(3)对t作图可求得k1;k1·qe为初始吸附速率,mg/(g·min)。
准二级动力学方程的线性表达式为:
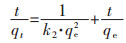
|
(4) |
式(4)中:k2为准二级吸附速率常数,g/(g·min);k2·qe2为初始吸附速率,mg/(g·min);利用式(4)对t作图可求得k2·qe2。
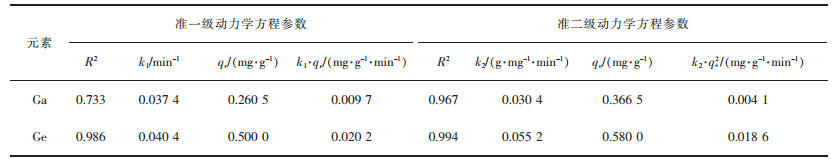
用图 4中的试验数据进行准一级和准二级动力学模拟,模拟结果如表 2所列。从表 2可以看出,准二级动力学方程的R2均大于0.96,因此,改性花生壳对镓、锗的吸附与准二级动力学方程更加拟合,表示吸附过程遵循准二级反应机理,其中化学吸附占主导地位,基本无物理扩散的影响,化学吸附控制吸附速率[29]。
| 表 2 准一级和准二级动力学拟合参数 Table 2 The pseudo first-order and pseudo second-order kinetic parameters for adsorption of Ga and Ge |
 |
| 点击放大 |
2.2.2 初始pH值的影响
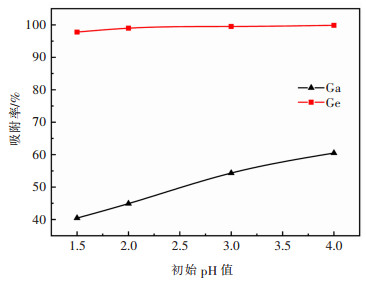
取模拟液20 mL,加入1 g改性花生壳,在温度为30 ℃、吸附时间为2 h的条件下,考察溶液初始pH值对镓、锗吸附的影响。结果如图 5所示。
 |
| 图 5 初始pH对镓、锗吸附率的影响 Fig. 5 The influence of initial pH on Ga and Ge adsorption |
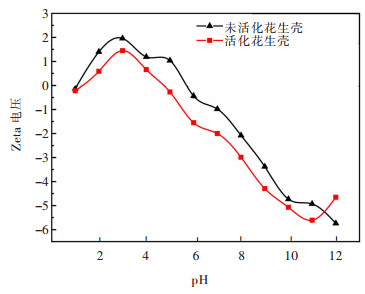
由图 5可知,在实验考察的pH值范围内,锗的吸附率均可达到97%以上,当pH值为3.0时,吸附率可达99.51%,此后继续增大pH值,锗的吸附率变化不明显。而对镓而言,其吸附率随pH值增大而增加,当pH值为4.0时,吸附率可达到60.49%。这是因为当溶液的pH值较低时,溶液中H+的浓度较高,导致H+的活动性增强,并与溶液中镓、锗的阳离子产生了竞争吸附关系,从而吸附率较低。但当溶液的pH值不断增大,H+的浓度会逐渐降低,同时H+的活动性也逐渐减弱,竞争吸附减弱,使得吸附率升高。此外,溶液pH值不仅影响改性花生壳的表面性质,而且还能改变溶液中吸附质存在的化学形态。花生壳等电位点示意见图 6。
 |
| 图 6 花生壳等电位点示意 Fig. 6 Equipotential point diagram of peanut shell |
从图 6改性花生壳pH-Zeta电位关系可知,改性花生壳的等电位点在pH=4.7处,改性花生壳表面带正电;当pH > 4.7时,改性花生壳表面带负电。在实验的pH值范围内,改性花生壳的表面带正电,而随着pH值升高,改性花生壳表面所带的正电荷逐渐减小,使得Ga3+、H2GeO3与花生壳表面的排斥力减小,有利于吸附的进行,这也可导致吸附率升高。与Ga、Ge吸附方式不同,在整个考察的溶液pH值范围内,Zn、Fe的吸附率均小于1%,并且主要以机械夹杂形式存在,从而实现硫化锌精矿浸出液中Ga、Ge有效分离。
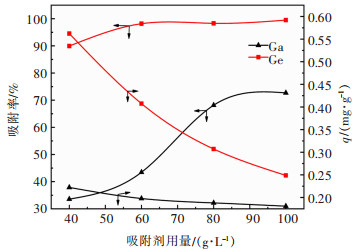
2.2.3 改性花生壳用量的影响取模拟液20 mL,在pH 1.5、吸附时间为2 h、温度为30 ℃的条件下,考察改性花生壳用量对镓、锗吸附的影响。结果如图 7所示。
 |
| 图 7 改性花生壳用量对镓、锗吸附的影响 Fig. 7 The influence of modified peanut shells dosage on Ga and Ge adsorption |
由图 7可知,随着改性花生壳用量的增加,镓和锗的吸附率均增加。当投入量由40 g/L增加至60 g/L时,镓、锗的吸附率分别由33.56%、89.95%增加至43.54%、98.18%;继续增加改性花生壳的用量,锗的吸附率增加不明显,而镓的吸附率继续增加,当改性花生壳的用量为100 g/L时,镓的吸附率增加至72.70%。因为随着改性花生壳用量的逐渐增加,溶液中能够发生吸附作用的改性花生壳的表面积不断增大,溶液中有效吸附点位也随之增多,更多的镓、锗可被吸附除去,因而吸附率提高。同时,随着改性花生壳用量的增加,单位质量花生壳的吸附量不断减小。这表明在改性花生壳表面已经吸附了大量的镓和锗,此时溶液中相应的镓、锗的质量浓度变得很低,但吸附剂表面仍存在大量不饱和吸附位点,因而吸附量下降[30]。
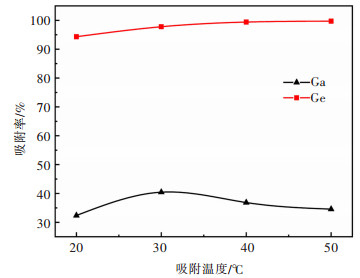
2.2.4 吸附温度的影响取模拟液20 mL,加入1 g改性花生壳,在初始pH=1.5、吸附时间为2 h的条件下,考察吸附温度对镓、锗吸附的影响。结果如图 8所示。
 |
| 图 8 吸附温度对镓、锗吸附率的影响 Fig. 8 The influence of absorption temperature on Ga and Ge adsorption |
由图 8可知,改性花生壳对锗的吸附率随温度升高而增加,当温度由20 ℃升高至50 ℃时,吸附率由94.34%增加到99.73%;在温度为20 ℃时,镓的吸附率达到整个考察范围内的最小值(32.37%),并且随着温度的升高,镓的吸附率呈现先增加后减小的趋势。在温度为30 ℃时,镓的吸附率达到最大值(40.45%)。改性花生壳对锗的吸附主要靠吸附在花生壳表面的有机试剂与Ge4+发生络合反应,温度升高导致离子活动性增强,与花生壳表面接触的概率增大,进而导致吸附率增加。对镓而言,吸附过程中存在两种吸附方式:交换吸附和分子吸附,温度升高时,离子交换吸附增强,而分子吸附减弱。这两种吸附方式综合作用的结果是使改性花生壳对镓的吸附率在30 ℃时达到最大,导致镓的吸附率随温度的增加而呈先增加后下降的趋势。
2.2.5 初始浓度的影响配制不同浓度的镓、锗溶液各20 mL,加入1 g改性花生壳,在初始pH值为3,温度为30 ℃,吸附时间为4 h的条件下,考察初始浓度对镓、锗吸附率的影响。结果如图 9所示。
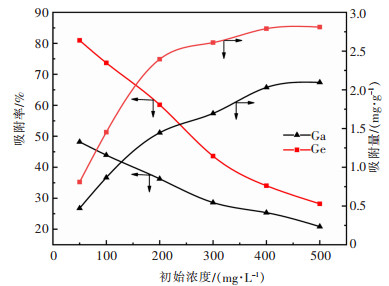 |
| 图 9 溶液初始离子浓度对镓、锗吸附率的影响 Fig. 9 The influence of initial ions concentration on Ga and Ge adsorption |
由图 9可知,当溶液中镓、锗的初始质量浓度从50 mg/L升高到500 mg/L时,镓、锗的吸附量的变化规律基本一致,吸附量均随溶液中镓、锗的初始质量浓度的增加而增大;镓、锗的吸附率则随溶液中镓、锗的初始质量浓度的增加而下降,分别由48.30%、81.09%下降至20.95%、28.16%。这是由于随着溶液中镓、锗的质量浓度升高,溶液与花生壳表面的浓度梯度增大,吸附的驱动力更大,使得吸附容量增大;而花生壳表面的吸附位点饱和后,吸附率则随着浓度升高而下降。根据图 9中数据所作的等温吸附曲线如图 10所示。采用朗格缪尔(Langmuir)等温模型与弗兰德里希(Freundlich)等温模型对吸附平衡数据进行拟合分析。
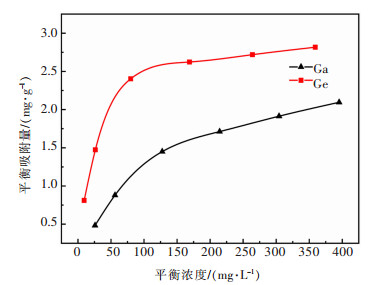 |
| 图 10 镓、锗的等温吸附曲线 Fig. 10 Adsorption isotherms curves for Ga and Ge |
朗格缪尔(Langmuir)方程为:
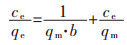
|
(5) |
式(5)中:qe表示镓、锗的在t时刻的吸附量,mg/g;qm为吸附剂的饱和吸附量,mg/g;ce为吸附平衡时溶液中金属离子质量浓度,mg/L;b为朗格缪尔(Langmuir)常数,L/mg。
Freundlich方程为:
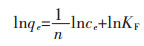
|
(6) |
式(6)中:KF(mg/g)和n为弗兰德里希(Freundlich)模型常数。
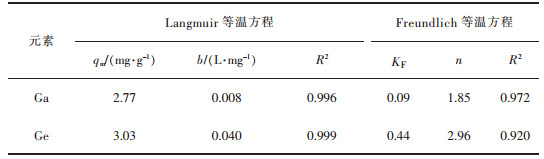
朗格缪尔吸附等温式(Langmuir isotherm equation)指恒温下均一表面上的单层吸附。由表 3的数据拟合结果可看出,改性花生壳对镓、锗的吸附更符合朗格缪尔(Langmuir)等温模型,表明改性花生壳对镓、锗的吸附为单层吸附,且以化学吸附为主。
| 表 3 朗格缪尔及弗兰德里希方程的主要参数 Table 3 The main parameters of Langmuir and Freundlich equation |
 |
| 点击放大 |
吸附镓、锗后的改性花生壳经0.05 mol/L酸及去离子水先后洗涤、干燥后,进行SEM-EDS分析,其结果如图 11所示。
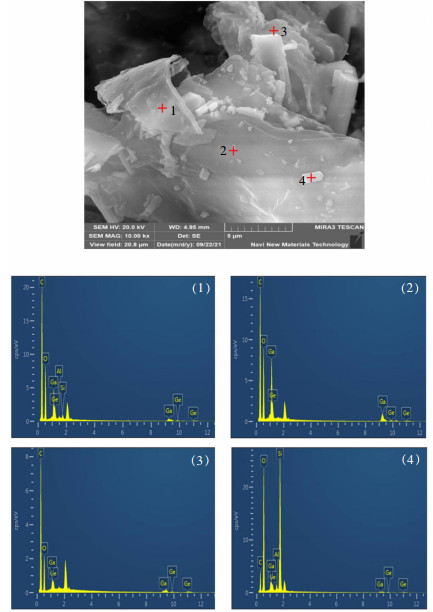 |
| 图 11 改性花生壳吸附镓、锗后的SEM-EDS像 Fig. 11 SEM-EDS images of the modified peanut shells after adsorption of Ga and Ge |
由图 11的EDS图谱可见明显的镓、锗峰,进一步证明了改性花生壳可实现镓、锗的富集;由于EDS图谱中主要峰为碳、氧、镓、锗峰,结合动力学分析结果进一步确定了硫酸锌溶液中锗离子主要以络合吸附为主,而镓离子吸附主要以离子交换和分子吸附两种方式进行。
2.3 镓、锗的解吸再生将已吸附镓、锗的改性花生壳用2 mol/L H2SO4在温度为50 ℃、时间为1 h、液固比为5∶1的条件下进行解吸再生,再生后的花生壳再经吸附、解吸,循环吸附镓、锗。吸附实验的条件为:溶液初始pH=3、温度为30 ℃、吸附时间为3 h、吸附剂用量为50 g/L、初始浓度为25 mg/L。实验结果如图 12所示,经过硫酸解吸再生后的改性花生壳对镓、锗吸附能力变化较小,即经过改性后的花生壳作为吸附镓、锗的吸附剂,至少可以循环使用5次以上。
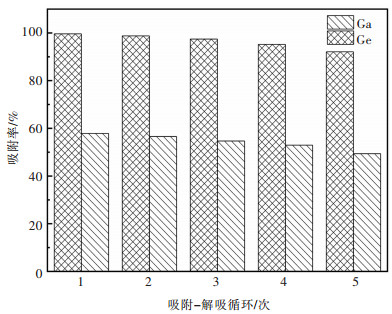 |
| 图 12 改性花生壳循环吸附-解吸的实验结果 Fig. 12 Adsorption-desorption cycles results of modified peanut shells |
3 结论
1)经酒石酸改性花生壳可实现湿法炼锌浸出液中镓和锗的有效分离,并且锗的吸附效果优于镓,在吸附时间为3 h、溶液初始pH=3、吸附温度为30 ℃的条件下锗的吸附率大于99%。
2)改性花生壳对镓、锗的吸附在30 ℃条件下吸附3 h时达到平衡,改性花生壳吸附镓、锗符合准二级动力学方程。改性花生壳吸附镓、锗实验的拟合效果更符合朗格缪尔(Langmuir)方程,表明改性花生壳对镓、锗的吸附为单层吸附,并且以化学吸附为主,镓、锗的饱和吸附量分别为2.77、3.03 mg/g。
3)吸附镓、锗的改性花生壳经H2SO4溶液解吸可实现再生,可循环使用5次以上。
| [1] |
WOOD S A, SAMSON I M. The aqueous geochemistry of gallium, germanium, indium and scandium[J].
Ore Geology Reviews, 2006, 28(1): 57–102. DOI: 10.1016/j.oregeorev.2003.06.002. |
| [2] |
崔毅琦, 童雄, 周庆华, 等. 我国伴生稀散金属锗镓的选矿回收研究概况[J].
中国工程科学, 2005(增刊1): 161–165.
|
| [3] |
高艳芬. 从锌浸出渣中综合回收镓锗的技术分析[J].
中国金属通报, 2020(13): 90–91.
DOI: 10.3969/j.issn.1672-1667.2020.13.044.
|
| [4] |
苏立峰, 林江顺, 李相良. 稀散金属镓锗提取新工艺研究[J].
中国资源综合利用, 2013, 31(10): 7–9.
DOI: 10.3969/j.issn.1008-9500.2013.10.008.
|
| [5] |
雷霆, 张玉林, 王少龙.
锗的提取方法[M]. 北京: 冶金工业出版社, 2006.
|
| [6] |
张伟, 李立清, 刘野平, 等. 采用两段逆流浸出工艺从镓锗渣中回收有价金属[J].
湿法冶金, 2021, 40(4): 289–293.
|
| [7] |
NUSEN S, ZHU Z, CHAIRUANGSRI T, et al. Recovery of germanium from synthetic leach solution of zinc refinery residues by synergistic solvent extraction using LIX 63 and Ionquest 801[J].
Hydrometallurgy, 2015, 151: 122–132. DOI: 10.1016/j.hydromet.2014.11.016. |
| [8] |
ZHANG L B, GUO W Q, PENG J H, et al. Comparison of ultrasonic-assisted and regular leaching of germanium from by-product of zinc metallurgy[J].
Ultrasonics Sonochemistry, 2016, 31: 143–149. DOI: 10.1016/j.ultsonch.2015.12.006. |
| [9] |
刘付朋, 刘志宏, 李玉虎, 等. 锌粉置换镓锗渣硫酸浸出过程[J].
中国有色金属学报, 2016, 26(4): 908–918.
|
| [10] |
刘付朋, 刘志宏, 李玉虎, 等. 锌粉置换镓锗渣草酸浸出过程[J].
中国有色金属学报, 2017, 27(10): 2154–2163.
|
| [11] |
陈欢, 刘志宏, 刘付朋, 等. 用N235从低浓度硫酸溶液中萃取锗试验研究[J].
湿法冶金, 2017, 36(5): 391–396.
|
| [12] |
CHIRKST D E, CHISTYAKOV A A, CHEREMISINA O V, et al. Sorption of germanium from alkaline solutions on anion-exchange resin[J].
Russian Journal of Applied Chemistry, 2008, 81(1): 38–41. DOI: 10.1134/S1070427208010096. |
| [13] |
CHEGROUCHE S, BENSMAILI A. Removal of Ga(Ⅲ) from aqueous solution by adsorption on activated bentonite using a factorial design[J].
Water Research, 2002, 36(11): 2898–2904. DOI: 10.1016/S0043-1354(01)00498-5. |
| [14] |
SHIMANSKⅡ A, YASINSKIY A, YAKIMOV I, et al. Aluminum smelting carbon dust as a potential raw material for gallium and germanium extraction[J].
JOM, 2021, 73(4): 1103–1109. DOI: 10.1007/s11837-021-04563-8. |
| [15] |
DÍEZ E, GÓMEZ J M, RODRÍGUEZ A, et al. Recovery of gallium from aqueous solution through preconcentration by adsorption/desorption on disordered mesoporous carbon[J].
Journal of Sustainable Metallurgy, 2021, 7: 227–242. DOI: 10.1007/s40831-021-00336-4. |
| [16] |
龙来寿, 奚长生, 曾懋华, 等. 络合吸附法提取镓的研究[J].
韶关学院学报, 2003, 24(12): 52–55.
DOI: 10.3969/j.issn.1007-5348.2003.12.013.
|
| [17] |
MARCO-LOZAR J P, CAZORLA-AMORÓS D, LINARES-SOLANO A. A new strategy for germanium adsorption on activated carbon by complex formation[J].
Carbon, 2007, 45(13): 2519–2528. DOI: 10.1016/j.carbon.2007.08.020. |
| [18] |
梁凯, 王大伟, 龙来寿, 等. 改性海泡石回收锌渣酸浸液中镓的实验[J].
矿物学报, 2006, 26(3): 277–280.
DOI: 10.3321/j.issn:1000-4734.2006.03.006.
|
| [19] |
CHEGROUCHE S, BENSMAILI A. Removal of Ga(Ⅲ) from aqueous solution by adsorption on activated bentonite using a factorial design[J].
Water Research, 2002, 36(11): 2898–2904. DOI: 10.1016/S0043-1354(01)00498-5. |
| [20] |
周虹, 刘健, 吴书凤. 泡沫塑料法在高浓度盐酸溶液中吸附回收锗[J].
应用化工, 2011, 40(11): 23–25.
|
| [21] |
张蕾, 李红梅, 韩光喜, 等. 纳米γ-Al2O3吸附Ge的机理及性能[J].
高等学校化学学报, 2010, 31(1): 135–140.
|
| [22] |
ZHANG L, LI H M, LIU X Y, et al. Sorption behavior of germanium on Titanium dioxide nanoparticles[J].
Russian Journal Inorganic Chemistry, 2012, 57(4): 622–628. DOI: 10.1134/S003602361204016X. |
| [23] |
SHARMA M, CHOUDHURY D, HAZRA S, et al. Effective removal of metal ions from aqueous solution by mesoporous MnO2 and TiO2 monoliths: Kinetic and equilibrium modelling[J].
Journal of Alloys and Compounds, 2017, 720: 221–229. DOI: 10.1016/j.jallcom.2017.05.260. |
| [24] |
董文召, 韩锁义, 徐静, 等. 花生壳研究现状与应用前景分析[J].
中国农学通报, 2018, 35(32): 14–19.
|
| [25] |
廖朝东, 廖正福. 花生壳的综合利用研究(一): 花生壳改性制备重金属吸附剂初探[J].
广西师范学院学报(自然科学版), 2004, 21(1): 68–70.
DOI: 10.3969/j.issn.1002-8743.2004.01.017.
|
| [26] |
张再利, 况群, 贾晓珊. 花生壳吸附Pb2+、Cu2+、Cr3+、Cd2+、Ni2+的动力学和热力学研究[J].
生态环境学报, 2010, 19(12): 2973–2977.
DOI: 10.3969/j.issn.1674-5906.2010.12.035.
|
| [27] |
LI Q, ZHAI J P, ZHANG W Y, et al. Kinetic studies of adsorption of Pb(Ⅱ), Cr(Ⅲ) and Cu(Ⅱ) from aqueous solution by sawdust and modified peanut husk[J].
Journal of Hazardous Materials, 2007, 141(1): 163–167. DOI: 10.1016/j.jhazmat.2006.06.109. |
| [28] |
JOHNSON P D, WATSON M A, BROWN J. Peanut shells pellets as a single use sorbent for the capture of Cu(Ⅱ) from wastewater[J].
Waste Management, 2002, 22(5): 471–480. DOI: 10.1016/S0956-053X(01)00036-8. |
| [29] |
ÖZER A, ÖZER D, EKIZ H I. The equilibrium and kinetic modelling of the biosorption of copper(Ⅱ) ions on Cladophora crispata[J].
Adsorption Journal of the International Adsorption Society, 2004, 10(4): 317–326. |
| [30] |
AMARASINGHE B, WILLIAMS R A. Tea waste as a low cost adsorbent for the removal of Cu and Pb from wastewater[J].
Chemical Engineering Journal, 2007, 132(1/2/3): 299–309. |
 2022, Vol. 13
2022, Vol. 13


