| 硫酸浸出磷石膏中稀土的动力学研究 |
磷石膏是湿法磷酸生产过程中产生的大宗固体废物,湿法磷酸生产工艺可分为无水法、半水法、二水法以及半水-二水联合法等,其中二水法由于其工艺简单、技术成熟、操作稳定可靠、对矿石种类尤其是中低品位矿石适应性强等优点,主导了我国80%以上的磷酸生产过程,所以通常所说的磷石膏主要是二水法工艺产生的二水石膏,此外还含磷、氟、有机物等主要杂质以及少量的重金属(Cr、Cu、Zn和Cd等)和稀土元素等有价金属元素,生产1吨P2O5约排放4~5吨磷石膏[1-3]。目前,全球磷复肥行业每年排放1.0~2.8亿吨磷石膏,综合利用率仅为15%[4],其中我国每年磷石膏排放量在6 000万吨以上,综合利用率也仅为30%左右。截至目前我国磷石膏累计堆存量已经超过5亿吨,这不仅产生极大的土地浪费,同时磷石膏中的杂质还会对堆存地周边的水体、大气以及土壤造成巨大污染,环境风险和压力巨大[5]。
为了有效消纳磷石膏,科研人员进行了大量的研究,目前磷石膏的主要利用途径包括替代天然石膏作为水泥缓凝剂,用于制硫酸联产水泥,用于生产石膏板、石膏砌块等建筑材料,用作道路基层材料,作为农业土壤的添加剂以及用于制备硫酸钠钾和硫酸铵等[6-8],然而这些利用途径却受到磷石膏中杂质的严重制约。如果能将磷石膏的再利用与其中有价杂质的回收利用结合起来,也许可以为破解磷石膏再利用的难题提供一种新的途径,尤其是磷石膏中含有一定量的稀土元素(0.01%~0.40%,以稀土氧化物计),稀土元素有“工业维生素”、“新材料之母”的美誉,是制造高效能电池、尖端材料的关键元素,也是国民经济中最为重要的战略金属资源之一[9]。并且随着稀土需求的不断增加和易处理稀土资源的不断萎缩,也使磷石膏成为稀土的潜在二次资源创造了可能。
针对磷石膏中稀土的分离,研究人员进行了大量的研究,目前主流方法是利用硫酸、盐酸和硝酸溶液浸出,如表 1所列。虽然关于磷石膏中稀土浸出的研究已经很多,但是对于工业生产过程中极为重要的浸出动力学的研究却很少。硫酸作为湿法磷酸生产的原料,资源丰富易得且成本优势明显,所以相对于盐酸和硝酸,硫酸作为磷石膏中稀土回收的浸出剂具有显著的优势。因此本研究以硫酸作为浸出剂深入研究了磷石膏中稀土在硫酸溶液中的浸出动力学,为后续的相关研究提供了借鉴。
| 表 1 磷石膏中稀土浸出的研究 Table 1 Summary of previous studies on the recovery of REEs from PG |
 |
| 点击放大 |
1 实验 1.1 磷石膏
湿法磷酸反应化学方程为Ca5F(PO4)3 + 5H2SO4 + 5nH2O → 3H3PO4 + 5CaSO4·nH2O↓+HF↑。根据不同的反应条件和产物浓度,反应式中n可以是0、0.5和2,对应的副产物分别为无水硫酸钙(CaSO4),半水硫酸钙(CaSO4·0.5H2O)和二水硫酸钙(CaSO4·2H2O)。
实验中所用的磷石膏来自云磷集团,磷石膏扫描电镜(SEM)和X射线衍射(XRD)分析结果如图 1所示。X射线荧光光谱(XRF)和电感耦合等离子体发射光谱(ICP-OES)分析结果见表 2和表 3。结果表明:磷石膏主要呈菱形片状晶体,主要成分为二水硫酸钙(CaSO4·2H2O),同时还有少量磷酸氢钙(CaHPO4·2H2O)和二氧化硅(SiO2),稀土总含量为0.020 8%,其中Y,La,Ce和Nd是含量最高的4种稀土元素,在本研究中也主要考察这4种稀土元素。
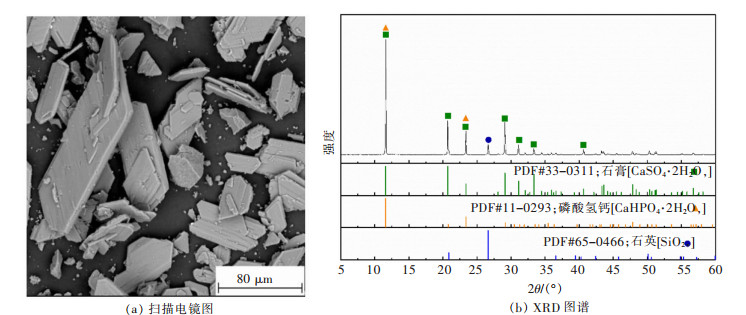 |
| 图 1 磷石膏样品的扫描电镜图和XRD谱 Fig. 1 SEM photograph and XRD pattern of the phosphogypsum sample |
| 表 2 磷石膏样品的化学组成 Table 2 Chemical composition of the PG sample |
 |
| 点击放大 |
| 表 3 磷石膏样品中稀土和钙含量 Table 3 Contents of REEs in the phosphogypsum sample |
 |
| 点击放大 |
分析纯试剂硫酸(96%~98%)、盐酸(36%~38%)、硝酸(65%~68%)、高氯酸(70%~72%)和氢氟酸(≥40%)购自西陇化工,这些酸用于固体样品的消解以及稀土浸出实验。
1.2 实验步骤浸出实验装置如图 2所示,配制300 mL,1.65 mol/L的硫酸溶液加入到三口圆底烧瓶中,用恒温磁力搅拌器在油浴环境中预热到指定温度(30、60、80 ℃),然后称取30.00 g磷石膏加入到硫酸溶液中,在100 r/min转速下搅拌反应并开始计时。每隔一段时间(5、15、30、45、60、90、120 min)用移液枪从圆底烧瓶中移取一定量的悬浊液,并马上用0.8 μm的针式过滤器过滤,之后滤液用1.0 mol/L的硝酸溶液稀释3倍,并用于电感耦合等离子体发射光谱(ICP-OES)检测。
 |
| 图 2 实验装置 Fig. 2 A schematic diagram of the apparatus used for the acid leaching tests |
稀土浸出率(α, %)按照下列公式计算:

|
(1) |

|
(2) |
其中,Cf(mg/L)为浸出液被1.0 mol/L硝酸溶液稀释后样品中元素浓度;V为初始浸出剂体积,即0.3 L;Cs(mg/L)为磷石膏样品中含有的元素浓度;∑REE代表Y、La、Ce和Nd 4种稀土元素之和;α∑REE代表这4种稀土元素的总浸出率,文章中提及的稀土总浸出率指的也是α∑REE。
2 结果与讨论 2.1 磷石膏中稀土的浸出动力学不同温度下磷石膏中稀土和钙浸出率随浸出时间的变化如图 3所示,从图 3中可以看出随着浸出时间的增加,稀土和钙的浸出率逐渐增加,当浸出时间超过1 h后,稀土和钙的浸出率基本保持不变或者有所下降;另一方面浸出温度的提高也进一步促进了磷石膏中稀土和钙的浸出。在30, 60,80 ℃浸出温度下,稀土最大总浸出率分别为44.4%、47.0%和55.8%,其中Y的浸出率最大分别为47.7%、50.5%和63.9%,钙的最大浸出率分别为3.1%、5.7%和11.0%。从图 3可以看出稀土浸出与钙的浸出具有一致性,为了进一步研究稀土浸出与钙浸出之间的关系,我们对不同浸出时间的稀土浸出率与钙浸出率进行了线性拟合,如图 4所示,并给出了拟合参数,如表 4。从表 4中可以看出稀土元素浸出率与钙浸出率线性拟合的决定系数(Radj2)均大于0.9,说明两者之间具有很强的线性关系,而钙离子主要来自二水硫酸钙,因此二水硫酸钙的溶解与稀土的浸出具有一致性,这可能是由于实验所用的磷石膏样品中大部分稀土元素赋存于二水硫酸钙晶格中的原因[17]。也就是说,当二水硫酸钙在浸出体系中达到其溶解度的极限时,稀土元素也达到了其浸出率的最大值,所以二水硫酸钙在浸出体系中的溶解动力学也可以在一定程度上说明稀土的浸出动力学,但是却不能准确说明磷石膏中稀土的浸出动力学。
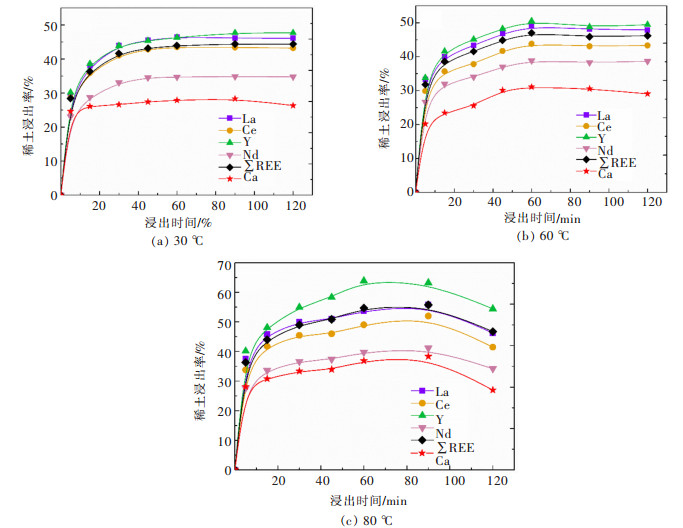 |
| 图 3 不同浸出温度下随着浸出时间的延长磷石膏中稀土和钙的浸出情况 Fig. 3 Leaching recoveries of REEs and calcium at different leaching temperatures as a function of leaching time |
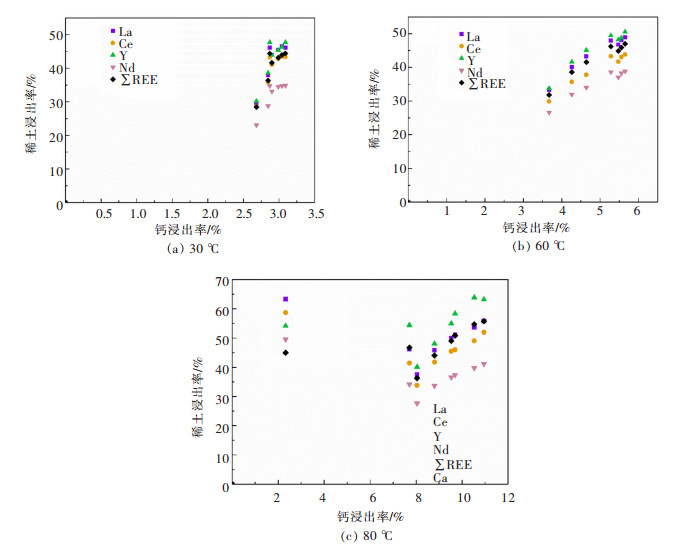 |
| 图 4 不同浸出温度下稀土浸出率与钙浸出率之间的关系 Fig. 4 Correlation between calcium recovery and the recoveries of REEs at different leaching temperatures |
| 表 4 稀土浸出率与钙浸出率之间的关系 Table 4 Linear fitting parameters for REEs versus Ca leaching kinetic data |
 |
| 点击放大 |
2.2 浸出动力学模型的确定
浸出过程是一个固体颗粒与液相之间的非均相反应过程。缩核模型(SCM)是目前应用最广泛的,被认为是最能体现浸出过程实际情况的动力学模型[22-23]。假设固体颗粒为球形(图 5),若浸出反应是化学反应控制,则其动力学模型可以用式(3)表示:

|
(3) |
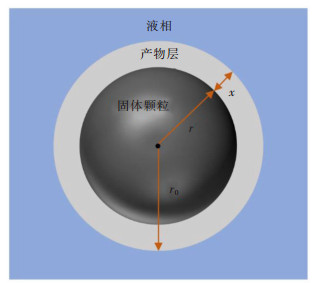 |
| 图 5 球形固体颗粒的缩核反应模型 Fig. 5 A spherical shrinking core model |
其中α为反应时间t时的稀土浸出率;kc为化学反应控制的表观反应速率常数。
若浸出反应是扩散控制,则其动力学模型可以用式(4)表示:

|
(4) |
其中kd为扩散控制的表观反应速率常数。
从图 3可以看出反应1 h后浸出反应基本停止,因此在确定磷石膏稀土浸出的动力学模型时,我们只采用浸出时间1 h内的浸出率数据。将不同浸出时间时的浸出率代入到式(3)、式(4)中,通过计算得到式(3)、式(4)左侧数值,作这些数值(纵坐标)与对应浸出时间(横坐标)的散点图,并对散点图进行线性拟合,拟合参数如表 5和表 6所列。
| 表 5 化学反应控制缩核模型的kc和Radj2 Table 5 kc and Radj2 for the SCM of chemical reaction control |
 |
| 点击放大 |
| 表 6 扩散控制缩核模型的kd和Radj2 Table 6 kd and Radj2 for the SCM of diffusion control |
 |
| 点击放大 |
线性拟合的决定系数(Radj2)代表了线性相关的大小,越接近1说明其线性相关性越大,从表 5和表 6可以看出扩散控制动力学模型的Radj2均大于化学反应控制动力学模型,因此相对于化学反应控制,扩散控制的缩核模型更能准确表征磷石膏中稀土的浸出过程,但是Radj2基本小于0.9,说明线性相关不强,也就是说即使是扩散控制的动力学模型也不能准确地表征此浸出过程。
为了更准确地表征固液非均相反应的动力学过程,研究人员以球形固体颗粒的缩核模型为基础,推导出了扩散和界面传质混合控制的动力学模型公式[24-25],如式(5):

|
(5) |
其中kms为扩散和界面传质混合控制的表观反应速率常数。
图 6是不同浸出温度下1/3·ln(1-α)-1+(1-α)-1/3与对应浸出时间的散点图及其线性拟合,表 7列出了线性拟合的相关参数。对比表 7和表 6可以看出,扩散和界面传质混合控制动力学模型的Radj2均大于单纯扩散控制动力学模型的,并且Radj2基本大于0.9,尤其对于总的稀土浸出(∑REE),说明扩散和界面传质混合控制动力学模型能较好的说明和表征磷石膏中稀土的浸出过程,也就是说磷石膏中稀土浸出是受扩散和界面传质混合控制的。
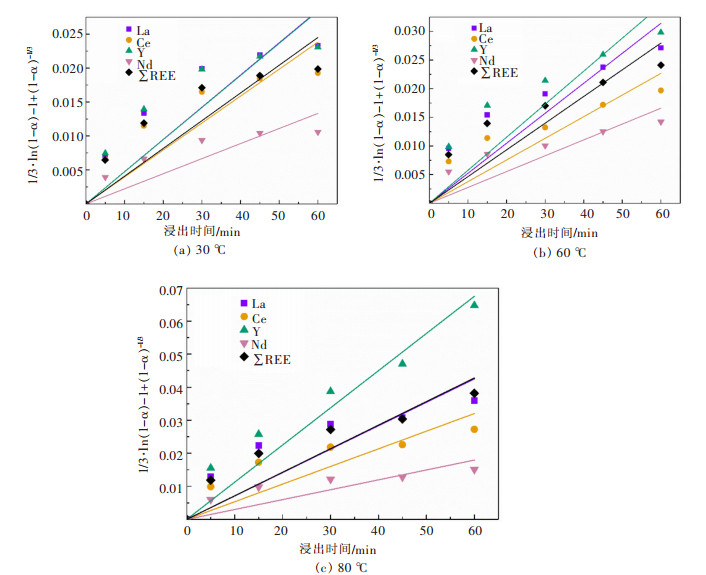 |
| 图 6 不同浸出温度下1/3·ln(1-α)+(1-α)-1/3-1与对应浸出时间的散点图及其线性拟合 Fig. 6 Variance of 1/3·ln(1-α) +(1-α)-1/3-1 between the experimental data and model predictions as a function of leaching time at different leaching temperatures |
| 表 7 扩散和界面传质混合控制缩核模型的kms和Radj2 Table 7 kms and Radj2 for the spherical shrinking core model controlled by the interfacial transfer and diffusion across the product layer |
 |
| 点击放大 |
2.3 稀土浸出的表观活化能
基于扩散和界面传质混合控制的动力学模型求出的浸出过程的表观速率常数kms,结合阿伦尼乌斯方程(式(6))计算磷石膏中稀土浸出过程的表观活化能[26]。

|
(6) |

|
(7) |
其中k为反应的表观速率常数,min-1;A为指前因子;T为反应温度,K;R为理想气体常数,8.314 J/(mol·K);Ea为反应的表观活化能(kJ/mol-1);kslope为线性方程的斜率。
首先作lnkms与1/T之间的散点图,对散点图进行线性拟合,如图 7。利用式(7)求得稀土浸出的表观活化能为9.10 kJ/mol。
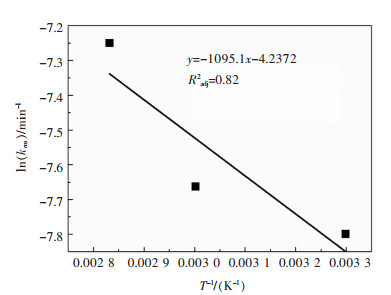 |
| 图 7 总稀土浸出的阿伦尼乌斯线性拟合关系 Fig. 7 Arrhenius plots for leaching REEs from the PG sample |
3 结论
通过对磷石膏中稀土硫酸浸出过程的动力学研究表明:
1)随着浸出温度和浸出时间的增加,稀土浸出率是逐渐增加的,当浸出时间超过1 h后,稀土浸出率基本达到平衡或者略有下降;
2)在30,60,80 ℃浸出温度下,稀土总浸出率最大分别为44.4%、47.0%、55.8%,其中Y的浸出率最大分别为47.7%、50.5%、63.9%;
3)磷石膏中稀土浸出与二水硫酸钙的溶解具有很强的线性相关性;
4)磷石膏中稀土浸出过程是受扩散和界面传质混合控制的,浸出过程的表观活化能Ea=9.10 kJ/mol。
| [1] |
黄照昊, 罗康碧, 李沪萍. 磷石膏中杂质种类及除杂方法研究综述[J].
硅酸盐通报, 2016, 35(5): 1504–1508.
|
| [2] |
WU S, WANG L, ZHAO L, ZHANG P, et al. Recovery of rare earth elements from phosphate rock by hydrometallurgical processes-A critical review[J].
Chemical Engineering Journal, 2018, 335: 774–800. DOI: 10.1016/j.cej.2017.10.143. |
| [3] |
茹晓红. 磷石膏基胶凝材料的制备理论及应用技术研究[D]. 武汉: 武汉理工大学, 2013.
|
| [4] |
YANG J, LIU W, ZHANG L, et al. Preparation of load-bearing building materials from autoclaved phosphogypsum[J].
Construction and Building Materials, 2009, 23(2): 687–693. DOI: 10.1016/j.conbuildmat.2008.02.011. |
| [5] |
杨冬蕾. 我国磷石膏和钛石膏资源化利用进展及展望[J].
硫酸工业, 2018, 10: 5–10.
|
| [6] |
GARRIDO F, ILLERA V, GARCIA-GONZALEZ M. Effect of the addition of gypsum-and lime-rich industrial by-products on Cd, Cu and Pb availability and leachability in metal-spiked acid soils[J].
Applied Geochemistry, 2005, 20(2): 397–408. DOI: 10.1016/j.apgeochem.2004.08.001. |
| [7] |
张利珍, 张永兴, 张秀峰, 等. 中国磷石膏资源化综合利用研究进展[J].
矿产保护与利用, 2019, 39(4): 14–18.
|
| [8] |
朱志伟, 何东升, 陈飞, 等. 磷石膏预处理与综合利用研究进展[J].
矿产保护与利用, 2019, 39(4): 19–25.
|
| [9] |
池汝安, 王淀佐.
稀土矿物加工[M]. 北京: 科学出版社, 2014.
|
| [10] |
JAROSINSKI A, KOWALCZYK J, MAZANEK C. Development of the polish wasteless technology of apatite phosphogypsum utilization with recovery of rare earths[J].
Journal of Alloys and Compounds, 1993, 200(1/2): 147–150. |
| [11] |
PRESTON J, COLE P, CRAIG W, et al. The recovery of rare earth oxides from a phosphoric acid by-product. Part 1: Leaching of rare earth values and recovery of a mixed rare earth oxide by solvent extraction[J].
Hydrometallurgy, 1996, 41(1): 1–19. DOI: 10.1016/0304-386X(95)00051-H. |
| [12] |
EL-REEFY S A, NAYL A A, ALY H F. Leaching and group separation of lanthanides from Phosphogypsum[A] // proceedings of 9th. international conference for nuclear sciences and Applications[C]. Sharm El Sheikh: ESNSA Press, 2008: 11-14.
|
| [13] |
LOKSHIN E, TAREEVA O, ELIZAROVA I. A study of the sulfuric acid leaching of rare-earth elements, phosphorus, and alkali metals from phosphodihydrate[J].
Russian Journal of Applied Chemistry, 2010, 83(6): 958–964. DOI: 10.1134/S1070427210060054. |
| [14] |
ABRAMOV Y K, VESELOV V M, ZALEVSKY V M, et al. Method for extracting rare earth elements from phosphogypsum[P]. US: 20120114538A1, 2012-05-10.
|
| [15] |
AL-THYABAT S, ZHANG P. REE extraction from phosphoric acid, phosphoric acid sludge, and phosphogypsum[J].
Mineral Processing and Extractive Metallurgy, 2015, 124(3): 143–150. DOI: 10.1179/1743285515Y.0000000002. |
| [16] |
ISMAIL Z, ELGOUD E A, HAI F, et al. Leaching of some lanthanides from phosphogypsum fertilizers by mineral acids[J].
Arab Journal of Nuclear Sciences and Applications, 2015, 48(2): 37–50. |
| [17] |
WALAWALKAR M, NICHOL C K, AZIMI G. Process investigation of the acid leaching of rare earth elements from phosphogypsum using HCl, HNO3, and H2SO4[J].
Hydrometallurgy, 2016, 166: 195–204. DOI: 10.1016/j.hydromet.2016.06.008. |
| [18] |
LIANG H, ZHANG P, JIN Z, et al. Rare earths recovery and gypsum upgrade from Florida phosphogypsum[J].
Minerals and Metallurgical Processing, 2017, 34(4): 201–206. |
| [19] |
LAMBERT A, ANAWATI J, WALAWALKAR M, et al. Innovative application of microwave treatment for recovering of rare earth elements from phosphogypsum[J].
ACS Sustainable Chemistry and Engineering, 2018, 6(12): 16471–16481. |
| [20] |
CáNOVAS C, CHAPRON S, ARRACHART G, et al. Leaching of rare earth elements (REEs) and impurities from phosphogypsum: A preliminary insight for further recovery of critical raw materials[J].
Journal of Cleaner Production, 2019, 219: 225–235. |
| [21] |
ANTONICK P J, HU Z, FUJITA Y, et al. Bio-and mineral acid leaching of rare earth elements from synthetic phosphogypsum[J].
The Journal of Chemical Thermodynamics, 2019, 132: 491–496. |
| [22] |
DICKINSON C, HEAL G. Solid–liquid diffusion controlled rate equations[J].
Thermochimica Acta, 1999, 340: 89–103. |
| [23] |
ZHANG W, NOBLE A, YANG X, et al. Lithium leaching recovery and mechanisms from density fractions of an Illinois Basin bituminous coal[J].
Fuel, 2020, 268: 117319. |
| [24] |
LI K, CHEN J, ZOU D, et al. Kinetics of nitric acid leaching of cerium from oxidation roasted Baotou mixed rare earth concentrate[J].
Journal of Rare Earths, 2019, 37(2): 198–204. |
| [25] |
边雪. 从包头混合型稀土精矿中回收稀土、磷, 、氟的研究[D]. 沈阳: 东北大学, 2008.
|
| [26] |
KIM C J, YOON H S, CHUNG K W, et al. Leaching kinetics of lanthanum in sulfuric acid from rare earth element (REE) slag[J].
Hydrometallurgy, 2014, 146: 133–137. |
 2021, Vol. 12
2021, Vol. 12


