| 氧化镁的制备方法及发展趋势综述 |
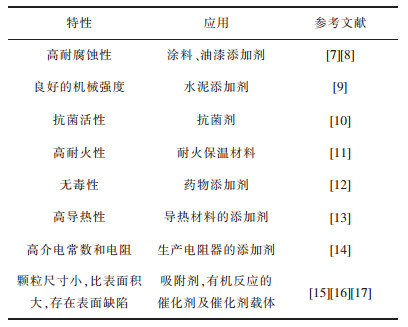
镁是地壳中含量排行第8的元素,镁单质化学性质比较活泼,镁元素通常存在于菱镁矿、白云石、蛇纹石、卤水等资源中。在我国,镁资源含量十分丰富。菱镁矿储量位居世界之首,达50亿t[1],占世界菱镁矿储量的80%以上,主要分布在辽宁省;白云石储量达70亿t[2],主要分布在山西、河北等地;蛇纹石储量超过50亿t,主要分布在辽宁、陕西、四川等地;卤水资源主要集中在西部盐湖,其中柴达木盐湖的镁盐储量高达48.1亿t。目前,镁资源被研发成各种形式的镁化合物应用于人们的生产生活中,镁产品主要包括氧化镁、氢氧化镁、镁金属及镁合金等,其中氧化镁是一种不可或缺的无机化工材料,被广泛应用于耐火材料、陶瓷、化工、医药及食品等各个领域[3-6]。表 1列举了氧化镁的特性及应用。
| 表 1 氧化镁的特性及应用 Table 1 Characteristics and application of magnesium oxide |
 |
| 点击放大 |
近年来,随着经济的高速发展,氧化镁应用领域越来越广泛,对氧化镁的质量要求越来越高。而传统的制备方法不能满足现有需求,因此,科研工作者们研究了制备氧化镁的不同方法[2, 18-38]。本文对含镁固体和液体原料制备氧化镁的方法进行了分类总结,此外对纳米氧化镁和特种氧化镁进行了评述,并对其未来的发展趋势进行了展望。
1 普通氧化镁制备方法 1.1 含镁固体为原料 1.1.1 直接煅烧法该法是将镁盐或菱镁矿直接置于高温中煅烧,得到氧化镁。Li等在450 ℃的条件下煅烧3 h五水碱式碳酸镁(4MgCO3·Mg(OH)2·5H2O)和氢氧化镁,得到了平均尺寸分别为9 nm和4.8 nm的MgO产品[18]。
其反应机理为:
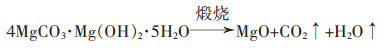
|
(1) |

|
(2) |
直接煅烧法工艺简便,对设备要求不高,易于工业化。但该方法不易对氧化镁的形貌进行调控。
1.1.2 铵浸法该法是将白云石煅烧后得到的产物与铵盐溶液反应,过滤后将滤液与氨水反应得到Mg(OH)2,煅烧Mg(OH)2得到氧化镁。Huang等以煅烧白云石为镁源,硫酸铵为浸取剂,在(NH4)2SO4与MgO摩尔比为1.8∶1,蒸馏氨的体积为350 mL,煅烧白云石用量为20 g的条件下,镁的浸出率达96.81%。并将得到的Mg(OH)2在500~1 000 ℃下煅烧,制得了颗粒尺寸为12.4~42.2 nm的氧化镁[19]。
其反应机理为:
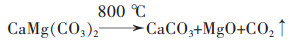
|
(3) |
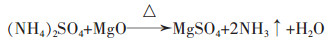
|
(4) |
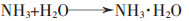
|
(5) |
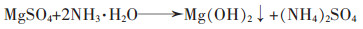
|
(6) |

|
(7) |
铵浸法在实验过程中会产生氨气,用水回收后可用做后续沉镁步骤的沉淀剂,可以形成闭环工艺,循环使用,所得到的氧化镁纯度也较高。但是选择铵盐浸取剂价格较贵,工艺流程长。
1.1.3 酸浸法该法是将含镁矿石粉碎后,浸入硫酸或盐酸溶液中制得MgSO4或MgCl2,使用沉淀剂制得MgCO3或Mg(OH)2沉淀,煅烧沉淀物得到氧化镁。常用的沉淀剂有Na2CO3,NH3·H2O,(HN4)2CO3,NH4HCO3等。曹星辰以蛇纹石为镁源,硫酸为浸取剂,在矿石粒径75 μm、硫酸浓度为40%、反应温度为95 ℃、反应时间为3 h时,镁的浸出率为98.40%。然后以NH4HCO3为沉淀剂,在镁与碳铵摩尔比为1∶2、反应物初始浓度C(Mg2+)=0.5 mol/L、反应温度为50 ℃、反应时间为50 min、反应溶液pH为9.5、添加剂CXC-13的加入量为总体系的1%(质量分数)时,制得MgCO3·3H2O晶须,并将得到的MgCO3·3H2O在600 ℃下煅烧2 h、得到氧化镁[20]。
其反应机理为:

|
(8) |
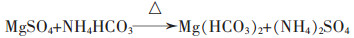
|
(9) |
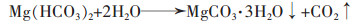
|
(10) |
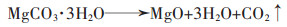
|
(11) |
酸浸法操作简单,对设备要求低,成本低,特别适用处理低品位的矿石。但是酸浸时会有一部分杂质离子进入到溶液中,需要后续对浸出液进行除杂处理,提高产品纯度。
1.1.4 碳化法该法是将含镁矿石煅烧后得到的物料,经过消化生成Mg(OH)2悬浊液,再进行碳化,制得Mg(HCO3)2,热解后得到碱式碳酸镁,最后煅烧得到氧化镁。甘宇等以白云石为镁源,在消化液固比10 mL/g、温度60 ℃、搅拌转速500 r/min、反应时间1 h;碳化液固比30 mL/g、温度25 ℃、搅拌转速600 r/min、二氧化碳通入速率2 L/min、碳化时间1 h;90 ℃下热解1 h,制备出MgO含量为99.56 %的高纯氧化镁[2]。
其反应机理为:
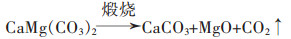
|
(12) |

|
(13) |
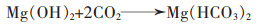
|
(14) |

|
(15) |
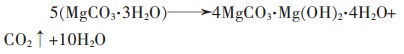
|
(16) |
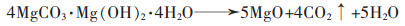
|
(17) |
碳化法选择性强、不易腐蚀设备、易于控制,工艺简单,产品质量稳定,且该方法使用的CO2成本低,来源广。该法适宜于工业化生产,有很大的发展前景。
1.2 含镁液体为原料 1.2.1 纯碱法该法是将卤水稀释后加入到反应釜中,不断搅拌并加入纯碱溶液,使卤水和纯碱发生反应,生成碱式碳酸镁沉淀,液固分离后烘干沉淀物,并在高温直接煅烧制得氧化镁。谢垚等以卤水为原料,纯碱为沉淀剂,在35 ℃的条件下,通过恒流进料,搅拌速度300 r/min,反应1 h,制备出氧化镁的前驱体,并在800 ℃的条件下煅烧2 h,得到纯度高于98.5%的活性MgO颗粒[21]。
其反应机理为:
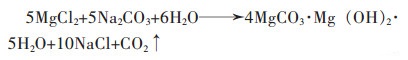
|
(18) |

|
(19) |
该法操作简单,制备出的MgO产品纯度高,但纯碱消耗量大,成本较高。
1.2.2 碳铵法该法是将卤水经过预处理后与碳酸铵或碳酸氢铵进行反应,得到碱式碳酸镁或碳酸镁,再经过过滤、洗涤、干燥、煅烧等程序,制得氧化镁。王犇以卤水为原料,碳酸氢铵为沉淀剂,在反应温度60 ℃、反应时间50~60 min、热解温度70 ℃、热解时间1 h、煅烧温度800 ℃、煅烧时间40~60 min时,制备了特级轻质氧化镁[22]。
其反应机理为:
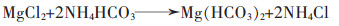
|
(20) |

|
(21) |
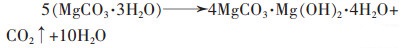
|
(22) |
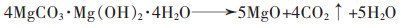
|
(23) |
碳铵法是一种循环工艺,反应过程中的CO2可以重复利用。但是该法对反应温度要求苛刻,只有在65~70 ℃的温度区间才能发生正碳酸镁的热解反应。
1.2.3 喷雾热分解法该法是将一定浓度的镁盐溶液直接喷到反应炉中进行反应,煅烧后得到粗氧化镁产品,洗涤后水化成Mg(OH)2,煅烧得到纯度较高的氧化镁。Pradita等以Mg(NO)3·6H2O为镁源,使用超声雾化器将溶液分散成细小的液滴,液滴将经历3个热处理阶段:预热阶段,煅烧阶段和冷却阶段。在预热阶段,液滴的溶剂蒸发,剩余的溶质在煅烧阶段沉淀出来。在煅烧阶段,发生了Mg(NO)3·6H2O分解形成MgO颗粒的情况。最后,冷却阶段将颗粒温度降低,以便更容易地从不锈钢管收集粉末。该研究制备出了空心球形和不规则MgO颗粒,并发现:随着热解温度的升高,氧化镁的颗粒尺寸逐渐减小,在900 ℃时,得到最小粒径在(354±104)nm范围内[23]。
喷雾热分解法需要高温及真空条件,对设备和操作要求较高。但工序简单,易制得粒径小、分散性好的MgO粉体,生产过程连续,产能大,生产效率高,有利于工业化生产。
综上所述,氧化镁制备的关键在于前驱体的制备,目前工业生产中最常见的前驱体是碳酸镁或碱式碳酸镁,在高温下煅烧,得到氧化镁产品。但是在煅烧过程中会产生大量的CO2,导致温室效应,所引起的气候变化和生态环境问题已严重地制约了人类的生存和发展。为了解决这一问题,我国一方面控制CO2的排放;另一方面,对排放出的CO2进行捕集和利用。当前,CO2的捕集方法主要有溶剂吸收法、物理吸附法、膜分离法以及低温分离法[24]。捕集后的CO2可还原为甲酸、甲醇和烃类等高附加值产品,采用的主要方法有光化学还原法、电化学还原法以及催化转移氢化法[25]。在达到CO2减排目的的同时,由于CO2廉价且来源广泛,又能创造巨大的经济效益。
2 纳米氧化镁制备方法 2.1 共沉淀法共沉淀法是使含镁溶液和沉淀剂反应得到沉淀物。常用的沉淀剂有Na2CO3,NH3·H2O,(HN4)2CO3,Na2C2O4,NaOH等。共沉淀法操作简便,成本低。但制得的氧化镁易受浓度、pH值、温度、时间、搅拌状态等因素的影响。共沉淀法主要包括直接沉淀法[26]和均匀沉淀法2种。
2.1.1 直接沉淀法该法是在镁盐溶液中直接加沉淀剂,使镁以沉淀物形式析出,然后热分解制得氧化镁。Cui等以Mg(NO)3·6H2O为镁源,草酸为沉淀剂,在反应中加入醋酸铜,混匀后在常温下静置12 h,得到草酸镁沉淀,将沉淀物在500 ℃下煅烧2 h,得到纯MgO和掺杂Cu的MgO纳米粒子。研究发现,随着铜含量的增加,MgO的粒径逐渐减小,比表面积逐渐增大。当Cu的掺杂量达5 %时,MgO的颗粒尺寸约3~5 nm,比表面积为274.8 m2/g[27]。
2.1.2 均匀沉淀法该法是指向镁盐溶液中加入分散剂,控制沉淀的生成速度以及颗粒的生长速度,获得粒径分布均一的氧化镁。Ashok以Mg(NO)3·6H2O为镁源,NaOH为沉淀剂,十二烷基硫酸钠为分散剂,在pH值为13,室温下制得了Mg(OH)2沉淀,并将沉淀物在400 ℃下煅烧2 h,得到平均粒径为7.86 nm的纳米氧化镁,并将其用于废食用油甲醇酯化反应中作催化剂。研究发现,当MgO纳米催化剂用量为2%(指质量分数)、甲醇与油的摩尔比为24∶1、反应温度为65 ℃、反应时间为1 h时,生物柴油的最高收率为93.3 %[28]。该方法可以避免出现浓度不匀现象,减少晶粒团聚。
2.2 溶胶-凝胶法该法是在较低温度下,将镁盐溶解在有机介质中,缩聚形成溶胶,溶胶蒸干后得到凝胶,凝胶经热处理后得到氧化镁,所得产品大多应用于MPV以及查尔酮反应中做催化剂。Wahab等以Mg(NO)3·6H2O为镁源,NaOH为引发剂,在室温下制得了Mg(OH)2沉淀,并将沉淀物在300 ℃和500 ℃下煅烧,得到颗粒尺寸在50~70 nm之间的立方形氧化镁纳米粒子[29]。Cui等以四水醋酸镁和十六烷基三甲基溴化铵(CTAB)为原料,通过改变煅烧温度、pH值和四水醋酸镁的用量,制备出不同粒径的球形和立方纳米MgO[30]。
溶胶-凝胶法制备的氧化镁纯度高、粒径小、比表面积大、晶体结构缺陷较多。但所使用的原料大都为价格较高的有机物,原料保存和反应条件也很苛刻,对人体有害;反应时间过长;由于凝胶中存在很多微孔,在干燥时又会放出气体及有机物,易发生收缩,影响产品质量[28]。目前,已经找到了解决方案,例如:在介质的临界温度和压力的条件下干燥,可以有效避免收缩现象;将前驱体由金属醇盐改为无机盐,可以降低原料成本;柠檬酸-硝酸盐法中利用自燃烧,可以缩短反应时间等[31]。
2.3 水热合成法水热合成法[32]是以水为反应体系,通过高温高压将水热反应釜内的反应体系升到临界温度,在水溶液或蒸汽流体中制备氧化镁,经分离和热处理后制得纳米氧化镁。Feng等分别以镁粉和六水硝酸镁为原料,在pH值为12,温度为120 ℃的条件下加热1.5~8 h,合成Mg(OH)2前驱体,将其在450 ℃下煅烧4 h,得到MgO。研究了制得的MgO对Ni(II)的吸附性能,在加热时间为4 h时,MgO吸附性能最佳,达到2 217 mg/g[33]。水热法所用的原料成本低,氧化镁产品纯度高、分散性好、晶粒大小可控,且对环境友好。
但水热法也存在一些问题:一是反应效果不直接,只能通过晶体的形态和结构了解晶体生长信息;二是理论基础不完善;三是只能制备氧化物粉体,对非氧化物粉体的制备很少;四是对生产设备要求严格。因此,未来不仅需要完善基础理论架构,还需要在技术上有所突破,向水热设备、溶媒、反应机理等方面发展[34]。
2.4 固相反应法该方法是将反应物按比例混合,再经过研磨、煅烧及粉碎后得到氧化镁产品。Chen等以四水醋酸镁为镁源,NaOH为沉淀剂,采用固相反应法在80 ℃下反应4 h,得到Mg(OH)2沉淀,将沉淀物在500 ℃的空气中煅烧4 h,制得由球状纳米晶组成的平均粒径为26.3 nm的立方相纳米MgO颗粒[35]。该法能耗大、效率低,但过程简单、不需溶剂且反应条件易于控制。
2.5 气相沉积法气相沉积法[36]是利用镁盐或镁单质蒸气通过化学反应生成氧化镁。Pradeep等以镁粉为原料,在无催化剂的条件下,将镁粉置于800~1 100 ℃,通有氩气和氧气混合气的氧化铝管中,反应1 h,制备了平均粒径为16 nm的立方形纳米MgO[37]。该法所需设备昂贵,产物收集困难,能耗大,但方法简单、所得氧化镁粉体的纯度高、分散性好、粒度分布窄、平均粒径小、活性高。
2.6 模板法模板法是将氧化镁前驱体溶液浸入到模板孔道中,进行焙烧,在孔道中生成氧化镁晶体,最后脱去模板剂,制备出氧化镁。常用的模板剂有活性炭、SiO2和脱脂棉等。Najafi以碳纳米颗粒为模板,以硫酸镁为镁源,氨水为沉淀剂,混合后在室温下搅拌过夜,制得灰色粉末,将灰色粉末在450~500 ℃下煅烧2 h,合成了孔径分别为3 nm和25 nm的双峰介孔氧化镁纳米片[38]。模板法制得的MgO比表面积大,且可以复制模板剂的形貌,具有有序结构,但所用模板剂制备复杂,价格贵,导致生产成本高。
模板法目前还存在以下问题:第一,模板脱除。模板脱除一般采用热处理法,但热处理过程如果温度过高造成模板塌陷,材料凝聚程度大,分散性降低;而温度过低,模板灰化程度不完全,残留在材料当中会影响材料特性。因此寻找一种更加完善的模板脱除法是目前研究的主要问题。2018年,Guo等报道了4种模板脱除的新方法,分别是微泡挤压法、膜挤压乳化法、沉淀挤压法和生物模挤压法[39]。第二,一些经过表面改性的模板,能使金属离子与位点更好结合,提高材料性能,所以对模板进行改性也是未来的研究热点之一[40]。
2.7 微波法微波法是指以微波辐射的方法制备氧化镁。Zhang等以硝酸镁为镁源,碳酸氢铵为沉淀剂,聚乙二醇为表面活性剂,在硝酸镁与碳酸氢铵摩尔比为1∶4,温度为80 ℃下反应50 min,产生白色沉淀物,将沉淀物通过逐步煅烧的方式制备纳米MgO,并将其掺杂在LDP中制备纳米复合材料。结果表明:微波辅助法制备的纳米MgO粒径为12.74 nm,无明显团聚;当纳米MgO质量分数为2%时,复合材料的空间电荷积累明显减少,体积电阻率和直流击穿强度均得到提高[6]。该法操作简单,快速高效,但由于其实验装置的特殊性,目前仍处于实验室研究阶段。
2.8 超声法超声法[41]是指在超声波频率为10 Hz到20 MHz之间进行的化学反应。Li等以硝酸镁为镁源,碳酸钾为沉淀剂,将溶液混合后,于90 ℃下静置30 min,收集白色前体。将前体于500 ℃煅烧2 h后,在常温下进行超声处理,最后在600 ℃煅烧2 h,制备横向尺寸约为200~600 nm、厚度约为10 nm的氧化镁纳米片[42]。与其他方法相比,超声法能够加快反应速度,使合成的氧化镁的直径更小且形状更均一。
2.9 电化学法电化学法[43]由于生产成本高和产品质量差,是很少用的一种合成氧化镁的方法。Amrulloh等以海水和卤水为原料,在固定电位18 V的双室电化学池中,室温下进行4 h的电化学过程,将得到的样品在500 ℃下煅烧4 h,合成了粒径在60~100 nm之间的球形和立方晶体纳米MgO[44]。
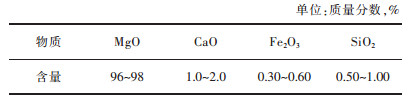
3 特种氧化镁 3.1 电工级氧化镁电工级氧化镁由于具有优良的导热性和绝缘性而应用在电热电器中,作为高温情况下导热的绝缘材料,其纯度达到96%~97%。由于电工级氧化镁还会影响电热管的工作温度和寿命,因此对电工级氧化镁的绝缘性、水化率、导电、导热性都有很高的要求。表 2列举了国内电工级氧化镁的化学指标[45]。
| 表 2 电工级氧化镁的化学指标 Table 2 Chemical index of electrical magnesium oxide |
 |
| 点击放大 |
电工级氧化镁的生产原理是以高含镁物质为原料,在电熔融炉中加热产生3 000 ℃以上的高温,经熔融、析晶、晶体长大、冷却等过程,制得氧化镁晶体,再经过后续加工,生产出适应不同用途的电工级氧化镁。目前,同发达国家相比,我国电工级氧化镁生产存在工艺落后,产品质量差,使用寿命短,缺乏现代控制手段等问题。
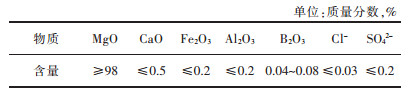
3.2 硅钢级氧化镁硅钢氧化镁是以氧化镁在工业上的用途命名的,主要应用在取向硅钢片制备过程中高温退火时作为隔离剂,脱磷,脱硫剂。它会和SiO2在硅钢表面形MgSiO3,并进一步反应生成一层绝缘的Mg2SiO4涂层。由于其特殊的用途,硅钢级氧化镁有以下要求:高纯度、低水化率、良好的水悬浮性、适当的活性以及强黏结性。生产硅钢级氧化镁的方法主要有卤水碳铵法和白云石碳化法。表 3和表 4分别列举了硅钢级氧化镁的化学及物理指标[46]。
| 表 3 硅钢级氧化镁的化学指标 Table 3 Chemical indexes of silicon-steel magnesium oxide |
 |
| 点击放大 |
| 表 4 硅钢级氧化镁的物理指标 Table 4 Physical indexes of silicon-steel magnesium oxide |
 |
| 点击放大 |
随着经济的飞速发展,硅钢的产量和质量也一直提出新的要求。硅钢级氧化镁作为重要的硅钢涂层材料,也从最初的一代产品发展到现在的第3代产品甚至发展到了正在研发的第4代产品。目前国内生产取向电工钢大约每年134万t,需求的硅钢级氧化镁在8 000~11 000 t之间,而我国硅钢级氧化镁产能低,产品缺口较大,数控及设备自动化技术落后,这些问题都急需解决。
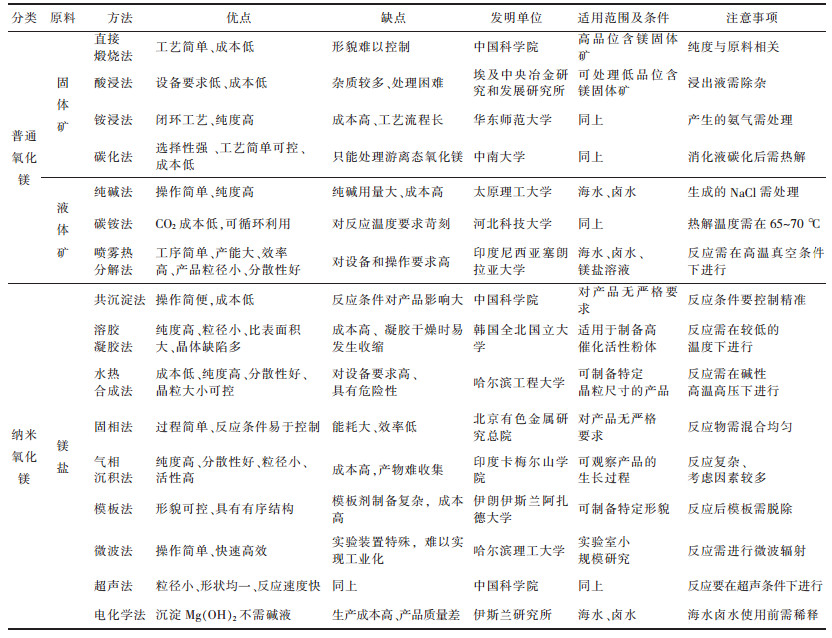
4 结束语与展望我国作为镁资源储量大国,在镁资源开采,镁产品开发等领域有着更为迫切的技术需求。近年来,随着科学技术的飞速发展,国内外对氧化镁的需求量越来越大,对产品质量的要求也越来越高。表 5对制备氧化镁的方法进行了详细的总结概述[18-23, 26-44]。其中酸浸法,直接煅烧法在处理镁矿时的提纯效果并不理想;铵浸法,纯碱法,碳铵法虽然可以生产出纯度较高的氧化镁,但所用原料价格昂贵,经济效益低;喷雾热分解法由于工艺简单,产能大,适合于工业化生产,但所需的反应条件比较苛刻。碳化法由于产品纯度高,原料成本低,工艺简单,有很大的发展前景。
| 表 5 制备氧化镁各种方法汇总 Table 5 Summary of preparation methods of magnesium oxide |
 |
| 点击放大 |
另外,我国在研究纳米氧化镁制备的方向上已经有了十几年的时间,也发明了很多专利,但是能大规模生产的制备方法很少,在已经应用于生产的纳米氧化镁工艺上,还存在着成本高的问题。因此,我国纳米氧化镁的生产仍需大量的研究,将理论实际化,在扩大生产规模的基础上降低生产成本。在特种氧化镁的生产方面,生产出的产品无法适应国际市场,仍需开发或引进新的生产技术,提高产品质量。另外,我国还要注重将产品生产与信息技术相结合,提高生产能力,降低生产成本,使我国精细化的氧化镁产品,走向国际市场,提高国际竞争力。
| [1] |
李俊丽. 盐湖卤水制备硅钢级氧化镁的研究[D]. 长沙: 中南大学, 2008.
|
| [2] |
甘宇, 曹占芳, 王帅. 白云石碳化法制备高纯氧化镁[J].
轻金属, 2019(6): 44–49.
|
| [3] |
WANG R, SI H B, WANG M, et al. Effects of elemental magnesium and magnesium oxide on hydrogen, methane and volatile fatty acids production in in vitro rumen batch cultures[J].
Animal Feed Science and Technology, 2019, 252: 74–82. DOI: 10.1016/j.anifeedsci.2019.04.009. |
| [4] |
SRIVASTAVA A, AHMED R, SHAH S, et al. Effects of magnesium oxide on carbonic acid resistance of oil well cement[J].
Journal of Petroleum Science and Engineering, 2018, 170: 218–230. DOI: 10.1016/j.petrol.2018.06.059. |
| [5] |
JOST H, BRAUN M, CARIUS C, et al. The role of reactivity in syntheses and the properties of magnesium oxide[J].
Solid State Ionics, 1997, 101: 221–228. |
| [6] |
ZHANG W L, DAI Y J, ZHAO H, et al. Influence of Nanocomposites of LDPE Doped with Nano-MgO by different preparing methods on its dielectric properties[J].
Journal of Nanomaterials, 2015: 1–6. |
| [7] |
WANG P, XIAO Y T, ZHOU Z H, et al. Effect of MgO microparticles on characteristics of microarc oxidation coatings fabricated on pure titanium[J].
International Journal of Electrochemical Science, 2019, 14(1): 287–300. |
| [8] |
LIU X T, WANG D D, WU Y K, et al. Investigation on corrosion and wear resistance of MgO-Al2O3 composite coating prepared by plasma electrolytic oxidation[J].
International Journal of Applied Ceramic Technology, 2020, 17(3): 1017–1025. DOI: 10.1111/ijac.13458. |
| [9] |
YAO K, AN D L, WANG W, et al. Effect of nano-MgO on mechanical performance of cement stabilized silty clay[J].
Marine Georesources & Geotechnology, 2020, 38(2): 250–255. |
| [10] |
LI X Y, ZHAO J, HONG X Y, et al. Calcination-dependent surface defect variation and antibacterial activity of magnesium oxide nanoplates[J].
Chemistryselect, 2020, 5(11): 3201–3207. DOI: 10.1002/slct.201904853. |
| [11] |
CHEN Y, DENG C J, WANG X, et al. Evolution of c-ZrN nanopowders in low-carbon MgO-C refractories and their properties[J].
Journal of the European Ceramic Society, 2021, 41(1): 963–977. DOI: 10.1016/j.jeurceramsoc.2020.07.062. |
| [12] |
潘晓鸿, 杨兆元, 李东哲, 等. 纳米氢氧化镁对抗菌类药物的增效作用[J].
基因组学与应用生物学, 2016, 35(12): 3249–3254.
|
| [13] |
王绍娟, 王文俊, 王栋栋, 等. PA6/MgO导热材料的研究[J].
现代塑料加工应用, 2020, 32(5): 21–24.
|
| [14] |
ZHANG J B, QIU M, ZHANG H J, et al. Dielectric properties of MgO/Epoxy nanocomposites in liquid nitrogen environment[J].
IOP Conference Series: Materials Science and Engineering, 2018, 423(1): 1–5. |
| [15] |
EI B M, IBRAHIM S. Differentiation between metronidazole residues disposal by using adsorption and photodegradation processes onto MgO nanoparticles[J].
International Journal of Nanomedicine, 2020, 15: 7117–7141. DOI: 10.2147/IJN.S265739. |
| [16] |
FAN A. Acid-base bifunctional magnesium oxide catalyst prepared from a simple hydrogen peroxide treatment for highly selective synthesis of jasminaldehyde[J].
Energy Sources Part A-Recovery Utilization and Environmental Effects, 2019, 42(20): 2501–2515. |
| [17] |
ZHANG B, TANG M H, YUAN J, et al. Support effect in meerwein-ponndorf-verley reduction of benzaldehyde over supported zirconia catalysts[J].
Chinese Journal of Catalysis, 2012, 33: 914–922. DOI: 10.1016/S1872-2067(11)60370-7. |
| [18] |
LI F J, LI H Q, WANG L G, et al. Magnesium oxide nanosheets as effective catalysts for the synthesis of diethyl carbonate from ethyl carbamate and ethanol[J].
Catalysis Science & Technology, 2015, 5(2): 1021–1034. |
| [19] |
HUANG C H, ZONG J, XU J X, et al. Fabrication of tubular magnesium oxide nanocrystals via combining ammonium sulfate leaching and precipitation method and it's crystal growth behavior[J].
Powder Technology, 2017(320): 80–88. |
| [20] |
曹星辰. 由蛇纹石制备氧化镁晶须及δ-层状结晶二硅酸钠的工艺研究[D]. 合肥: 合肥工业大学, 2013.
|
| [21] |
谢垚, 陈镇, 吴玉龙, 等. 用六水氯化镁制备高纯镁砂工艺[J].
化工进展, 2014, 33(3): 714–719.
|
| [22] |
王犇. 卤水-碳铵法制备特级轻质氧化镁的新工艺技术研究[D]. 郑州: 郑州大学, 2004.
|
| [23] |
PRADITA T, SHIH S J, AJI B B, et al. Synthesis of MgO powder from magnesium nitrate using spray pyrolysis[A]. AIP Conference Proceedings[C]//Yogyakarta IndonesiA, Univ Islam Indonesia, 2017.
|
| [24] |
邬高翔, 田瑞. 二氧化碳捕集技术研究进展[J].
云南化工, 2020, 47(4): 22–23.
|
| [25] |
赵毅, 王永斌, 王添颢. 二氧化碳资源化技术研究进展[J].
再生资源与循环经济, 2020, 13(2): 26–30.
DOI: 10.3969/j.issn.1674-0912.2020.02.010.
|
| [26] |
张小玲. 新型氧化镁材料的制备及吸附性能研究[D]. 西安: 西安石油大学, 2016.
|
| [27] |
CUI H M, WU X F, CHEN Y F, et al. Influence of copper doping on chlorine adsorption and antibacterial behavior of MgO prepared by co-precipitation method[J].
Materials Research Bulletin, 2015, 61: 511–518. DOI: 10.1016/j.materresbull.2014.10.067. |
| [28] |
ASHOK A, KENNEDY L J, VIJAYA J J, et al. Optimization of biodiesel production from waste cooking oil by magnesium oxide nanocatalyst synthesized using coprecipitation method[J].
Clean Technologies and Environmental Policy, 2018, 20(6): 1219–1231. DOI: 10.1007/s10098-018-1547-x. |
| [29] |
WAHAB R, ANSARI S G, DAR M A, et al. Synthesis of magnesium oxide nanoparticles by sol-gel process[A]//Materials Science Forum[C]. Jeju Isl, South Korea, Korean Inst Met & Mat, 2007, 558-559.
|
| [30] |
CUI Z X, LIU J Y, GAO H F, et al. Size and shape dependences of the adsorption kinetics of malachite green on nano-MgO: a theoretical and experimental study[J].
Physical Chemistry Chemical Physics, 2019, 21(25): 13721–13729. DOI: 10.1039/C9CP01279F. |
| [31] |
王焆, 李晨, 徐博. 溶胶-凝胶法的基本原理、发展及应用现状[J].
化学工业与工程, 2009, 26(3): 273–277.
DOI: 10.3969/j.issn.1004-9533.2009.03.020.
|
| [32] |
张永芬. 纳米氧化镁粉体的制备及其烧结特性与催化性能研究[D]. 秦皇岛: 燕山大学, 2014.
|
| [33] |
FENG J, GAO M M, ZHANG Z Q, et al. Fabrication of mesoporous magnesium oxide nanosheets using magnesium powder and their excellent adsorption of Ni (Ⅱ)[J].
Journal of Colloid and Interface Science, 2015, 510: 69–76. |
| [34] |
祝大伟, 尚鸣, 顾万建, 等. 水热法在材料合成中的应用及其发展趋势[J].
硅谷, 2014, 7(17): 126–136.
|
| [35] |
CHEN H K, LUO Z X, CHEN X G, et al. Preparation of nano-MgO by ionic liquid-assisted solid-state reaction[J].
Micro & Nano Letters, 2017, 12(1): 27–29. |
| [36] |
丛文娟, 霍超, 刘化章. 高比表面积纳米MgO的制备及其在催化反应中的应用[J].
工业催化, 2015, 23(6): 419–423.
DOI: 10.3969/j.issn.1008-1143.2015.06.001.
|
| [37] |
PRADEEP N, VENKATACHALAIAH C, VENKATRAMAN U, et al. Magnesium oxide nanocubes deposited on an overhead projector sheet: synthesis and resistivity-based hydrogen sensing capability[J].
Microchim Acta, 2017, 184(9): 3349–3355. DOI: 10.1007/s00604-017-2348-3. |
| [38] |
NAJAFI A. A novel synthesis method of hierarchical mesoporous MgO nanoflakes employing carbon nanoparticles as the hard templates for photocatalytic degradation[J].
Ceramics International, 2017, 43(7): 5813–5818. DOI: 10.1016/j.ceramint.2017.01.135. |
| [39] |
GUO P, HUANG J, ZHAO Y, et al. Nanomaterial preparation by extrusion through nanoporous membranes[J]. Small, 2018, 1703493.
|
| [40] |
慕霞霞, 陈虎魁, 蒋红丽, 等. 模板法制备纳米金属氧化物材料现状及发展趋势[J].
化工新型材料, 2020, 48(11): 39–43.
|
| [41] |
白宗权. 氧化镁的制备及其性能研究[D]. 西安: 西安石油大学, 2018.
|
| [42] |
LI P, LIU C, ZHANG L, et al. Enhanced boron adsorption onto synthesized MgO nanosheets by ultrasonic method[J].
Ultrasonics Sonochemistry, 2017, 34: 938–946. DOI: 10.1016/j.ultsonch.2016.07.029. |
| [43] |
齐晓霞. 纳米氧化镁的制备及其应用[D]. 石河子: 石河子大学, 2019.
|
| [44] |
AMRULLOH H, SIMANJUNTAK W, SITUMEANG R T M, et al. Preparation of nano-magnesium oxide from Indonesia local seawater bittern using the electrochemical method[J].
Inorganic and Nano-metal Chemistry, 2020, 50(8): 693–698. DOI: 10.1080/24701556.2020.1724146. |
| [45] |
宗俊. 近年来国内外特种氧化镁现状及发展趋势[A]. 中国无机盐工业协会镁化合物分会, 2019年全国镁化合物行业年会暨调结构、促融合、增效益、可持续发展论坛论文集[C]//中国无机盐工业协会镁化合物分会: 中国无机盐工业协会钙、镁盐分会, 2019, 7.
|
| [46] |
胡庆福, 孙绥中, 靳星瑞, 等.
镁化合物生产与应用[M]. 北京: 化学工业出版社, 2004: 1-577.
|
 2021, Vol. 12
2021, Vol. 12


