| 2-(2-苯并咪唑基)-6-甲基吡啶-1,1'-联萘-2,2'-双二苯膦铜(I)配合物 |
铜(I)配合物因环境友好、结构多样、性能优越,以及在发光器件、催化合成、生物制药等方面的良好应用前景而被广泛关注[1-12]。铜(I)配合物在激发态时易发生姜-泰勒结构形变,加快其非辐射跃迁速率,从而显著降低其发光效率或直接导致其发光猝灭[13]。为改善铜(I)配合物发光性能,一是可通过增大配体空间位阻或直接在配体邻位上引入基团,来减少其激发态结构发生姜-特勒效应,从而抑制其非辐射失活过程[14-17],二是引入位阻大、刚性好的双膦配体[18-19]。因此,选取在吡啶邻位上含甲基的2-(2-苯并咪唑基)-6-甲基吡啶(Hbmp)和位阻较大、刚性较好的1, 1’-联萘-2, 2’-双二苯膦(BINAP)配体,与[Cu(CH3CN)4](ClO4)进行分子组装来构建铜(I)发光配合物,合成得到一个铜(I)单核配合物[Cu(Hbmp)(BINAP)](ClO4) (1),并对其结构和光物理性质进行了表征。
1 实验部分 1.1 主要试剂和仪器1, 1’-联萘-2, 2’-双二苯膦(分析纯)购于百灵威科技有限公司,2-(2-苯并咪唑基)-6-甲基吡啶和[Cu(CH3CN)4](ClO4)根据文献[20-21]方法合成得到。石油醚(分析纯)、丙酮(分析纯)和二氯甲烷(分析纯)等购于国药集团化学试剂有限公司。
德国布鲁克公司生产的ALPHA傅里叶变换红外光谱仪;德国布鲁克公司生产的D8 QUEST型X-射线单晶衍射分析仪;日本岛津公司生产的UV-2550型电子吸收光谱仪;日本日立公司生产的F-4600型荧光光谱仪。
1.2 配合物[Cu(Hbmp)(BINAP)](ClO4) (1)的制备在氮氛围下,加15 mL二氯甲烷到2-(2-苯并咪唑基)-6-甲基吡啶(21.6 mg, 0.103 mmol)和[Cu(CH3CN)4](ClO4) (33.7 mg, 0.103 mmol)的双口烧瓶里,室温搅拌10 min,变为橙黄色透明溶液,加入1, 1’-联萘-2, 2’-双二苯膦(62.2 mg, 0.1 mmol),继续搅拌1 h,减压抽干得橙黄色固体物,加少许丙酮-二氯甲烷混合溶剂溶解,转置4支试管里,在其溶液上面慢慢添加石油醚,放置扩散3 d,得橙黄色块状晶体(92.7 mg, 0.088 mmol, 88%)。
1.3 晶体结构测定配合物1的单晶衍射数据在德国布鲁克X-射线单晶结构分析仪上室温收集。单晶结构应用SHELXTL软件通过直接法解析,除重原子外,其他非氢原子在差分傅立叶合成中得到,通过全矩阵最小二乘法精修结构。单晶结构数据(CCDC 2019092)已上传至英国剑桥晶体结构数据库,读者可免费索取。配合物1的晶体学数据列于表 1。
| 表 1 配合物1的晶体数据 Table 1 Crystal data of compound 1 |
 |
| 点击放大 |
2 结果与讨论 2.1 配合物的合成与表征
应用1, 1’-联萘-2, 2’-双二苯膦、2-(2-苯并咪唑基)-6-甲基吡啶和[Cu(CH3CN)4](ClO4),按照1:1:1的摩尔比在二氯甲烷中进行反应,合成得到配合物1,其分子结构如图 1所示。运用X-射线单晶衍射、红外光谱、紫外可见吸收光谱和荧光发射光谱对配合物1的结构和光物理性能进行了表征。从图 2可知,配合物1在3 461 cm-1和1 110 cm-1两处各有一个吸收峰,它们分别来源于苯并咪唑的N-H伸缩振动和高氯酸根离子的Cl-O伸缩振动。这清晰表明,配合物1是一个离子型化合物,苯并咪唑环的N-H并未发生去质子化,也就是说,2-(2-苯并咪唑基)-6-甲基吡啶仍是一个中性配体。
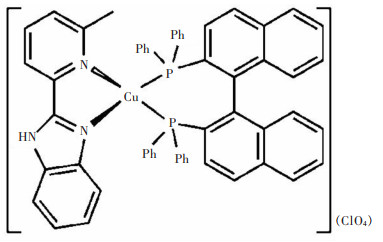 |
| 图 1 配合物1的结构示意 Fig. 1 Molecular structure of compound 1 |
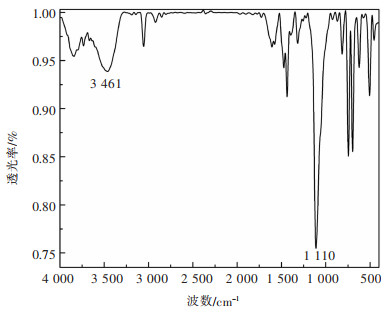 |
| 图 2 配合物1的红外谱 Fig. 2 IR spectrum of compound 1 |
2.2 单晶结构分析
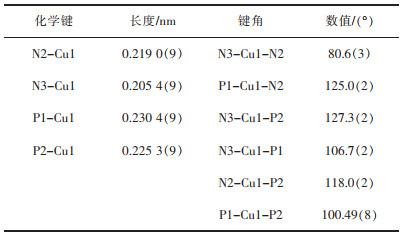
图 3所示为配合物1的单晶结构。表 2所列为重要的键长与键角。图 3中,配合物1的铜(I)离子与2-(2-苯并咪唑基)-6-甲基吡啶(Hbmp)配体的2个氮原子和1, 1’-联萘-2, 2’-双二苯膦(BINAP)配体的2个磷原子相连,构成一个扭曲变形的N2P2四面体构型。两个键角N2-Cu1-N3和P1-Cu1-P2的大小分别为80.6(3)°和100.49(3)°,与文献[22-24]所报道的相应角度值接近,但与正四面体的角度(109°28′)偏差较大。2-(2-苯并咪唑基)-6-甲基吡啶(Hbmp)并未发生N-H去质子化,仍作为一个中性二齿螯合配体与铜(I)离子螯合配位,这与它的红外光谱分析结果相符合。咪唑环上的NH质子与高氯酸根的一个O原子的最短距离为0.208 nm,这表明它们之间存在弱NH…O氢键作用。此外,Cu1-N3键的键长0.205 4(7)nm比Cu1-N2键的键长0.219(9)nm短得多,这表明位于苯并咪唑环上的氮原子相较位于吡啶环上的氮原子,具有更强的与铜(I)离子配位的能力[25]。
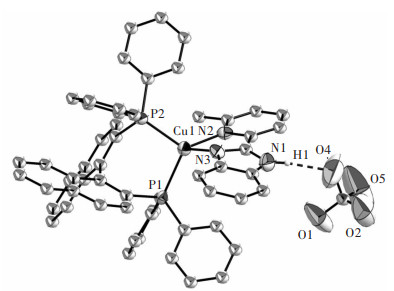 |
| 图 3 配合物1的单晶结构 Fig. 3 Single-crystal structure for compound 1 |
| 表 2 配合物1的重要键长与键角 Table 2 Important bond distances (nm) and bond angles (°) for compound 1 |
 |
| 点击放大 |
2.3 光谱性质
配体Hbmp和配合物1在二氯甲烷中的电子吸收光谱如图 4所示。由图 4可知,配体Hbmp在 < 345 nm区域有强吸收,其来自于配体Hbmp内部的π-π*电子跃迁。配合物1在230~345 nm范围有多个吸收峰,它们归因于Hbmp和BINAP两个配体内的π-π*类型的电子跃迁,比较Hbmp,发生12 nm的红移,这主要由于配体Hbmp与铜(I)离子配位后形成一个共轭性更好的π-体系所造成。在340~450 nm,配合物1存在一个低能量的弱吸收,其主要归属Cu(I)到Hbmp的金属到配体电荷转移(MLCT)跃迁,可能含少量的BINAP到Hbmp的配体间电荷转移(LLCT)跃迁。
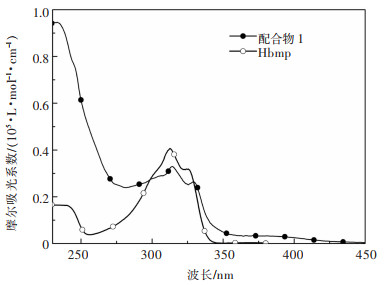 |
| 图 4 Hbmp配体和配合物1的电子吸收光谱 Fig. 4 Electronic absorption spectra of Hbmp chelate and compound 1 |
配合物1的常温荧光发射光谱如图 5所示。
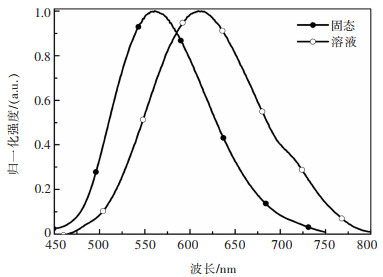 |
| 图 5 配合物1在液态和固态的荧光发射光谱 Fig. 5 Emission spectra of compound 1 in solution and solid states |
由图 5可知,常温下,在波长为365 nm的激发光作用下,配合物1在固态时有一个橙黄光发射,其最大发射波长为561 nm,而在除氧的二氯甲烷溶液中有一个最大发射波长为611 nm的橙红光发射,相较其固态时荧光发射,它红移了47 nm,这主要是由于外围环境刚性的显著下降所致。
3 结论应用1, 1’-联萘-2, 2’-双二苯膦(BINAP)配体和2-(2-苯并咪唑基)-6-甲基吡啶(Hbmp)配体,合成得到一个铜(I)单核配合物[Cu(Hbmp)(BINAP](ClO4)(1)。配合物1的铜(I)离子采用四配位的配位模式,分别与中性二齿螯合配体BIANP的2个P和Hbmp的2个N相连接,产生一个以一价铜离子为中心的P2N2型的变形四面体。配合物1在二氯甲烷溶液中和固态时均具有很好的光致发光性质,其最大发射波长分别为611 nm和561 nm。
| [1] |
TROSE M, LAZREG F, CHANG T, et al. Neutral dinuclear copper(I)-NHC complexes: synthesis and application in the hydrosilylation of ketones[J].
ACS Catalysis, 2017, 7: 238–242. DOI: 10.1021/acscatal.6b02723. |
| [2] |
PERRUCHAS S, GOFF X, MARO S, et al. Mechanochromic and thermochromic luminescence of a copper iodide cluster[J].
Journal of the American Chemical Society, 2010, 132: 10967–10969. DOI: 10.1021/ja103431d. |
| [3] |
CHEN X L, YUAN L H, HE L H, et al. A sublimable dinuclear cuprous complex showing selective luminescence vapochromism in the crystalline state[J].
Inorganic Chemistry, 2019, 58: 14478–14489. DOI: 10.1021/acs.inorgchem.9b01972. |
| [4] |
尹少云, 张露尹, 王政, 等. "眼镜"状碘化亚铜配合物的调光和双光子发光性质[J].
高等学校化学学报, 2020, 41(4): 646–651.
|
| [5] |
朱晗, 寇军锋, 刘丰祎, 等. 一个三维三唑类铜配位聚合物的合成及催化亚甲基蓝降解性能和机理研究[J].
广东化工, 2020, 47(2): 12–13.
|
| [6] |
柴轲, 高月泽, 张静. 新型环硫脲亚铜配合物的结构及固体发光性质[J].
中国科学院大学学报, 2019, 36(5): 620–625.
|
| [7] |
PELLEI M, GANDIN V, MARINELLI M, et al. Novel triazolium based 11th group NHCs: synthesis, characterization and cellular response mechanisms[J].
Dalton Transactions, 2015, 44: 21041–21052. DOI: 10.1039/C5DT02934A. |
| [8] |
SCHINABECK A, LEITL J M, YERSIN H, et al. Dinuclear Cu(I) complex with combined bright TADF and phosphorescence. Zero-field splitting and spin-lattice relaxation effects of the triplet state[J].
Journal of Physical Chemistry Letters, 2018, 9: 2848–2856. DOI: 10.1021/acs.jpclett.8b00957. |
| [9] |
CHEN J L, GUO Z H, LUO Y S, et al. Luminescent mononuclear Cu(I) triphenylphosphine complexes based on methylated 5-trifluoromethyl-3-(2′-pyridyl)-1, 2, 4-triazole ligands[J].
New Journal of Chemistry, 2016, 40: 5325–5332. DOI: 10.1039/C5NJ03529E. |
| [10] |
CHEN J L, GUO Z H, YU H G, et al. Luminescent dinuclear copper(I) complexes bearing 1, 4-bis(diphenyl phosphine)butane and functionalized 3-(2′-pyridyl)pyrazole mixed ligands[J].
Dalton Transactions, 2016, 45: 696–750. DOI: 10.1039/C5DT03451E. |
| [11] |
何丽华, 陈景林, 曹兴付, 等. 2-(2-苯并咪唑基)-6-甲基吡啶铜(I)溴化物的合成与发光[J].
有色金属科学与工程, 2012, 3(3): 6–9.
|
| [12] |
陈景林, 宋鹏, 温和瑞, 等. 双核铜(I)配合物的合成及其固态发光性质的研究[J].
有色金属科学与工程, 2010, 1(1): 27–29.
|
| [13] |
LUO Y S, CHEN J L, ZENG X H, et al. A highly stable and luminescent mononuclear Cu(I) bis{5-tert-butyl-3-(6-methyl-2-pyridyl)-1H-1, 2, 4-triazole} complex[J].
Chinese Chemical Letters, 2017, 28: 1027–1030. DOI: 10.1016/j.cclet.2016.12.015. |
| [14] |
KELLER S, PRESCIMONE A, CONSTABLE C E, et al. Copper(I) and silver(I) complexes of 9, 9-dimethyl4, 5-bis(di-tert-butylphosphino)xanthene: photophysical properties and structural rigidity under pressure[J].
Photochemical & Photobiological Sciences, 2018, 17: 375–385. |
| [15] |
LIN Y, CHEN D H, YU R, et al. Photo- and electro-luminescence of three TADF binuclear Cu(I) complexes with functional tetraimine ligands[J].
Journal of Materials Chemistry C, 2017, 5: 4495–4504. DOI: 10.1039/C7TC00443E. |
| [16] |
HAMZE R, PELTIER L J, SYLVINSON D, et al. Eliminating nonradiative decay in Cu(I) emitters: > 99% quantum efficiency and microsecond lifetime[J].
Science, 2019, 363: 601–606. DOI: 10.1126/science.aav2865. |
| [17] |
ZINK D M, VOLZ D, BAUMANN T, et al. Heteroleptic dinuclear copper(I) complexes for application in organic light-emitting diodes[J].
Chemistry of Materials, 2013, 25: 4471–4486. DOI: 10.1021/cm4018375. |
| [18] |
ANDRES-TOME I, FYSON J, DIAS F B, et al. Copper(I) complexes with bipyridyl and phosphine ligands: a systematic study[J].
Dalton Transactions, 2012, 41: 8669–8674. DOI: 10.1039/c2dt30698k. |
| [19] |
FEMONI C, MUZZIOLI S, PALAZZI A, et al. New tetrazole-based Cu(I) homo- and heteroleptic complexes with various P.P ligands: synthesis, characterization, redox and photophysical properties[J].
Dalton Transactions, 2013, 42: 997–1010. DOI: 10.1039/C2DT32056H. |
| [20] |
SUN W H, HAO P, ZHANG S, et al. Iron(II) and cobalt(II) 2-(benzimidazolyl)-6-(1-(arylimino)ethyl) pyridyl complexes as catalysts for ethylene oligomerization and polymerization[J].
Organometallics, 2007, 26: 2720–2734. DOI: 10.1021/om0700819. |
| [21] |
KUBAS G J, MONZYK B, CRUMBLISS A L, et al. Tetrakis(acetonitrile)copper(I) hexafluorophosphate[J].
Inorganic Syntheses, 1979, 19: 90–92. |
| [22] |
曾雪花, 罗燕生, 陈景林, 等. 2-(2-苯并咪唑基)-6-甲基吡啶铜(I)铁(II)异双核配合物的合成与表征[J].
有色金属科学与工程, 2017, 8(1): 94–98.
|
| [23] |
DI B S, CHEN J L, LUO Y S, et al. Synthesis, structures and photophysical properties of copper(I) 2-(2-benzimidazolyl)-6-methylpyridine complexes with different diphosphine ligands[J].
Polyhedron, 2016, 119: 525–531. DOI: 10.1016/j.poly.2016.09.033. |
| [24] |
CHEN J L, CAO X F, GU W, et al. Phosphorescent copper(I) complexes bearing 2-(2-benzimidazolyl)- 6-methylpyridine and phosphine mixed ligands[J].
Inorganic Chemistry Communications, 2011, 14: 1894–1897. DOI: 10.1016/j.inoche.2011.09.005. |
| [25] |
HE L H, CHEN J L, WANG J Y, et al. Structures and luminescence properties of two copper(I) halide complexes featuring 2-(2-benzimidazolyl)-6-methylpyridine[J].
Chinese Chemical Letters, 2012, 23: 1169–1172. DOI: 10.1016/j.cclet.2012.07.014. |
 2020, Vol. 11
2020, Vol. 11


