| 稀土铈在电催化水分解中的应用研究进展 |
2. 曲阜师范大学物理工程学院,山东 曲阜 273165
2. School of Physics and Physical Engineering, Qufu Normal University, Qufu 273165, Shandong, China
日益严峻的能源与环境危机迫使人们亟需寻找可持续发展的绿色能源,以此维持社会的高速运行和人类发展。H2作为一种燃烧产物是水的高热值能量载体,其绿色高效的生产方式得到了研究人员的广泛关注与社会的普遍认可。目前氢能的生产方式包括传统工业产氢(甲烷蒸汽重整、煤的气化)与电解水制氢技术[1],传统工业产氢的原材料是化石能源的衍生产品,受到化石能源枯竭的影响并严重污染环境。电解水制氢是直流电驱动水中的氢离子与氢氧根发生氧化还原反应生成氢气与氧气,其过程碳排放为零,是重要的绿色制氢途径。实际生产过程中,研究人员发现水分解的最低电解槽电压(能够析出氢气的最低电压为1.8~2.0 V)比计算得到的水分解理论电压(1.23 V)高570~770 mV[2-3]。电解槽的实际电压η由理论电压、阴极电压、阳极电压以及溶液电阻等其他电压(η其他)组成,如式(1)[4]所示:
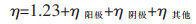
|
(1) |
式(1)中的阴极电压和阳极电压分别是阴极发生析氢反应(HER,Hydrogen evolution reaction)与阳极发生析氧反应(OER, Oxygen evolution reaction)的过电位,过电位是HER和OER反应需要的活化能[5-7]。直接驱动水分解析出氢气和氧气的过电位较高,如果可以降低阴极和阳极的过电位,使实际析出氢气与氧气的最低电压接近1.23 V,将极大地降低电解水制氢的能耗。
在阴极与阳极表面附着高性能催化剂可以有效降低HER和OER的过电位,加快反应动力学速率,降低电能消耗,提升其析氢与析氧效率。目前,商用性能最好的HER催化剂是Pt和Pd等铂族贵金属[8],Ir、Ru及其氧化物IrO2、RuO2是最好的OER催化剂[9-10]。虽然贵金属极大地降低了反应的过电位,但其在地壳中储量极少,价格昂贵,限制了贵金属在电解水制氢技术中的大规模应用[11-12]。随后,研究人员发现地壳中储量丰富的过渡族金属和非金属催化材料在经过掺杂以后,获得了接近于贵金属的较低过电位[13]。目前,提升电催化材料的水分解效率主要包含两大策略[14],如图 1所示,一是提升活性位点的固有催化活性,例如通过掺杂改变催化剂的晶体结构,使其原有活性增强;二是增加活性位点的数量,通过增加负载量或改善催化剂表面结构,增大催化材料的比表面积,获得更多的活性位点,进而提升材料的催化活性。以过渡族金属电催化水分解为例,研究人员制备了大量的Ni-Co基[15]、Ni-Fe基[16]和Co-Mn基[17]催化材料,相较于金属Ni、Fe、Co等作为阴极和阳极材料,其过电位显著降低,双金属间的相互协同作用使其比单金属往往表现出更好的催化性能。掺杂会产生晶格畸变和缺陷,可以改善催化活性物质的固有活性和晶体结构;掺杂元素与基体材料耦合产生协同作用可以改善催化剂的界面性质,获得更多的活性位点,进一步提升电催化效率。
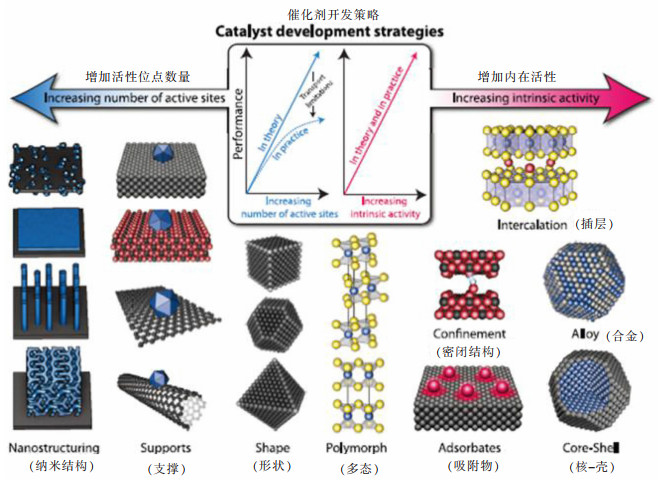 |
| 图 1 各种催化剂开发策略示意(增加活性位点的数量和增加每个活性位点的固有活性[14]) Fig. 1 Schematic diagram of various catalyst development strategies, increasing the number of active sites and increasing the inherent activity of each active site[14] |
诸多掺杂元素中,稀土元素具有特殊的4f轨道外电子层结构,当其作为络合物的中心原子时,其剩余的多个电子轨道可与其他物质形成新的化学键,这种特性使得稀土元素在很多领域拥有极其广泛的运用,被称为“工业维生素”。Ce是常见的轻稀土材料,主要运用于催化材料领域,常见价态为+3和+4,它可以在Ce3+和Ce4+之间进行可逆转变(Ce4+↔Ce3+);其次,Ce及其氧化物具有出色的氧化还原能力,它的结构中含有许多氧空位,当2个Ce4+→Ce3+时,会释放一个氧空位(图 2),有利于提高材料的氧迁移率[18]。掺杂的Ce与其他组分耦合时,会产生较强的协同作用,表现出远超预期的催化效果。此外,在电化学测试过程中,引入Ce或Ce的氧化物后,过渡金属电催化材料的稳定性和耐腐蚀能力也得到了较好的提升。因此,将Ce与非贵金属催化材料进行耦合,开发廉价高效的稀土基电催化材料引起了研究人员的关注[19]。
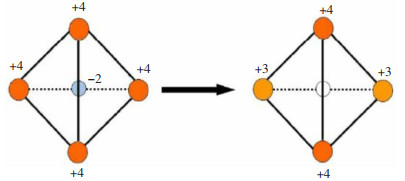 |
| 图 2 Ce元素价态变化及氧空位的形成过程[18] Fig. 2 The change of valence state of Ce element and the formation process of oxygen vacancy[18] |
本文旨在综述Ce元素在HER和OER催化材料上应用的研究进展,介绍Ce在非贵金属催化材料中的结构设计和调控对其析氢及析氧性能的影响,并总结Ce在电催化水分解领域应用的技术瓶颈及未来的发展趋势。为Ce及其他稀土元素在未来催化材料设计过程中,在引入方式、存在形式及稀土元素与其他元素的相互作用等方面提供更多思路。
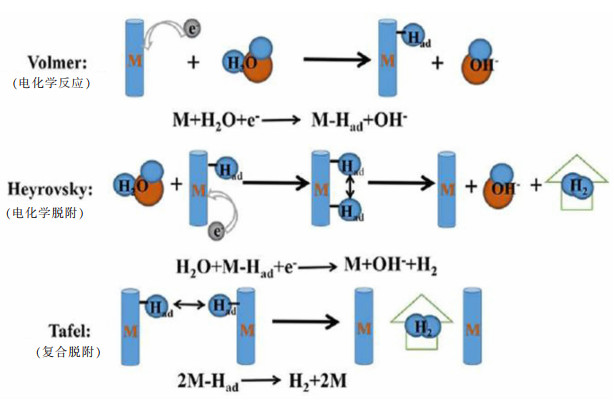
1 稀土Ce元素在HER阴极催化材料中的研究进展在HER反应中,中间体M-Had在催化材料表面吸附和脱附的平衡决定了反应动力学的快慢。碱性条件下的HER反应包括Volmer、Heyrovsky、Tafel 3种基本反应,如图 3所示,体现了电化学反应中吸附态氢原子(M-Had)形成和脱附步骤转换生成H2的过程,电极上存在2种最基本的反应历程:Volmer-Heyrovsky(电化学-电化学脱附)机理和Volmer-Tafel(电化学-复合脱附)机理[20]。高效的电解水HER阴极催化材料可以提供更多的活性位点吸附中间体,并降低中间体的脱附能,加快电化学反应的进行。
1.1 稀土Ce颗粒修饰纳米结构HER阴极催化材料
在过渡金属催化材料的研究中,Ni、Co、Fe、Mo、Cu等研究最多,但是纯过渡金属催化材料的导电性差、表面暴露的活性位点数量少,限制了它的HER活性[21]。通常,利用多孔的导电基底(如泡沫镍、泡沫铜、碳布)生长活性材料,获得中空、多孔、多层的纳米结构,这样的结构具有更大的活性比表面积、更高的导电性及更多的活性位点,提高了催化材料的HER活性[22]。在此基础上,引入具有催化能力的Ce元素,利用Ce的特殊性质,相比于单种催化材料,其活性将进一步提高。WANG等利用一步水热法在泡沫镍基底(NF)上原位生长CeO2-CuO/NF阵列,经过磷化获得了三维多孔结构的CeO2-Cu3P /NF阵列[23]。在1 mol/L浓度的KOH中进行电化学测试,电流密度为20 mA/cm2时,CeO2-Cu3P/NF所需的过电位仅需148 mV,比Cu3P/NF的过电位(245 mV)小97 mV;密度泛函理论计算表明,耦合生成的CeO2-Cu3P间没有带隙,电导率提高,其热力学氢吸附自由能也明显减小,CeO2-Cu3P界面结构有利于水分解,且其HER活性超过了普通非贵金属[24]。
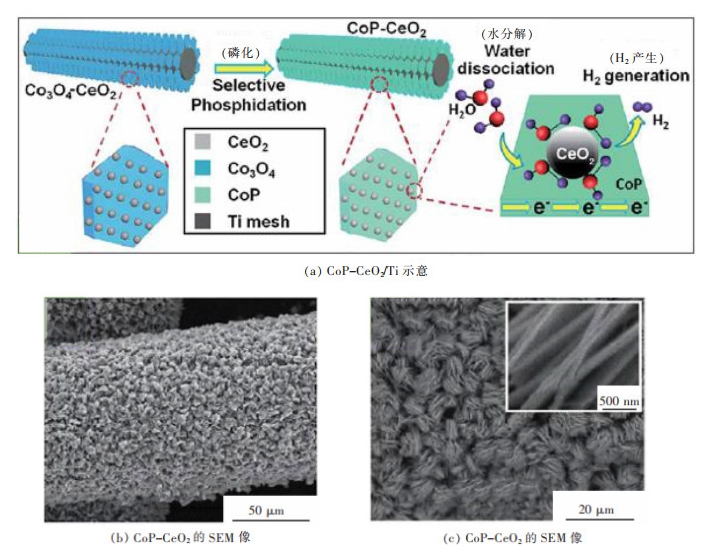
此外,CeO2可有效提升催化材料在碱性电解液中的HER性能。ZHANG等通过建立有效的磷化钴/氧化物界面提高了碱性条件下CoP催化材料的析氢性能,在Ti板上通过一步水热制得的Co3O4-CeO2/Ti纳米阵列,经过选择性磷化后开发出一种新型的CoP-CeO2/Ti纳米结构催化材料,如图 4(a)所示[25]。低温磷化仅将Co3O4转化为CoP,而周围的CeO2不变,利用扫描电镜,可以获得图 4(b)、图 4(c)所示的SEM图像,直观的观察到整个Ti网格的表面都被纳米片覆盖,磷化后的CoP-CeO2纳米片结构密集分布,暴露出更大的活性比表面积。在1 mol/L KOH中,单纯的CeO2/Ti几乎没有活性,电流密度为10 mA/cm2时,CoP-CeO2/Ti的过电位为43 mV,比CoP/Ti的过电位(70 mV)低27 mV。密度泛函理论计算发现与CoP相比,CoP-CeO2界面的水分解能垒降低至1.06 eV,使得CoP-CeO2具有较低的水分解自由能和较优的氢吸附自由能。在反应发生过程中,CeO2充当水分解的促进剂,促进被吸附在CoP-CeO2表面上的H2O分子分解成活性H*,提高CoP表面的H*形成率和M-Had中间体的脱附。CeO2纳米颗粒与过渡金属氧化物纳米阵列耦合,二者的特殊界面增强了CoP和CeO2之间的电子相互作用,使CoP-CeO2之间表现出协同作用,有效提升了过渡金属催化材料的HER性能。
1.2 稀土Ce颗粒作为HER阴极催化材料骨架的研究进展
CeO2除了以纳米颗粒的形式修饰在纳米阵列上,还能作为支撑结构耦合更小的金属纳米颗粒形成金属/氧化物结构,金属/氧化物界面结构可以用于清洁能量的储存和转化,在催化过程中有着重要作用[26]。GAO等利用化学沉积和还原法成功制备了Pd/CeO2/C杂化结构电催化材料,在1 mol/L KOH电解质中,电流密度为10 mA/cm2时,Pd/CeO2/C的HER过电位为109 mV,Tafel斜率为75mV/(°),比Pd/C(Tafel斜率142 mV/(°))和物理混合物Pd/C-CeO2/C(Tafel斜率为115mV/(°))都要低[27]。实验表明其析氢性能的增强不是Pd与CeO2的简单物理混合,Pd与CeO2纳米颗粒之间紧密接触,产生了较强的金属相互作用,CeO2的存在可以作为Pd颗粒的附着位点,增强Pd颗粒的稳定性,Pd到CeO2的电子转移导致表面的Pd被部分氧化为Pd氧化物,并在Pd/CeO2/C中形成了合理的Pd-O-Ce结构。这种独特的结构提供了一种新的催化活性位点,使HER性能得到了提升。
WENG等设计了一种以CeO2纳米颗粒作为骨架,将金属Ni掺杂到生长在碳纳米管(CNT)上的CeO2颗粒上[28]。该催化剂的活性物质是Ni/CeO2,在电流密度为10 mA/cm2时,Ni/CeO2-CNT催化剂的过电位为80 mV,比纯Ni/CNT的过电位(183 mV)小103 mV。Ni/CeO2-CNT中的Ni原子尺寸远小于Ni-CNT材料的尺寸,CeO2颗粒上吸附的Ni颗粒数量明显增加,并可以通过界面促进水分解,改变氢结合能。Ni/CeO2间良好的电子/离子导电性和CNT的大比表面积,使其具有优异的析氢活性。
特殊的金属/氧化物结构促进了中间体与催化剂的结合,金属与氧化物之间紧密结合,提升了催化材料的电子传输能力,二者之间的相互作用产生协同效应,对于HER性能的提升有明显作用。这样的设计思路可用于合成各种金属/氧化物界面纳米结构,探索液相电催化中的金属/氧化物作用机理,获得更高性能的电催化材料。
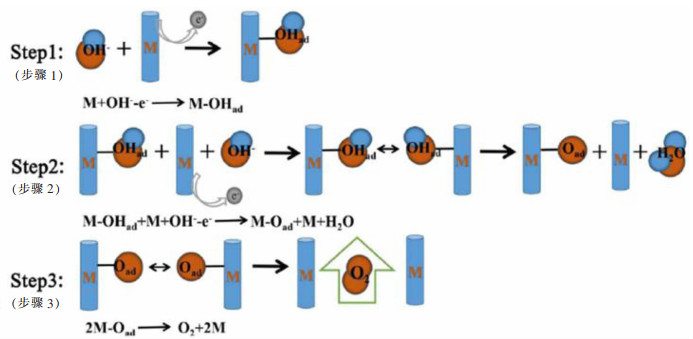
2 稀土Ce元素在OER阳极催化材料中的研究进展OER反应是水分解的阳极反应,阳极析出氧气是四电子反应过程,中间态粒子多,过程复杂[29-31],目前大家普遍认同的碱性条件下OER机理流程如图 5所示。OER过程的电子转移步骤多,降低了OER反应效率,且步骤越多动力学越缓慢,反应所需的过电位也越高。良好的OER催化剂与反应中间体有适中的结合强度,保证中间体M-OHad和M-Oad的顺利形成与转化[32]。Ce的氧化物中具有很多氧缺陷,2个Ce4+变成Ce3+时,也会释放1个氧空位,且其本身拥有良好的储氧性能。因此,引入稀土元素开发高活性的析氧催化材料降低OER反应的过电位得到了研究人员的广泛关注。
2.1 稀土Ce元素在氢氧化物型OER催化剂中的研究进展
金属氢氧化物是比较常见的类水滑石结构(LDHs)电催化材料,特别是在过渡族金属中,根据包含金属元素的种类可分为单金属氢氧化物、双金属氢氧化物和多金属氢氧化物。水滑石结构是一种层状结构,水滑石中金属原子的粒径大小和分布会影响其结构[33]。
单金属氢氧化物组成简单,制备便捷,简单的结构组成有利于研究其结构和性质的关系。FENG等以ZnO纳米棒为牺牲模板,把CeO2和FeOOH层依次电沉积到ZnO纳米阵列上,并在1 mol/L NaOH溶液中移除ZnO纳米棒模板,在泡沫Ni上获得了一种FeOOH/CeO2纳米管复合材料[34]。该催化剂在碱性条件下有很好的活性和稳定性,在300 mV过电位时电流密度达到80.2 mA/cm2,能够在400 mV的过电位下连续工作50 h,保持催化性能不变。引入CeO2后的FeOOH/CeO2的活性比表面积为161.2 m2/g,比FeOOH的比表面积(104.3 m2/g)大56.9 m2/g,获得了更大的活性比表面积。该催化材料OER性能的提升得益于CeO2和FeOOH之间的紧密接触,促进了两者电子相互交换。LIU等在N、O、S掺杂的泡沫碳(NOSCF)基底上原位生长Ni(OH)2纳米片,然后将CeO2纳米颗粒装载到Ni(OH)2纳米片上,获得了一种三维CeO2/Ni(OH)2/NOSCF析氧催化材料,其两步合成法示意图如图 6(a)所示[35]。在碱性条件下,CeO2/Ni(OH)2/NOSCF的过电位为240 mV,引入CeO2后,过电位下降了30 mV,塔菲斜率(57 mV/(°))下降了8 mV/(°)。通过紫外可见吸收光谱分析(图 6(b)),CeO2引入后其谱线在385 nm处的吸收峰相比于Ni(OH)2叠加了一个CeO2的强度,表明CeO2和Ni(OH)2之间有很强的电子相互促进作用。利用XPS分析表明(图 6(c)),Ce3d3/2,Ce3d5/2峰的出现表示Ce3+和Ce4+同时存在,在CeO2/Ni(OH)2/NOSCF和纯CeO2/NOSCF中,二种峰的位置发生偏移,表明沉积在Ni(OH)2上的CeO2中Ce3+:Ce4+的比率相比纯CeO2发生变化,价态分布发生重排。CeO2与金属氢氧化物结合可以调节Ce3+与Ce4+的含量,加快其与Ni(OH)2纳米片之间的电荷转移,二者之间协同促进,加速NiⅡ氧化成NiⅢ/Ⅳ的转变过程,电子传输能力大幅增强,OER活性显著提升。
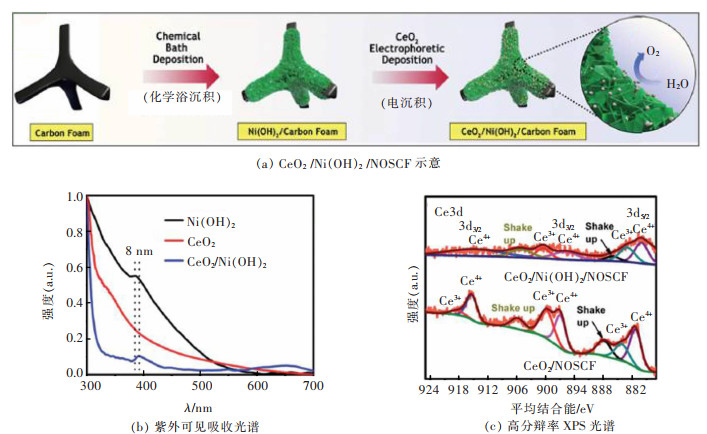 |
| 图 6 CeO2 /Ni(OH)2 /NOSCF合成示意图、紫外可见吸收光谱和XPS图[35] Fig. 6 Design process、UV-vis absorption spectra and XPS spectra of CeO2 /Ni(OH)2 /NOSCF[35] |
双金属氢氧化物中两种金属间的相互协同作用可以获得更好的电催化性能,常见的有NiCo-LDH、NiFe-LDH。XU等运用一种简便、低成本的原位自组装策略,合成了一种碳纳米管(CNT)包裹的Ce掺杂NiFe-LDH超薄纳米片作为高效OER催化剂[36]。在Ce掺杂浓度为5%时,碱性电解质下,电流密度为10 mA/cm2时,NiFeCe-LDH/CNT纳米复合材料的过电位(227 mV)和Tafel斜率(33 mV/(°)),低于商用的Ir/C电催化剂过电位280 mV,Tafel斜率(51mV/(°)),并且优于已报道的大多数非贵金属基OER电催化材料,OER电催化活性明显提升。NiFe-LDH本身具有很高的固有催化活性,加上Ce丰富的氧化还原特性和Ce3+的多配位数,形成了Ni-Fe-Ce强耦合的界面,提升了其OER性能。WANG等以氧化石墨烯为前体,在Ce-N-C材料上原位生长CeO2,并和剥离的NiFe-LDH复合得到了杂化的NiFe-LDH/CeO2@CeNC材料[37]。在碱性电解质中,电流密度为10 mA/cm2时,NiFe-LDH和CeO2@CeNC的质量比为2时,复合得到的NiFe-LDH/CeO2@CeNC材料过电位为235 mV,优于NiFe-LDH催化剂(491 mV)和商业的20%Ir/C(280 mV)基准材料,表现出超高的OER活性。测试表明CeO2@CeNC本身几乎没有电催化活性,但将CeO2@CeNC引入催化剂材料后,后者过电势变低,表明CeO2@CeNC可以作为助催化剂显著提升LDH体系对OER的电催化作用。
综上所述,虽然Ce的氧化物本身电催化性能很差,但是将其引入到金属氢氧化物电催化材料中,可以使本来OER活性较好的LDHs材料的催化活性进一步提高。CeO2可以作为异质结构调控活性物质的电子结构,促进电荷转移,并且含有大量易于迁移的氧空位,利于中间体的形成与转变;与金属氢氧化物耦合形成的特殊结构,有效的降低了反应中间体的吸附能,提升了OER活性。
2.2 稀土Ce元素构造金属有机框架结构(MOF)析氧催化材料金属有机框架化合物(MOFs)具有大比表面积、结构灵活、尺寸可控和表面可修饰性等特点,广泛用于能量转换、储存、气体吸附等研究领域[38]。将其作为结构前驱体或模板,经过化学处理、与金属氧化物等进行复合,可以获得纳米棒、核壳结构和3D多孔结构[39-40]。XU等利用ZIF材料合成了CeOx修饰的MOF结构CoS杂化纳米材料[41]。ZIF也叫沸石咪唑盐骨架,如ZIF-67,是合成金属有机框架结构(MOF)的常用原料,具有大比表面积和高效的传质性等特点,因此常被用作构建多孔或中空结构材料的有效前体或模板[42]。独特的中空结构具有巨大的空腔和多孔薄壁,使电解质和离子容易进入,暴露出更多的电化学活性位点,降低了电子的迁移阻力。在碱性电解质中,电流密度为10 mA/cm2时,Ce掺杂量为14.6%的CeOx/CoS过电位仅为269 mV,比CoS的过电位(347 mV)小78 mV,电化学性能的提升主要源于CeOx/CoS在ZIF-67衍生的空心CoS表面原位生成,适当控制CoS表面上CeOx的量可以实现Co2+/Co3+比的精确调节,诱发更多的氧缺陷,同时,CeOx薄层的存在保护了钴离子不从活性表面向溶液中溶解,有效地抑制了腐蚀,提高了OER稳定性。此外,XU还将长的CeO2纳米棒(L-CeO2NRs)制造成束的MOF衍生CeOx/CoS材料,设计了一种类似中国糖葫芦形状的多功能MOF结构衍生CeOx/CoS@L-CeO2NRs杂化材料[43]。它将晶格应变和高能界面同时汇集到独特的核壳纳米结构中,相邻的CeOx/CoS单元之间的互连引起晶格应变的产生,出现大量晶格畸变、晶格缺陷以及高能界面,这些界面由于异质结构的存在变得活跃,相邻的CeOx/CoS多面体之间的每个接触面产生了更多的活性位点。如图 7(a)、图 7(b)所示,在碱性电解质中,电流密度为10 mA/cm2时,CeOx/CoS@L-CeO2NRs的过电位为238 mV,优于CeOx/CoS催化剂(269 mV)和商业的20%Ir/C(280 mV)基准材料,表现出超高的电催化活性,这样的结构在改善电化学活性方面非常有效。
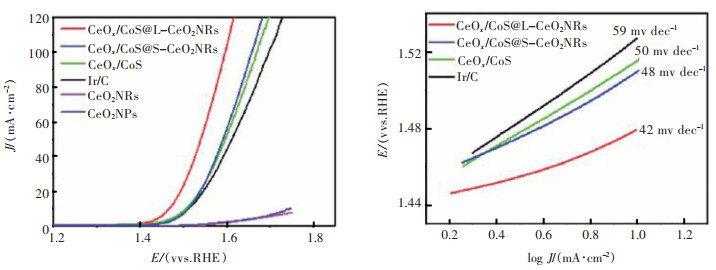 |
| 图 7 CeOx/CoS@L-CeO2NRs等的LSV曲线和Tafel斜率[43] Fig. 7 LSV curves and Tafel plots of CeOx/CoS@L-CeO2NRs et.al[43] |
王柄凯等利用MOF材料的结构特点,合成了一种以CeO2为核,ZIF-67材料衍生的NiCo-LDH为外壳层的新型CeO2@NC/LDH异质结构用于OER反应。1 mol/L KOH溶液中进行电化学测试,电流密度为10 mA/cm2时,该催化剂的过电位为271 mV,性能远超过同等条件下的NC/LDH(331 mV)、ZIF-67(390 mV)和商用20%Ir/C催化剂(280 mV)[44]。催化性能的提升主要来源于独特的核壳结构与CeO2和LDH的协同作用,该催化剂核壳结构内部的ZIF-67衍生材料具有丰富孔结构,使其有较大的比表面积,提供了更多的反应活性位点。其次,刚性的核壳骨架使NC/LDH保持剥离状态,有限阻止了纳米片层团聚,最大程度的暴露活性位点。封装的CeO2内核可以优化NC/LDHs电子结构,增加材料中的氧缺陷数量,大大提升了催化反应的活性和动力学反应速率。
MOFs结构衍生的材料有大的比表面积、丰富的孔结构,可以提供更多的活性位点。其次,CeOx纳米颗粒可以改变材料的表面电子学性质,增加缺陷数量,提升OER反应动力学。CeOx薄层、糖葫芦状结构、核壳结构等骨架可以阻止纳米片团聚,获得多维稳定结构,提升催化材料的工作稳定性。
2.3 稀土Ce构筑其他结构OER电催化材料的研究进展CeOx不仅可以修饰在水滑石结构中,在本身拥有极佳OER性能的过渡金属硫化物、磷化物等催化材料中也有极其广泛的运用。WU等运用水热法设计合成了一种在柔性支撑碳布(CC)上生长的CeOx纳米颗粒修饰NiCo2S4空心纳米管阵列,如图 8(a)所示[45]。在碱性电解质下,电流密度为10 mA/cm2时,过电位为270 mV,超过文献中对比的NiCo2S4材料(300 mV),表现出超高的OER活性。CeOx纳米颗粒的引入,可以从图 8(b)~图 8(d)明显看出,光滑的NiCo2S4纳米线外表面修饰有颗粒状的CeOx,改变了NiCo2S4材料的表面形貌,并保持了原本的稳定纳米结构,从而提升了NiCo2S4的OER性能。新构建的电催化材料成本低廉,拥有有效的分级结构,有利于反应底物在催化剂表面的快速吸附,降低反应中间体的活化能,提高催化活性。这种包含稀土的中空纳米阵列为合理设计和制备高活性电催化材料提供了一种新的策略,该催化剂不仅适用于过渡金属硫化物,而且适用于其他电催化剂,从而广泛用于OER反应。ZHENG等用多元醇还原法在CoSe2/DETA纳米结构表面复合CeO2纳米颗粒,开发了一种新的CeO2/CoSe2催化剂[46]。在碱性溶液中进行电化学测试,电流密度为10 mA/cm2时,过电位为288 mV,Tafel斜率为44 mV/(°),过电位远低于RuO2和Ir/C等贵金属催化剂,并且拥有很好的电化学稳定性。该催化剂中,CeO2纳米颗粒带来了大量的高迁移率氧空位,有利于反应物在催化剂表面快速吸附,另一方面CeO2和CoSe2在界面紧密结合产生了良好的化学协同作用,提升了OER性能。
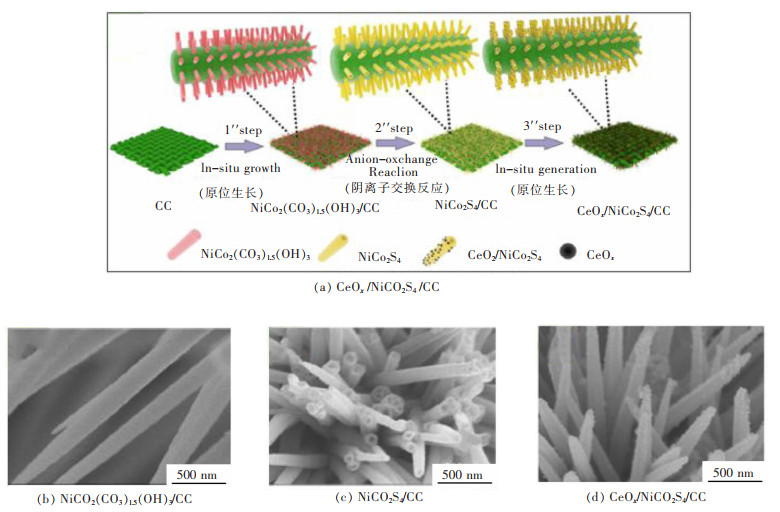 |
| 图 8 CeOx/NiCo2S4/CC的合成示意图及SEM照片[45] Fig. 8 schematic illustration of the formation process and SEM images of CeOx/NiCo2S4/CC[45] |
为了更加快速、低能耗的制备电催化材料,研究人员还利用电沉积的方法进行制备,电沉积相较于水热法,设备简单,反应时间短,能耗低。TAKANABE等在研究NiFeOx催化活性时,通过阳极电沉积在NiFeOx表面获得了一层CeOx薄层,使其OER稳定性得到提升[47]。KIM等在研究Co基材料时首先在Ti片上沉积得到高密度的CoOx片层结构,随后在其表面阳极电沉积CeOx,运用两次电沉积获得CeOx/CoOx电催化材料,CeOx/CoOx的过电位为313 mV,比CoOx过电位(331 mV)低18 mV[48]。密度泛函理论计算表明Ce的加入改变了Co表面的电子结构,降低了活性中间体的活化能,在电化学反应过程中CoOx容易转变为活性物质CoOOH,OER性能得到提高。电沉积得到CeOx薄层还可以有效阻止电极上Fe、Co等具有催化活性的过渡金属成分溶解进入电解液中,可以像渗透膜一样有选择的促进氧化还原反应离子的扩散而不影响OH-的进入和O2的析出。
3 结论与展望目前,Ce元素主要以Ce的氧化物CeO2和CeOx的形式应用于新兴电催化材料中,其氧化物中Ce3+和Ce4+的可逆转换、结构内大量的氧空位以及与其他材料耦合形成特殊结构,赋予Ce基催化材料具有可逆的氧离子交换能力、良好的电子/离子传导性及卓越的储氧能力[49-50],促进了反应中间体的转变,加快了水分解反应的动力学速率。此外,电沉积得到的最外层CeOx薄膜可以提升其电化学稳定性。通过构建纳米结构、掺杂、薄膜等形式,从增加催化材料表面活性位点数量和增加活性位点固有活性2个方向,研究人员开发了一系列性能优异的CeOx非贵金属电催化材料。但是对CeOx电催化材料优化策略的认识中,我们仍然存在许多不足,例如,Ce对电催化材料催化效率提升的深层次机理仍需进一步深入探索。未来基于Ce开发新型催化材料可以从以下几个方面进一步研究[51]。
1) 开发新的合成方法。通过水热法,可以在高压反应釜中获得修饰在基底材料上具有高纯度、结晶度良好和形态规则的CeOx纳米颗粒,但实验周期长,通常水热时间为12 h左右。利用电沉积法,获得包裹在基底材料外表面的CeOx薄层,这样的薄层可以有效的保护基底材料上的活性物质在工作时不溶解在电解液中,而且沉积时间短,但是这种方法在实际应用中操作不易控制。利用模板辅助和选择性刻蚀的方法,可以获得中空的CeOx纳米结构。一般情况下我们会同时选择几种合适的方法混合使用。
2) 结构优化。除了将CeOx以纳米颗粒的形式修饰在基底材料上,或者在表面形成CeOx薄膜,我们还可以借鉴过渡金属催化材料的结构设计经验,设计多孔结构、核壳结构和夹心结构等,不仅可以表现出更好的导电性,催化剂的表面也得到了更充分的利用。
3) 提高Ce基催化材料的电导率。纯CeO2或CeOx的导电性很差,一般提高非贵金属电催化材料电荷迁移能力是将高导电性材料结合在一起,掺杂活性元素并进行磷化或硫化等处理。在引入Ce的过程中,利用碳纸、铜箔、不锈钢网丝和泡沫镍等多孔基材作为基底,在基底上原位生长纳米级别催化活性物质,可以获得更好的导电性和大比表面积,并且在高电流密度下,催化材料依然可以保持很好的稳定性。此外,将催化剂和导电黏合剂混合均匀的浆料滴到电极片上,干燥后获得测试用的催化电极,这种方法有2个缺点:一是黏合剂会减少催化剂和电解质的接触面积,减少活性位点数量,使电催化性能下降;二是在高电流密度测试条件下,H2和O2气泡的产生速率大,催化活性物质易从电极上脱落,导致催化材料稳定性变差。因此,基于基底原位生长的方式使用较为广泛。
综合以上3个方向,我们可以进一步深入探究Ce元素在HER和OER催化剂中的应用,从制备手段和机理研究两方面进行研究,完善稀土基电催化材料的制备工艺,缩小与贵金属催化材料的商业应用差距,将稀土元素在电催化材料中的应用拓展到更广阔的研究领域。
| [1] |
ZHU Y P, GUO C X, ZHENG Y, et al. Surface and interface engineering of noble-metal-free electrocatalysts for efficient energy conversion processes[J].
Accounts of Chemical Research, 2017, 50(4): 915–923. DOI: 10.1021/acs.accounts.6b00635. |
| [2] |
SIVANANTHAM P, GANESAN P, SHAANMUGAM S. Hierarchical NiCo2S4 nanowire arrays supported on Ni foam: an efficient and durable bifunctional electrocatalyst for oxygen and hydrogen evolution reactions[J].
Advanced Functional Materials, 2016, 26(26): 4661–4672. DOI: 10.1002/adfm.201600566. |
| [3] |
PU Z H, LUO Y L, ASIRI A M, et al. Efficient electrochemical water splitting catalyzed by electrodeposited nickel diselenide nanoparticles based film[J].
ACS Applied Materials & Interfaces, 2016, 8(7): 4718–4723. |
| [4] |
姚俊杰, 唐佳易, 杨志娟, 等. 电解水制氢中钌基电催化剂的研究进展[J].
电池工业, 2019, 23(3): 151–156.
|
| [5] |
ZHANG Q T, WANG Y H, WANG Y C, et al. Myriophyllum-like hierarchical TiN@Ni3N nanowire arrays for bifunctional water splitting catalysts[J].
Journal of Materials Chemistry A, 2016, 4(15): 5713–5718. DOI: 10.1039/C6TA00356G. |
| [6] |
TANG C, CHENG N Y, PU Z H, et al. NiSe nanowire film supported on nickel foam: an efficient and stable 3D bifunctional electrode for full water splitting[J].
Angewandte Chemie International Edition, 2015, 54(32): 9351–9355. DOI: 10.1002/anie.201503407. |
| [7] |
LU X Y, YIM W L, SURYANTO B H R, et al. Electrocatalytic oxygen evolution at surface-oxidized multiwall carbon nanotubes[J].
Journal of the American Chemical Society, 2015, 137(8): 2901–2907. DOI: 10.1021/ja509879r. |
| [8] |
GONG M, WANG D Y, CHEN C C, et al. A mini review on nickel-based electrocatalysts for alkaline hydrogen evolution reaction[J].
Nano Research, 2016, 9(1): 28–46. DOI: 10.1007/s12274-015-0965-x. |
| [9] |
REIER T, OEZASLAN M, STRASSER P. Electrocatalytic oxygen evolution reaction (OER) on Ru, Ir, and Pt catalysts: a comparative study of nanoparticles and bulk materials[J].
ACS Catalysis, 2012, 2(8): 1765–1772. DOI: 10.1021/cs3003098. |
| [10] |
CHEREVKO S, GEIGER S, KASIAN O, et al. Oxygen and hydrogen evolution reactions on Ru, RuO2, Ir, and IrO2 thin film electrodes in acidic and alkaline electrolytes: A comparative study on activity and stability[J].
Catalysis Today, 2016, 262: 170–180. DOI: 10.1016/j.cattod.2015.08.014. |
| [11] |
ZHANG L, XIONG K, NIE Y, et al. Sputtering nickel-molybdenum nanorods as an excellent hydrogen evolution reaction catalyst[J].
Journal of Power Sources, 2015, 297: 413–418. DOI: 10.1016/j.jpowsour.2015.08.004. |
| [12] |
CHEN W Y, WANG C H, SASAKI K, et al. Highly active and durable nanostructured molybdenum carbide electrocatalysts for hydrogen production[J].
Energy & Environmental Science, 2013, 6(3): 943–951. |
| [13] |
苏兰.镍铁复合材料的调控及其电解水阳极催化机理的研究[D].重庆: 西南大学, 2018.
|
| [14] |
SHE Z W, KIBSGAARD J, DICKENS C F, et al. Combining theory and experiment in electrocatalysis: Insights into materials design[J].
Science, 2017, 355(6321): 4998. DOI: 10.1126/science.aad4998. |
| [15] |
NING Y Y, MA D D, SHEN Y, et al. Constructing hierarchical mushroom-like bifunctional NiCo/NiCo2S4@ NiCo/Ni foam electrocatalysts for efficient overall water splitting in alkaline media[J].
Electrochimica Acta, 2018, 265: 19–31. DOI: 10.1016/j.electacta.2018.01.150. |
| [16] |
SU L, DU H, TANG C, et al. Borate-ion intercalated NiFe layered double hydroxide to simultaneously boost mass transport and charge transfer for catalysis of water oxidation[J].
Journal of Colloid and Interface Science, 2018, 528: 36–44. DOI: 10.1016/j.jcis.2018.05.075. |
| [17] |
SONG F, XU X L. Ultrathin cobalt-manganese layered double hydroxide is an efficient oxygen evolution catalyst[J].
Journal of the American Chemical Society, 2014, 136(47): 16481–16484. DOI: 10.1021/ja5096733. |
| [18] |
RODRIGUEZ J A, GRINTER D C, LIU Z Y, et al. Ceria-based model catalysts: fundamental studies on the importance of the metal-ceria interface in CO oxidation, the water-gas shift, CO2 hydrogenation, and methane and alcohol reforming[J].
Chemical Society Reviews, 2017, 46(7): 1824–1841. DOI: 10.1039/C6CS00863A. |
| [19] |
ZHAN W C, GUO Y, GONG X Q, et al. Current status and perspectives of rare earth catalytic materials and catalysis[J].
Chinese Journal of Catalysis, 2014, 35(8): 1238–1250. DOI: 10.1016/S1872-2067(14)60189-3. |
| [20] |
SHENG W C, GASTEIGER H A, SHAO-HOM Y. Hydrogen oxidation and evolution reaction kinetics on platinum: acid vs alkaline electrolytes[J].
Journal of the Electrochemical Society, 2010, 157(11): 1529–1536. DOI: 10.1149/1.3483106. |
| [21] |
ZENG K, ZHANG D K. Recent progress in alkaline water electrolysis for hydrogen production and applications[J].
Progress in Energy and Combustion Science, 2010, 36(3): 307–326. DOI: 10.1016/j.pecs.2009.11.002. |
| [22] |
宁瑶瑶. Ni-Co基纳米阵列的构筑及其电催化性能的研究[D].天津: 天津大学, 2018.
|
| [23] |
WANG Z, DU H T, LIU Z, et al. Interface engineering of a CeO2-Cu3P nanoarray for efficient alkaline hydrogen evolution[J].
Nanoscale, 2018, 10(5): 2213–2217. DOI: 10.1039/C7NR08472B. |
| [24] |
OPPERMANN H. Hintergründe und Chronologie eines komplexen projektes in einem ökologisch sensiblen Umfeld[J].
Erdöl Erdgas Kohle, 2006, 122(4): 128–136. |
| [25] |
ZHANG R, REN X, HAO S. Selective phosphidation: an effective strategy toward CoP/CeO2 interface engineering for superior alkaline hydrogen evolution electrocatalysis[J].
Journal of Materials Chemistry A, 2018, 6(5): 1985–1990. DOI: 10.1039/C7TA10237B. |
| [26] |
ROLDAN CUENYA B. Synthesis and catalytic properties of metal nanoparticles: Size, shape, support, composition, and oxidation state effects[J].
Thin Solid Films, 2010, 518(12): 3127–3150. DOI: 10.1016/j.tsf.2010.01.018. |
| [27] |
GAO T Y, YANG J, NISHIJIMA M, et al. Evidence of the strong metal support interaction in a palladium-ceria hybrid electrocatalyst for enhancement of the hydrogen evolution reaction[J].
Journal of the Electrochemical Society, 2018, 165(14): 1147–1153. DOI: 10.1149/2.0351814jes. |
| [28] |
WENG Z, LIU W, YIN L C, et al. Metal/oxide interface nanostructures generated by surface segregation for electrocatalysis[J].
Nano Letters, 2015, 15(11): 7704–7710. DOI: 10.1021/acs.nanolett.5b03709. |
| [29] |
MA T Y, DAI S, JARONIEC M, et al. Metal-organic framework derived hybrid Co3O4-carbon porous nanowire arrays as reversible oxygen evolution electrodes[J].
Journal of the American Chemical Society, 2014, 136(39): 13925–13931. DOI: 10.1021/ja5082553. |
| [30] |
WANG J, ZHONG H X, QIN Y L, et al. An efficient three-dimensional oxygen evolution electrode[J].
Angewandte Chemie-International Edition, 2013, 52(20): 5248–5253. DOI: 10.1002/anie.201301066. |
| [31] |
BURKE M S, ZOU S H, ENMAN L J, et al. Revised oxygen evolution reaction activity trends for first-row transition-metal (oxy) hydroxides in alkaline media[J].
The Journal of Physical Chemistry Letters, 2015, 6(18): 3737–3742. DOI: 10.1021/acs.jpclett.5b01650. |
| [32] |
FABBRI E, HABEREDER A, WALTAR K, et al. Developments and perspectives of oxide-based catalysts for the oxygen evolution reaction[J].
Catalysis Science & Technology, 2014, 4(11): 3800–3821. |
| [33] |
YU J F, MARTIN B R, CLEARFIELD A, et al. One-step direct synthesis of layered double hydroxide single-layer nanosheets[J].
Nanoscale, 2015, 7(21): 9448–9451. DOI: 10.1039/C5NR01077B. |
| [34] |
FENG J X, YE S H, XU H, et al. Design and synthesis of FeOOH/CeO2 heterolayered nanotube electrocatalysts for the oxygen evolution reaction[J].
Advanced Materials, 2016, 28(23): 4698–4703. DOI: 10.1002/adma.201600054. |
| [35] |
LIU Z Q, LI N, ZHAO H Y, et al. Regulating the active species of Ni (OH)2 using CeO2: 3D CeO2/Ni (OH)2/carbon foam as an efficient electrode for the oxygen evolution reaction[J].
Chemical Science, 2017, 8(4): 3211–3217. DOI: 10.1039/C6SC05408K. |
| [36] |
XU H J, WANG B K, SHAN C F, et al. Ce-doped NiFe-layered double hydroxide ultrathin nanosheets/nanocarbon hierarchical nanocomposite as an efficient oxygen evolution catalyst[J].
ACS Applied Materials & Interfaces, 2018, 10(7): 6336–6345. |
| [37] |
WANG B K, XI P X, SHAN C F, et al. In Situ growth of ceria on cerium-Nitrogen-carbon as promoter for oxygen evolution reaction[J].
Advanced Materials Interfaces, 2017, 4(13): 1700272. DOI: 10.1002/admi.201700272. |
| [38] |
GUAN B Y, YU X Y, WU H B, et al. Complex nanostructures from materials based on metal-organic frameworks for electrochemical energy storage and conversion[J].
Advanced Materials, 2017, 29(47): 1703614. DOI: 10.1002/adma.201703614. |
| [39] |
TONG Z M, HUANG L, LEI W, et al. Carbon-containing electrospun nanofibers for lithium-sulfur battery: Current status and future directions[J].
Journal of Energy Chemistry, 2021(54): 254–273. |
| [40] |
JIAO L, WANG Y, JIANG H L, et al. Metal-organic frameworks as platforms for catalytic applications[J].
Advanced Materials, 2018, 30(37): 1703663. DOI: 10.1002/adma.201703663. |
| [41] |
XU H J, CAO J, SHAN C F, et al. MOF-derived hollow CoS decorated with CeOx nanoparticles for boosting oxygen evolution reaction electrocatalysis[J].
Angewandte Chemie-International Edition, 2018, 57(28): 8654–8658. DOI: 10.1002/anie.201804673. |
| [42] |
ZHANG M, HUANG Y L, WANG J W, et al. A facile method for the synthesis of a porous cobalt oxide-carbon hybrid as a highly efficient water oxidation catalyst[J].
Journal of Materials Chemistry A, 2016, 4(5): 1819–1827. DOI: 10.1039/C5TA07813J. |
| [43] |
XU H J, YANG Y W, YANG X X, et al. Stringing MOF-derived nanocages: a strategy for the enhanced oxygen evolution reaction[J].
Journal of Materials Chemistry A, 2019, 7(14): 8284–8291. DOI: 10.1039/C9TA00624A. |
| [44] |
王柄凯.稀土复合水滑石基非均相催化剂的设计合成及性质研究[D].兰州: 兰州大学, 2019.
|
| [45] |
WU X X, YANG Y W, ZHANG T, et al. CeOx-Decorated hierarchical NiCo2S4 hollow nanotubes arrays for enhanced oxygen evolution reaction electrocatalysis[J].
ACS Applied Materials & Interfaces, 2019, 11(43): 39841–39847. |
| [46] |
ZHENG Y R, GAO M R, GAO Q, et al. An efficient CeO2/CoSe2 nanobelt composite for electrochemical water oxidation[J].
Small, 2015, 11(2): 182–188. DOI: 10.1002/smll.201401423. |
| [47] |
OBATA K, TAKANABE K. A Permselective CeOx coating improves the stability of oxygen evolution electrocatalysts[J].
Angewandte Chemie, 2017. |
| [48] |
KIM J H, SHIN K, KAWASHIMA K, et al. Enhanced activity promoted by CeOx on a CoOx electrocatalyst for the oxygen evolution reaction[J].
ACS Catalysis, 2018, 8(5): 4257–4265. DOI: 10.1021/acscatal.8b00820. |
| [49] |
CODOLA Z, GOMEZ L, KLEESPIES S T. Evidence for an oxygen evolving iron-oxo-cerium intermediate in iron-catalysed water oxidation[J].
Nature Communications, 2015(6): 5865. |
| [50] |
CAMPBELL C T, PEDEN C H F. Oxygen vacancies and catalysis on ceria surfaces[J].
Science, 2005, 309(5735): 713–714. DOI: 10.1126/science.1113955. |
| [51] |
WANG J D, XIAO X, LIU Y, et al. The application of CeO2-based materials in electrocatalysis[J].
Journal of Materials Chemistry A, 2019, 7(30): 17675–17702. DOI: 10.1039/C9TA04804A. |
 2020, Vol. 11
2020, Vol. 11