| 焙烧铜渣中磁铁矿的物性转变研究 |
时至今日,冶炼铜的主要技术手段仍然是火法冶炼,在转炉和冰铜熔炼环节,炉料和燃料中的各种氧化物形成一种复杂的硅酸盐矿物--铜渣[1]。2017年我国铜渣年产量已超1 700万t,占据了世界铜渣年产量的30%[2-5]。目前,国内企业对于铜渣多采取堆存处理,这相当不利于环境保护[6-7];铜渣还可用于道路铺设和生产水泥[8],但铜渣中剩余金属的价值仍待挖掘[9]。因此,铜渣的二次利用急需一个行之有效的方法。
铜渣含有大量的铜、锌、钴、镍等有价金属和金、银等贵金属[10-12],铁含量可达35%至40%,比一般的铁矿石品位还要高[13]。但铜渣中大部分的铁与二氧化硅结合紧密,只有少部分的磁铁矿游离在渣中,使得磁选效果并不好[14]。国内外对铜渣中铁回收的方法主要有选矿法和冶金法[15-19]。
选矿法是先将铜渣磨细到一定的粒度,之后通过浮选或磁选的方法直接对渣中的铁进行回收。但由于铜渣中的铁主要存在于铁橄榄石相中且紧密结合,所以选矿法获得的精矿铁品位及铁回收率都不高。而冶金法分为还原焙烧法,氧化焙烧法和湿法。还原焙烧法是通过加入还原剂将渣中亚铁还原成单质铁后进行回收[20],铁精矿品位可达90%以上,铁回收率达到了80%,该方法可以获得较高品位的还原铁粉,但是该方法也会产生大量的CO2,且能耗较高,不符合相关的环保要求。而氧化焙烧法则是利用CaO可与SiO2反应,使FeO从Fe2O4中分离出来,再在氧化性气氛下氧化成Fe3O4后回收,效果相比于还原焙烧法更好,但流程较长是该方法的一个缺点。因此有研究者提出了采用湿法来回收铜渣中的铁资源,湿法是通过酸浸出-萃取-分杂的方法,对铜渣中的铁资源进行回收[21],该方法可以获得较高的铁浸出率和铁回收率。但酸法处理铜渣,所需的萃取液的量比较大,且产生的酸液不但会对设备产生腐蚀,还会危害环境。
刘金生等提出了弱氧化焙烧铜渣,磁选回收渣中铁的新方法[22]。通过控制炉内CO2与CO的体积比,进而对炉内的氧分压进行控制,使炉内处于一个弱氧化性气氛,将渣中铁选择性氧化为Fe3O4后进行磁选回收, 最终获得了品位为57.49%的铁精矿,铁回收率达到了80.14%。但文中的反应温度都是在铜渣熔点之下,即铜渣是以固体的状态反应的。而熔融状态下渣中铁相的物性变化和Fe3O4的迁移与富集并未提及,为了探究加热到熔融状态下铜渣中磁铁矿的物性变化,进一步进行了CO2/CO气氛下熔融焙烧铜渣的实验,考察不同的CaO添加量与焙烧温度对于熔融铜渣中磁铁矿的物性转变影响。
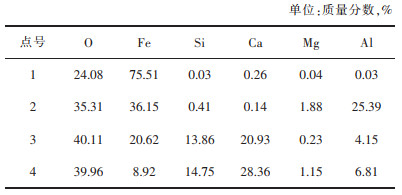
1 实验部分 1.1 实验原料 1.1.1 铜渣实验所使用的铜渣是来自江西某炼铜企业的浮选铜渣尾矿。表 1所列为铜渣原渣中主要成分,从中可以看出,渣中铁含量超过了40%,具有较大的回收价值。
| 表 1 铜渣原渣的主要化学成分 Table 1 The main chemical composition of the original copper slag |
 |
| 点击放大 |
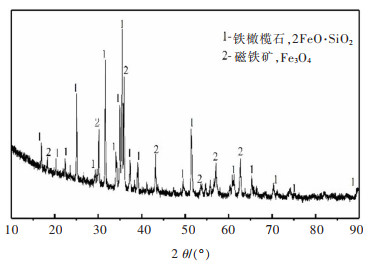
图 1所示为铜渣原渣的XRD图,可以看出铜渣中的主要物相是2FeO·SiO2和Fe3O4, 此外在衍射角小于40°的位置还发现了一个未成峰形的鼓包,分析得出这应该是铜渣中的玻璃相。
 |
| 图 1 铜渣原渣的XRD像 Fig. 1 XRD pattern of the original copper slag |
1.1.2 实验所需气体和添加剂
本实验采用分析级纯氧化钙(纯度 > 98%),粒度均小于74 μm。氧化钙作为添加剂,依所需比例进行添加。实验中所使用的气体(CO2、CO、Ar)的气体纯度都在99.99%以上,由建利气体有限公司(赣州,中国)提供。
1.2 实验方法取100 g的铜渣分别和0、15、25 g的氧化钙在球磨机充分混合2 h后分为3组放入干燥器中干燥备用。分别取这3组中25 g铜渣与氧化钙的混合样品加入刚玉坩埚并放入管式炉内,开始加热之前先以200 mL/min的气体流速向炉内通入Ar气体30 min,以排出炉内空气。之后通过控温面板设定反应温度(1 200、1 300、1 400 ℃)并将升温速率控制为10 ℃/min,升温过程通入气体流速为100 mL/min的氩气以避免铜渣在达到反应温度前就开始反应,达到反应温度后,以总流速200 mL/min的气体流速通入CO2和CO混合气体,在保温2 h后,停止通入CO和CO2气体,转为通入流速为100 mL/min的Ar气体直到样品冷却至室温后取出。将冷却后的样品破碎后通过XRD、SEM和EDS对其进行分析。
1.3 试验设备及表征方法实验进行前使用YXQM-1L型球磨机(长沙米琪仪器设备有限公司,长沙,中国)对铜渣与CaO进行研磨与混合。
实验所使用的加热装置是一台型号为GWL-LKQGA高温立式管式电炉(洛阳国炬实验电炉有限公司,洛阳,中国),反应气体流量由电子气体流量计(ALICAT)控制,图 2所示为设备简易图。
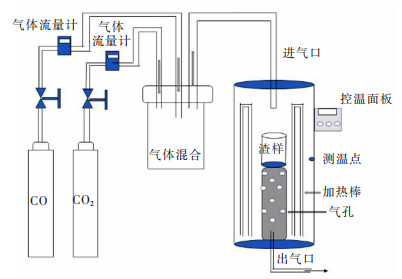 |
| 图 2 设备简易图 Fig. 2 Simple diagram of equipment |
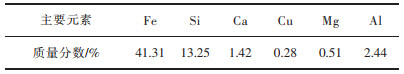
用X荧光分析仪(AxiosmAX-Metals,荷兰Panalytical公司)、电感耦合等离子体质谱ICP-MS(Agilent 8800)和化学分析方法对铜渣的主要成分进行分析。铜渣改性前后的物相组成用X射线多晶粉末衍射仪(EMPYREAN,荷兰Panalytical公司)测定,步长为0.013°,扫描范围确定为2θ=10°~90°,扫描时间为30 min。测定结果用jade6软件分析。用场发射扫描电子显微镜(MLA650F,美国FEI公司)和能谱仪(EDAX,德国布鲁克公司)对铜渣原样进行形貌和元素分析。
2 结果与讨论 2.1 CaO对熔融铜渣中磁铁矿转变的影响本研究分3组,选取以不同的铜渣与氧化钙质量比(分别为100:0、100:15、100:25)混匀后的样品进行焙烧,焙烧温度1 300 ℃,反应时间设置为2 h,CO2与CO的体积比为190:10,混合后通入炉内,而气体体积比通过气体流速比进行控制。观察CaO添加量对熔融铜渣中磁铁矿转变的影响。
图 3和图 4所示分别是未添加CaO焙烧时得到的铜渣XRD图谱和SEM图。从图 3可以看出,图 3中衍射峰以Fe2SiO4为主,并伴有Fe3O4的峰。说明未加入CaO时,焙烧铜渣中的物相主要还是Fe2SiO4和Fe3O4。
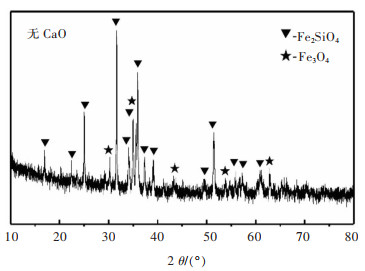 |
| 图 3 未加入CaO的焙烧铜渣的XRD图谱 Fig. 3 XRD pattern of calcined copper slag without CaO addition |
 |
| 图 4 未加入CaO的焙烧铜渣的SEM像 Fig. 4 SEM image of calcined copper slag without addition of CaO |
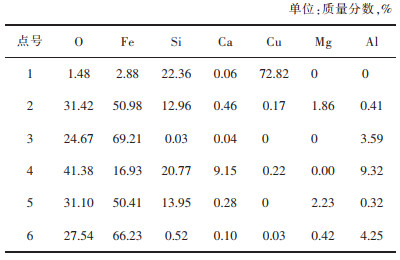
对图 4中的渣样做点扫描,得到了各点的元素百分比组成。由表 2可看出,发亮的点1主要成分为铜氧化物和部分的SiO2;点2与点5根据元素比例可确定为Fe2SiO4,点3和点6的主要元素为Fe和O,可确定点3与点6应为Fe3O4,点4呈黑色应为铜渣中的玻璃体。图 4中Fe3O4颗粒的粒径主要为30 μm。
紧接着是加入了15% CaO的焙烧铜渣的XRD图(图 5)及SEM图(图 6)。与未加入CaO的样品XRD图谱对比发现,新的物相--钙铁橄榄石(CaFe·2SiO4)和Ca2SiO4在焙烧铜渣中出现了,而原本的Fe2SiO4的峰则消失了,Fe3O4的峰仍然很少。钙铁橄榄石和Ca2SiO4的出现,也印证了Fe2O3、Ca和SiO2三者之间存在反应,有利于磁铁矿的产生。反应式如下:
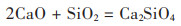
|
(1) |
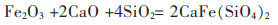
|
(2) |
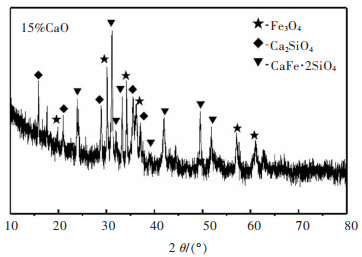 |
| 图 5 加入15%CaO的焙烧铜渣的XRD图谱 Fig. 5 XRD pattern of copper slag with 15% CaO added |
 |
| 图 6 加入15%CaO的焙烧铜渣的SEM像 Fig. 6 SEM pattern of copper slag with 15% CaO added |
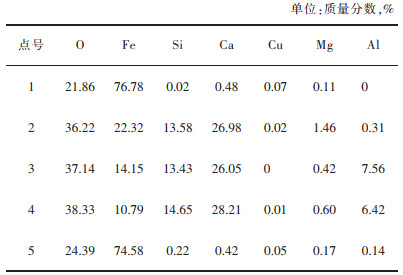
对图 6中的渣样做点扫描分析,得到了各点的元素组成。分析表 3中各点的元素组成可知,点1和点5磁铁矿;点2和点3则主要是CaFe·2SiO4;点4成分复杂,应为铜渣中的玻璃体。而图 6对比图 4可发现,部分Fe3O4晶体的晶粒尺寸增大了,出现了粒径为50 μm的Fe3O4颗粒,说明Fe3O4正在聚集,仍有进一步反应的空间。
图 7和图 8所示为将CaO的添加量增加至25%后,焙烧铜渣的XRD图和SEM图。相比较图 7,磁铁矿的衍射峰更多了,并且出现了CaFe(Si2O6)和部分钙镁铁橄榄石这两种新的物相,应该是多余的CaO与铁橄榄石分离出的FeO、SiO2还有铜渣中少量的镁结合生成的。
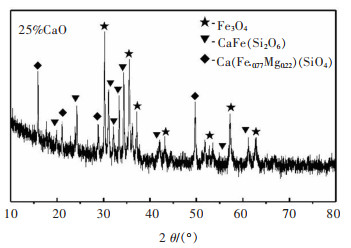 |
| 图 7 加入25%CaO的焙烧铜渣的XRD图谱 Fig. 7 XRD pattern of roasted copper slag with 25% CaO added |
 |
| 图 8 加入25%CaO的焙烧铜渣SEM像 Fig. 8 SEM image of roasted copper slag with 25% CaO added |
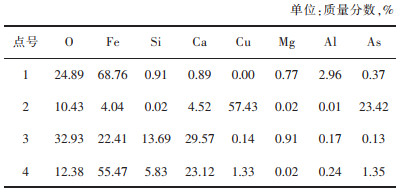
通过对图 8中的渣样进行点扫描分析,我们得到了各点的元素组成。分析表 4中各点的元素组成可知,点1为Fe3O4晶体;发亮的点2主要为氧化铜,并伴有较高的As含量;点3就是新出现的CaFe(Si2O6)和部分钙镁铁橄榄石;而点4是铜渣中的玻璃体。由图 8可知,此时铜渣中的磁铁矿晶体分布较广,且晶粒尺寸进一步增大了,基本处于30~100 μm,说明Fe2SiO4的转变已基本完成,磁铁矿也在这一转化过程中发生了迁移与富集,此时的渣中磁铁矿情况是有利于后续的分离回收的。
综上所述,增加CaO在样品中的比例,会提高铁橄榄石向磁铁矿转化程度。这是由于CaO会与铜渣中的SiO2结合生成稳定的硅酸钙,使从铁橄榄石中分离出的FeO不会重新与SiO2结合重新生成Fe2SiO4。但是过量的的CaO又会与铁、硅、镁结合成CaFe(Si2O6)和部分钙镁铁橄榄石。所以CaO的适宜加入量为25%。
2.2 温度对熔融铜渣中磁铁矿转变的影响在上节反应的基础上,以温度作为变量,CaO加入量固定为25%,探究不同温度下Fe3O4的转变,1 300 ℃下的实验结果已在上节表述。
图 9所示为1 200 ℃时,焙烧铜渣的XRD图。通过观察图片可发现,Fe2SiO4的衍射峰已消失,取而代之的是Ca2SiO4和CaFe·2SiO4这两个新的物相,Fe3O4的衍射峰占少数。说明在此温度下,Fe2SiO4已完全分解,但生成的Fe2O3并没有全部转变为Fe3O4,而此时加入的CaO则与SiO2和铜渣中尚未被还原的Fe2O3反应生成了Ca2SiO4和CaFe·2SiO4。
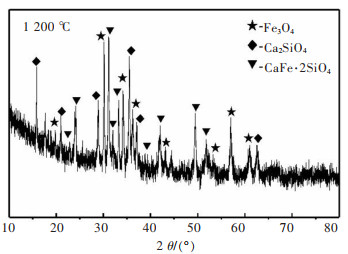 |
| 图 9 1 200 ℃时渣样的XRD图谱 Fig. 9 XRD pattern of roasted copper slag at 1 200 ℃ |
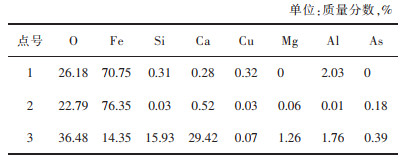
图 10所示是1 200 ℃焙烧铜渣的SEM图。为确定焙烧铜渣中的矿物分布,对图 10中各标记点进行了点扫描分析,表 5所列为扫描结果。根据表 5中各点的元素含量比可确定图 10中白色的点1和点2部分为Fe3O4晶体;呈黑色的点3区域为CaFe·2SiO4。观察图片可知Fe2SiO4已基本消失,此时有较为细小的Fe3O4晶体生成,尺寸在10 μm至30 μm但分布较为无序,说明Fe2SiO4开始发生反应,但进行程度并不高,且Fe3O4尚未发生迁移和聚集。
 |
| 图 10 1 200 ℃时渣样的SEM像 Fig. 10 SEM image of calcined copper slag at 1 200 ℃ |
图 11和图 12所示分别是1 400 ℃下焙烧得到的铜渣XRD图谱和SEM图。由图 11可发现,此时焙烧铜渣的衍射峰以CaFe·2SiO4的衍射峰为主,并伴有Ca2SiO4,而Fe3O4衍射峰数量相比1 300 ℃焙烧铜渣有所减少。这是因为Fe3O4在此温度下会与渣中SiO2和CaO反应转化为CaFe·2SiO4。
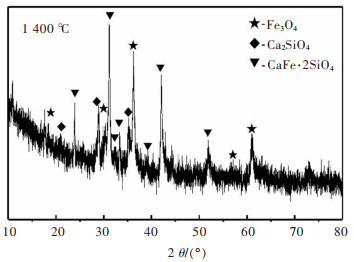 |
| 图 11 1 400 ℃下的焙烧铜渣的XRD图谱 Fig. 11 XRD pattern of roasted copper slag at 1 400 ℃ |
 |
| 图 12 1 400 ℃下的焙烧铜渣SEM像 Fig. 12 SEM image of baked copper slag at 1 400 ℃ |
对图 12中各标记点进行点扫描分析,得到了表 6。图 12中呈白色的点1为球状和条状的Fe3O4晶体;点2为Fe与Al、Zn等元素结合形成的玻璃体;点3和点4是由Ca、Fe、Si、O等元素组成的含铁硅酸盐。对比图 8可知,Fe3O4晶体变小了,为10 μm至40 μm。说明Fe3O4与渣中的Ca2SiO4反应产生了CaFe·2SiO4,对于Fe3O4的迁移聚集起到了阻碍的作用。
综上所述,1 200 ℃时,提高反应温度可以促进Fe2SiO4反应生成Fe3O4,且有利于Fe3O4的迁移聚集;1 300 ℃时,铜渣中的磁铁矿晶体分布较广,且晶粒尺寸进一步增大了,Fe2SiO4的转变已基本完成,磁铁矿也在这一转化过程中发生了迁移与富集,此时的渣中磁铁矿情况是有利于后续的分离回收的;但超过1 300 ℃后,温度的提高反而会促进CaFe·2SiO4的生成,让Fe3O4含量降低。所以焙烧温度选择1 300 ℃更为合适。
3 结论为进一步探究液态铜渣中磁铁矿物相变化规律,将铜渣加热至熔融,考察不同条件下Fe3O4的物性变化。
1) CaO的作用是消耗渣中SiO2,阻碍SiO2与FeO的结合,使转化反应正向进行,促进Fe3O4的生成。加入25% CaO,此时焙烧渣中的Fe3O4含量最高并且晶体迁移聚集效果最好。
2) 1 200 ℃时,提高反应温度可以促进Fe2SiO4反应生成Fe3O4,且有利于Fe3O4的迁移聚集;1 300 ℃时,铜渣中的磁铁矿晶体分布较广,且晶粒尺寸进一步增大了,Fe2SiO4的转变已基本完成,磁铁矿也在这一转化过程中发生了迁移与富集,此时的渣中磁铁矿情况是有利于后续的分离回收的;但超过1 300 ℃后,温度的提高反而会促进CaFe·2SiO4的生成,让Fe3O4含量降低。所以焙烧温度选择1 300 ℃更为合适。
| [1] |
DURINCK D, ENGSTR M F, ARNOUT S, et al. Hot stage processing of metallurgical slags[J].
Resources, Conservation and Recycling, 2008, 52(10): 1121–31. DOI: 10.1016/j.resconrec.2008.07.001. |
| [2] |
CHUN T, NING C, LONG H, et al. Mineralogical characterization of copper slag from tongling nonferrous metals group china[J].
Jom, 2015, 68(9): 2332–40. |
| [3] |
GBOR P, VALENTINAMOKRI, JIA C. Characterization of smelter slags[J].
Environ Lett, 2000, 35(2): 147–67. |
| [4] |
胡建杭, 王华, 赵鲁梅, 等. 贫化铜渣的特性分析[J].
安全与环境学报, 2011, 11(2): 90–93.
|
| [5] |
NAJIMI M, POURKHORSHIDI A R. Properties of concrete containing copper-slag-waste[J].
Magazine of Concrete Research, 2011, 63(8): 605–15. DOI: 10.1680/macr.2011.63.8.605. |
| [6] |
GORAI B, JANA R K, PREMCHAND. Characteristics and utilisation of copper slag-a review[J].
Resources, Conservation and Recycling, 2003, 39(4): 299–313. DOI: 10.1016/S0921-3449(02)00171-4. |
| [7] |
SHEN H, FORSSBERG E. An overview of recovery of metals from slags[J].
Waste Manag, 2003, 23(10): 933–49. DOI: 10.1016/S0956-053X(02)00164-2. |
| [8] |
陈友德. 铜冶炼浮选矿渣的利用价值[J].
水泥技术, 2015(1): 111–119.
|
| [9] |
SHI C, MEYER C, BEHNOOD A. Utilization of copper slag in cement and concrete[J].
Resour Conserv Recycl, 2008, 52(10): 1115–1134. DOI: 10.1016/j.resconrec.2008.06.008. |
| [10] |
汤海波.铜冶炼主要副产物处理与综合利用工艺研究[D].武汉: 武汉科技大学, 2014.
|
| [11] |
胡建杭, 王华, 赵鲁梅, 等. 贫化铜渣的特性分析[J].
安全与环境学报, 2011(2): 90–93.
|
| [12] |
吴龙, 郝以党. 铜渣资源化利用现况及高效化利用探讨[J].
中国有色冶金, 2015(2): 61–64.
|
| [13] |
徐露, 库建刚, 林存键, 等. 从铜渣中回收铁的研究进展[J].
现代化工, 2016(2): 26–29.
|
| [14] |
BRINKMANN U, LAQUA W. Decomposition of fayalite (Fe2SiO4) in an oxygen potential gradient at 1, 418 K. Phys[J].
Chem. Miner, 1985, 12: 283. DOI: 10.1007/BF00310341. |
| [15] |
李黎. 从铜渣中回收铁的研究概况[J].
中国化工贸易, 2012(11): 177.
|
| [16] |
赵艳, 关翔. 铁矿石焙烧-磁选探索性试验研究[J].
新疆钢铁, 2007(2): 10–12.
|
| [17] |
汤海波.铜冶炼主要副产物处理与综合利用工艺研究[D].武汉: 武汉科技大学, 2014.
|
| [18] |
姚春玲, 刘振楠, 滕瑜, 等. 铜渣资源综合利用现状及展望[J].
矿冶, 2019, 28(2): 77–81.
|
| [19] |
余志翠. 选矿技术在铜渣综合利用中的应用[J].
中国高新技术企业, 2016(28): 157–158.
|
| [20] |
赵凯, 宫晓然, 李杰, 等. 直接还原法回收铜渣中铁、铜和锌的热力学[J].
环境工程学报, 2016, 10(5): 2638–2646.
|
| [21] |
张铃, 方建军, 唐敏, 等. 铜冶炼渣湿法处理技术研究进展[J].
矿产保护与利用, 2019, 39(3): 81–87.
|
| [22] |
刘金生, 姜平国, 肖义钰, 等. 从铜渣中回收铁的研究现状及其新方法的提出[J].
有色金属科学与工程, 2019, 10(2): 19–24.
|
 2020, Vol. 11
2020, Vol. 11