| NaCl-CaCl2熔盐体系中电脱氧制备金属Fe的工艺研究 |
2. 中国原子能科学研究院放射化学研究所, 北京 102413
2. Department of Radiochemistry, China Institute of Atomic Energy, Beijing 102413, China
FFC-剑桥工艺是基于高温氯化物熔盐体系的氧化物[1-8]电化学还原为金属的重要方法之一。由于工艺简单[2-4]、绿色环保等优点,FFC-剑桥工艺广泛应用于过渡金属(如Ni[1]、Fe[2-3])、难熔金属(如Zr[4]、V[5]等)和稀土合金(如LaNi5[6]、Tb2Fe17[7])等。
同时,由于FFC-剑桥工艺可将乏燃料中的UO2还原为金属铀[8],因此也用于干法后处理流程中电解还原工艺的研究。乏燃料中含有一定量的稀土裂变产物,由于稀土元素对氧具有强亲和力,且稀土氧化物的高热力学稳定性[9],因此采用FFC-剑桥工艺还原氧化物型乏燃料时,稀土氧化物的还原率极低。为了提高稀土氧化物的还原率,Min等采用NiO作为共还原组分,用于稀土氧化物的共还原(Co-reduction),结果表明添加NiO后稀土氧化物(Nd2O3、La2O3)的还原率提高至81.1%和80.2%,但CeO2的还原率仅为43.8%。由于使用NiO的成本较高,为进一步提高稀土氧化物的还原率,选择合适且廉价的共还原剂是关键[9]。谢宏伟等在CaCl2熔盐中以摩尔分数比为1:1:2的Tb2O3、Dy2O3、Fe2O3混合氧化物为阴极,采用FFC剑桥工艺电化学还原制备了铽-镝-铁合金[10];邱国红等采用相似的方法制备了Tb2Fe17合金,表明Fe2O3为稀土氧化物的潜在共还原组分[7]。
因此,本研究拟开展NaCl-CaCl2熔盐体系中共还原组分Fe2O3的工艺试验。采用不锈钢网包裹高温烧结后的Fe2O3片为阴极,以石墨棒为阳极,于NaCl-CaCl2熔盐体系中采用FFC-剑桥工艺电化学还原为金属铁。研究了烧结工艺(烧结温度、黏结剂用量)对孔隙率的影响,电解工艺(电解电压、电解时间、烧结温度、黏结剂用量和电解温度等)对Fe2O3电还原为Fe的影响。同时,也研究了Fe2O3于NaCl-CaCl2中的电化学还原机理。
1 实验 1.1 实验过程1)压片和烧结:熔盐电解法还原Fe2O3过程主要包括压片、烧结和电解三步。称取一定量(约1.20 g)的Fe2O3粉末(分析纯, 上海紫一试剂厂)于烧杯中,加入少量黏结剂聚乙烯醇(99%, 上海紫一试剂厂),于刚玉坩埚(唐山开平盛兴化学瓷厂)中研磨混匀后,称量混合物于压片模具中,并于压片机(PC-24型,天津精拓仪器科技有限公司)中保压2 min后,取出Fe2O3片,观察片状物的外观是否完整。采用马弗炉(SX3-6-13型,杭州卓驰仪器有限公司)在空气中烧结以去除圆片中的黏结剂,并使压的圆片紧密,采用游标卡尺量外观尺寸,并采用式(1)计算烧结后样品的孔隙率(P)。
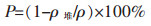
|
(1) |
式中:ρ堆为堆积密度,ρ为真空密度。
2)电解:电解装置如图 1所示,主要包括电阻炉、供气系统、电极系统和尾气处理系统等部分。将烧结的Fe2O3片置于不锈钢网中并压紧,用Mo丝(Φ1, 洛阳稀之研金属材料有限公司)连接作为阴极;以高纯石墨棒(Φ20, 温州乐清市石墨及碳素制品厂)连接作为阳极。将NaCl和CaCl2加热400 ℃并保温2 h,以去除盐中的水分。将摩尔比为1:1的NaCl和CaCl2混匀后,置于坩埚炉(SJL-1400型,上海钜晶精密仪器制造有限公司)中,通入氩气,待熔盐熔融后,将阴极和阳极插入熔盐液面以下。首先使用钼棒(Φ10, 洛阳稀之研金属材料有限公司)作为阴极,采用稳压直流电源(IT6723型,艾德克斯电子(南京)有限公司)于2.0 V预电解2 h,以去除熔盐中的杂质离子和水分;然后以Fe2O3片为阴极,进行电解还原实验。同时,将尾气排入集气瓶中。电解结束后,将阴极阳极提起,待盐冷却至室温后,取出阴极用乙醇和水超声清洗以去除片中的盐和其他杂质,并用砂纸打磨备用。
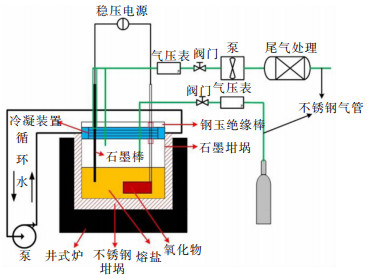 |
| 图 1 熔盐电解还原Fe2O3装置示意 Fig. 1 Schematic diagram of molten salt electrolysis of Fe2O3 device |
1.2 表征
采用德国布鲁克公司D8 advance XRD表征了电解前后样品的物相及组成;采用FEI捷克有限公司Nova NanoSEM 450型场发射扫描电子显微镜观察了烧结后样品的微观形貌。
2 结果与讨论 2.1 烧结工艺 2.1.1 烧结温度压片时加入的黏结剂随着温度升高分解时可产生孔穴,有利于熔盐的进入,加快电解速度[11]。在相同的黏结剂(聚乙烯醇)质量分数(2.0%)、压强(20 MPa)、润湿剂(H2O)与润湿剂用量(6%)的条件下,研究了烧结温度分别为700、800、900、1 000 ℃时,对Fe2O3片的孔隙率的影响。不同烧结温度时,Fe2O3片孔隙率如图 2所示。由图 2可知,烧结温度对Fe2O3片有明显的影响[12],随着烧结温度由700 ℃升高至1 000 ℃时,孔隙率由38.8%降至30.9%。
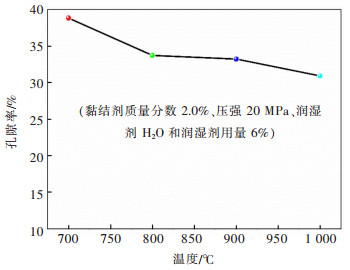 |
| 图 2 烧结温度对Fe2O3片孔隙率的影响 Fig. 2 Effect of sintering temperature on porosity of Fe2O3 pellets |
烧结后Fe2O3片如图 3内插图所示,Fe2O3片表面颜色均呈黑色,表明在烧结过程中浅色的Fe2O3于高温条件下发生转化或黏结剂分解残留了部分的碳。
 |
| (注:内插图:不同温度烧结后Fe2O3片的照片) 图 3 不同温度烧结Fe2O3片的SEM像和样品 Fig. 3 SEM and sample diagram of Fe2O3 sintered at different temperatures |
为进一步了解烧结温度对Fe2O3片孔隙率的影响,采用SEM表征了不同烧结温度的Fe2O3片的表面微观结构,结果如图 3所示,烧结后的Fe2O3片逐渐黏结在一起,结构之间连接更紧密。烧结温度为700 ℃时,Fe2O3颗粒未有明显的结合,颗粒之间的孔隙比较明显,粒径大小约为0.41 μm。当烧结温度由700 ℃升高至1 000 ℃时,烧结产物的粒径由0.41 μm增大至1.21 μm,这是由于在烧结作用驱动下,晶粒重结晶,因此粒径明显增大[8]。
以上结果表明,提高烧结温度可使Fe2O3片的粒径增大,并且使颗粒间连接紧密,有利于减小电阻,促进电脱氧反应;同时,也会使孔隙率降低,不利于O2-向外扩散[13],因此综合考虑选择900 ℃作为较优的烧结温度。
2.1.2 黏结剂用量黏结剂聚乙烯醇用量为1.0%、1.5%、2.0%和2.5%时,Fe2O3片于900 ℃下烧结后的孔隙率如图 4所示。黏结剂用量由1%升高至2.5%时,孔隙率由30.77%升高至36.33%附近,这是由于黏结剂用量增加,黏结剂高温分解后生产的孔较多;但黏结剂用量继续增大时,烧结时部分孔道可能塌陷,造成孔隙度变化较小。不同黏结剂用量下Fe2O3片的微观形貌如图 5所示,烧结后的Fe2O3表面具有丰富的孔结构。为使烧结后的Fe2O3片具有较高的孔隙率和一定的强度,选择2.0%作为较优的黏结剂用量。
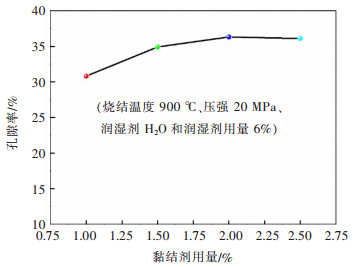 |
| 图 4 黏结剂用量对Fe2O3片孔隙率的影响 Fig. 4 Effect of binder content on porosity of Fe2O3 pellets |
 |
| 图 5 不同黏结剂用量Fe2O3片的SEM像 Fig. 5 SEM of Fe2O3 pieces under different amount of binder |
2.2 电解工艺
主要考察了电解电压、电解时间、电解温度、黏结剂用量、烧结温度等对电解的影响。
2.2.1 电解电压的影响将烧结温度和黏结剂用量分别为900 ℃和2.0%的Fe2O3片置于阴极,熔盐体系的温度为722 ℃,电解均为8 h时,由不同电压电解的电解产物XRD(图 6)可知,电压为2.6、2.8、3.0、3.2 V时,主要的电解产物依次为Fe3O4、FeO和Fe,电解时所施加的槽电压越高,电解产物的XRD中杂质峰越小,表明电解效率越高。
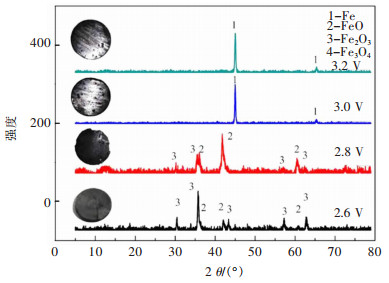 |
| (注:烧结温度900 ℃;黏结剂用量2.0%;电解温度722 ℃;电解时间8 h) 图 6 不同电压电解产物的照片和XRD谱图(内插图为不同电压下的电解产物) Fig. 6 Photos and XRD spectra of electrolytic products with different voltage (Inset the photograghs of the products of electrolysis under different voltages) |
当槽电压为2.6 ~2.8 V时,产物中存在大量的中间产物FeO和Fe3O4[3],并未有目标产物Fe的生成。随着施加的槽电压増大,当槽电压为3.0~3.2 V时,产物检测中仅有目标产物Fe。
不同电压电解后的样品如图 6内插图所示,由图 6可知,电压为2.6 V时样品基本呈黑色;电压为2.8 V时,打磨后表面出现略微的金属光泽;电压为3.0 V和3.2 V时,表面呈金属光泽,表明生成了金属Fe,因此选择3.2 V作为较优槽电压。
2.2.2 电解时间的影响控制烧结温度为900 ℃,黏结剂聚乙烯醇用量为2%,电解温度为722℃,电解电压为3.2 V,电解时间分别为2 h、4 h和8 h时,烧结后的Fe2O3片和不同时间电解产物的XRD谱图如图 7所示。电解的过程是从外向内的扩散的过程,由图 7可知,当电解2 h,主要的产物为Fe3O4;电解4 h时,产物的XRD中还出现了FeO和目标产物Fe的衍射峰;电解8 h后,中间产物Fe3O4和FeO的衍射峰消失,主要的产物为Fe,表明此时电解还原较为完全。因此后续的实验,采用的电解时间为8 h。
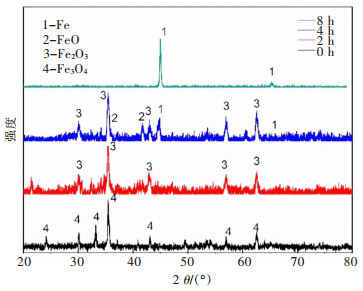 |
| (注:槽电压3.2 V;烧结温度900 ℃;黏结剂用量2.0%;电解温度722 ℃) 图 7 不同时间电解Fe2O3阴极后产物的XRD Fig. 7 XRD of products after electrolysis of Fe2O3 cathode at different times |
结合电解电压和时间的影响推断,NaCl-CaCl2熔盐体系中Fe2O3电脱氧的可能机理为:
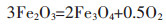
|
(2) |
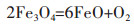
|
(3) |
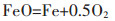
|
(4) |
阳极反应为:
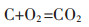
|
(5) |
总反应为:
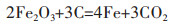
|
(6) |
以上结果与Li等[3]于NaCl-CaCl2熔盐体系中电解还原Fe2O3所得结论相同。
2.2.3 烧结温度的影响当控制电解时间为8 h,黏结剂聚乙烯醇用量为2%,电解温度为722 ℃,电解电压为3.2 V时,烧结温度为700、800、900和1 000 ℃时,电解产物的XRD谱图如图 8所示。由图 8可知,当烧结温度为700 ℃和1 000 ℃时,虽然电解产物为Fe,但含有一定量的杂质峰;烧结温度为800、900 ℃时,产物为Fe且几乎无杂质峰。由不同烧结温度下的Fe2O3片的SEM(图 3)可知,高温烧结使颗粒的粒径由0.41 μm增大至1.21 μm;同时Fe2O3颗粒间的连接方式由点转为面,有利于电子和空穴的传递;但是,随着烧结温度由700 ℃升高至1 000 ℃时,Fe2O3片的孔隙率由38.8%下降至30.9%,导致比表面减小,阻碍脱氧反应的进行,从而影响了熔盐电脱氧效率[14]。因此,在该体系中开展电脱氧制备Fe的较优烧结温度应为800~900 ℃。
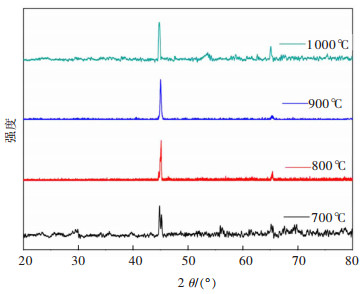 |
| (注:槽电压3.2 V;电解时间8 h;黏结剂用量2.0%;电解温度722 ℃) 图 8 不同烧结温度Fe2O3片电解后产物的XRD Fig. 8 XRD of products after electrolytic sintering of Fe2O3 cathode at different temperatures |
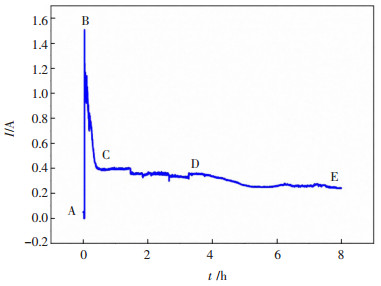
由图 9可知,当电压为3.2 V时,烧结温度为800 ℃时Fe2O3电解曲线可分为4个阶段:AB段:电解初始阶段靠近电极线的Fe2O3先电解,电子快速使阴极表面的氧于阴极-熔盐-电子三相界面发生离子化反应:
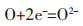
|
(7) |
 |
| 图 9 800 ℃烧结Fe2O3阴极的电解曲线 Fig. 9 Electrolysis curve of Fe2O3 sintered at 800 ℃ |
此时,阴极表面的还原反应迅速完成,此时电流达到最大值[7];BC段:阴极片表面的O2-游离出来,并扩散到熔盐中,继续发生还原反应生成金属,并形成金属-氧化物-熔盐三相界面[14],但由于阴极片内部与熔盐的接触性较差,导致O2-扩散速率变慢,同时熔盐进入Fe2O3阴极芯块内部的距离变长,导致电流急剧下降[11];CD段:氧离子的扩散与电化学还原达到平衡时电流值稳定于0.4 A左右;DE段:电解还原后期,随着还原反应的进一步进行,氧离子在Fe2O3阴极内部中的扩散速率低于还原速率,使电流逐步减小。
2.2.4 黏结剂用量的影响黏结剂聚乙烯醇用量分别为1.0%、1.5%、2%和2.5%时,当控制烧结温度为900 ℃,烧结时间为3 h,电解温度和时间分别为722 ℃和8 h,电解电压为3.2 V时,电解产物的XRD谱图如图 10所示。由图 10可知,当黏结剂用量为1.0%、1.5%、2%和2.5%时,电解产物均为Fe,但1.0%时XRD谱的背景峰较强。结合不同黏结剂用量烧结后Fe2O3片的孔隙率可知,当黏结剂用量为1.0%时,孔隙率仅为30.33%,而当黏结剂用量为1.5%~2.5%之间时,孔隙率升高至35.00%左右,孔隙率增大有利于O2-的往外扩散与熔盐的渗入,有利于Fe2O3片的电脱氧反应进行。因此,在NaCl-CaCl2熔盐体系中电解Fe2O3制备Fe的较优黏结剂用量为1.5%~2.5%。
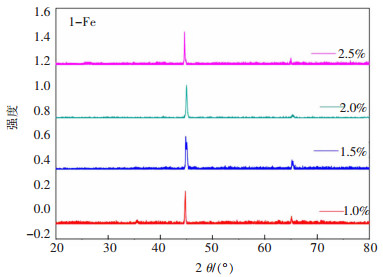 |
| (注:槽电压3.2 V;电解时间8 h;烧结温度900℃;电解温度722℃) 图 10 不同黏结剂用量时烧结Fe2O3阴极电解产物的XRD Fig. 10 XRD of electrolytic products of sintered Fe2O3 cathode with different binder content |
2.2.5 电解温度的影响
当控制电解时间为8 h,黏结剂聚乙烯醇用量为2%,电解电压为3.2 V时,烧结温度为900 ℃时,不同电解温度(636、680、722、764 ℃)电解产物的XRD谱图如图 11所示。
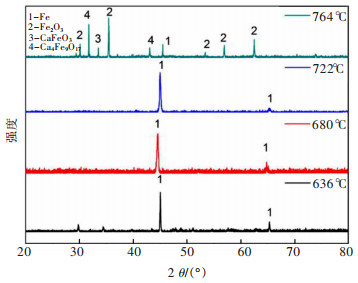 |
| (注:槽电压3.2 V;电解时间8 h;烧结温度900℃;黏结剂用量2.0%) 图 11 不同熔盐温度时Fe2O3阴极电解产物的XRD Fig. 11 XRD of electrolytic products of Fe2O3 cathode at different molten salt temperatures |
由图 11可知,熔盐体系温度为636 ℃时,虽然主要产物为Fe,但仍存在一些杂质峰;当电解温度为680 ℃和722 ℃时,从XRD谱可知电解产物仅为Fe。这是由于过程温度的升高有助于降低分解电压,提高氧化物的电导率,加快O2-的扩散并提高O2-的溶解性,因此有利电解还原反应的进行[15]。但是,电解温度为764 ℃时,产物除了Fe还有Fe3O4、CaFeO3和Ca4Fe9O17,这是由于在高温条件下Fe2O3易与CaO等发生反应生成上述产物,从而阻止氧化物的进一步还原。因此,在NaCl-KCl熔盐体系中开展Fe2O3电脱氧制备Fe的较优电解温度为680~722 ℃。
3 结论采用等摩尔的CaCl2-NaCl熔盐为电解质,研究了Fe2O3的电化学脱氧还原为金属的过程。研究各种实验条件对还原的影响,得到较优的工艺条件分别为:槽电压为3.2 V,电解时间为8 h,烧结温度为800~900 ℃,黏结剂用量为1.5%~2.5%和电解温度为680~722 ℃。在上述较优条件下,CaCl2-NaCl熔盐体系中电解8 h可得到金属Fe。Fe2O3在CaCl2-NaCl熔盐体系中的电化学还原机理为:3Fe2O3=2Fe3O4+0.5O2、2Fe3O4=6FeO+O2、FeO=Fe+0.5O2。
| [1] |
周正. FFC剑桥工艺制备金属Ni及LaNi5合金[D].唐山: 河北理工大学, 2008.
|
| [2] |
WANG D H. Direct reduction of solid Fe2O3 in molten CaCl2 by potentially green process[J].
Journal of Materials Science and Technology, 2009, 25(6): 767–771. |
| [3] |
LI H. Study on the direct electrochemical reduction of Fe2O3 in NaCl-CaCl2 melt[J].
International Journal of Electrochemical Science, 2019, 14(12): 11267–11278. |
| [4] |
李晴宇, 杜继红, 奚正平, 等. 掺杂CaCO3对熔盐电脱氧制备金属锆的影响[J].
稀有金属材料与工程, 2008, 37(增刊4): 537–541.
|
| [5] |
WANG S L, LI S C, WAN L F. Electro-deoxidation of V2O3 in molten CaCl2-NaCl-CaO[J].
矿物冶金与材料学报, 2012, 19(3): 212–216. |
| [6] |
KANG X, XU QIAN, MA SUJUAN, et al. Mechanistic insight into electrochemical synthesis of LaNi5 in a eutectic CaCl2-NaCl melt at 850 ℃[J].
Electrochemistry, 2009, 77(8): 663–666. DOI: 10.5796/electrochemistry.77.663. |
| [7] |
邱国红, 汪的华, 金先波, 等. 直接熔盐电化学还原固态Tb4O7-Fe2O3制备Tb2Fe17[J].
金属学报, 2008(7): 859–862.
|
| [8] |
ABDELKADER A M, FRAY D J. Electro-deoxidation of hafnium dioxide and niobia-doped hafnium dioxide in molten calcium chloride[J].
Electrochimica Acta, 2012, 64: 10–16. DOI: 10.1016/j.electacta.2011.11.107. |
| [9] |
MIN W L, EUNYOUNG C, SANG C J, et al. Enhanced electrochemical reduction of rare earth oxides in simulated oxide fuel via co-reduction of NiO in Li2O-LiCl salt[J].
Electrochemistry Communications, 2016, 72: 23–26. DOI: 10.1016/j.elecom.2016.08.021. |
| [10] |
谢宏伟, 王锦霞, 金炳勋, 等. CaCl2熔盐中直接电化学还原制备铽-镝-铁合金机制[J].
稀有金属材料与工程, 2012, 41(12): 2233–2237.
|
| [11] |
陈征, 赵兴科. 致密ZrO2陶瓷板表面金属层的熔盐电解法制备[J].
稀有金属, 2018, 42(2): 175–181.
|
| [12] |
LAI P S, HU M L, QU Z F, et al. Initial reactions at the electrodes of the FFC-Cambridge process in molten CaCl2 to produce Ti[J].
Metallurgical and Materials Transactions B-process Metallurgy and Materials Processing Science, 2018, 49(6): 3403–3412. DOI: 10.1007/s11663-018-1409-2. |
| [13] |
胡小锋, 许茜. CaCl2-NaCl熔盐电脱氧法制备金属Ta[J].
金属学报, 2006(3): 285–289.
|
| [14] |
SRI M V, SANIL N, MOHANDAS K S. Electrochemical characterisation of CaCl2 deficient LiCl-KCl-CaCl2 eutectic melt and electro-deoxidation of solid UO2[J].
Journal of Nuclear Materials, 2016, 470: 179–186. DOI: 10.1016/j.jnucmat.2015.12.003. |
| [15] |
VISHNU D S, SANIL N, NAGARAJAN K, et al. Factors influencing the direct electrochemical reduction of Nb2O5 Pellets to Nb metal in molten chloride salts[J].
Acta Metallurgica Sinica(English Letters), 2017, 30(3): 218–227. DOI: 10.1007/s40195-016-0503-1. |
 2020, Vol. 11
2020, Vol. 11


