| P2型层状钠离子电池正极材料的研究 |
b. 江西理工大学,江西省动力电池及材料重点实验室,江西 赣州 341000
b. Jiangxi Key Laboratory of Power Battery and Materials,Jiangxi University of Science and Technology, Ganzhou 341000, China
锂离子电池具有能量密度大、循环寿命长、工作电压高、无记忆效应、自放电小、工作温度范围宽等优点,但是锂在地壳和海水中的含量较低[1-2]。相比于锂而言,钠在地球上资源丰富,价格便宜,分布广泛。所以钠离子电池也被公认为是锂离子电池的替代品。同时,钠和锂在元素周期表的同一主族,具有相似的物理化学性质[3-5]。钠离子电池与锂离子电池具有相同的结构:正极材料、负极材料、电解质、隔膜。电池充放电过程中,Na+在两个电极之间往返嵌入和脱嵌:充电时,Na+ 从正极脱嵌,经过电解质嵌入负极,负极处于富钠状态;放电时,Na+ 从负极脱嵌,经过电解质嵌入正极,正极处于富钠状态[6-7]。钠离子电池的电极材料主要有层状NaxMO2(M=Co、Ni、Fe、Mn和V等)材料,金属氟化物,聚阴离子型材料等。由于Mn在地壳中储量丰富,无毒,比容量较高,则层状NaxMnO2材料比容量高,毒性较低,被广泛应用于钠离子电池材料中,所以层状NaxMnO2材料的技术研究已经成为热点[8]。
层状NaxMnO2材料的结构由Mn-O八面体,通过共边形成层状结构。钠的大离子半径(0.102 nm)有利于八面体或棱柱位点的六重配位。NaxMO2系统主要结构是O3,O,3,P3或P2型[9]。最常见的结构一般为O3和P2型结构,O型层状氧化物在八面体位置容纳钠离子,而P型材料在棱柱位点包含钠离子[10]。O3相结构由于钠离子迁移要通过狭窄的四面体中心位置,具有更大的扩散势垒[11]。而层状P2型结构中钠离子需要通过相对宽阔的平面四边形中心位置,所以P2相比O3相扩散势垒更低,一般表现出更好的电化学性能[12-14]。这四种结构的电池材料均能够发生可逆脱嵌。前3种材料O3↔O,3↔P3相之间发生了相互转变,会导致循环性能恶化。但P2相的NaxCoO2材料在充放电过程中,保持其原结构,具有较优的电化学性能[15-17]。Bruce等[18]认为层状的P2型NaxMnO2拥有较高的理论比容量,而且价格低廉,相对于NaxCoO2更加有优势。
虽然P2型Na0.5MnO2具有较好的性能,但其电化学性能仍需提高。为了改善其电化学性能,通常在MO2片中加入过渡金属(Fe[19]、Co[20]、Ni[21]等)取代一部分Mn3+来改善NaxMnO2的结构,这样化合物表现出层状相变,不会转变为尖晶石结构,改善材料的循环稳定性, 提高其电化学性能[22-23]。过渡金属层中的活性Ni2+[24, 25]取代可以通过抑制Mn3+ 在高电压(>4 V)下的溶解来稳定层状结构,从而提高整个电池电压。合成温度和保温时间都是影响材料合成的重要因素[26-27]。本研究通过将Ni2+掺入Na0.5MO2化合物中,来提高层状正极材料电化学性能。采用溶胶-凝胶法合成P2型结构正极材料Na0.5Ni0.25Mn0.75O2,并研究该材料的最佳制备条件。该材料做成电池后,在4.2 V的电压下具有稳定的充放电曲线,具有优良的电化学性能。
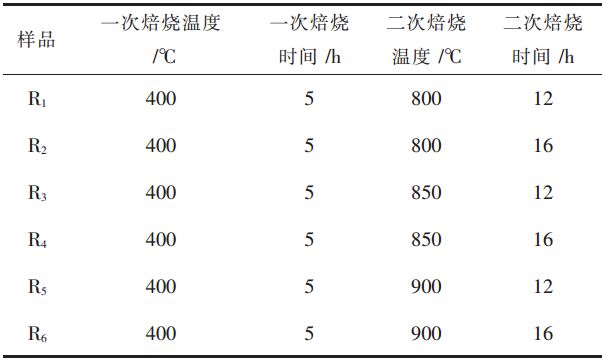
1 实 验 1.1 样品Na0.5Ni0.25Mn0.75O2的制备采用溶胶凝胶法制备Na0.5Ni0.25Mn0.75O2前驱体,将Na2CO3(99.9%),Ni(CH3COO)2·4H2O(99.9%)和Mn(CH3COO)2·4H2O(99.9%)按化学计量比称取,溶解于去离子水中。在快速搅拌过程中将络合剂一水合柠檬酸加入该溶液中,反应过程中将pH值保持在8~9,然后在85 ℃下蒸发浓缩,制得凝胶,最后将凝胶放进120 ℃烘箱中干燥。在空气气氛中加热到400 ℃高温热解5 h,去除样品中的H2O、NH4和CO2, 待马弗炉自然冷却后,再一次研磨样品后放入马弗炉中,在空气气氛下按不同煅烧制度(如表 1所示)合成不同的样品材料。
表 1是样品在400 ℃下高温热解后,转移到马弗炉中,在空气气氛下进行二次焙烧的煅烧制度。合成温度和保温时间都是影响材料合成的重要因素,探索在800、850 ℃和900 ℃温度下,分别保温12 h和16 h,对样品性能的影响。
| 表 1 样品的煅烧制度 Table 1 Calcination system of samples |
 |
| 点击放大 |
1.2 样品Na0.5Ni0.25Mn0.75O2的表征
本实验采用日本理学公司生产的MiniFlex 600型X射线衍射仪(XRD)对样品进行物相分析。其测试管压为40 kV; 管流10 mA, 使用 CuKα射线在2θ为10°~80°的范围内对材料进行测试, 扫描步长0.02°;配备EDS能谱仪的S-4800型扫描电子显微镜(SEM)表征材料的形貌和显微结构。
1.3 样品Na0.5Ni0.25Mn0.75O2的电化学性能测试以样品为活性物质, 以有机物N-甲基吡咯烷酮(NMP)为溶剂, 以乙炔黑(S-P)为导电剂, 以聚偏氟乙烯(PVDF)为粘结剂, 将样品与S-P、PVDF按8:1:1质量比混合, 使用行星式球磨机混合均匀后将浆料涂在铝箔上, 并制成正极片, 然后以钠箔(厚度约0.6 mm)作为负极, 电解液为1 M NaClO6/(EC+PC)(体积比1:1), VMP32340玻璃纤维作为隔膜, 在填充氩气的手套箱(Mbraun MB200G)中组装CR-2032电池, 手套箱内氧气和水份含量控制在0.0001‰以下。在室温下, 使用Land系统对电池进行进行循环伏安测试(CV), 工作电压范围在1.5~4.2 V(vsNa+/Na), 扫描速率为0.1 mV/s。相同条件下, 以0.1 C的电流进行恒电流充放电测试和循环性能测试。
2 结果与讨论 2.1 不同煅烧制度对材料结构的影响不同煅烧制度下样品的XRD图谱如图 1所示。可以看出, 制备的材料具有层状P2型的结构, 对应于标准卡片(PDF#54-0894)。合成的Na0.5Ni0.25Mn0.75O2材料, 空间群为P63/mmc 。合成的Na0.5Ni0.25Mn0.75O2材料吸收峰越尖锐, 峰强度越大, 材料结晶性能和结构稳定性越好, 更有利于材料的电化学性能。通过X射线衍射未检测出碳的衍射峰, 表明柠檬酸在热分解后形成的是无定形碳, 而且碳的存在未影响Na0.5Ni0.25Mn0.75O2晶体结构的完整性。保温时间保持在12 h, 在800~900 ℃温度范围, 随着温度升高, 样品的衍射峰逐渐增强, 而且峰形更尖锐, 这是由于温度升高更有益于晶核的形成, 结晶也越来越完善。而R1(800 ℃, 12 h)样品在2θ=12.611°处出现一个杂相的衍射峰, 随着温度升高, 该相消失, 所以Na0.5Ni0.25Mn0.75O2的合成温度不宜过低。当保温时间延长到16 h, 在800~900 ℃温度范围, 随着温度升高, 材料的衍射峰逐渐增强, 峰越来越尖锐, 这说明延长保温时间有利于材料的结晶和晶粒生长。而R2(800 ℃, 16 h)样品在2θ=12.611°处有一个杂峰, R4样品在2θ=38°和46°处出现衍射峰, 表明层状的P3型相出现。随着煅烧温度达到900 ℃, 煅烧时间达到16 h后, 获得的XRD图表明没有任何其他不纯的第二相。此外, 在2θ=38°, 46°, 53°和58°处未观察到衍射峰, 表明没有层状的P3型相出现。这是因为Na0.5Ni0.25Mn0.75O2中的Na/Mn比低(Na/Mn<1), 形成P2型相的高温煅烧(>850 ℃)有助于实现高的电化学性能。因此, 随着温度升高, 时间的延长, 表明材料的衍射峰逐渐增强, 峰越来越尖锐均能使材料的晶型更加完善, 晶体结构趋于完整, 高温下保温时间的增加可以促进材料晶体的生长。
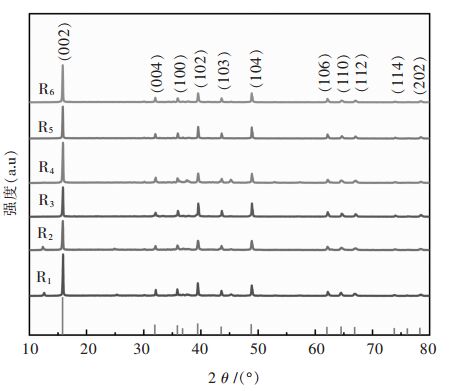 |
| 图 1 不同煅烧制度下Na0.5Ni0.25Mn0.75O2样品的XRD谱 Fig. 1 XRD Charts of Na0.5Ni0.25Mn0.75O2 samples under different calcination systems |
2.2 形貌分析
不同煅烧制度下制备的样品形貌如图 2所示。从图中可以发现, 煅烧温度对材料微观形貌影响很大:当温度较低时, 样品的形貌不规则, 而且颗粒尺寸小, 不均匀, 容易发生团聚, 材料结晶和生长条件受到限制, 结晶不完全。随着温度的不断升高, 颗粒尺寸逐渐变得均匀, 材料的形貌越来越规整。当煅烧温度为800 ℃时, 合成时间为12 h时, 样品的形貌不规则延长保温时间对样品结晶度没有影响, 这可能是因为煅烧温度不够高, 样品结晶不完全造成的。当煅烧温度提高到850 ℃时, 样品团聚严重。保温时间增加到16 h时, 样品的颗粒变大, 并且团聚更多, 这可能是烧结温度不够, 结晶不完全, 烧结时间延长, 样品晶粒过分生长造成的。材料的颗粒尺寸对材料的电化学性能发挥起到很大的作用, 因为离子在脱嵌过程中与Na+和电子的迁移相关, 颗粒尺寸较大不便于电解液往电极内部渗透, 使得Na+在充放电循环中的扩散路径延长, 从而使得Na+迁移受到阻碍。当煅烧温度为900 ℃, 保温时间为12 h时的SEM图显示样品的粒径均匀, 可以观察到片束状形态, 片状尺寸在4 μm范围内。随着保温时间延长到16 h, 样品的颗粒变大, 晶体结构趋于完整, 晶粒表面光滑, 便于材料与电解液充分接触, 利于钠离子在充放电过程中Na+的嵌入/脱出, 高温下保温时间的增加可以促进材料晶体的生长。
 |
| 图 2 不同煅烧制度下Na0.5Ni0.25Mn0.75O2样品的SEM像 Fig. 2 SEM diagrams of Na0.5Ni0.25Mn0.75O2 samples under different calcination systems |
2.3 电化学性能分析
图 3是在1.5~4.5 V(vsNa+/Na)扫描速率为0.1 mV/s条件下, 进行循环伏安测试。可以看出, 六种产品前两个周期的曲线基本相似, 在800 ℃(R1、R2)合成的样品, 氧化还原峰的数目比800 ℃以上(R3、R4、R5、R6)合成的样品少, 相应的峰面积小, 比容量不高, 这是由于煅烧温度不够高, 样品结晶不完全造成的。在900 ℃(R5、R6)合成的样品, 峰面积最大, 说明该产品的比容量最高。图上出现的四对氧化还原峰源自于充放电过程中的复杂相变。首次扫描时, 在4.22/3.99 V处观察到高电压可逆氧化还原峰, 对应于P2/O2相变, 而在3.43/3.35 V, 3.73/3.63 V处的两个氧化还原峰归因于Ni2+/3+、Ni3+/4+的氧化还原过程;在2.15/1.93 V处的氧化还原峰与Mn3+/4+的氧化和Mn4+/3+的还原相关。
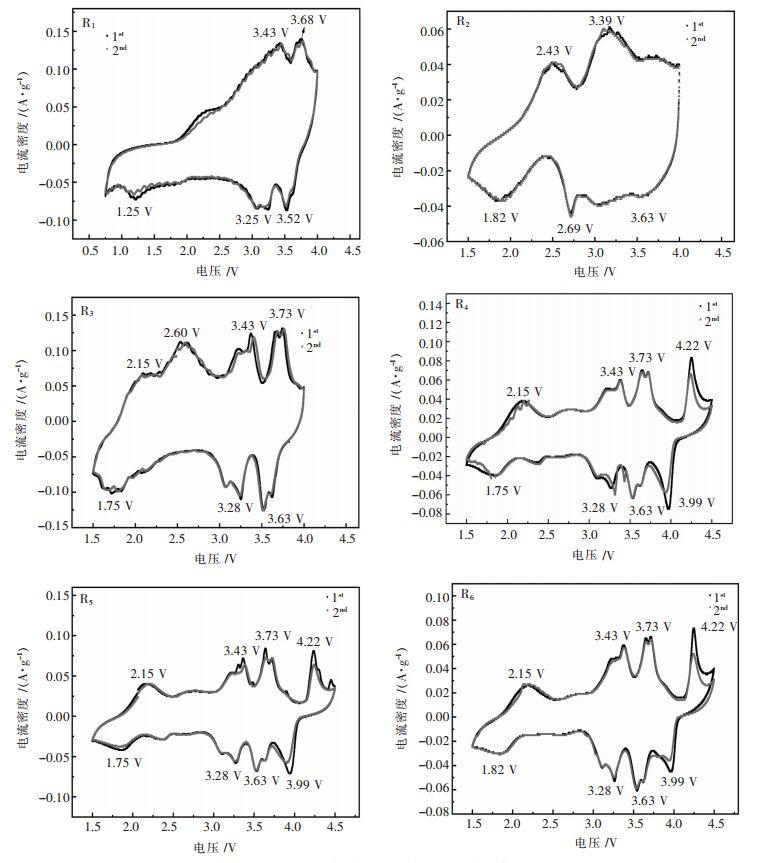 |
| 图 3 不同煅烧温度下的样品的循环伏安 Fig. 3 Cyclic voltammetry of samples at different calcination temperatures |
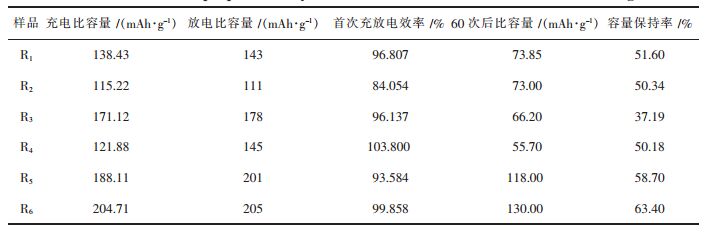
表 2列出了不同煅烧制度下合成材料的电化学性能, 不同的样品的充电比容量、放电比容量、首次充放电效率、循环60次后的比容量及其容量保持率。由R1和R3 和R5, R2和R4和R6 分别进行对比。可以看出, 提高烧结温度, 延长保温时间, 充电比容量和放电比容都有所提升, 这是因为随着温度的不断升高, 颗粒尺寸逐渐变得均匀, 材料的形貌越来越规整。高温下保温时间的增加可以促进材料晶体的生长。但是循环性能随着温度和时间的改变, 变化不明显。
| 表 2 不同煅烧制度下合成材料的电化学性质 Table 2 Electrochemical properties of synthetic materials under different calcination regimes |
 |
| 点击放大 |
图 4是前驱体在不同煅烧温度和不同保温时间条件下合成的Na0.5Ni0.25Mn0.75O2, 以0.1 C电流在室温下, 在1.5~4.2 V(vs Na+/Na)电压范围内的首次充放电曲线。充放电曲线中的两个平台区域对应Mn3+/4+, Ni2+/4+氧化还原过程。这些充放电平台的位置与图 3中的峰位置相对应。可以看出, 在900 ℃以下合成的样品首次充放电比容量都在200 mAh/g 以下。在900 ℃, 保温时间为12 h和16 h, 材料的首次放电比容量达到201 mAh/g和205 mAh/g, 首次充放电效率达到93.584%、99.858%, 首次不可逆容量是由于材料表面形成了SEI膜, 消耗了钠离子。
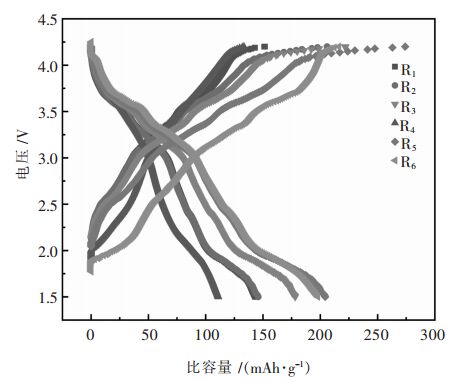 |
| 图 4 不同煅烧制度下样品的充放电性能 Fig. 4 Ectrochemical properties of samples with different calcination systems |
图 5是前驱体在不同煅烧温度和不同保温时间条件下合成的Na0.5Ni0.25Mn0.75O2, 以0.1 C电流在室温下, 在1.5~4.2 V(vs Na+/Na)电压范围内的循环性能曲线。在0.1 C电流下循环60次比容量还能保持118 mAh/g和130 mAh/g, 容量保持率为58.7%和63.4%。这与图 3的循环伏安曲线相吻合。
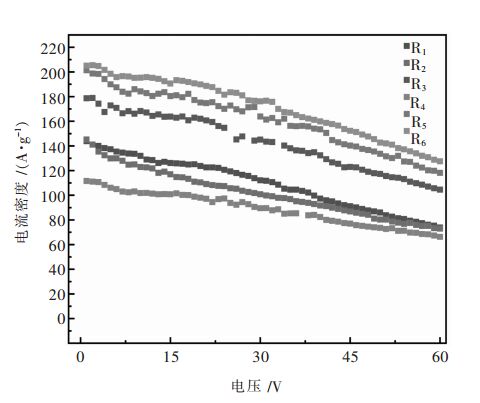 |
| 图 5 不同煅烧制度下样品的循环性能 Fig. 5 Cyclic properties of samples with different calcination systems |
3 结 论
1)通过溶胶凝胶法合成具有六方层状P2型结构的Na0.5Ni0.25Mn0.75O2正极材料。
2)当煅烧温度达到900 ℃, 煅烧时间达到16 h后, 获得的XRD图清楚地显示出样品地高度结晶性, 样品的粒径比较均匀, 可以观察到片束状形态, 晶粒表面光滑。
3)适宜的煅烧时间可以保证材料充分生长接触, 反应并且减少杂相的生成, 从而提高材料的电化学性能。
4)在0.1 C, 1.5~4.2V的电压范围内充放电测试, 具有非常平滑的充放电曲线, 并且具有非常高的放电容量205 mAh/g和良好的容量保持率。
| [1] |
GOODENOUGH J B, KIM Y, et al. Challenges for rechargeable Li batteries[J].
Chemistry of Materials, 2010, 22(3): 587–603. DOI: 10.1021/cm901452z. |
| [2] |
ARMAND M, TARASCON J M, et al. Building better batteries[J].
Nature, 2008, 451(7179): 652–657. DOI: 10.1038/451652a. |
| [3] |
李慧, 吴川, 吴锋, 等. 钠离子电池:储能电池的一种新选择[J].
化学学报, 2014, 72(1): 21–29.
|
| [4] |
HOU H, GAN B, GONG Y, et al. P2-Type Na0.67Ni0.23Mg0.1Mn0.67O2 as a high-performance cathode for a sodium-ion battery[J].
Inorganic Chemistry, 2016, 55(17): 9033. DOI: 10.1021/acs.inorgchem.6b01515. |
| [5] |
YUAN D, HU X, QIAN J, et al. P2-type Na0.67Mn0.65Fe0.2Ni0.15O2 cathode material with high-capacity for sodium-ion battery[J].
Electrochimica Acta, 2014, 116: 300–305. DOI: 10.1016/j.electacta.2013.10.211. |
| [6] |
LI Z, GAO R, SUN L, et al. Designing an advanced P2-Na0.67Mn0.65Ni0.2Co0.15O2 layered cathode material for Na-ion batteries[J].
Journal of Materials Chemistry A, 2015, 3(31): 16272–16278. DOI: 10.1039/C5TA02450A. |
| [7] |
SAUVAGE F, LAFFONT L, TARASCON J M, et al. Study of the insertion/deinsertion mechanism of sodium into Na0.44MnO2[J].
Inorganic Chemistry, 2010, 38(28): 142–146. |
| [8] |
马小玲, 谭宏斌. 钠离子电池锰酸钠系正极材料的研究进展[J].
电源技术, 2019(3): 507–510.
|
| [9] |
方永进, 陈重学, 艾新平, 等. 钠离子电池正极材料研究进展[J].
物理化学学报, 2017, 33(1): 211–241.
|
| [10] |
LIU H, XU J, MA C, MENG Y S. Initio Study of the sodium intercalation and intermediate phases in Na0.44MnO2 for sodium-ion battery[J].
Chemistry of Materials, 2012, 24(6): 1205–1211. DOI: 10.1021/cm300065y. |
| [11] |
WANG Y, LIU J, LEE B, et al. Ti-substituted tunnel-type Na0.44MnO2 oxide as a negative electrode for aqueous sodium-ion batteries[J].
Nature Communications, 2015, 6(12): 6401. |
| [12] |
SAINT J A, DOEFF M M, WILCOX J, et al. Electrode Materials with the Na0.44MnO2 Structure: Effect of Titanium substitution on physical and electrochemical properties[J].
Chemistry of Materials, 2008, 20(10): 3304–3310. |
| [13] |
WANG D, CHEN N, LI M, et al. Na3V2(PO4)3/C composite as the intercalation-type anode material for sodium-ion batteries with superior rate capability and long-cycle life[J].
Journal of Materials Chemistry A, 2015, 3(11): 550–554. |
| [14] |
BUCHER N, HARTUNG S, NAGASUBRAMANIAN A, et al. Layered NaxMnO2+z in sodium ion batteries-influence of morphology on cycle performance[J].
ACS Applied Materials & Interfaces, 2014, 6(11): 8059. |
| [15] |
BUCHER N, HARTUNG S, FRANKLIN J B, et al. P2-NaxCoyMn1-yO2 (y=0, 0.1) as cathode materials in sodium-ion batteries-effects of doping and morphology to enhance cycling stability[J].
Chemistry of Materials, 2016: acs.chemmater.5b04557. |
| [16] |
DOUBAJI S, MA L, ASFAW H D, et al. On the P2-NaxCo1-y(Mn2/3Ni1/3)yO2 cathode materials for sodium-ion batteries: synthesis, electrochemical performance, and redox processes occurring during the electrochemical cycling[J].
ACS Applied Materials & Interfaces, 2018, 10(1): 488. |
| [17] |
SU D, WANG C, AHN H, WANG G. Single crystalline Na0.7MnO2nanoplates as cathode materials for sodium-ion batteries with enhanced performance[J].
Chem. Eur. J., 2013, 20(19): 10884–10889. |
| [18] |
张斌, 王晓艳, 张廷, 等. 熔盐法合成Na2/3Ni1/3Mn2/3O2@C钠离子电池正极材料及其电化学性能[J].
材料科学与工程学报, 2018, 36(4): 554–559.
|
| [19] |
ZHU Q, WANG M, NAN B, et al. Core/shell nanostructured Na3V2(PO4)3/C/TiO2 composite nanofibers as a stable anode for sodium-ion batteries[J].
Journal of Power Sources, 2017, 362: 147–159. DOI: 10.1016/j.jpowsour.2017.07.004. |
| [20] |
XIANG X, ZHANG F, LI W, et al. Nanocrystal‐assembled porous Na3MgTi(PO4)3 aggregates as highly stable anode for aqueous sodium‐ion batteries[J].
Chemistry-A European Journal, 2017, 23(52): 12944. DOI: 10.1002/chem.201703044. |
| [21] |
王强. NASICON型Na3V2(PO4)3正极材料的研究及改性[D].赣州:江西理工大学,2018.
|
| [22] |
秦牡兰, 刘万民, 张志成, 等. 钠离子电池正极材料VO2(B)纳米带阵列的可控合成与电化学性能[J].
中国有色金属学报, 2018, 28(6): 1151–1158.
|
| [23] |
史文静, 燕永旺, 徐守冬, 等. 钠离子电池正极材料Na0.44MnO2的研究进展[J].
化工进展, 2017, 36(9): 3343–3352.
|
| [24] |
庄林. 基于P2-Na0.7CoO2微球的高性能钠离子电池正极材料[J].
物理化学学报, 2017, 33(7): 1271–1272.
|
| [25] |
SINGH G, ACEBEDO B, CABANAS M, et al. An approach to overcome first cycle irreversible capacity in P2-Na2/3[Fe1/2Mn1/2]O2[J].
Electrochemistry Communications, 2013, 37: 61–63. DOI: 10.1016/j.elecom.2013.10.008. |
| [26] |
DING J, ZHOU Y, SUN Q, et al. Electrochemical properties of P2-phase Na0.74CoO2 compounds as cathode material for rechargeable sodium-ion batteries[J].
Electrochimica Acta, 2013, 87: 388–393. DOI: 10.1016/j.electacta.2012.09.058. |
| [27] |
BHIDDE A, HARIHARAN K. Physicochemical properties of NaxCoO2 asacathodefor solid state sodium battery[J].
Solid State Ionics, 2011, 192: 360–363. DOI: 10.1016/j.ssi.2010.04.022. |
 2020, Vol. 11
2020, Vol. 11


