| 硫铁矿在废水处理中的研究现状 |
2. 江西省矿业工程重点实验室,江西 赣州 341000
2. Jiangxi Key Laboratory of Mining Engineering, Ganzhou 341000, China
水污染严重危害生态系统,造成巨大的经济损失,甚至威胁人类身体健康。由于水中污染物成分复杂,导致处理其所需的材料不尽相同。20世纪90年代初,首次提出“环境材料”的概念[1]。“环境材料”是指消耗的资源尽可能少,对生态造成的不良影响尽可能小,可再生、循环或降解的材料,不仅具有优良的使用性能,还具有净化和修复环境的能力。保水材料、吸附材料等是常见的环境材料,其中保水材料较多用于土壤中。目前应用最广泛的水环境材料是吸附剂[2-3],有无机[4-5]、有机[6-8]和复合吸附剂[9]3种。无机吸附成本低,对环境无污染,但存在吸附效率不高,循环使用能力差等缺点;而有机吸附剂的反应通常比较复杂,且易造成二次污染;复合吸附剂大多制备复杂,成本较高,吸附性能不稳定。因此,绿色高效的水处理材料成为环保研究者和企业研究的热点。
金属矿物被认为是一类资源丰富、价格低廉的环境友好型材料,很多本来就为尾矿,其中硫铁矿最具有代表性。近年,国内外众多研究者对硫铁矿与水中污染物质作用机理进行探索,发现其实质是化学吸附作用,即硫铁矿的表面功能基(羟基化功能基、Lewis酸位和Bronsted酸位等)可与污染物分子或离子发生表面配位和离子交换等作用。在吸附过程中,污染物分子或离子被氧化、还原、分解或沉淀等,从而达到去除或降低废水中有害分子或离子的含量或毒性,起到净化水体的作用[10]。
基于硫铁矿的优良特性,将硫铁矿和水污染治理相结合,既治理了水污染,又合理利用了矿物资源,是对水资源和矿物资源的双重保护和利用,具有重要的意义。文中系统阐述了黄铁矿和磁黄铁矿的来源、晶体结构以及在废水处理中的反应机理。
1 硫铁矿黄铁矿和磁黄铁矿是主要的硫铁矿,常存在于热液矿床中,易被氧化分解,且在一定的水介质条件下表现出一定的溶解度。另外,其具有较高的化学活性,常常发生氧化还原和沉淀转化作用,可以用来处理含多种污染物的工业废水。
1.1 黄铁矿黄铁矿是地球上最丰富的矿物之一[11],常呈浅铜黄色, 金属光泽, 无解理, 参差状断口, 硬度较大,是一种半导体矿物,具有热电性。主要成分为FeS2,具有氯化钠型即立方晶体结构,属于等轴晶系[12-14],晶体结构见图 1所示。黄铁矿的晶体稳定性好,反应活性低,通过制备纳米黄铁矿,增加悬空未配位键和点缺陷,增大比表面积,提高反应活性。由于黄铁矿中的Fe和S都可以提供电子,因此具有很好的还原特性,黄铁矿中的Fe可以和水中的OH-反应生成Fe(OH)3和污染物发生强的络合作用。
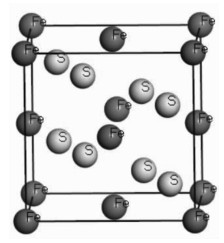 |
| 图 1 黄铁矿的单胞模型 Fig. 1 Cell of pyrites |
1.2 磁黄铁矿
磁黄铁矿通常在尾矿中广泛存在,呈黄白色、黄褐色,他形浸染状,粒径较小,有镍黄铁矿、黄铁矿、黄铜矿等多种矿物与之共生,通式为Fe(1-x)S,其中x从0(FeS)到0.125(Fe7S8)发生变化。根据铁原子亏损数不同,主要有2种同质多象变体:六方、单斜。Fe7S8的原子最亏空,属于单斜磁黄铁矿[12],见图 2。晶体结构中的空缺点降低了磁黄铁矿的对称性,从而有更高的活性[15]。另外,磁黄铁矿因为本身的性质,比如弱磁性和高氧化还原电位,成为近年来热门的吸附剂。利用磁黄铁矿的等电点,可以为污染物的去除提供依据。磁黄铁矿在水溶液中会形成铁氧化物和羟基氧化铁,利用配位体交换吸附污染物。
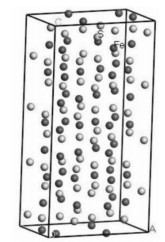 |
| 图 2 单斜磁黄铁矿的单胞模型 Fig. 2 Cell of monoclinic pyrrhotite |
2 硫铁矿在废水处理中的应用
废水中有多种污染物质,主要有重金属离子、放射性元素、非金属无机毒物、营养元素、各种有机物和微生物[16]。下面分别分析了几种污染物质的来源与危害并对硫铁矿处理上述几种废水的研究现状进行了综述。
2.1 重金属汞、铅、铜、铬、镉等重金属具有高毒性,可以与蛋白质、核酸及其代谢产物相结合,且能通过食物链在生物体内富集,从而对人类和生态系统造成一定的危害[17-18]。
六价铬极易被人体吸收,不仅会使皮肤过敏,还有致癌的风险,对水生生物有持久性的危害[19-21]。影响黄铁矿去除六价铬的因素众多,其中最主要的因素是溶液pH。pH影响黄铁矿和反应产物的沉淀和溶解,当pH < 7时,黄铁矿作氧化剂,将六价铬还原为三价铬,其反应为:
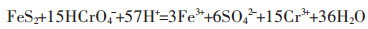
|
(1) |
但是随着H+的消耗,pH升高,Fe3+和OH-生成氢氧化铁沉淀,覆盖在黄铁矿表面,阻碍了黄铁矿与六价铬的进一步反应。另外,溶液pH改变黄铁矿的表面性质,进而影响六价铬在黄铁矿表面的吸附。
Kantar等[22]研究了pH值和pH缓冲液对黄铁矿催化还原Cr6+的影响。实验表明,在酸性条件下,有机缓冲液(3-(N-吗啉基)丙磺酸)比无机缓冲液(碳酸氢盐)去除效果更好,而在碱性条件下,无机缓冲液比有机缓冲液去除效果更好。因为在酸性条件下,有机酸可以和黄铁矿表面的Fe(OH)3反应,使黄铁矿表面暴露出来,继续和六价铬反应。而在碱性条件下,有机缓冲液和黄铁矿表面反应生成配合物,黄铁矿表面带负电荷,CrO42-和负电荷之间存在静电斥力,阻碍了黄铁矿和六价铬的反应。
镉(Cd)主要积累在肾脏和骨骼中,可导致贫血、代谢不正常及高血压等慢性疾病[23-24]。崔晋艳等[25]用天然黄铁矿和经过机械球磨的黄铁矿去除水中的Cd2+,Cr6+和Pb2+,发现在相同的反应条件下, 天然黄铁矿和Cd2+几乎不反应,与Cr6+、Pb2+的反应程度也较小。而通过机械球磨后的黄铁矿对Cr6+、Cd2+和Pb2+的去除率都达到了99. 69%以上,并且处理后的3种金属含量都低于综合排放标准。因为机械球磨减小了黄铁矿的粒径,比表面积和表面的活性位点都大大增加,从而提高了黄铁矿的反应活性。胶状黄铁矿是黄铁矿与石炭纪地层同沉积,在开放环境下快速沉淀的产物,或由海底喷流经过沉积作用形成,是纳米粒级的黄铁矿,巨大的比表面积导致胶状黄铁矿比普通黄铁矿的化学活性更高。朱宇珂等[26]利用热分解技术,将胶状黄铁矿置于氮气氛围下,使之完全分解成多孔结构的产物,经检测,分解产物是单斜磁黄铁矿。在弱酸无氧条件下,该多孔磁黄铁矿可以去除95%以上的Cd2+,机理主要是微溶于水的多孔磁黄铁矿与Cd2+反应生成CdS沉淀,而多孔磁黄铁矿与Cd2+发生络合作用、氧化形成铁氢氧化物是次要作用。
金属加工、电镀工厂等会产生含铜废水,这种废水会抑制水的自净作用,甚至会影响饮用。如果生物体摄入的铜过高就会发生呕吐、腹泻、乏力等症状,还会对肾脏和胃造成损伤[27]。Guo等[28]在探究黄铁矿和氰化铜溶液中的铜离子相互作用的过程中,发现Cu(Ⅰ)可以进入黄铁矿的晶格中,高氧化电位时,在氰化铜溶液中形成了一种类似CuS的硫化物,但是在高还原电位时,则形成一种类似Cu2S的硫化物,与此同时,在黄铁矿表面还会形成类似FeS的物质。另外,在高的CN/Cu时,黄铁矿表面的一价铜硫化物被氰化物溶解,会严重降低铜的去除率。
无机汞中的升汞(氯化汞)是剧毒物质;有机汞中的甲基汞是亲脂性毒物,进入人体很容易被吸收,而且不容易被降解和转化,会使中枢神经系统紊乱[29-31]。Duan等[32]用氯化铁和硫氢化钠为原料合成黄铁矿,并通过微波辐射法制得纳米级黄铁矿。利用自制的纳米级黄铁矿,在5 min内,Hg2+的脱除率达90%,12 h后则彻底脱除Hg2+。其吸附机理包括2步:
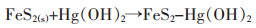
|
(2) |
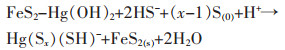
|
(3) |
根据前人的研究,利用硫铁矿处理重金属的方法包括用天然矿物进行处理,用制备成的纳米粒级的矿物颗粒进行处理,用改性后的矿物进行处理。纳米粒径可以增加矿物比表面积和表面的活性位点,改性可以改变矿物表面结构或性质,如变成多孔结构,进而提高矿物的表面活性。前人的研究中利用硫铁矿对铅、锌、锡、镍等重金属的处理报道较少,未来也可借鉴上述方法进行探索和研究。
2.2 放射性元素由于核能相对于化石燃料来说是清洁且高效的能源,所以核能的发展趋势很好,但会产生放射性废物,具有放射线,会对土壤和水体造成危害,并最终威胁人类健康,所以应该谨慎处理[33]。
铼和锝都属于第Ⅶ B族,因此两者具备相似的化学性质,但是铼相比锝的化学标准电极更小,因此更难进行还原反应,而且铼没有放射性,所以可以选择铼作为锝的替代元素。李宁等[34]在天然磁黄铁矿去除地下水中的高锝酸根离子的实验中,利用高铼酸根离子代替高锝酸根离子,模拟锝的化学行为,发现去除率与反应时间、磁黄铁矿投加量和体系温度成正比,与pH成反比。当反应温度为25 ℃,反应8 d后,去除率不到10%,而温度升高到80 ℃时,反应7 d后,铼的去除率达到98.31%;在相同条件下,100 g/L的磁黄铁矿投加量比25 g/L的去除率提高20%;当pH=1.02时,10 h去除率就能达到93.33%,24 h内就能达到99.69%,而pH值为3.00~8.50时,去除率变化不大,在80天时才能达到90%的去除率。
铀(U)也是一种放射性元素,在水溶液中具有很高的溶解度,这严重影响了铀在水下环境中的反应性和迁移率。Liu等[35]进行了黄铁矿和磁黄铁矿去除U(Ⅵ)的对比实验,发现在pH < 4时,磁黄铁矿和黄铁矿在去除U(Ⅵ)的过程中产生外表面络合物SOHUO22+,表明pH < 4时以外层表面络合作用为主。在中性和碱性条件下,磁黄铁矿和黄铁矿在去除U(Ⅵ)的过程中产生内层表面络合物SOUO2+和SOUO2(OH)2NO32-,表明pH > 5时以内层表面络合作用为主。
铕Eu(Ⅲ)的空轨道可以接受孤对电子,与遗传物质反应,从而破坏遗传物质的结构。Zhu等[36]在氮气保护下,923 K焙烧黄铁矿1.5 h合成了单斜磁黄铁矿,利用间歇实验研究了合成磁黄铁矿对Eu(Ⅲ)的吸附行为。结果表明在酸性到中性条件下,合成磁黄铁矿对Eu(Ⅲ)的吸附量与pH值成正比,pH为2时,吸附量仅20%,当pH增加至7时,吸附量达到100%。在中性和碱性条件下,Eu(Ⅲ)和含硫官能团成键,且不受离子强度影响,说明合成磁黄铁矿对Eu(Ⅲ)的吸附机理为内层表面络合作用。
表面络合作用在硫铁矿处理放射性污染物中起主要作用,增加离子强度可能会促进Fe和S与放射性污染物之间的反应速度。对于放射性污染物,选择性质相同的无放射性污染物进行研究,是确保研究者安全的有效方法。
2.3 非金属无机毒物硒可以被用作生产光敏材料和催化剂,是动植物生长所需的营养元素,但是过度摄入会引发皮肤病和心肌病等。刘宏芳等[37]利用湿法球磨制备的黄铁矿去除Se(Ⅳ),去除效率可达95%,大多数变成了Se(0),去除的机理以氧化还原反应和吸附反应为主,另外,经过湿法球磨的黄铁矿粒径更小,比表面积更大,也加快了反应速度。Ma等[38]研究了天然磁黄铁矿在pH为4.0~5.5的条件下对Se(Ⅳ)的还原固定。发现在pH为4.0~5.0的条件下,随pH值的增加,反应速率降低。在pH为5.0和6.0时,反应速率随反应时间的增加而增加。在强酸条件下,酸溶的硫化物主导该反应,而弱酸条件下,吸附在天然磁黄铁矿表面的二价铁离子主导该反应。
三价砷化合物是所有砷化合物中毒性最强的,也是较难去除的一种污染物,长期饮用砷浓度超标的地下水,可导致中毒,引发皮肤病甚至癌症[39]。史亚丹等[40]将黄铁矿置于氮气下,高温焙烧,合成了多孔结构的单斜磁黄铁矿,并用其处理含三价砷的废水。发现600 ℃时,单斜磁黄铁矿含量达到最大,此时去除率可达98%,当温度继续升高,去除率逐渐降低,说明亏空的Fe越多,活性越大。在有氧水溶液中,合成的单斜磁黄铁矿表面会发生氧化,其中的二价铁被氧化成三价铁,形成新的铁氢氧化物有利于三价砷的吸附,因此该方法适合在有氧条件下进行。三价砷容易被氧化为五价砷,因此除砷的对象也应该包括五价砷。刘卓等[41]研究了天然磁黄铁矿对五价砷的去除机理,是自发吸热的H2AsO4-取代矿物上S2-的配位离子交换反应,体系中如果有PO43-、SiO32-、CO32-存在时,会和H2AsO4-发生竞争关系,导致砷的去除效果显著降低,另外,磁黄铁矿的Fe-S键断裂,形成新的Fe-O-As键,说明砷是以化学吸附的方式吸附在磁黄铁矿上。pH为3.83时,有最高的去除率。因为pH很小时,H2AsO4-会和H+反应变成电中性的H3AsO4,而且磁黄铁矿会溶解,这不利于五价砷的吸附;在pH为3.83左右,磁黄铁矿带正电,不会溶解,有利于对五价砷的吸附,在pH为3.83时,吸附率最高;当pH超过3.83后,磁黄铁矿表面带负电,由于静电相斥作用,吸附能力开始下降。
目前研究硫铁矿去除非金属无机毒物一般是通过氧化还原将有毒的离子转变成低毒或者无毒的离子,或者将有毒的离子吸附在矿物表面,不同的pH条件下,黄铁矿发挥的作用各不相同,一是和非金属无机毒物形成共价键,进行化学吸附,二是溶解的硫化矿物起作用。
2.4 营养元素富营养化污染是指由于人类的活动,湖泊、河流等缓流水体,接纳了大量生物所需的氮、磷、有机碳等营养物质,使得藻类和浮游生物迅速繁殖,导致水中溶解氧急剧下降,鱼类和其他生物大量死亡的现象[42-44]。
Li等[45]利用天然磁黄铁矿去除废水中的磷,发现在pH为3.5~12的范围内,去除率可达90%以上。磷在黄铁矿的吸附符合朗格缪尔吸附等温线和二级动力学,吸附机理为化学吸附,通过化学吸附破坏磁黄铁矿颗粒表面的Fe-S键,形成一种新的Fe-O-P键。
Yang等[46]采用天然黄铁矿煅烧制备的纳米结构磁黄铁矿作为磁黄铁矿自养反硝化生物滤池(PADBs)的生物膜基质,可以缩短水力停留时间,减少污泥产生量,扩大工业应用的可能。处理含N浓度为(13.81±1.52)mg/L,P浓度为(2.44±0.05)mg/L的污水,在536 d的试验中,水力停留时间(HRT)从7.2 h逐渐降低到0.6 h。水力停留时间(HRT)为1.2 h时,处理实际二级出水的N平均浓度为(0.05±0.01)mg/L,P平均浓度为(0.03±0.01)mg/L。其中,N是通过自养反硝化去除,反应见式(4)~式(5)。P主要通过生成FePO4(s)沉淀去除,反应方程见式(6)~式(7)。
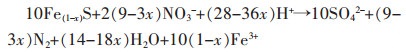
|
(4) |
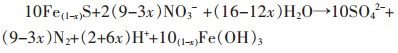
|
(5) |
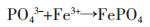
|
(6) |
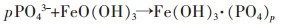
|
(7) |
生活和工农业都是造成富营养化污染的原因,但是目前利用硫铁矿去除营养物质的研究并不多,未来可和已成熟的方法联用,如活性污泥法、生物膜法等,这可成为日后研究的一个方向。
2.5 有机物存在于水体中的需氧性有机物虽然没有直接的毒性,但是会自发地进行生物降解,其结果和富营养化污染一样,会消耗水中的溶解氧,当水中的需氧性有机物超过一定量时,就会使水质恶化;易分解有机毒物、持续性有机污染物等毒物会对生物和人体产生急性、亚急性、慢性、潜在性等几种毒性。
磷酸三氯乙酯(TCEP)是被广泛用于阻燃剂和添加剂,具有致癌性、神经毒性、致突变性和遗传毒性,浓度过高时,还会导致癫痫和记忆受损。2017年,TCEP被WHO(世界卫生7组织)的癌症研究机构列入了致癌物质的名单。Lian等[47]在黄铁矿活化过硫酸盐降解TCEP的实验中,发现该方法几乎可以将TCEP完全降解。黄铁矿有两个作用,作用一是向系统中引入Fe2+,产生SO4-·和·OH起氧化作用,经过120 min,可以完成接近100%的TCEP降解率;作用二是酸化作用,使得该方法在较宽的pH范围内都适用。
硫化矿物浮选中应用很广泛的捕收剂除了黄药和黑药类,还有硫氮类,但是其毒性高、生物降解困难,如果不加以处理,将造成严重的环境问题。CHEN等[48]在研究黄铁矿活化过硫酸盐降解乙硫氮的间歇实验中,发现了和Lian类似的去除机理。另外,发现Mn2+、Cu2+、CO32-、PO43-和HCO3-的存在对乙硫氮的降解具有显著的抑制作用, 依次为:PO43- > HCO3- > CO32- > Mn2+ > Cu2+。其机理可解释为:CO32-、HCO3-和PO43-通过水解增加溶液pH,抑制SO4-·的生成。Mn2+和Cu2+也会和SO4-·结合,从而抑制乙硫氮的降解。WU等[49]研究了乙硫氮在磁黄铁矿/过硫酸盐体系中的降解机理,除了硫离子的还原外,乙胺还可以促进Fe3+向Fe2+转化,Fe2+的顺利释放使得乙硫氮具有更好的矿化能力。
零价铁是一种常用的还原剂,已成功地应用于修复受各种污染物污染的地下水,但在反应介质中仍存在表面钝化和pH升高的问题。硝基苯具有急性毒性、致突变性、生殖毒性,而且在水中很稳定,被世界卫生组织国际癌症研究机构列在2B类致癌物清单中。Lü等[50]在黄铁矿和零价铁联合去除硝基苯的实验中,发现黄铁矿和零价铁对硝基苯的去除有协同作用,可以显著提高零价铁和硝基苯的反应速度,扩大体系的pH适用范围。机理研究表明,黄铁矿可以抑制反应介质中pH的升高,促进Fe2+的再生,活化零价铁表面。
在有机物的去除中,有很多利用硫铁矿活化过硫酸盐,产生SO4-·和·OH起氧化作用,还有其他一些方法,都是利用了硫铁矿协同其他物质处理有机物,因此未来可以将硫铁矿和已知的去除有机物的方法结合,提高有机物的去除率。
2.6 微生物水中的微生物有细菌、病毒和真菌等,会严重影响水质,危害人类和动物的健康。Xia等[51]探究了天然磁黄铁矿活化过硫酸盐对水中的大肠杆菌的氧化去除机理。由于有氧条件产生了更多活性氧簇(ROS),因此有氧条件比厌氧条件更有利于细胞失活。根据阳性清除试验和原位ROS测定,不同ROS导致细胞失活的顺序为SO4-· > ·OH > H2O2。原位表征表明,过硫酸盐与天然磁黄铁矿表面的有效结合很可能形成电荷转移复合物,进而产生ROS并使大肠杆菌氧化。
利用含硫化矿物解决微生物污染的研究也不多,主要就是利用硫铁矿和其他氧化剂,氧化微生物,使细胞失活,可以将微生物技术和硫铁矿相结合,共同降解水中的微生物。
3 问题与展望经过处理的污水可以进行回用,用作工业上的工艺用水、冷却用水、洗涤用水、锅炉用水,或者用作农、林、牧、渔业用水等。处理污水失活的硫铁矿既可以重新用于铺路、筑尾矿坝、填露天采场,又可以用于覆土造田和井下回填。与目前工业中的其他环境材料相比,利用硫铁矿处理污水具有无二次污染,可综合利用,成本较低等优点,但是也存在着天然硫铁矿比表面积小,反应活性不高,pH对处理的影响较大,工业应用少,工艺尚未成熟等问题。因此,全面应用于工业生产,广泛处理环境问题,还有以下方面可以改善:
1)离子强度可能会增加矿物与污染物之间的反应速度,或者与污染物产生竞争吸附,因此控制离子强度和去除顺序是有必要的;
2)高温煅烧黄铁矿得到原子更亏空的磁黄铁矿,高效、低成本制备纳米级硫铁矿,可以增大硫铁矿的比表面积和反应活性,未来可以研究对硫铁矿的改性方法,增强去除污染物的能力;
3)pH对表面络合、氧化还原和吸附作用有较大影响,因此选择合适的pH调整剂并研究相关机理,可成为未来研究的方向;
4)联合使用硫铁矿和其他环境处理材料或环保技术,为提高传统环境材料和环保技术对污染物的去除效率提供思路,比如联合黄铁矿和零价铁、黄铁矿和过硫酸盐、黄铁矿和生物滤池,可以更好地发挥零价铁的还原作用、过硫酸盐的氧化作用以及生物滤池的成本效益;
5)研究不同类型、不同行业、不同地区的污水废水处理流程,将硫铁矿处理融入其中(如将硫铁矿和污染物的沉淀反应设在沉淀池前),可加快硫铁矿在实际生产中的应用进度。
| [1] |
王天民, 郝维昌, 王莹, 等. 生态环境材料——材料及其产业可持续发展的方向[J].
中国材料进展, 2011, 30(8): 8–16.
|
| [2] |
SINGH N B, GARIMA N, SONAL A, et al.Water purification by using Adsorbents: A Review[J]. Environmental Technology & Innovation, 2018: S2352186417302663.
|
| [3] |
吴彩斌, 闵露艳, 习海滨, 等. 粉煤灰活性炭吸附含Cr废水试验研究[J].
有色金属科学与工程, 2014, 5(3): 70–75.
|
| [4] |
张巍. 膨润土在水污染治理中吸附无机污染物的应用进展[J].
工业水处理, 2018, 38(11): 10–16.
|
| [5] |
曹才放, 章行, 李小文, 等. 氯型季铵树脂对钨酸根吸附的热力学研究[J].
有色金属科学与工程, 2018, 9(3): 1–4+52.
|
| [6] |
安连财, 韩久放, 章应辉, 等. 多孔有机聚合物吸附分离水体系中有机污染物研究和应用进展[J].
应用化学, 2018, 35(9): 1019–1025.
|
| [7] |
商鹏溟, 贾瑛, 戴津星. 金属有机骨架材料UiO-66的制备及其对溶液中NO3-的吸附[J].
化工环保, 2018, 38(6): 710–715.
|
| [8] |
黄志慧, 李育珍, 张宁, 等. 无机、有机及复合吸附材料处理有机污染物的研究[J].
化学研究与应用, 2016, 28(6): 770–776.
|
| [9] |
陶媛, 戴伟明, 韦真周, 等. 处理镉废水的复合螯合吸附剂的制备[J].
有色金属工程, 2016, 6(1): 81–84.
|
| [10] |
王吉中, 李胜荣, 孙惠芳. 金属矿物的环境属性及其在环境保护中的应用[J].
矿产综合利用, 2004(4): 31–36.
|
| [11] |
刘善琪, 李永兵, 石耀霖. 高温高压下黄铁矿热力学性质的第一性原理研究[J].
岩石学报, 2018, 34(6): 1813–1818.
|
| [12] |
陈建华.
硫化矿物浮选固体物理研究[M]. 长沙: 中南大学出版社, 2015.
|
| [13] |
林清泉, 詹信顺, 张红华, 等. 辉钼矿和黄铁矿的晶体结构与表面性质研究[J].
矿冶工程, 2019, 39(3): 40–45.
|
| [14] |
李玉琼, 陈建华, 陈晔, 等. 黄铁矿(100)表面性质的密度泛函理论计算及其对浮选的影响[J].
中国有色金属学报, 2011, 21(4): 919–926.
|
| [15] |
洪秋阳, 汤玉和, 王毓华, 等. 磁黄铁矿结构性质与可浮性差异研究[J].
金属矿山, 2011(1): 64–67.
|
| [16] |
高廷耀, 顾国维, 周琪.
水污染控制工程[M]. 北京: 高等教育出版社, 2014: 94-100.
|
| [17] |
GAO Z. Evaluation of heavy metal pollution and its ecological risk in one river reach of a gold mine in Inner Mongolia, Northern China[J]. International Biodeterioration & Biodegradation, 2017: S096483051730001X.
|
| [18] |
CAROLIN C F, KUMAR P S, SARAVANAN A, et al. Efficient techniques for the removal of toxic heavy metals from aquatic environment: A review[J]. Journal of Environmental Chemical Engineering, 2017: S2213343717302208.
|
| [19] |
谢文强. 六价铬对人体急性与慢性危害探究[J].
资源节约与环保, 2016(7): 131–135.
|
| [20] |
马晓蕾. 地下水过度开采引起六价铬污染危害及治理措施探析[J].
地下水, 2017, 39(5): 85–87.
|
| [21] |
王浩东, 李群, 杨琦. SRB去除废水中Cr(Ⅵ)的动力学和热力学研究[J].
环境科学与技术, 2018, 41(增刊2): 37–42.
|
| [22] |
KANTAR C, BULBUL M S. Effect of pH-buffering on Cr(Ⅵ) reduction with pyrite in the presence of various organic acids: Continuous-flow experiments[J].
Chemical Engineering Journal, 2016, 287: 173–180. DOI: 10.1016/j.cej.2015.11.019. |
| [23] |
代淑娟, 王玉娟, 魏德洲, 等. 枯草芽孢杆菌对电镀废水中镉的吸附[J].
有色金属, 2010, 62(3): 156–159.
|
| [24] |
SONG T, LIANG J, BAI X, et al. Biosorption of cadmium ions from aqueous solution by modified, Auricularia Auricular, matrix waste[J].
Journal of Molecular Liquids, 2017, 241: 1023–1031. DOI: 10.1016/j.molliq.2017.06.111. |
| [25] |
崔晋艳, 钱天伟, 丁庆伟, 等. 纳米级天然黄铁矿去除水中Cr6+, Cd2+和Pb2+[J].
环境工程学报, 2016, 10(12): 7103–7108.
|
| [26] |
朱宇珂, 李平, 刘海波, 等. 热活化胶状黄铁矿去除酸性溶液中的Cd(Ⅱ)[J].
高校地质学报, 2016, 22(4): 638–643.
|
| [27] |
LINDER M C. The relationship of copper to DNA damage and damage prevention in humans[J].
Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2012, 733(1/2): 83–91. |
| [28] |
GUO B, PENG Y. The interaction between copper species and pyrite surfaces in copper cyanide solutions[J].
International Journal of Mineral Processing, 2017, 158: 85–92. DOI: 10.1016/j.minpro.2016.11.021. |
| [29] |
苗利军. 汞污染对人体的危害[J].
农业工程, 2013, 3(3): 83–84.
|
| [30] |
HA E, BASU N, BOSEO R, et al. Current progress on understanding the impact of mercury on human health[J]. Environmental Research, 2016: S0013935116302754.
|
| [31] |
AQUINO L F M C D, RIBEIRO R D O R, SIMOES J S, et al. Mercury content in whey protein and potential risk for human health[J].
Journal of Food Composition and Analysis, 2017, 59: 141–144. DOI: 10.1016/j.jfca.2017.02.014. |
| [32] |
DUAN Y, HAN D S, BATCHELOR B, et al. Synthesis, characterization, and application of pyrite for removal of mercury[J].
Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2016, 490: 326–335. DOI: 10.1016/j.colsurfa.2015.11.057. |
| [33] |
VANDENHOVE H, SWEECK L, VIVES B J, et al. Predicting the environmental risks of radioactive discharges from Belgian nuclear power plants[J].
Journal of Environmental Radioactivity, 2013, 126: 61–76. DOI: 10.1016/j.jenvrad.2013.07.004. |
| [34] |
李宁, 李一菲, 钱天伟. 磁黄铁矿对铼的还原固定及其影响因素研究[J].
安全与环境学报, 2015, 15(5): 204–208.
|
| [35] |
LIU H, ZHU Y, XU B, et al. Mechanical investigation of U(Ⅵ) on pyrrhotite by batch, EXAFS and modeling techniques[J].
Journal of Hazardous Materials, 2017, 322: 488–498. DOI: 10.1016/j.jhazmat.2016.10.015. |
| [36] |
ZHU Y, LIU H, CHEN T, et al. Kinetics and thermodynamics of Eu(Ⅲ) adsorption onto synthetic monoclinic pyrrhotite[J].
Journal of Molecular Liquids, 2016, 218: 565–570. DOI: 10.1016/j.molliq.2016.01.100. |
| [37] |
刘宏芳, 钱天伟, 张敏刚. 利用黄铁矿去除地下水中Se(Ⅳ)污染的XPS分析[J].
光谱学与光谱分析, 2015, 35(2): 543–546.
|
| [38] |
MA B, KANG M, ZHENG Z, et al. The reductive immobilization of aqueous Se(Ⅳ) by natural pyrrhotite[J].
Journal of Hazardous Materials, 2014, 276: 422–432. DOI: 10.1016/j.jhazmat.2014.05.066. |
| [39] |
康家琦. 砷对健康危害的研究进展[J].
卫生研究, 2004(3): 372–376.
|
| [40] |
史亚丹, 陈天虎, 李平, 等. N2气氛下煅烧的黄铁矿对As(Ⅲ)的吸附作用[J].
岩石矿物学杂志, 2016, 35(2): 363–370.
|
| [41] |
刘卓, 张小梅, 肖才林, 等. 利用天然磁黄铁矿去除水中As(V)的研究[J].
环境科学学报, 2016, 36(10): 3701–3708.
|
| [42] |
徐若冰. 湖泊水体富营养化的来源、危害及治理研究[J].
环境与发展, 2019, 31(4): 56–58.
|
| [43] |
WILKINSON G M. Encyclopedia of sustainable technologies || eutrophication of freshwater and coastal ecosystems[J].
Encyclopedia of Sustainable Technologies, 2017: 145–152. |
| [44] |
DESMIT X, THIEU V, BILLEN G, et al. Reducing marine eutrophication may require a paradigmatic change[J].
Science of the Total Environment, 2018, 635: 1444–1466. DOI: 10.1016/j.scitotenv.2018.04.181. |
| [45] |
LI R, KELLY C, KEEGAN R, et al. Phosphorus removal from wastewater using natural pyrrhotite[J].
Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2013, 427: 13–18. |
| [46] |
YANG Y, CHEN T H, MORRISON L, et al. Nanostructured pyrrhotite supports autotrophic denitrification for simultaneous nitrogen and phosphorus removal from secondary effluents[J].
Chemical Engineering Journal, 2017, 328: 511–518. DOI: 10.1016/j.cej.2017.07.061. |
| [47] |
LIAN W, YI X, HUANG K, et al. Degradation of tris(2-chloroethyl) phosphate (TCEP) in aqueous solution by using pyrite activating persulfate to produce radicals[J].
Ecotoxicology and Environmental Safety, 2019, 174: 667–674. DOI: 10.1016/j.ecoenv.2019.03.027. |
| [48] |
CHEN S, XIONG P, ZHAN W, et al. Degradation of ethyl thionocarbamate by pyrite-activated persulfate[J].
Minerals Engineering, 2018, 122: 38–43. DOI: 10.1016/j.mineng.2018.03.022. |
| [49] |
WU B, GU G, DENG S, et al. Efficient natural pyrrhotite activating persulfate for the degradation of O-isopropyl-N-ethyl thionocarbamate: Iron recycle mechanism and degradation pathway[J].
Chemosphere, 2019, 224: 120–127. DOI: 10.1016/j.chemosphere.2019.02.062. |
| [50] |
LÜ Y, LI J, LI Y, et al. The roles of pyrite for enhancing reductive removal of nitrobenzene by zero-valent iron[J].
Applied Catalysis B:Environmental, 2019, 242: 9–18. DOI: 10.1016/j.apcatb.2018.09.086. |
| [51] |
XIA D, LI Y, HUANG G, et al. Activation of persulfates by natural magnetic pyrrhotite for water disinfection: Efficiency, mechanisms, and stability[J].
Water Research, 2017, 112: 236–247. DOI: 10.1016/j.watres.2017.01.052. |
 2020, Vol. 39
2020, Vol. 39


