| 基于海绵状纳米多孔金盘的G-四链体表面增强拉曼散射传感器 |
2. 中国科学院微电子研究所光电研发中心, 北京, 100029;
3. University of Houston, Department of Electrical and Computer Engineering, USA, TX, Houston, 77204
2. Institute of Microelectronics of the Chinese Academy of Sciences, Beijing, 100029, China;
3. Department of Electrical and Computer Engineering, University of Houston, 4800 Calhoun Road, Houston, TX 77204, USA
Au、Ag等金属纳米结构中的自由电子在入射光的激发作用下易表现出集体振动[1],促使金属周围电场得到明显增强,同时Au或Ag表面自由电子因集体振动而离开原子核,从而引起表面等离子体共振(surface plasmon resonance,SPR)和局域表面等离子体共振效应(Localized surface plasmon resonance,LSPR)[2-4].且表面共振强度和频率与金属纳米结构的尺寸和形态有着密切关系.而Au或Ag纳米结构表面结合一些分子时,在激光的激发下,它们的拉曼散射信号强度由于其电子跃迁和分子振动的耦合作用,也会极大地得到增强,这种现象通常称为表面增强拉曼散射效应(Surface enhanced Raman scattering,SERS)[5-8].
纳米多孔金盘由于其独特海绵状结构,且拥有大量韧带、孔径结构和盘状结构导致了高密度的等离子体共振热点,进而诱导纳米多孔金盘周围电场明显增强,使其具有极强的等离子体共振效应[9-11].因此,海绵状纳米多孔金盘(Spongy nanoporous disks,SNPD)是等离子体共振传感器的理想选择之一.基于SNPD的诸多优势,Shih课题组[12]设计了一种高灵敏SERS传感器用于监测DNA序列之间的杂交过程.他们将一端修饰有染料Cy3的发卡式DNA结合在SNPD表面.当加入与颈环部分互补的目标DNA时,其发卡式结构展开,致使修饰Cy3的一端远离SNPD表面,使其SERS信号因距离的增加而逐渐减小,从而达到监测DNA杂交过程的目的.在理想状态下,该方法能监测到单个DNA序列的杂交.同时,该课题组还提出了一种表面增强荧光传感技术用于识别癌症生物条形码,其灵敏度低至2.4 zeptomole[13].然而这些技术都建立在复杂的染料标记基础上,增加了该类技术的操作成本和繁琐性.但上述研究结果仍然表明了SNPD具有优异的表面等离子体共振效应,为高灵敏识别DNA独特的二级结构提供了可能性.
端粒DNA主要由重复串联的富G DNA序列折叠形成,例如(TTAGGG)n,易折叠成G-四链体[14-16]. G-四链体被认为在哺乳动物基因组中转录调节、DNA复制和基因组稳定性等方面都起着至关重要的作用.然而目前很多识别G-四链体的方法局限在荧光技术方面[17-18]. Bhasikuttan等基于G-四链体易与孔雀石绿分子形成复合物的特性,提出了一种简单的G-四链体荧光识别方法[19].由于G-四链体与孔雀石绿分子特有的相互作用并没有在单链DNA(ssDNA)和双链DNA(dsDNA)中发现,因此该方法能够用于识别G-四链体结构.然而该方法的最低识别浓度为2.0?滋mol/L,灵敏度不足.因此,本研究基于SNPD提出一种新的SERS传感器,用于G-四链体的高灵敏识别,且无需经过复杂的标记过程.
1 实验方法 1.1 SNPD的制备选取厚度为75 nm的Au/Ag合金薄膜为基底,采用匀速流动注射器在其表面覆盖一层聚苯乙烯纳米颗粒(直径为460 nm),形成单分子层.通过氧气电浆对其表面进行刻蚀2 min,其压力和功率分别设置为4 Pa和100 W.然后将上述刻蚀好的Au/Ag合金薄膜置入氩气电浆中继续刻蚀12 min,其压力和功率分别是0.27 Pa和100 W,刻蚀结束后将得到表面含有纳米盘状结构的Au/Ag合金薄膜,将其置于氯仿溶液中超声1 min,以除去表面残留的聚苯乙烯纳米颗粒.最后,将含有纳米盘状结构的Au/Ag合金薄膜浸没在70%左右的浓硝酸中1 min,以溶解合金薄膜中的Ag成分,形成多孔的海绵状结构SNPD,采用二次水冲洗3次,以除去表面反应产物和过多的硝酸.并采用钻石刀将上述SNPD切割成大小为4 mm×5 mm备用.
1.2 G-四链体的识别巯基功能化的端粒DNA(碱基序列为:5’-HS-(CH2)6-TTT TTT TTT GGT GGT GGT GGT GGT GGT GGT GG-3’)加入至10 mmol/L PBS缓冲液中(pH为7.38,且含有50 mmol/L KCl),加热至90 ℃,并保持10 min.然后慢慢冷却至37 ℃,并培育1.0 h,形成G-四链体结构.随后,将2.0 μL的10 mmol/L tris(2-carboxyethyl)phosphine(TCEP)加入至上述G-四链体溶液中,在室温条件下保持1.0 h以活化巯基基团.接着将洗净的4 mm×5 mm SNPD浸没于上述溶液中,加入MG(2.0 μmol/L)溶液,反应30 min后,形成G-四链体/MG复合物修饰的SNPD.最后,将上述修饰好的SNPD采用去离子水冲洗其表面,并转移至0.3 mmol/L MCH溶液中3 h,用于除去MG分子的表面非特异性吸附.
1.3 拉曼测试拉曼测试采用组装的线性扫描拉曼显微系统[20],采用60X物镜(NA=1.2),激光激发波长为785 nm,激光聚焦在样品上的线长度为133 μm,宽度为1.0 μm.曝光时间为10 s.所有的SERS光谱都需基线校正[21].
2 结果与讨论 2.1 SNPD表面形貌特征采用SEM对SNPD的表面形貌进行表征,如图 1所示.
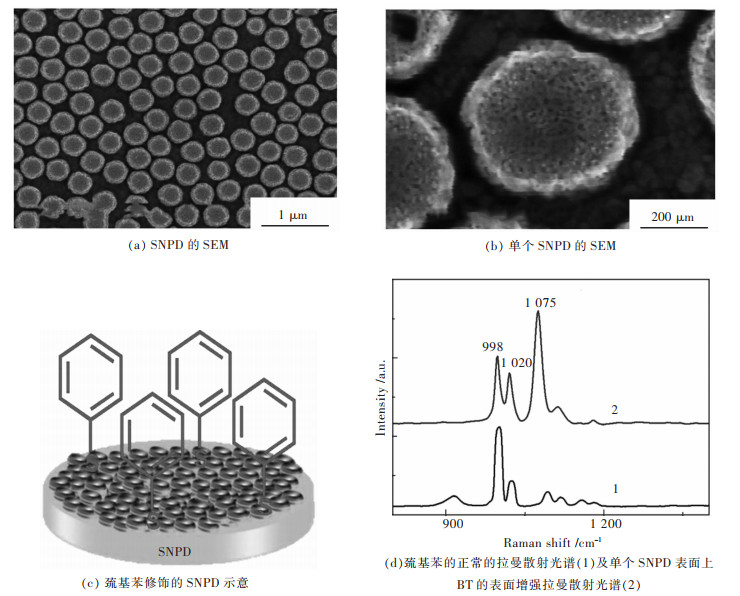 |
| 图 1 SNPD形貌示意 Fig. 1 SEM of SNPD and diagram of BT decorated 1 μm |
从图 1中可以观察到SNPD呈现半有序的盘状结构,且金盘尺寸大小均一,其直径是360 nm左右(如图 1(a)),其直径大小主要是由Au/Ag合金表面覆盖的聚苯乙烯纳米颗粒尺寸控制,且随着聚苯乙烯纳米颗粒尺寸的增大而增大.每个金盘均含有高密度的孔径结构和韧带结构,孔径大小为15 nm左右,高度为75 nm左右(如图 1(b)).上述SNPD的半有序盘状结构,高密度孔径结构和韧带结构均能为表面增强拉曼散射提供大量增强热点和比表面积,也为外来分子提供大量结合位点. SNPD被认为是一种较为理想的SERS传感基底.
为了更好地计算SNPD的表面增强拉曼散射因子(Enhancement factor,EF),首先将结构简单的巯基苯(Benzenethiol, BT)组装在SNPD表面,组装时间为30 min,形成单分子层(如图 1(c)所示),然后依次采用乙醇和二次水清洗SNPD表面,以除去过多的BT,最后测试BT的SERS光谱(如图 1(d)所示).从图 1(d)中明显观察到单个SNPD表面上BT的拉曼光谱强度在1 075 cm-1处远大于其正常拉曼光谱强度.通过式(1)可计算出其在1 075 cm-1处的表面增强拉曼散射因子为7.4×108:
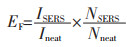
|
(1) |
ISERS和Ineat分别为SNPD表面的SERS强度和正常拉曼强度;NSERS和Nneat分别为贡献于SNPD表面SERS强度分子数和贡献于正常拉曼强度的分子个数.
2.2 G-四链体SERS传感原理将上述所制备的SNPD作为SERS传感基底,用于G-四链体的高灵敏检测,其构建示意图如图 2所示.首先巯基修饰的富G端粒酶DNA序列固定在SNPD表面,随着K+的加入,该富G DNA序列将折叠成G-四链体结构,其能与MG分子产生π-π共轭作用和静电作用,从而将MG分子捕获到SNPD表面,因此在SNPD表面大量共振热点的增强作用下,MG分子能产生强SERS信号.为了减小MG分子的表面非特异性吸附的影响,将MCH分子加入至该传感体系,其能通过Au-S键结合在SNPD表面,占据MG分子的表面非特异性结合位点,以达到除去非特异性吸附的目的.
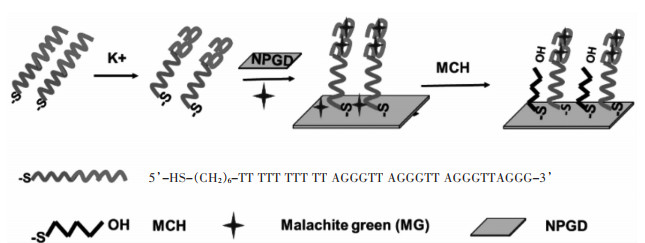 |
| 图 2 基于SNPD的G-四链体SERS传感技术示意 Fig. 2 Scheme of the SERS sensing for G-quadruplexes detection based on SNPD |
2.3 G-四链体与MG之间的相互作用
SNPD表面的消光光谱被测试用于研究其表面修饰状态及G-四链体与MG之间的相互作用.从图 3中可以看出,当SNPD浸没在G-四链体/MG混合溶液中后,其表面吸收波长发生了明显的红移现象,从825 nm红移至858 nm,红移波长为32 nm,且在632 nm处出现了一个新的较为明显的吸收峰(如图 3(b)).且该波长与MG的吸收波长一致[22],因此632 nm被归属于SNPD表面的MG分子吸收峰.上述结果表明G-四链体通过-SH与SNPD表面Au相互作用,被结合在了SNPD表面,同时MG也被成功捕获至SNPD表面.但是由于MG结合在SNPD表面除了通过G-四链体的特异性捕获外,可能还存在非特异性吸附.因此,本研究采用MCH分子除去非特异性吸附.将上述修饰有G-四链体和MG的SNPD转移至MCH溶液中3 h后,632 nm处的吸收峰强度呈现显著下降,并伴随着另一个吸收峰从858 nm红移至863 nm(如图 3(c)).导致这种现象的主要原因是MCH分子替换了原本结合在SNPD表面上的MG非特异性吸附位点.因此,该结果进一步证实了先前MG可能在SNPD表面存在非特异性的推测,但其能够被MCH分子替换,从而能够有效降低MG的非特异性吸附.
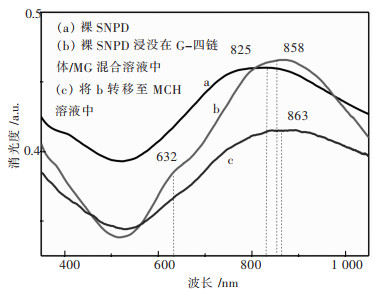 |
| 图 3 SNPD在不同修饰阶段的消光光谱 Fig. 3 Extinction spectra of NPG disks at different modification steps |
2.4 选择性
图 4显示了不同DNA修饰SNPD浸没在MG溶液后,其表面SERS信号的变化.如图 4所示,当ssDNA修饰SNPD和dsDNA修饰SNPD浸没在MG溶液时,仅在1 100 cm-1处观察到1个较强的SERS峰信号,该峰来自于MCH分子的Raman振动峰,其余SERS峰信号均非常弱(如图 4(a)和4(b)).然而,当G-四链体修饰SNPD浸没在MG溶液时,除了在1 100 cm-1处观察到MCH分子的SERS信号外,也能明显观察到其它的SERS信号,且信号强度远高于ssDNA修饰SNPD和dsDNA修饰SNPD(如图 4(c)).每个新出现的SERS信号归属如表 1所列,发现其它的SERS信号均来自于SNPD表面捕获的MG分子,且峰位置与文献[23-26]报道一致.上述结果表明G-四链体能够高效捕获MG分子,而ssDNA与dsDNA对MG分子的捕获能力较差.因此,这种SERS传感体系能够被拓展用于识别G-四链体结构.
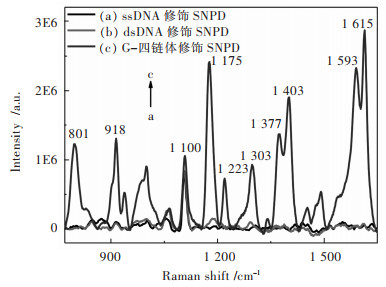 |
| 在此所有的DNA浓度均为1.0 μmol/L 图 4 不同DNA修饰SNPD的SERS光谱 Fig. 4 SERS spectra of different DNA modified NPG disks |
| 表 1 MG分子的SERS光谱中Raman位移及其强度和归属 Table 1 The Raman shifts, relative intensity, and band assignments for the SERS spectra of MG |
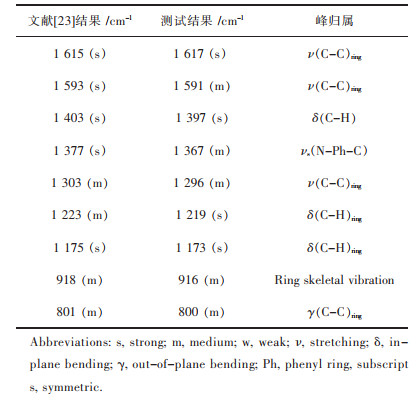 |
| 点击放大 |
2.5 灵敏度
通过考察不同G-四链体浓度的SERS信号变化来阐明该技术的灵敏度.如图 5所示,在100 pmol/L~100 nmol/L范围内,SERS信号强度随着G-四链体浓度的增加而迅速增大,当浓度大于100 nmol/L时,SERS强度呈现缓慢增加,并趋于平衡.这主要归因于随着G-四链体浓度的增加,捕获的MG分子数量越多,从而引起MG的SERS信号增大.当SNPD表面G-四链体结合位点均被MG分子占据时,此时SERS信号最大,并保持平衡.以SERS信号高于噪音信号3倍为限(S/N=3),发现该SERS传感器能识别到最低G-四链体浓度为100 pmol/L,远低于其它相关文献报道的荧光方法[27-28],表明该方法对G-四链体检测显示出高灵敏性.
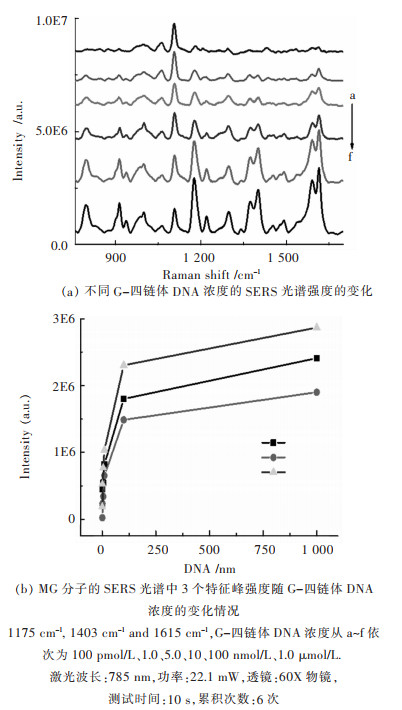 |
| 图 5 该传感技术对不同G-四链体DNA浓度的识别 Fig. 5 Dependence of G-quadruplexes concentrations on the sensing system: the SERS spectra |
3 结论
1)基于Au/Ag合金薄膜制备了一种海绵状多孔纳米金盘材料.该纳米金盘高度约为75 nm,直径约为360 nm,其内部孔径大小约为15 nm.
2)将海绵状多孔纳米金盘作为SERS传感基底,建立了一种高灵敏检测G-四链体的SERS传感器,其检测限低至100 pmol/L,且具有良好的选择性,能从ssDNA和dsDNA中识别出G-四链体结构.
3)引起上述SERS传感技术高灵敏和高选择性的原因主要归为两方面:一是SNPD表面的高密度韧带和孔径结构为SERS传感器提供了大量共振增强热点;二是G-四链体能够高效捕获MG分子至SNPD表面,而ssDNA和dsDNA并未发现明显捕获MG分子的能力.
| [1] |
SRIRAM M, ZONG K, VIVEKCHAND S R, et al. Single nanoparticle plasmonic sensors[J].
Sensors, 2015, 15(10): 25774–25792. DOI: 10.3390/s151025774. |
| [2] |
LEE H C, LI C T, CHEN H F, et al. Demonstration of an ultrasensitive refractive-index plasmonic sensor by enabling its quadrupole resonance in phase interrogation[J].
Optics Letters, 2015, 40(22): 5152. DOI: 10.1364/OL.40.005152. |
| [3] |
CAMPOSEO A, PERSANO L, MANCO R, et al. Metal-enhanced near-Infrared fluorescence by micropatterned gold nanocages[J].
ACS Nano, 2015, 9(10): 10047–10054. DOI: 10.1021/acsnano.5b03624. |
| [4] |
马小明, 孙密, 林悦, 等. 基于金纳米材料的可视化生物传感器的研究进展[J].
分析化学, 2018, 46(1): 1–10.
DOI: 10.3969/j.issn.2095-1035.2018.01.001.
|
| [5] |
ZHENG Y, SOERIYADI A H, ROSA L, et al. Reversible gating of smart plasmonic molecular traps using thermoresponsive polymers for single-molecule detection[J].
Nature Communications, 2015(6): 8797. |
| [6] |
郑春辰, 张丽颖, 都述虎. 高灵敏性表面增强拉曼散射传感器的构建及其用于人体尿液中痕量甲醛的快速检测[J].
南京医科大学学报, 2017, 7(37): 906–911.
|
| [7] |
邓媛, 易润芳, 周晓东, 等. 基于无标记核酸适配体的凝血酶表面增强拉曼散射传感器[J].
分析科学学报, 2018, 34(5): 577–582.
|
| [8] |
马群, 李艳乐, 龚年春, 等. 基于磁场诱导纳米金聚集的表面增强拉曼散射传感器用于细菌DNA的检测[J].
分析化学, 2015, 43(11): 1676–1681.
DOI: 10.11895/j.issn.0253-3820.150215.
|
| [9] |
ZHAO F, ZENG J, PARVEZ ARNOB M M, et al. Monolithic NPG nanoparticles with large surface area, tunable plasmonics and high-density internal hot-spots[J].
Nanoscale, 2014, 6(14): 8199–8207. DOI: 10.1039/C4NR01645A. |
| [10] |
QI J, MOTWANI P, GHEEWALA M, et al. Surface-enhanced Raman spectroscopy with monolithic nanoporous gold disk substrates[J].
Nanoscale, 2013, 5(10): 4105–4109. DOI: 10.1039/c2nr33242f. |
| [11] |
LI M, ZHAO F, ZENG J, et al. Microfluidic surface-enhanced Raman scattering sensor with monolithically integrated nanoporous gold disk arrays for rapid and label-free biomolecular detection[J].
Journal of Biomedical Optics, 2014, 19(11): 111611. DOI: 10.1117/1.JBO.19.11.111611. |
| [12] |
QI J, ZENG J, ZHAO F, et al. Label-free, in situ SERS monitoring of individual DNA hybridization in microfluidics[J].
Nanoscale, 2014, 6(15): 8521–8526. DOI: 10.1039/C4NR01951B. |
| [13] |
SANTOS G M, ZHAO F, ZENG J, et al. Label-free, zeptomole cancer biomarker detection by surface-enhanced fluorescence on nanoporous gold disk plasmonic nanoparticles[J].
Jounal of Biophotonics, 2015, 8(10): 855–863. DOI: 10.1002/jbio.201400134. |
| [14] |
RUTTKAY-NEDECKY B, KUDR J, NEJDL L, et al. G-quadruplexes as sensing probes[J].
Molecules, 2013, 18(12): 14760–14779. DOI: 10.3390/molecules181214760. |
| [15] |
RODRIGUES PONTINHA A D, CHIORCEA-PAQUIM A M, ERITJA R, et al. Quadruplex nanostructures of d(TGGGGT): influence of sodium and potassium ions[J].
Analytical Chemistry, 2014, 86(12): 5851–5857. DOI: 10.1021/ac500624z. |
| [16] |
WEI C, JIA G, YUAN J, et al. A spectroscopic study on the interactions of porphyrin with G-quadruplex DNAs[J].
Biochemistry, 2006, 45(21): 6681–6691. DOI: 10.1021/bi052356z. |
| [17] |
BHASIKUTTAN A C, MOHANTY J. Targeting G-quadruplex structures with extrinsic fluorogenic dyes: promising fluorescence sensors[J].
Chemical Communications, 2015, 51(36): 7581–7597. DOI: 10.1039/C4CC10030A. |
| [18] |
SUN H, YU L, CHEN H, et al. A colorimetric lead (Ⅱ) ions sensor based on selective recognition of G-quadruplexes by a clip-like cyanine dye[J].
Talanta, 2015, 136: 210–214. DOI: 10.1016/j.talanta.2015.01.027. |
| [19] |
BHASIKUTTAN A C, MOHANTY J, PAL H. Interaction of malachite green with guanine-rich single-stranded DNA: preferential binding to a G-quadruplex[J].
Angewandte Chemie International Edition, 2007, 48(46): 9305–9307. |
| [20] |
QI J, SHIH W C. Performance of line-scan Raman microscopy for high-throughput chemical imaging of cell population[J].
Applied Optics, 2014, 53(13): 2881–2885. DOI: 10.1364/AO.53.002881. |
| [21] |
MASETTI M, XIE H N, KRPETIC Z, et al. Revealing DNA interactions with exogenous agents by surface-enhanced Raman scatterings[J].
Jounal of American Chemistry Society, 2015, 137(1): 469–476. DOI: 10.1021/ja511398w. |
| [22] |
SUN H, CAO L, LU L. Magnetite/reduced graphene oxide nanocomposites: One step solvothermal synthesis and use as a novel platform for removal of dye pollutantss[J].
Nano Research, 2011, 4(6): 550–562. DOI: 10.1007/s12274-011-0111-3. |
| [23] |
FU W L, ZHEN S J, HUANG C Z. One-pot green synthesis of graphene oxide/gold nanocomposites as SERS substrates for malachite green detection[J].
Analyst, 2013, 138(10): 3075–3081. DOI: 10.1039/c3an00018d. |
| [24] |
XIAO G N, MAN S Q. The effect of L-cysteine on surface-enhanced raman scattering of malachite green in silver colloids[J].
Spectroscopy Letters, 2013, 46(8): 577–582. DOI: 10.1080/00387010.2013.771189. |
| [25] |
QIU S, ZHAO F, ZENASNI O, et al. Nanoporous gold disks functionalized with stabilized G-quadruplex moieties for sensing small molecules[J].
ACS Applied Materials Interfaces, 2016, 44(8): 29968–29976. |
| [26] |
QIU S, ZHAO F, ZENASNI O, et al. Catalytic assembly of DNA nanostructures on a nanoporous gold array as 3D architectures for label-free telomerase activity sensing[J].
Nanoscale Horizons, 2017(2): 217–224. |
| [27] |
MOHANTY J, BAROOAH N, DHAMODHARAN V, et al. Thioflavin T as an efficient inducer and selective fluorescent sensor for the human telomeric G-quadruplex DNA[J].
Jounal of American Chemistry Society, 2013, 135(1): 367–376. DOI: 10.1021/ja309588h. |
| [28] |
YAN J W, TIAN Y G, TAN J H, et al. Colorimetric and fluorescence detection of G-quadruplex nucleic acids with a coumarin-benzothiazole probe[J].
Analyst, 2015, 140(21): 7146–7149. DOI: 10.1039/C5AN01573A. |
 2019, Vol. 10
2019, Vol. 10


