| Cu-Ni合金腐蚀行为的宏观电化学研究进展 |
管道在海洋工程中应用广、种类多、保养维修困难,多数常年暴露在易发生腐蚀的环境中,一旦发生腐蚀泄露,非常难以更换,将造成巨大的经济损失. Cu-Ni合金由于优良的耐海水腐蚀能力被广泛应用于各类舰船用管道、滨海电厂的热交换管以及其它海洋设备的管道系统.虽然有数十年的应用历史,但该合金在使用过程中仍发生过严重腐蚀.随着对海洋的不断深入开发,工程方面对材料的性能、使用寿命提出了更高的要求.因此,国内外学者对Cu-Ni合金的腐蚀过程进行了大量的研究,以期提高该合金的耐蚀性能,延长其使用寿命,更好地为海洋工程服务.
论文综述了国内外学者对Cu-Ni合金进行的大量有效而细致的成果,主要从合金自身成分、腐蚀环境、表面产物膜、初始表面等4个方面进行论述,深入探讨该合金的腐蚀规律,为进一步探索该合金的耐蚀机制提供参考.
1 合金成分对Cu-Ni合金腐蚀行为的影响 1.1 Ni元素的影响在铜中加入Ni有益于耐蚀性能的提高,杨博均等[1]研究证明铜镍合金B10、B30在海水中的腐蚀速率分别为纯铜的25%、20%. Ni含量的增加会降低溶解电流密度和阴极电流密度[2-3],Beccari, et al.和Crousier, et al.研究发现[4-5],Cu-Ni合金阳极极化部分存在一个电流平台,Ni含量越高电流平台越低,腐蚀速度降低,当对应的Ni含量高达30%时,对应的平台电流值接近纯Ni的钝化电流.当Ni含量高达10%时,合金的电流平台较宽,表明钝态性能稳定,其对应的耐蚀性能稳定.
North和Efird等[2, 3, 6-8]提出Ni能通过式(1)、式(2)的反应过程结合进入Cu2O薄膜中,Cu2O是高缺陷的P型半导体,Ni与阳离子空位的结合会与铜离子结合氧化物层相竞争,从而减少Cu2O薄膜中存在的阳离子空位浓度,提高了膜层电阻,改善合金的耐蚀性.
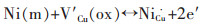
|
(1) |
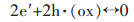
|
(2) |
式中:Ni(m)为金属Ni原子;V′Cu(ox)为Cu2O薄膜中带负电的阳离子空位;
Mansfeld和Uhlig[9]利用钝化电子配置理论对Cu-Ni合金的腐蚀行为进行解释,认为如果电子能级的‘d’轨道未被填充满,即Cu含量高于40%,则能建立氧的化学吸附条件,并形成稳定的钝化膜.他们同时发现,当Cu/Ni原子比超过了1.6(质量比1.478)时,钝化膜的性质会变得不稳定. North[6]对不同镍含量的铜合金的表面Cu2O膜厚度进行了研究,发现纯铜膜厚最小,Cu-10Ni的Cu2O钝化膜厚度最大,Cu-30Ni的Cu2O钝化膜厚度次之.这可能是由于在低氧环境中膜会部分氧化溶解,而Ni能稳定Cu2O膜,减少膜的溶解,而Cu-30Ni表面Cu2O膜厚度较Cu-10Ni薄可能是由于膜层具有较高的电阻率导致.
1.2 Fe元素的影响Ni能提高铜的耐腐蚀性,若合金中再添加适量Fe,其作用将大大提高[3].姜雁斌[10]利用EDS和XPS发现增加Fe含量能促进腐蚀产物膜中Fe、Ni、O等元素含量的增加. Utheman在1907年首次提出在冷凝管材中添加适量Fe会形成能降低腐蚀速率的含铁腐蚀产物膜.后来的学者也证实了这个观点,当Cu-10Ni中Fe含量<2%时,腐蚀速率随着Fe含量的增加而降低,这是由于腐蚀后会在表面形成致密的、缺陷少的富含Fe、Ni的腐蚀产物膜,阻碍溶液中的Cl-、O等介质向基体的扩散,从而保护基体. Efird[3]和Popplewell[11]认为添加的Fe以固溶态或者析出态形式存在都会对耐蚀性能有提高作用.当铁以固溶形式存在时改变了Cu2O的缺陷,提高了产物膜的腐蚀阻力,同时固溶态Fe会促进Ni在钝化膜中的富集.而Fe以析出态存在时,会形成一种复杂的含铁析出相,这种析出相具有高的离子阻力,提高了耐蚀性[11].但Burleigh, et al.[12]认为铜管在焊接过程中,溶解的Fe可能从固溶体中析出,富集在热影响区的晶界上,导致铜管在服役过程中这些富铁的析出物会优先进行溶解,发生晶间腐蚀. Drolenga, et al.[13]发现实验室熔炼的合金会产生不连续的析出相,当在合金中添加少量Fe(≤1.5%)时,则会产生低浓度的连续析出物,表现出较好的耐蚀性.
1.3 Mn元素的影响合金中存在少量Fe时,Cu-Ni合金的冲击腐蚀性能可通过增加Mn得到显著提高,当含Fe量较低时,Mn能替代Fe起作用,但Mn的改性能力不如Fe强;Mn还能够消除Cu-Ni合金中过剩的C对耐蚀性能产生的影响[14].张荣伟[15]发现,合金中含有低含量的Mn有助于提高合金的耐蚀性能,降低合金的腐蚀速率.
当合金的原始膜富集Mn时,腐蚀产物膜中会出现Ni的富集,反之亦然.这说明腐蚀产物膜中Ni的富集情况是与原始膜中Mn的含量有关. Mn和Ni均可生成离子型结构的氧化物,在任意温度条件下Mn的氧化物标准生成自由能ΔGf均小于Ni的氧化物的标准生成自由能,导致Mn先于Ni发生氧化[16].而Mn在氧化物中的价态由合金的状态决定,Mn2+的离子半径为0.08 nm,Mn4+的离子半径为0.052 nm,Ni2+离子半径为0.06~0.07 nm. Ni、Mn的二价离子半径相差很小,Mn2+溶解留下的空位易被氧化物中的Ni2+填补,而Mn4+溶解后会留下空位[16]. Mn在腐蚀产物膜中主要以MnO2形式存在,当腐蚀产物膜中MnO2含量高时,能促进Ni对阳离子空位的填充,减少腐蚀产物膜中阳离子空位数量,增大Cl-膜中扩散阻力,增强腐蚀产物膜的保护性能[17].
1.4 稀土元素的影响在铜及铜合金中加入稀土后耐蚀性能均有不同程度的提高,对此现象的解释主要有[18-21]:①稀土的净化作用,消除铜基体中杂质,减少原电池数量. ②在铜及铜合金表面形成致密的氧化层,阻止基体原子向外扩散和外部原子向内扩散.稀土能在BFe10-1-1合金表面形成一层微裂纹少、与基体结合牢固的含稀土相的腐蚀产物层,能增加在流动海水中的耐腐蚀性能[21].③提高铜及铜合金的腐蚀电位.含Ce黄铜在NaCl水溶液中的自腐蚀电位比没有加Ce的黄铜要高,是由于微量的稀土加入会使H70合金中的β相减少,而β相电极电位较低,从而提高了合金的耐腐蚀能力. ④稀土的加入缩小了铜合金的结晶温度范围.对于加入稀土后的ZQSn10-1合金,凝固时液相线和固相线温度降低,从而减轻了枝晶偏析,促使了耐蚀性能的进一步提高.毛向阳[22]认为在Cu-Ni合金中添加少量稀土能有效地减少Ni在枝晶中的偏析,降低枝晶与晶间的腐蚀电位差,从而改善Cu-Ni合金的耐蚀性能.谈荣生等[23]发现混合稀土的加入不仅可以改善锡黄铜的耐蚀性能,还可以通过影响腐蚀机制而改变锡黄铜的腐蚀形貌,不仅减小了易脱落层的厚度,同时也大大减小了渗透层的厚度.
1.5 Cr元素的影响20世纪70年代,美国海军在舰船及潜艇上应用了一种新型Cu-Ni合金,对应牌号C72200.该牌号在添加Fe、Mn等元素外,还添加了0.5%的Cr. Kirkd等[24]的研究结果表明C72200的耐冲击腐蚀性能优于B10、B30. Zhang[25]发现在B30中添加适量Cr可以增加合金的钝化膜电阻和膜厚度. Jeon[26]研究不同Cr含量对Cu-Ni-Sn合金的耐腐蚀性能的影响,发现Cr增加了合金的极化电阻并降低了腐蚀电流密度. Anderson[27]研究了不同Cr含量对Cu-Ni合金抗海水冲击腐蚀性能的影响,发现添加约0.5%的Cr可以显著改善合金的耐冲击腐蚀性.张雅妮[28]认为在Cu中添加的Cr可以填充到Cu2O的阳离子空位中,同时也与基体中的位错缠绕,阻碍了离子在膜层中的扩散,有助于提高Cu的耐蚀性能.
1.6 其他元素的影响Al在Cu-Ni合金中的固溶度受温度影响较大. Tuck[29]和Nady[30]研究认为在NaCl溶液中添加Al元素的Cu-Ni合金其耐蚀性能较普通Cu-Ni合金有较大提升,主要原因是Al在合金表面形成了一层具保护性的钝化膜.也有研究认为Al能在合金表面形成保护作用强于Cu2O的Al2O3层,阻碍合金与溶液的接触,阻止合金的进一步腐蚀.
Burleigh和Waldeck[12]在选择元素代替Fe参杂入p型n型半导体研究的基础上探索了Ga、In、Ge等元素对90Cu-10Ni合金耐蚀性能的影响,发现In能改善合金耐蚀性能. Taher[31]认为与Al、Cr、Ti、Mo、In、V相比,添加Co元素的Cu-Ni合金在含硫海水及波罗的海海水环境下的耐蚀性更强,甚至可以取代Fe的地位.
2 环境对Cu-Ni合金腐蚀行为的影响 2.1 温度和浸泡时间的影响温度的影响是综合性的,一方面随着温度的升高加快了离子的扩散速度,另一方面促进了保护性腐蚀产物膜的生成.
孙婷婷,等[32]和Ezuber, et al.[33]研究了温度对Cu-10Ni合金耐蚀性能的影响,发现腐蚀介质的温度升高会加速腐蚀的进行.孙婷婷认为温度升高导致溶液中离子活性增大,更容易穿过产物膜发生反应.而Wang研究Cu-30Ni合金在20、40、60、80 ℃下的腐蚀行为,取得了与孙婷婷等不同的结论[34]. Wang利用失重法和电化学阻抗谱发现介质的温度上升时,B30的腐蚀层具有更强的钝化能力,膜中Cu/Ni比下降,腐蚀失重降低.这可能是由于温度升高加速了Cu的消耗,提高了Ni在膜层中的占比,从而提高了钝化能力.同时发现温度的变化会改变钝化膜的成分:室温时,氧化物和大量碱性盐(氯化物和碳酸氢氧化物)共同沉淀形成钝化膜;温度升至40~60 ℃时,氧化物和碳酸氢氧化物、硫代硫酸盐共同沉淀;到了80 ℃时,则形成由氧化物和硫代硫酸盐组成的膜.
浸泡初期,Cu-Ni合金基体与海水直接接触,此时腐蚀速率最快.随着浸泡时间的延长,合金表面产物膜开始生长并逐渐完整、致密,阻碍了基体与海水的接触,提高了耐蚀性能[32, 35].
2.2 Cl-的影响大量学者[30,36-39]对Cu-Ni合金在不同腐蚀介质中的腐蚀行为进行了研究,发现形成于合金表面的钝化膜的结构和性质取决于电解质的类型和接触时间.
文献[2]发现铜镍合金在含氯离子溶液中的腐蚀速率会先上升后下降,原因是氯离子会和表面的铜反应生成一层不溶的CuCl,CuCl层不具有保护性,不能对基体提供有效的保护.当氯离子浓度增加到一定浓度(0.3 mol/dm3)时,不溶的CuCl层会发生水解转化为可溶解的CuCl2-络合物,当合金表面存在高浓度的CuCl2-会发生如下水解反应,生成Cu2O,这也解释了为什么氯离子浓度高时,腐蚀速率反而下降:

|
(3) |
Cl-对铜合金的加速氧化行为与Cu2O结构缺陷变化有显著关系. Cl-使Cu2O的保护性能劣化,表明Cl-取代了Cu2O晶格中的O-,晶格中的Cu+进入溶液中,保持电中性的同时产生了新的阳离子空位,加速Cu2O中的Cu+向外扩散,降低合金的耐蚀性[6].也有学者[33]认为是由于氯离子吸附在保护膜的表面,试图占据由CuO的阳离子产生的空位,随着膜中氯离子渗入量的增加,氯离子占据的氧空位数也随之增加.而膜的化学稳定性由膜中铜、氯离子比决定,当Cu+:Cl-的离子数比超过1时,膜将变得不稳定,氯离子浓度大的区域会率先溶解. Badawy[2]认为Cl-的吸附增大了被动膜之间的电位差,这提高了金属离子从金属/膜界面到膜/溶液界面的扩散速率,导致阳离子空位的形成,从而造成合金表面和被动薄膜的破坏. Gusmano[40]认为Cl的作用是双重的,一方面降低了生物活性;另一方面游离的氯会增加腐蚀电位Ecorr.
2.3 S2-的影响Cu-Ni合金对硫化物比较敏感,海水中存在硫离子时往往会加速合金的腐蚀.在完全无氧的情况下,海水中的硫化物使Cu-Ni合金腐蚀电位向活化方向迁移.在活化电位时,阴极反应依赖于氢离子还原.因此,即使在无氧时腐蚀反应仍能进行.在被硫化物的污染海水中,Cu-Ni合金表面可生成一层Cu2S膜.该膜为多孔、非保护性的腐蚀产物,并且沉积于金属表面,该硫化物与氧还会共同加速Cu-Ni合金腐蚀. Yuan[39]研究了Cu-30Ni在不同模拟海水中的腐蚀行为,发现在洁净海水中Cu-30Ni的表面能形成具有保护性的氧化膜,降低了腐蚀速率.而在含硫的海水中由于硫离子或硫化物与阴阳极反应的催化作用,Cu-30Ni的腐蚀速率显著增加.而Domiaty[41]认为是Cu-Ni合金在含硫海水中发生了选择性溶解才导致了合金的高腐蚀速率. Kong[42]研究了铜在含硫溶液中钝化膜的结构和性质,发现铜在含硫溶液中的腐蚀产物膜为p型半导体,膜中缺陷数量量级在1022~1023 cm-3,并且缺陷数量随着硫化物浓度的增加而增加,使合金耐蚀性能进一步降低.
Kharafi和Chervyakov等[38, 43-44]研究了Cu-Ni合金在H2SO4、Na2SO4、NaCl和含硫酸盐/氯化物等不同电解质溶液中的腐蚀行为.在存在氯离子的情况下,电极表面易形成多孔厚膜,膜的厚度和膜中的Cu含量随氯离子的浓度降低而增加. Kharafi发现在硫酸及硫酸盐溶液中电极则易形成致密的产物层,而Chervyakov发现在含Na2S的条件下,合金表面会生成富含Ni的保护性较差的薄膜,一段时间后,产物膜中富集铜的硫化物,保护性能更差.
2.4 冲刷速度的影响当铜合金与流体界面间发生相对运动时,其速度的大小会对其腐蚀的速度有影响.杜娟[45]对B10铜镍合金腐蚀的流速因素进行研究,发现在静态海水中B10合金的腐蚀速率明显低于流动海水中的腐蚀,流动海水中冲刷初期的腐蚀速率较大,随着冲刷腐蚀时间的增加,腐蚀速率逐渐减小并趋于稳定.孙婷婷等[32]发现海水流速由0提高到3 m/s,材料的腐蚀速率变化缓慢;海水流速提高到5 m/s后,B10的腐蚀速率迅速增大,材料的腐蚀明显加速.原因可能是在低于3 m/s流速下,B10铜镍合金表面存在保护膜,冲刷腐蚀过程受扩散过程控制,腐蚀速率增加缓慢;高于临界流速时,海水的机械冲刷作用会导致表面保护膜破裂,Cl-等向界面传输加速,导致表面膜溶解,B10铜镍合金的腐蚀随着流速升高迅速加剧.
3 腐蚀产物膜对Cu-Ni合金腐蚀行为的影响North和Pryor[6]在1970年提出了一个双层产物膜模型对腐蚀机理和腐蚀产物膜的形成进行了解释,认为铜镍合金之所以具有良好的耐蚀性能,应归功于其薄而致密的内层Cu2O膜,许多学者也证实了这个观点. Cu2O的结构是立方点阵,Cu+和O2-被包含在立方晶格的两个贯穿孔内,是具有高度缺陷的‘p’型半导体,其结构可以表述为一些Cu+从晶格中缺失,为保持电中性,阳离子空位附近的单个正电荷(空位)发生迁移,产生了阳离子空位.由于大量阳离子空位的存在,阳离子通过相对容易,这一结构特征降低了膜层的电阻值.外层则为厚且疏松、保护性差的具有化学吸附水分子的CuO膜.溶液中的O、Cl、S等元素易通过扩散穿过外层与内层接触,同时由于附着性差容易剥落形成点蚀坑.近数十年来,大量学者[38, 43-44, 46-48]对Cu-Ni合金的腐蚀产物膜进行了深入的研究,North的双层模型得到了多数学者[39, 46-47, 49]的验证和认同.
Chauhan[47]对Cu-10Ni合金在污染和未污染的海水中的腐蚀行为进行了研究,发现合金表面的腐蚀产物膜具有双层结构,外层为吸附水分子和少量氯离子的CuO,内层则为含有Ni2+和Ni3+的Cu2O. Yuan[39]的研究发现在洁净海水中,随着时间的延长,Cu-30Ni表面的腐蚀产物膜由1层变成了2层,而且随着产物膜的厚度增加,其耐蚀性得到了提高. MA[8]通过对浸泡一个月的Cu-10Ni合金的产物层进行分析发现产物膜分为3层,外层是为Cu2O、γ-FeOOH及只有数个纳米厚的Cu(OH)2Cl层,中间层为白色的小晶粒,内层则为比外层致密的Cu2O,这在别的文献中是没有出现过的.利用EPMA对腐蚀层进行分析,发现白色小晶粒富集铜,其形成机理尚不明确.
利用XPS对浸泡不同时间形成的产物膜进行成分分析[39-40],发现在洁净海水浸泡早期的产物膜主要是Cu2O及少量的CuO、NiO、CuCl组成,浸泡10 d之后则主要由Cu2O、CuO组成.而在含硫的海水中,合金只能在表面形成一层多孔的不具有保护性的由CuCl、Cu2S、NiS、Cu2O、NiO、CuO、Ni(OH)2、Cu2S组成的产物层,这一多孔的产物层还会干扰具有保护性作用的产物层的生成. Milosev[49]研究了Cu-10Ni在含氯离子溶液中的腐蚀行为,发现合金的钝化可以分为两个相互竞争的过程,分别为双层氧化膜的形成和增厚以及CuCl层的形成. CuCl层不具有保护性,而且容易发生点蚀.
但Burleigh等[12]对North等的解释持相反的态度. Burleigh认为North的解释忽略了伴随Ni和Fe并入Cu2O晶格的氧阴离子(O2-)的影响, Burleigh认为是NiO和Fe2O3,而不是Ni2+或者Fe2+、Fe3+并入到Cu2O晶格,这种情况不仅不会消除阳离子空位,反而会产生新的空位. Burleigh利用阳离子空位浓度和电子空穴浓度在恒氧压条件下的关系式对他的观点进行解释:阳离子空位增加将导致电子空穴减少,添加适量Fe、Mn能提高铜镍合金耐蚀性的原因可能与电子空穴的减少有关.
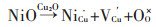
|
(4) |

|
(5) |
式中:
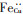
朱小龙[50]利用氩离子溅射对合金腐蚀产物膜内部的化学成分进行分析,结果发现合金的腐蚀产物膜中存在一个Ni的富集区,富集区会随着浸泡时间的增长而变宽,并且Ni的富集程度也随之增加.林乐耘[51]的研究也证实了表面膜中出现了Ni的富集.并入Cu2O薄膜中的Ni2+比Cu+稳定,随着腐蚀的进行,Cu+从膜中向溶液流失,产生了Ni的富集,随着富集程度增大,掺入Cu2O晶格中的Ni含量也相应上升. Zhu[52]发现不完全再结晶板放入海水中浸泡一定时间后,产物膜外层疏松多孔,具有大量的海水组分,内层出现脱镍现象.完全再结晶板浸泡相同时间后形成平滑紧凑并且富Ni的产物膜,并且富Ni程度以及富Ni层的厚度会随着浸泡时间的延长而增大.但是MA[8]利用EPMA得出了与Zhu相反的现象,B10的腐蚀产物膜内层富集Ni,外层贫Ni,在内外层之间不存在一个逐渐减小的浓度梯度差,而是存在着一个空白区域.当Ni富集到一定程度时,Cu2O中的NiO会转化为非晶或者微晶的NiO.也有学者[3, 53-54]认为NiO作为钝化膜的一种,起到提高耐蚀性的作用.
姜雁斌[10]发现添加Fe元素后能在表面形成一层水合氧化铁膜,这层膜主要起两方面的作用:一方面,阻碍各种离子的扩散,防止溶液中的离子接触到基体;另一方面包覆基体,避免冲击腐蚀,MA[8]利用XPS也证实了水合氧化铁膜具有改善耐蚀性的作用,由于当Cu溶解时,Fe会氧化和沉淀,所以MA还提出γ-FeOOH的含量可以用来判断腐蚀速率的快慢.张荣伟[17]提出FeOOH会提高腐蚀产物膜中Ni及NiO含量,减少腐蚀产物膜中阳离子空位数量,加大Cl-膜中扩散阻力,提高腐蚀产物膜的保护能力.
4 初始表面膜对Cu-Ni合金腐蚀行为的影响铜镍合金的腐蚀特征是局部腐蚀.由于电极表面的不均匀性,在早期很难用常规方法对表面发生的局部腐蚀过程进行探测,各种侵蚀性离子(氯离子、硫离子、硫酸根离子等)在某些活性点上对铜镍合金表面膜的破坏是一个不均匀过程.
由于Cu、Ni元素无限固溶,Cu-Ni合金具有非常好的均匀性,这也致使Cu-Ni合金的腐蚀破坏以点蚀为主.而合金的耐点蚀能力与合金的初始表面膜有关.管材加工过程中表面易残留润滑剂,退火时残留的润滑剂容易分解为碳膜覆盖在管壁,构成以Cu为阴极的电化学腐蚀形成点蚀坑[55].林乐耘[51]将表面残碳和不含残碳的Cu-30Ni合金进行两年全浸实验,发现碳以游离态形式存在时,会导致合金管壁严重腐蚀,而非游离态的“碳膜”不影响合金的耐蚀性. Cigna[56]发现表面存在碳膜与不存在碳膜的样品的电位差不具有显著的差异. Zanoni[53]利用XPS对不同工艺处理后的管材表面进行分析,发现光亮退火后的管材表面含锰量高达30%,经过酸洗后表层含锰量略低于基体含锰量,富集的Mn主要以MnO2形式存在. Cigna[56]利用EPMA发现在Mn富集在晶界,并在相同位置上还存在O.由于富含氧化锰的区域与不富含锰的区域存在电位差,形成腐蚀微电池,高浓度的锰使合金更容易受到不同形式的局部腐蚀的影响.但Gusmano[40]认为富锰氧化膜本身并不是有害的,只是不正确的使用条件,促进了点蚀的发展.
5 展望我国拥有着非常漫长的海岸线和及其丰富的海洋资源,随着国家“一带一路”倡议、“海洋强国战略”“海洋十三五规划”等重大战略的提出与实施,为我国海洋经济带来了前所未有的发展机遇.因此,针对海洋耐蚀材料尤其是舰船用Cu-Ni合金提出了更高的要求.目前,国内外很多学者针对Cu-Ni合金做了很多工作,得到了很多有价值的数据,但是关于Cu-Ni合金产物膜成膜机理、各元素在合金中的分布及作用仍未得到统一的解释.其具体表现如下:
1)Cu-Ni合金腐蚀产物膜的形成过程及其转变机理研究存在不足,铜的氧化物是通过直接氧化还是溶解铜的再沉积形成的,目前尚未有一致的观点.
2)各合金元素和腐蚀产物膜在腐蚀过程中的作用尚不明确,合金元素是以金属态还是氧化态存在?微量合金元素如Fe、Mn含量变化影响腐蚀过程的机制,以何种形式强化Cu-Ni合金的耐蚀性能尚不明确.
3)形成稳定腐蚀产物膜后,Cu-Ni合金的腐蚀速率趋于稳定,这表明Cu-Ni合金与介质之间达到了动态平衡,关于这个动态平衡的形式尚不明确.
| [1] |
杨博均, 陈翔峰, 姚敬华, 等. 铜及铜合金在淡海水交替自然环境条件下的腐蚀行为研究[J].
装备环境工程, 2017, 14(2): 24–30.
|
| [2] |
BADAWY W A, ISMAIL K M, FATHI A M. Effect of Ni content on the corrosion behavior of Cu-Ni alloys in neutral chloride solutions[J].
Electrochimica Acta, 2005, 50(18): 3603–3608. DOI: 10.1016/j.electacta.2004.12.030. |
| [3] |
EFIRD K. The synergistic effect of Ni and Fe on the sea-water corrosion of copper-alloys[J].
Corrosion, 1977, 33(10): 347–350. DOI: 10.5006/0010-9312-33.10.347. |
| [4] |
BECCARIA A M, CROUSIER J. Dealloying of Cu-Ni alloys in natural sea water[J].
British Corrosion Journal, 1989, 24(1): 49–53. DOI: 10.1179/000705989798270342. |
| [5] |
CROUSIER J, BECCARIA A M. Behaviour of Cu-Ni alloys in natural sea water and NaCl solution[J].
Materials & Corrosion, 1990, 41(4): 185–189. |
| [6] |
NORTH R F, PRYOR M J. The influence of corrosion product structure on the corrosion rate of Cu-Ni alloys[J].
Corrosion Science, 1970, 10(5): 297–311. DOI: 10.1016/S0010-938X(70)80022-1. |
| [7] |
BLUNDY R G, PRYOR M J. The potential dependence of reaction product composition on copper-nickel alloys[J].
Corrosion Science, 1972, 12(1): 65–75. |
| [8] |
MA A L, JIANG S L, ZHENG Y G, et al. Corrosion product film formed on the 90/10 copper-nickel tube in natural seawater:Composition/structure and formation mechanism[J].
Corrosion Science, 2015, 91: 245–261. DOI: 10.1016/j.corsci.2014.11.028. |
| [9] |
MANSFELD F, UHLIG H H. Effect of d-band structure on secondary passivity in Ni-Cu alloys[J].
Corrosion Science, 1969, 9(6): 377–384. DOI: 10.1016/S0010-938X(69)80033-8. |
| [10] |
姜雁斌, 谢建新. Fe含量对CuNi10FeMn1合金组织与性能的影响[J].
中国有色金属学报, 2016, 35(8): 1659–1667.
|
| [11] |
POPPLEWELL J M, HART R J, FORD J A. The effect of iron on the corrosion characteristics of 90-10 cupro nickel in quiescent 3.4%NaCl solution[J].
Corrosion Science, 1973, 13(4): 295–309. DOI: 10.1016/0010-938X(73)90007-3. |
| [12] |
BURLEIGH T D, WALDECK D H. Effect of alloying on the resistance of Cu10% Ni alloys to seawater impingement[J].
Corrosion, 1999, 55(8): 800–804. DOI: 10.5006/1.3284036. |
| [13] |
DROLENGA L J P, IJSSELING F P, KOLSTER B H. The influence of alloy composition and microstructure on the corrosion behaviour of Cu-Ni alloys in seawater[J].
Materials & Corrosion, 1983, 34(4): 167–178. |
| [14] |
张杰, 王清, 王英敏, 等. 含Fe和Mn的Ni30Cu70固溶体团簇模型与耐蚀性研究[J].
金属学报, 2009, 45(11): 1390–1395.
DOI: 10.3321/j.issn:0412-1961.2009.11.019.
|
| [15] |
张荣伟, 孙军伟, 李升燕, 等. 锰元素对铜镍合金电化学性能的影响[J].
有色金属科学与工程, 2018, 9(4): 60–65.
|
| [16] |
罗利阳, 朱安印, 陈景林, 等. 抗变色仿金稀土铜合金的耐蚀行为[J].
中国有色金属学报, 2011, 21(7): 1639–1646.
|
| [17] |
张荣伟.铁、锰对B10白铜合金耐蚀性能的影响及机理研究[D].赣州: 江西理工大学, 2019.
|
| [18] |
毛向阳, 方峰, 谈荣生, 等. 稀土对铜及铜合金组织和性能影响的研究进展[J].
稀土, 2008, 29(3): 75–80.
DOI: 10.3969/j.issn.1004-0277.2008.03.019.
|
| [19] |
程巨强, 刘志学, 倪自飞, 等. 稀土和硼细化处理对铸造铅黄铜组织和脱锌腐蚀性能的影响[J].
铸造, 2008, 57(4): 378–380.
|
| [20] |
唐宁, 李周, 程建奕, 等. 稀土铝黄铜在NaCl溶液中腐蚀行为的研究[J].
材料热处理学报, 2007, 28(6): 104–108.
|
| [21] |
林高用, 万迎春, 杨伟, 等. 稀土含量对BFe10-1-1铁白铜在流动人工海水中的腐蚀行为影响[J].
腐蚀科学与防护技术, 2010, 22(6): 514–517.
|
| [22] |
毛向阳, 谈荣生, 赵秀明, 等. 含稀土Cu-30Ni-xRE(x=0~0.213)合金耐腐蚀性能及其机理研究[J].
稀有金属材料与工程, 2016, 45(5): 1349–1352.
|
| [23] |
谈荣生, 蒋建清, 孙连超. 稀土锡黄铜的耐蚀性能及腐蚀机理研究[J].
中国稀土学报, 1995(S1): 457–461.
|
| [24] |
KIRK W W, LEE T S, LEWIS R O. Corrosion and marine fouling characteristics of copper-nickel alloys: proceedings of the symposium on copper alloys in marine environments[C]// Copper Development Association. Proceedings of Seminar on Copper Alloys in Marine Environments. Edgbaston: University of Birmingham, 1985: 41-53.
|
| [25] |
ZHANG J, WANG Q, WANG Y, et al. Highly corrosion-resistant Cu70(Ni, Fe, Mn, Cr)30 cupronickel designed using a cluster model for stable solid solutions[J].
Journal of Alloys and Compounds, 2010, 505(1): 176–182. |
| [26] |
JEON W S, SHUR C C, KIM J G, et al. Effect of Cr on the corrosion resistance of Cu-6Ni-4Sn alloys[J].
Journal of Alloys and Compounds, 2008, 455(1/2): 359–363. |
| [27] |
ANDERSON D B, BADIA F A. Chromium modified Copper-Nickel alloys for improved seawater impingement resistance[J].
Journal of Engineering for Gas Turbines & Power, 1973, 95(2): 132. |
| [28] |
张雅妮, 訾进蕾, 郑茂盛, 等. 微量Cr的添加对铜合金耐蚀性的影响[J].
稀有金属材料与工程, 2007, 36(3): 49–52.
|
| [29] |
TUCK C D S, BENDALL, et al. High strength copper nickel- Optimization of mechanical strength and marine corrosion resistance for use in naval architecture and offshore oil and gas[C]. Corrosion, 1996.
|
| [30] |
MARY N, ALEMANY-DUMONT C, NORMAND B, et al. Electrochemical behaviour of copper-nickel alloys as immobilisation matrices for the storage of fission products in CO2-enriched synthetic groundwater[J].
Electrochimica Acta, 2013, 98(5): 11–19. |
| [31] |
TAHER A, JARJOURA G, KIPOUROS G J. Electrochemical behaviour of synthetic 90/10 Cu-Ni alloy containing alloying additions in marine environment[J].
British Corrosion Journal, 2013, 48(1): 49–52. |
| [32] |
孙婷婷, 李宁, 薛建军, 等. 环境因素对B10铜镍合金耐蚀性的影响[J].
装备环境工程, 2010(4): 25–28.
DOI: 10.3969/j.issn.1672-9242.2010.04.007.
|
| [33] |
EZUBER H M, AL-SHATER A, MURRA F, et al. Corrosion behavior of Copper-Nickel alloys in seawater environment[C]//MECC. 16th Middle East Corrosion Conference & Exhibition. Bahrain : Bahrain Society of Engineers, 2016.
|
| [34] |
WANG Y Z, BECCARIA A M, POGGI G. The effect of temperature on the corrosion behaviour of a 70/30 Cu-Ni commercial alloy in seawater[J].
Corrosion Science, 1994, 36(8): 1277–1288. DOI: 10.1016/0010-938X(94)90181-3. |
| [35] |
NADY H, HELAL N H, EL-RABIEE M M, et al. The role of Ni content on the stability of Cu-Al-Ni ternary alloy in neutral chloride solutions[J].
Materials Chemistry and Physics, 2012, 134(2/3): 945–950. |
| [36] |
AWAD N K, ASHOUR E A, FOUDA A S, et al. Effect of alloying elements on the electrochemical behavior of Cu-Ni-Zn ternary system in sulfide-polluted saltwater[J].
Applied Surface Science, 2014, 307(8): 621–630. |
| [37] |
ISMAIL K M, FATHI A M, BADAWY W A. Electrochemical behavior of copper-nickel alloys in acidic chloride solutions[J].
Corrosion Science, 2006, 48(8): 1912–1925. DOI: 10.1016/j.corsci.2005.07.004. |
| [38] |
CHERVYAKOV V N, MARKOS'YAN G N, PCHEL'NIKOV A P. Corrosion behavior of Copper-Nickel alloys in neutral chloride and sulfide containing solutions[J].
Protection of Metals and Physical Chemistry of Surfaces, 2004, 40(2): 111–115. |
| [39] |
YUAN S J, PEHKONEN S O. Surface characterization and corrosion behavior of 70/30 Cu-Ni alloy in pristine and sulfide-containing simulated seawater[J].
Corrosion Science, 2007, 49(3): 1276–1304. DOI: 10.1016/j.corsci.2006.07.003. |
| [40] |
GUSMANO G, TRAVERSA E, SIMONCELLI C, et al. Effect of service conditions on corrosion performance of alloy CN 108 tubes in MSF desalinators[J].
Materials Chemistry & Physics, 1990, 24(5): 457–471. |
| [41] |
DOMIATY A E, AL-HAJJI J N. The susceptibility of 90Cu-10Ni alloy to stress corrosion cracking in seawater polluted by sulfide ions[J].
Journal of Materials Engineering and Performance, 1997, 6(4): 534–544. DOI: 10.1007/s11665-997-0126-9. |
| [42] |
KONG D C, DONG C F, XU A N, et al. Effect of sulfide concentration on copper corrosion in anoxic chloride-containing solutions[J].
Journal of Materials Engineering and Performance, 2017, 26(4): 1740–1750. |
| [43] |
AL-KHARAFI F M, GALAL A, NAZEER A A, et al. Electrochemical and surface investigation of thin-surface films over 90copper-10nickel alloy in chloride ion-containing electrolytes[J].
Corrosion, 2015, 71(4): 455–469. DOI: 10.5006/1447. |
| [44] |
MUKHOPADHYAY N, BASKARAN S. Characterization of corrosion products on cupronickel 70:30 alloy in sulfide-polluted seawater[J].
Corrosion -Houston Tx-, 1986, 42(2): 113–117. |
| [45] |
杜娟, 王洪仁, 杜敏, 等. B10铜镍合金流动海水冲刷腐蚀电化学行为[J].
腐蚀科学与防护技术, 2008, 20(1): 12–18.
DOI: 10.3969/j.issn.1002-6495.2008.01.004.
|
| [46] |
KATO C. A Rotating disk study of the corrosion behavior of Cu9.4Ni1.7Fe alloy in air-saturated aqueous NaCl solution[J].
Journal of the Electrochemical Society, 1984, 131(6): 1219–1224. DOI: 10.1149/1.2115791. |
| [47] |
CHAUHAN P K, GADIYAR H S. An XPS study of the corrosion of Cu-10Ni alloy in unpolluted and polluted sea-water; the effect of FeSO4 addition[J].
Corrosion Science, 1985, 25(1): 55–68. |
| [48] |
林乐耘, 刘少峰, 刘增才, 等. 铜镍合金海水腐蚀的表面与界面特征研究[J].
腐蚀科学与防护技术, 1999(1): 37–43.
DOI: 10.3969/j.issn.1002-6495.1999.01.005.
|
| [49] |
MILOSEV I, METIKOS-HUKOVIC M. ChemInform abstract:passive films on 90Cu-10Ni alloy:The mechanism of breakdown in chloride containing solutions[J].
Cheminform, 1991, 22(9): 102–108. |
| [50] |
朱小龙, 雷廷权. 70Cu-30Ni合金海水腐蚀产物膜形成过程[J].
金属学报, 1997, 14(12): 1256–1261.
|
| [51] |
林乐耘, 罗德清. 原始表面状态对Cu-Ni(70:30)合金管耐海水腐蚀性能的影响[J].
稀有金属, 1989(2): 142–146.
|
| [52] |
ZHU X, LEI T. Characteristics and formation of corrosion product films of 70Cu-30Ni alloy in seawater[J].
Corrosion Science, 2002, 44(1): 67–79. |
| [53] |
ZANONI R, TRAVERSA E, MONTESPERELLI G, et al. X-ray photoelectron spectroscopy investigation of corrosion behavior of ASTM C71640 copper-nickel alloy in seawater[J].
Corrosion, 1992, 48(5): 404–404. DOI: 10.5006/1.3315953. |
| [54] |
EFIRD K D. Potential-pH diagrams for 90-10 and 70-30Cu-Ni in sea water[J].
Corrosion -Houston Tx-, 1975, 31(3): 77–83. |
| [55] |
MARSDEN D D. Early failure of cupro-nickel heat exchanger tubes a case history[J].
Materials Performance, 1978, 17(8): 9–15. |
| [56] |
CIGNA R, GUSMANO G, ZAMA M. Influence of surface finishes on corrosion behaviour of CN108 alloy for condenser tubes in sea water[J].
Materials Chemistry & Physics, 1989, 23(3): 311–327. |
 2019, Vol. 10
2019, Vol. 10


