| 螺旋藻对模拟矿山废水中稀土镱离子的吸附性能 |
钐(Sm)、铽(Tb)、镱(Yb)等15种镧系元素和与镧系元素性质极为相似的钪、钇共17种元素,统称为稀土元素.稀土是冶金机械、石油化工、玻璃陶瓷、磁性材料、发光和激光材料、储氢材料、催化材料、核材料、肥料、饲料等重要的添加剂,被誉为“工业维生素”[1-3].在我国南方地区(如江西赣州)广泛分布着以离子相形态存在的稀土矿,其富含中重稀土元素.由于稀土元素分布分散,往往杂乱成矿,再加上它们的性质彼此很相似,所以单一稀土元素的分离是一个极为困难和复杂的过程.目前,主要采用原地浸矿法来实现稀土元素的开采利用,这类方法使用简单、自动化程度高,但缺点是稀土矿层各部位的矿石胶结程度和渗透性不均匀,这样在增加浸出液的时候会将部分稀土元素带入矿山废水中,导致资源浪费.
因此,从稀土矿山废水中回收和循环利用稀土技术已成为解决当前稀土领域资源和环境问题的重要途径和手段.但是,稀土矿山废水中稀土离子含量在1~100 mg/L,通常利用树脂吸附分离法进行稀土元素(如镱元素)的纯化处理回收[4-6].如熊春花等[7, 8]利用新型螯合亚氨基二乙酸树脂在NaAc-HAc缓冲体系中对镱(Ⅲ)进行吸附研究,研究发现亚氨基二乙酸树脂对镱(Ⅲ)的吸附在pH=5.13的NaAc-HAc缓冲体系中较优,每克树脂在298 K下的静态饱和吸附容量为187 mg,并且1~2 mol/L HCl可以对亚氨基二乙酸树脂进行脱附.之后,又在此研究基础上开发出凝胶型弱酸树脂对镱(Ⅲ)进行吸附研究,结果显示凝胶型弱酸树脂对镱(Ⅲ)的吸附在pH=5.5的NaAc-HAc缓冲体系中较优,每克树脂在298 K下的静态饱和吸附容量为256.8 mg,利用3 mol/L HCl可以进行脱附处理.
虽然树脂法在纯化回收稀土离子方面性能优良,但是生产树脂需要大量的有机溶剂,并且后期处理成本高,且产生的二次废水、废气问题会进一步污染环境.对此研究人员提出利用生物材料对稀土矿山废水中稀土离子的吸附回收,主要选取细菌、真菌、酵母、藻类作为金属离子的吸附剂.相比于传统树脂吸附法,生物吸附法是一种新兴的废水处理技术,其具有以下优点:原料来源丰富,品种多,成本低;设备简单,易操作,投资小,运行费用低;吸附量大,处理效率高;在低浓度下金属可以被选择性地去除;pH值和温度范围宽;可有效进行金属回收[9-11].如徐淑霞等[12]利用黄孢原毛平革菌210作为生物吸附剂处理La3+,当pH=7,La3+浓度为40 mg/L,菌体投加量为60 mg/L,吸附时间为120 min时,La3+吸附量可达到最大值141±4.72 mg/g. Abuzer等[13]首次将螺旋藻运用在含有低浓度Cd2+和Ni2+工业废水的处理上,结果发现Cd2+和Ni2+的最大吸附量分别为73.64 mg/g和69.04 mg/g.
基于使用螺旋藻吸附分离矿山废水中的低浓度稀土离子(如Yb3+)的报道较缺乏的现状,文中尝试将螺旋藻运用于吸附分离模拟矿山废水中的Yb3+,并通过研究被处理液的pH值、螺旋藻的剂量、初始镱离子浓度和吸附时间等因素,探讨螺旋藻吸附Yb3+过程中的影响因素.以期在稀土离子生物富集、生物分离和稀土矿山废水的治理方面发挥作用.
1 实验材料与方法 1.1 螺旋藻生物质吸附剂的培养螺旋藻的培养过程如下:①将藻种放入Zarrouk培养基中,冷光源3000 lx连续光照,并将转速和温度设定为90 r/min和25 ℃;②培养完成后,将收集到的螺旋藻经离心机于8 000 r/min下离心8 min,收集螺旋藻生物质;③将收集到的螺旋藻沉淀物用蒸馏水洗涤2次,并重复离心作用2次,放入烘箱中于70 ℃干燥24 h,收集干燥后的螺旋藻生物质;④将收集到的干燥螺旋藻生物质研磨,并经75~100 μm筛网筛选,存储备用.
1.2 螺旋藻结构表征利用扫描电子显微镜(SEM,MLA650,美国FEI公司)观察螺旋藻的外观形貌;利用傅里叶红外光谱仪(FT-IR,Magna-IR 750,美国Nicolet公司),经KBr压片法分析吸附Yb3+前后的螺旋藻表面官能团的变化;通过多功能成像电子能谱仪(XPS,ESCALAB 250XI,美国赛默飞世公司),采用单色Al Kl(hv=1 486.6 eV),功率为150 W,50 000束斑对螺旋藻吸附Yb3+前后不同元素之间所形成的价键情况差异进行了分析.
1.3 稀土镱离子的浓度测定水溶液中镱的测定按照中国国家标准体系中的《GB/T 18115.11-2006单道扫描电感耦合等离子体发射光谱(ICP-AES)法[14, 15].
1.4 吸附实验为了测定吸附剂较优吸附条件,通过调节pH值、吸附剂剂量、吸附时间和Yb3+初始浓度,实验于25 ℃下批量进行. Yb3+的吸附实验在pH值2~6范围内进行,螺旋藻剂量为1~8 g/L,吸附时间为10~150 min,Yb3+初始浓度为50~300 mg/L,实验中使用0.1 mol/L HNO3 / 0.1 mol/L NaOH调节溶液pH值.
Yb3+的吸附效率、t时间的吸附量qt、平衡吸附量qeq和解吸附率可分别用下式计算:
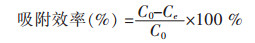
|
(1) |
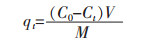
|
(2) |
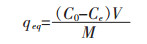
|
(3) |

|
(4) |
qeq(mg/g)为金属离子平衡吸附量,qt(mg/g)为吸附剂在时间t的金属离子吸附量,Ce(mg/L)为吸附平衡时溶液的金属离子浓度,t(min)为吸附时间,M(g)为吸附剂质量,V(L)为溶液体积.
1.5 解吸附实验为了研究螺旋藻吸附Yb3+的解吸附与回收效果,进行了以下实验研究,具体如下:①取0.1 g的螺旋藻吸附剂与100 mg/L 50 mL的Yb3+进行吸附作用一段时间,结束吸附,通过离心分离出螺旋藻吸附剂,并用去离子水冲洗3次;②将吸附Yb3+后的螺旋藻与50 mL 0.1 mol/L的硝酸溶液混合均匀,充分振荡5 h,静置,离心分离螺旋藻,并测定溶液中的Yb3+浓度.
1.6 等温吸附模型、吸附热力学及吸附动力学方程通过Langmuir型吸附模型、Freundlich型吸附模型、Dubinin-Radushkevich(D-R)吸附模型、Redlich-Peterso吸附模型应用在Yb3+的吸附研究上[16],以上模型的表示形式如下:

|
(5) |

|
(6) |

|
(7) |
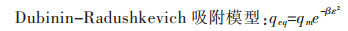
|
(8) |
qeq(mg/g)为金属离子平衡吸附量,Ce(mg/L)为吸附平衡时溶液的金属离子浓度,KF(L/mg)和nF为表征吸附能力的Freundlich等温常数,qm(mg/g)为金属离子的最大吸附量,KL(L/mg)为表征吸附能力的Langmuir等温常数,KR-P和aR-P(L/mg)是表征吸附能力的Redlich-Peterso等温常数,α为Redlich-Peterso指数常数,β(mol2/J2)为表征吸附自由能的吸附常数,ε是Polanyi电位,常数β可用于计算吸附自由能E(kJ/mol),计算公式为:
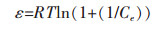
|
(9) |
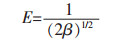
|
(10) |
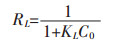
|
(11) |
不同吸附温度(25~45 ℃)下的热力学参数由下式计算,包括吉布斯自由能(ΔG0)、熵(ΔS0)和焓(ΔH0):
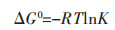
|
(12) |
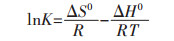
|
(13) |
吸附动力学对于研究实际生物吸附过程中的变化规律和对生物吸附系统的设计都具有非常重要的意义.动力学研究为生物吸附过程中的吸附速率、处理机制和内在速率控制步骤提供研究依据.因此,文中使用伪一级动力学方程,伪二级动力学方程,Elovich动力学方程和内扩散模型来模拟螺旋藻吸附Yb3+过程中的动力学参数[17, 18].其数学方程模型用以下公式表示:
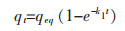
|
(14) |
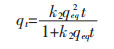
|
(15) |
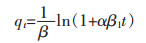
|
(16) |
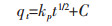
|
(17) |
qt(mg/g)为吸附剂在时间t的金属离子吸附量,qeq(mg/g)为金属离子平衡吸附量,k1(min-1)和k2(g·mg-1·min-1)为伪一级动力学方程和伪二级动力学方程常数,α(mg·g-1·min-1)为初始吸附速率,β1(g·mg-1)解吸附常数,kp(mg·g-1·min-1/2)颗粒内扩散模型的速率常数,C(mg·g-1)为边界层厚度常数.
2 结果与讨论 2.1 吸附剂的表征对螺旋藻吸附Yb3+前后的表面形貌进行了扫描电镜分析,结果如图 1所示,从图 1中可以看出螺旋藻表面结构在吸附前后的变化,螺旋藻吸附前表面较为光滑,吸附之后表面结构变得粗糙,由此可以看出螺旋藻表面在吸附镱离子前后存在显著差异,这与Rezaei[19]发现的结果相似;表 1列出了螺旋藻吸附Yb3+前后的元素变化情况.
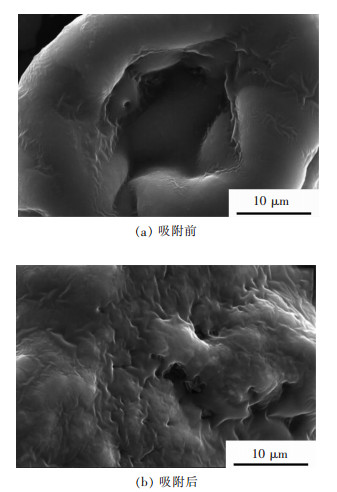 |
| 图 1 螺旋藻吸附Yb3+前的及吸附Yb3+后的SEM分析图谱 Fig. 1 Scanning electron microscope analysis spectra of spirulina before (a) and adsorption of Yb3+ (b) |
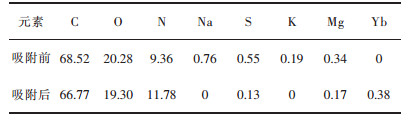
| 表 1 吸附Yb3+前后螺旋藻中的各元素含量/% Table 1 Element content of spirulina before and after adsorption of Yb3+ /% |
 |
| 点击放大 |
从表 1可以看出,C、O、N是螺旋藻的主要组成部分,Na、S、K、Mg是螺旋藻主要的几种金属元素,而Yb在吸附前并未在螺旋藻中出现,吸附后发现在能谱图中出现了与Yb相对应的峰,且与Na和K相对应的峰消失,由此可知,螺旋藻在对Yb3+的吸附过程中,发生了阳离子交换,Yb3+被吸附到螺旋藻上,而K、Na被释放到溶液中.
通过FT-IR观察了吸附Yb3+前后的螺旋藻中官能团的峰强度的变化情况,吸附Yb3+前后的FT-IR光谱如图 2(a)和图 2(b)所示,从图 2(a)中可以看出,在3 315 cm-1、2 926 cm-1、1 659 cm-1、1 539 cm-1、1 451 cm-1、1 394 cm-1、1 239 cm-1、1 040 cm-1附近有强吸收峰.图谱中在3 315 cm-1处的吸收峰是由于-OH和-NH基团的伸缩振动[20],在2 926 cm-1处的吸收峰是由于-CH的伸缩振动[21],在1 730~1 390 cm-1区间内的吸收峰是由于醛基、酮基、羧基的伸缩振动[22],其中在1 300~1 000 cm-1处可以观测到-C-O,-C-C,-C-OH基团的伸缩振动[23],在750~900 cm-1的吸收峰可以归因于-P-O,-S-O,芳烃环上C-H的伸缩振动[13].从图 2(b)中可以看出,吸附后螺旋藻的吸收峰发生变化,从谱图中可以看出,螺旋藻吸附Yb3+后,与氨基(3 315 cm-1),羧基(1 730~1 390 cm-1,1 300~1 000 cm-1),羟基(3 265 cm-1,1 300~1 000 cm-1),磷酸基及磺酸基(750~900 cm-1)等相对应的特征峰的强度发生了变化[24].以上特征峰强度的偏移变化表明这些基团参与了生物吸附过程,当吸附过程发生的时候,这些带负电荷的官能团会与带正电荷的金属离子在螺旋藻表面螯合.
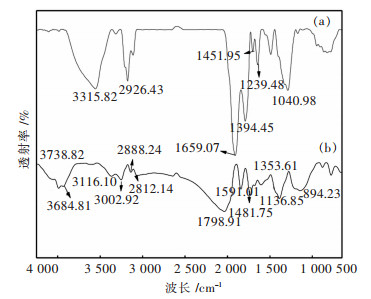 |
| 图 2 螺旋藻吸附Yb3+前(a)和吸附后(b)红外光谱 Fig. 2 Fourier infrared spectroscopy of spirulina (a) and adsorption (b) |
为了解螺旋藻吸附Yb3+前后,其含有的各种元素的价态情况,从而确定吸附的有效性,对吸附Yb3+前后的吸附剂进行了X射线光电子能谱表征分析,结果见图 3.
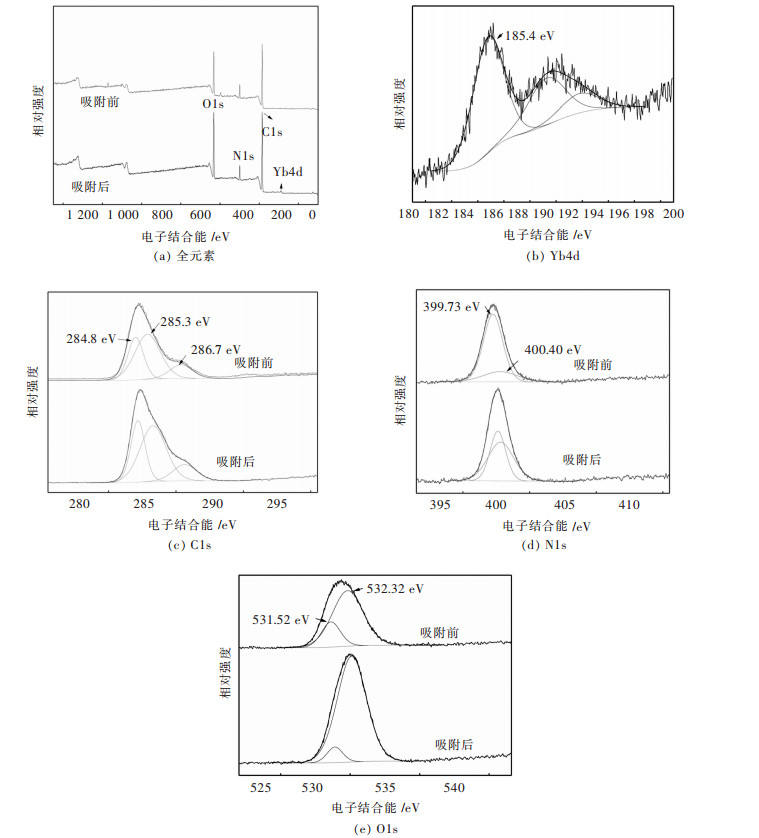 |
| 图 3 吸附Yb3+前后螺旋藻的XPS图谱 Fig. 3 X-ray photoelectron spectroscopy of spirulina before and after adsorption of Yb3+ |
图 3(b)为Yb4d谱图,在结合能为185.4 eV处出现结合能峰,属于Yb3+结合能特征峰[25],证明螺旋藻在表面吸附镱离子. 图 3(c)为C1s谱图,吸附前在结合能为284.8 eV、285.3 eV和286.7 eV处出现的结合能峰,分别属于C-C、C-O和C=O键的结合能峰[26],吸附后在结合能为285 eV、285.7 eV和287.2 eV处出现结合能峰. 图 3(d)为N1s谱图,吸附前结合能峰分别在399.73 eV和400.40 eV处,属于C-NH2基团,吸附后在399.93 eV和400.62 eV处得到结合能峰[27].观察图 3(e)中的O1s谱图,吸附前在结合能531.52 eV和532.32 eV处出现的峰分别对应C-O和C=O键的结合能特征峰,吸附后在531.98 eV和532.46 eV出现的峰分别对应金属碳酸盐和C=O键结合能特征峰[27].由此可以得出以下结论:镱元素的存在说明稀土离子成功吸附在螺旋藻表面,图 3(c)C1s中C-O结合能峰消失可能是由于C-O官能团参与吸附过程.在图 3(d)中N1s的结合能出现了高能偏移的现象,这是由于镱元素和C=O元素均具有吸电子效应,导致N元素的价电子层密度减小,降低了外层电子对芯层电子的屏蔽作用,增大芯层电子的结合能,从而致使结合能向高位偏移.也正是Yb3+的这种作用,直接影响了N1s和C1s的结合能状态,为吸附反应的进行提供可能.其中图 3(e)中O1s的结合能出现的金属碳酸盐结合能特征峰也说明镱离子已经吸附在螺旋藻表面.
2.2 吸附条件对吸附的影响 2.2.1 溶液pH值对螺旋藻吸附Yb3+的影响取50 mg/L和100 mg/L Yb3+的模拟废水于50 mL的锥形瓶中,将投加量设置为2 g/L,并利用0.1 mol/L HNO3 / 0.1 mol/L NaOH调节溶液的pH值在2~6,之后置于摇床中反应60 min.从图 4可以看出,当2≤pH<5时,螺旋藻的吸附效率随着pH的增加上升;当5<pH≤6时螺旋藻的吸附效率随着pH的增加下降.从图 4中可以看出,当溶液在pH值为5时,该吸附剂对Yb3+的去除率最高.
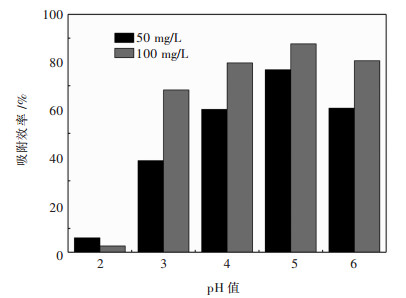 |
| 图 4 不同pH值条件下的吸附效率 Fig. 4 Adsorption efficiency at different pH |
2.2.2 吸附剂用量的选择
取100 mg/L Yb3+模拟废水于50 mL锥形瓶中,调节pH为5,取吸附剂0.4~8.0 g/L置于摇床中反应60 min,结果如图 5.实验结果表明,随着吸附剂用量的增加,去除率先增大后趋于平缓.在吸附剂投加量为2.0 g/L时,吸附率达到最大.因此,较优投加量为2.0 g/L.
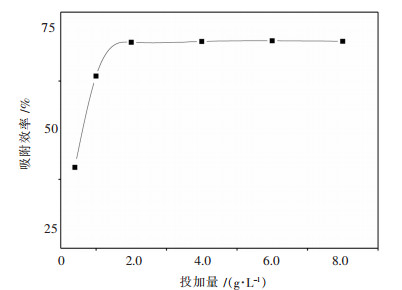 |
| 图 5 不同螺旋藻投加量对吸附效率的影响 Fig. 5 Effect of spirulina dosage on adsorption efficiency |
2.2.3 吸附时间的影响
反应时间是影响吸附剂吸附效率的重要因素.通过图 6中吸附时间对金属离子吸附效率的影响关系可知:螺旋藻在前30 min吸附速率很快,可达到总吸附量的90 %以上,随后吸附速率增速减缓,30 min后吸附速率曲线趋于平稳,反应60 min以后曲线基本不变.实验表明,螺旋藻对金属离子吸附过程为快速的表面吸附过程.重金属离子浓度越高,其与吸附剂之间接触的几率增大,因此吸附速率加快,吸附量增大,达到平衡所需的时间越短.为保证吸附体系充分达到平衡,实验中选定吸附时间为60 min.
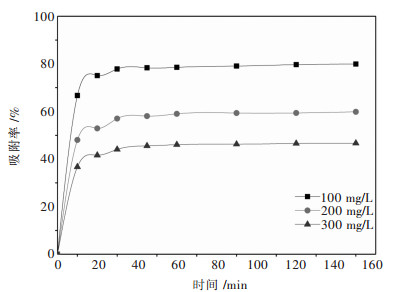 |
| 图 6 不同Yb3+初始浓度下吸附率随时间的变化 Fig. 6 Change of adsorption rate with time at different initial concentrations of metal ions |
2.3 等温吸附线
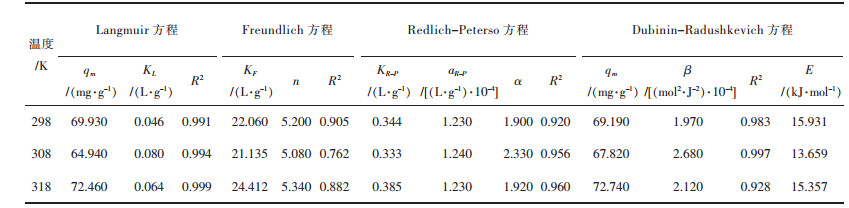
对不同温度下螺旋藻吸附初始浓度100 mg/L Yb3+的吸附结果利用Langmuir方程(式(6))进行拟合,拟合图表如图 7和表 2. Langmuir等温吸附模型拟合结果较好,模拟线性的相关系数达到0.99以上,在25 ℃时螺旋藻吸附Yb3+的最大吸附量为69.93 mg/g.从图 8可以看出分离因子RL值随Yb3+初始浓度增加而减小,说明提高起始Yb3+浓度更有利于吸附,且0 < RL < l进一步证明该吸附为有利吸附,其中螺旋藻对于Yb3+的饱和吸附容量渐趋于定值[28].
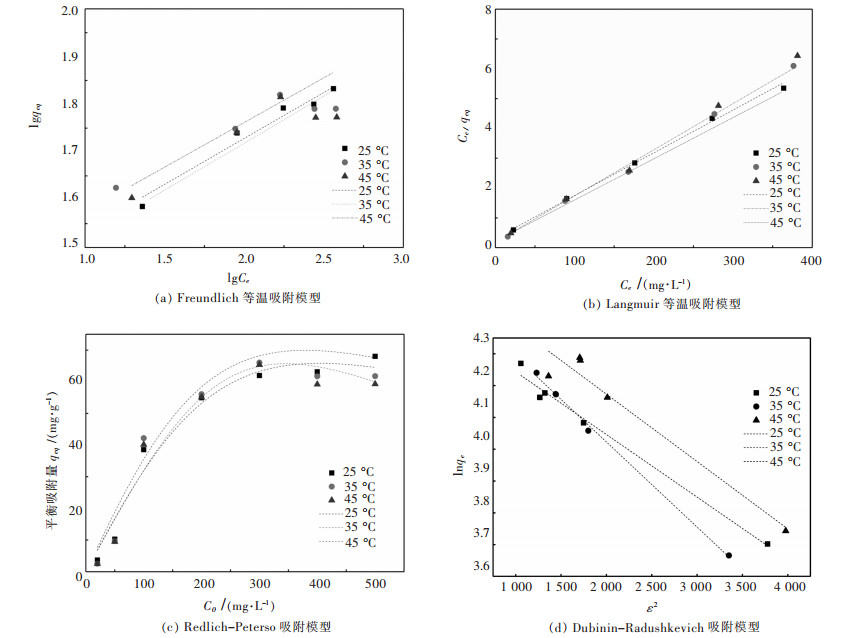 |
| 图 7 吸附模型 Fig. 7 Freundlich isothermal adsorption model |
| 表 2 各等温吸附模型拟合参数数据 Table 2 Fitting data of isothermal adsorption models |
 |
| 点击放大 |
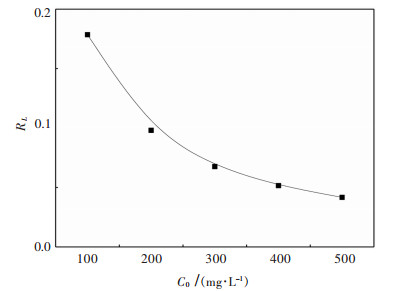 |
| 图 8 分离因子RL随Yb3+浓度的变化 Fig. 8 The variation of separation factor RL with Yb3+ concentration |
吸附平衡数据对Dubinin-Radushkevich方程(式(8))进行拟合得到的结果显示,吸附数据也可以应用在基于非均相吸附质表面的D-R等温吸附模型,其中测定系数R2为0.983(表 2).从D-R等温吸附模型的拟合图发现,qm与β分别为69.19 mg/g和1.970×10-4 mol2/J2.其中吸附能E可以判断吸附机理是物理吸附还是化学吸附,如果E在8~16 kJ/mol之间,则吸附过程由化学吸附的离子交换完成;如果E < 8 kJ/mol,则吸附过程是由物理吸附完成. 表 2中E的数值为15.931 kJ/mol,表明吸附过程由离子交换完成[28].
另一方面,吸附平衡数据也可以应用在基于吸附质在多相表面吸附的Freundlich方程(式(5))上.实验证明,对应螺旋藻单组分吸附体系,F型吸附模型可以一定程度上解释吸附机理.从F型拟合图可以得到KF和n的数值分别为22.060 L/g和5.200,表明螺旋藻在对Yb3+的吸附过程是有利且可以进行的.对于单一组分吸附体系,还可以利用Redlich-Peterso吸附等温模型解释吸附过程. R-P模型结合了L型和F型吸附等温模型特征,利用KR-P,aR-P和α 3个参数来表征吸附体系.通过拟合得到KR-P,aR-P和α3个参数分别为0.344 L/g,1.230×10-4 L/g和1.900,其中相关系数表明该模型拟合数据有一定的相关性,但不足以很好的解释吸附过程.
2.4 吸附热力学吸附热力学参数包括吉布斯自由能ΔG、焓变ΔH以及熵变ΔS.通过式(12)和式(13)计算得到表 3结果,从表 3可以看出,ΔH为0.405 kJ/mol,说明该吸附过程是吸热过程,且绝对值处在氢键键能范围之内(2~40 kJ/mol).吸附自由能变ΔG < 0,说明该吸附过程是自发的. ΔG的绝对值随着温度的上升而逐渐增加,因此升高温度有利于吸附的进行.熵变ΔS>0,说明该吸附过程是熵增加的过程,进一步说明该反应是自发的.
| 表 3 热力学参数数值 Table 3 Thermodynamic parameter values |
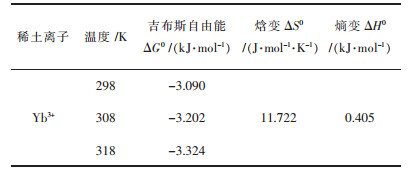 |
| 点击放大 |
2.5 吸附动力学
由吸附动力学方程式(14)~式(17)得到图 9和表 4结果,根据表 4可知,伪二级动力学方程的R2接近0.999,线性相关性很好,说明该吸附过程更符合伪二级动力学方程模型.根据建立伪二级动力学模型的假设可知,吸附过程中吸附剂表面也存在物理相互作用进而影响吸附速率,但是主要以化学吸附为主.
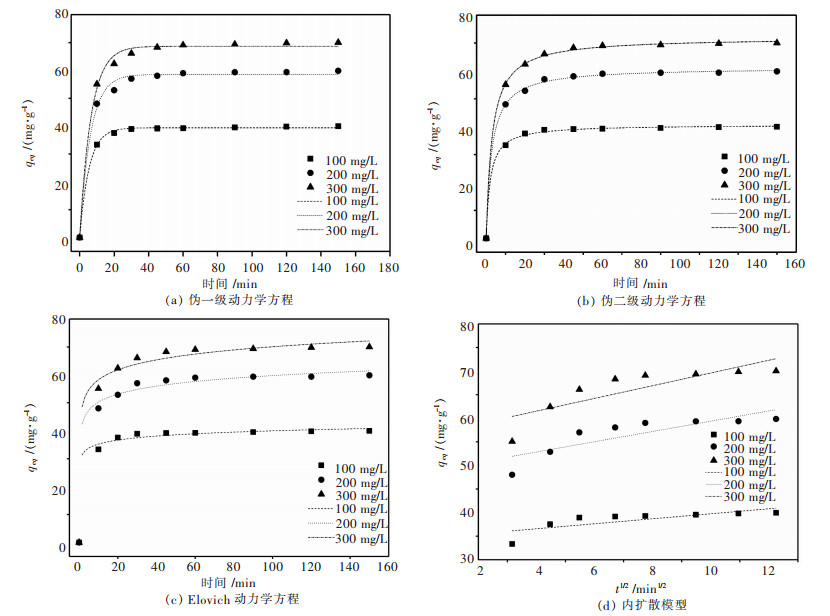 |
| 图 9 动力学方程 Fig. 9 pseudo first-order equation |
| 表 4 动力学方程拟合参数数值 Table 4 Numerical values of fitting parameters of dynamic equations |
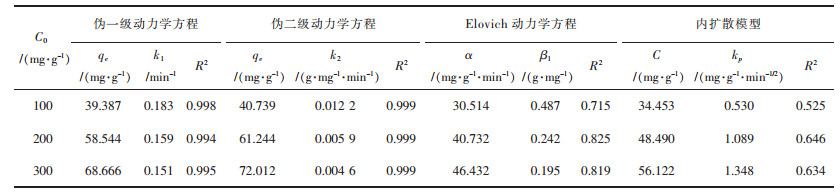 |
| 点击放大 |
2.6 解吸实验
螺旋藻在吸附Yb3+后,需要选择合适的解吸剂将螺旋藻吸附的Yb3+洗脱下来,实现对稀土离子的回收.通过对螺旋藻吸附动力学的研究发现,螺旋藻吸附稀土离子主要是化学吸附为主,因此较优解吸剂为稀酸.实验中选用0.1 mol/L的硝酸作为解吸剂.结果表明,0.1 mol/L HNO3对Yb3+的解吸率达到了92.3 %,解吸效果十分理想,解吸得到Yb3+可以富集回收,进行循环利用.
3 结论通过研究螺旋藻生物吸附剂对Yb3+吸附和解附过程的实验结果发现,Yb3+的吸附受反应时间、初始Yb3+浓度、pH值的影响.当pH=5.0,反应温度为25 ℃,吸附剂用量为2 g/L,废液浓度为100 mg/L,吸附时间为60 min时,螺旋藻对Yb3+的最大去除率为77 %.通过对吸附过程进行多种模拟拟合分析,结果发现langmuir等温线模型对螺旋藻吸附Yb3+过程的拟合相关性较好,相关系数R2=0.991,最大吸附量为69.930 mg/g,属于单分子层吸附.螺旋藻吸附Yb3+过程动力学符合伪二级动力学模型,相关系数R2=0.999,以化学吸附为主.螺旋藻吸附Yb3+过程的ΔG < 0,且随着温度的升高,ΔG绝对值增加;ΔH为0.405 kJ/mol,说明该吸附过程为吸热过程,升高温度有利于吸附;ΔS为11.722 J/(mol·K),表明该吸附是熵增过程.由此可以看出螺旋藻对Yb3+稀土离子的吸附能力很强,并且解吸附剂对螺旋藻吸附的稀土离子解的吸附作用效果良好,由此可用于稀土离子的生物富集回收.
| [1] |
王岩, 况军. 热分析技术的发展现状及其在稀土功能材料中的应用[J].
金属功能材料, 2014, 21(4): 43–46.
|
| [2] |
贺海钧, 赵英. 稀土功能材料与其应用产业群之间的关联和趋势分析[J].
稀土, 2006, 27(6): 91–94.
DOI: 10.3969/j.issn.1004-0277.2006.06.025.
|
| [3] |
曹剑锋, 张鹏英, 陈靠山. 稀土钕元素的生物学效应及机制研究进展[J].
植物生理学报, 2010, 46(4): 325–328.
|
| [4] |
ANNECLAIRE TEXIER, YVES ANDRES A, P L C. Selective biosorption of lanthanide (La, Eu, Yb) Ions by pseudomonas aeruginosa[J].
Environmental Science & Technology, 1999, 33(33): 489–495. |
| [5] |
GEOFFREY MICHAEL GADD. Bioremedial potential of microbial mechanisms of metal mobilization and immobilization[J].
Current Opinion in Biotechnology, 2000, 11(3): 271–279. DOI: 10.1016/S0958-1669(00)00095-1. |
| [6] |
PHILIP L, IYENGAR L, VENKOBACHAR C. Original papers biosorption of U, La, Pr, Nd, Eu and Dy by pseudomonas aeruginosa[J].
Journal of Industrial Microbiology & Biotechnology, 2000, 25(1): 1–7. |
| [7] |
XIONG C, YAO C, WANG Y. Sorption behaviour and mechanism of ytterbium(Ⅲ) on imino-diacetic acid resin[J].
Hydrometallurgy, 2006, 82(3): 190–194. |
| [8] |
ZHENG Z W, XIONG C H. Adsorption behavior of ytterbium (Ⅲ) on gel-type weak acid resin[J].
Journal of Rare Earths, 2011, 29(5): 407–412. DOI: 10.1016/S1002-0721(10)60469-3. |
| [9] |
QIN Q, ZHAO H, YAN L, et al. Extraction of rare earth metals by liquid surfactant membranes containing cyanex272 as a carrier[J].
Mining & Metallurgical Engineering, 2002, 22(3): 74–78. |
| [10] |
MEHTA S K, GAURAUR J P. Use of algae for removing heavy metal ions from wastewater: progress and prospects[J].
Critical Reviews in Biotechnology, 2005, 25(3): 113–152. DOI: 10.1080/07388550500248571. |
| [11] |
WANG J L, CHEN C. Biosorbents for heavy metals removal and their future[J].
Biotechnology Advances, 2009, 27(2): 195–226. DOI: 10.1016/j.biotechadv.2008.11.002. |
| [12] |
NOURBAKHSH M, SAG Y, öZER D, et al. A comparative study of various biosorbents for removal of chromium(Ⅵ) ions from industrial waste waters[J].
Process Biochemistry, 1994, 29(1): 1–5. |
| [13] |
ÇELEKLI A, BOZKURT H. Bio-sorption of cadmium and nickel ions using spirulina platensis: kinetic and equilibrium studies[J].
Desalination, 2011, 275(1/2/3): 141–147.
|
| [14] |
张文娟, 谢玲君, 刘鸿. ICP-AES法测定氟碳铈矿中低含量稀土总量[J].
有色金属科学与工程, 2016, 7(6): 141–146.
|
| [15] |
程明焱, 刘和连, 吴伟明, 等. 稀土分析检测方法标准述评[J].
有色金属科学与工程, 2012, 3(4): 108–114.
|
| [16] |
SöNMEZAY A, ÖNCEL M S, BEKTAÇN. Adsorption of lead and cadmium ions from aqueous solutions using manganoxide minerals[J].
Transactions of Nonferrous Metals Society of China, 2012, 22(12): 3131–3139. DOI: 10.1016/S1003-6326(12)61765-8. |
| [17] |
QIU H, LU L V, PAN B C, et al. Critical review in adsorption kinetic models[J].
Journal of Zhejiang University-Science A(Applied Physics & Engineering), 2009, 10(5): 716–724. |
| [18] |
郭钟群, 金解放, 王观石, 等. 风化壳淋积稀土矿浸取动力学基础理论研究[J].
有色金属科学与工程, 2017, 8(5): 127–132.
|
| [19] |
REZAEI H. Biosorption of chromium by using spirulina, sp[J].
Arabian Journal of Chemistry, 2016, 9(6): 846–853. DOI: 10.1016/j.arabjc.2013.11.008. |
| [20] |
HANG T T, VU N D, MATSUKAWA M, et al. Heavy metal biosorption from aqueous solutions by algae inhabiting rice paddies in Vietnam[J].
Journal of Environmental Chemical Engineering, 2016, 4(2): 2529–2535. DOI: 10.1016/j.jece.2016.04.038. |
| [21] |
GUIZA S. Biosorption of heavy metal from aqueous solution using cellulosic waste orange peel[J].
Ecological Engineering, 2017, 99: 134–140. DOI: 10.1016/j.ecoleng.2016.11.043. |
| [22] |
DENIZ F, KARABULUT A. Biosorption of heavy metal ions by chemically modified biomass of coastal seaweed community: Studies on phycoremediation system modeling and design[J].
Ecological Engineering, 2017, 106: 101–108. DOI: 10.1016/j.ecoleng.2017.05.024. |
| [23] |
HE J, CHEN J P. A comprehensive review on biosorption of heavy metals by algal biomass: materials, performances, chemistry, and modeling simulation tools[J].
Bioresource Technology, 2014, 160(6): 67–78. |
| [24] |
REZAEI H. Biosorption of chromium by using spirulina, sp[J].
Arabian Journal of Chemistry, 2016, 9(6): 846–853. DOI: 10.1016/j.arabjc.2013.11.008. |
| [25] |
AZIMI G, DHIMAN R, KWON H M, et al. Hydrophobicity of rare-earth oxide ceramics[J].
Nature Materials, 2013, 12(4): 315–320. DOI: 10.1038/nmat3545. |
| [26] |
SHU Q, TANG G, LESMANA H, et al. Preparation, characterization and application of a novel solid Brönsted acid catalyst SO42- /La3+ /C for biodiesel production via esterification of oleic acid and methanol[J].
Renewable Energy, 2018, 119: 253–261. DOI: 10.1016/j.renene.2017.12.013. |
| [27] |
LIU B, HUANG Y. Polyethyleneimine modified eggshell membrane as a novel biosorbent for adsorption and detoxification of Cr(Ⅵ) from water[J].
Journal of Materials Chemistry, 2011, 21(43): 17413–17418. DOI: 10.1039/c1jm12329g. |
| [28] |
HUANG L Z, ZENG G M, HUANG D L, et al. Adsorption of lead(Ⅱ) from aqueous solution onto hydrilla verticillata[J].
Biodegradation, 2009, 20(5): 651–660. DOI: 10.1007/s10532-009-9252-4. |
 2019, Vol. 10
2019, Vol. 10


